基于线粒体Cyt b基因的中国南方唇鱼骨(Hermibarbuslabeo)和间鱼骨(Hermibarbusmedius)种群分化及亲缘地理研究
2016-11-28蓝昭军范明君黄小林
蓝昭军,范明君,黄小林,赵 俊
1 广东省水产健康安全养殖重点实验室,广东省高等学校生态与环境科学重点实验室,广州市亚热带生物多样性与环境生物监测重点实验室,华南师范大学生命科学学院,广州 510631 2 韶关市水产研究所, 韶关 512006 3 深圳华大水产科技有限公司, 深圳 518083 4 中国水产科学研究院南海水产研究所, 广州 510300
基于线粒体Cytb基因的中国南方唇鱼骨(Hermibarbuslabeo)和间鱼骨(Hermibarbusmedius)种群分化及亲缘地理研究
蓝昭军1,2,范明君1,3,黄小林1,4,赵 俊1,*
1 广东省水产健康安全养殖重点实验室,广东省高等学校生态与环境科学重点实验室,广州市亚热带生物多样性与环境生物监测重点实验室,华南师范大学生命科学学院,广州 510631 2 韶关市水产研究所, 韶关 512006 3 深圳华大水产科技有限公司, 深圳 518083 4 中国水产科学研究院南海水产研究所, 广州 510300
为了解中国南方唇鱼骨(Hermibarbuslabeo)和间鱼骨(Hermibarbusmedius)的种群分化、亲缘地理格局及物种有效性,作者对唇鱼骨 8个水系及间鱼骨 9个水系共148尾样本的Cytb基因全序列进行了测定。在所有序列中,共有128个变异位点,共检测出了41个单倍型,单倍型多样性为0.954,核苷酸多样性为0.02153。基于Cytb基因全序列构建的NJ树显示,中国南方的唇鱼骨与间鱼骨合聚为两大支,其中韩江和九龙江的全部唇鱼骨样本组成了Ⅰ支,而其他水系的唇鱼骨和间鱼骨样本则组成了Ⅱ支。两支系间的遗传距离为5.1%,而唇鱼骨和间鱼骨之间的遗传距离为3.2%。现有证据不支持间鱼骨与唇鱼骨达到种一级的分化。单倍型网络图显示,韩江、九龙江种群和其他水系的种群分化较大;海南岛三大水系种群和漠阳江种群的单倍型分支与代表珠江水系单倍型的分支之间的亲缘关系较近,与其他地理区间种群的亲缘关系则相对较远;西江可能为珠江水系、漠阳江水系和海南岛三大水系间鱼骨种群的扩散中心,其中一支往东向北江和东江扩散;另一支往南向海南岛扩散,海南岛三大水系种群尔后在冰期海退时向北扩散至漠阳江水系及珠江水系。AMOVA分析表明,唇鱼骨和间鱼骨地理区之间变异约占54.50%,地理区内种群间变异约占18.64%,种群内的变异占26.86%,这说明,唇鱼骨和间鱼骨种群Cytb的遗传分化主要是来自地理区之间。错配分析及中性检验显示,全部种群、唇鱼骨种群、间鱼骨种群在历史上均没有发生过明显的扩张,两个mtDNA支系亦未发生过扩张,而海南岛的昌化江种群曾发生过种群扩张。
唇鱼骨;间鱼骨;种群分化;亲缘地理;细胞色素b基因;中国南方
亲缘地理学,又称谱系生物地理学,是研究有密切亲缘关系的种间和种内支系现有的地理分布格局的形成过程和形成机制的学科。生物在漫长的演化过程中,受各种因素(地质因素、气候因素等)的影响,都会在其演化的过程中留下印迹,如影响生物的地理隔离、迁移、区域扩张和灭绝等,而生物的这些活动都会具有影响一定区域内物种基因流的作用,改变遗传变异的分布,从而产生新的物种进化模式[1]。尤其是,地质地貌的格局对于种群基因流的改变和分化往往起着重要的作用[2- 6]。而分子亲缘地理学是采用分子生物技术,在分子水平上探讨物种的系统地理格局的形成机制,进一步阐述其起源进化历史,分析区域类群在时间上和空间上的发展变化,从而重建生物区系的进化历史过程[7]。
唇鱼骨(Hemibarbuslabeo)和间鱼骨(Hemibarbusmedius)均隶属于鲤形目(Cypriniformes),鲤科(Cyprinidae),鮈亚科(Gobioninae),鱼骨属(Hemibarbus)[8- 9],两者为近缘种。间鱼骨是在原唇鱼骨种群中划分出的一个种[8],在此之前,一直被归为唇鱼骨[10- 14]。1995年,乐佩琦对我国鱼骨属鱼类进行分类整理后认为,唇鱼骨华南地区及西南部分地区的种群与唇鱼骨其他地方种群的差别已经达到了物种级的水平,并以海南岛的12尾标本作为模式标本,将华南及西南部分地区的唇鱼骨种群描述为一新种——间鱼骨(H.mediusYue),并指出其与唇鱼骨的鉴别特征主要为吻长较短,唇稍薄,不甚发达,下唇侧叶稍狭窄,无皱褶,背鳍刺较细弱及鳃耙数较少等[8]。1998年,乐佩琦等较为详细地记载唇鱼骨和间鱼骨的地理分布,其中唇鱼骨分布于我国台湾各水系和闽江、钱塘江、长江、黄河等直至黑龙江水系;间鱼骨分布于华南、西南部分地区各水系[9]。
然而,目前不同学者对于两者的分布区域与乐佩琦等的观点不尽相同[15- 18]。唇鱼骨和间鱼骨之间的鉴别特征较为模糊,且某些性状可能存在连续变化,不易区分。因此,造成对两者分布区描述差异的原因可能为物种鉴定存在偏差。此外,两者的分布均较为广泛,是研究亲缘地理的理想素材。有关唇鱼骨和间鱼骨的亲缘地理的研究,目前已有林宗键[17]及Lin等[18]基于线粒体控制区序列对唇鱼骨的报道,但该研究并未涉及珠江等水系的种群。因此,作者在中国南方唇鱼骨和间鱼骨的分布区,采集不同地理种群的样本,对其线粒体细胞色素b(Cytb)基因序列进行了测定与分析,旨在澄清二者物种有效性的前提下,探讨其种群分化和分布特征,推测其种群演化历史及亲缘地理模式。
1 材料与方法
1.1 样品采集
本研究所用样品均为2009年9月—2010年8月采自贵州省、广西壮族自治区、广东省、海南省、福建省、江西省和浙江省等地,所有样本根据乐佩琦等提出的分类鉴定特征[8- 9]进行鉴定,其中间鱼骨样本共92尾;唇鱼骨样本56尾。将所有个体按所采样的水系进行种群划分,即用水系名称对种群进行命名。具体的样品信息及采样点见表1。
1.2 DNA的提取及测序
基因组 DNA的提取参考庆宁等[19]的方法,即采用从上海生工生物工程技术服务有限公司购买的“基因组 DNA抽提试剂盒”所示方法,略有改动。PCR反应体系:反应体系约25μL,按顺序分别将PCR Master Mix 12.5μL、Primer1 3μL、Primer2 3μL、模板DNA 4μL及灭菌双蒸水2.5μL混合,每一次反应都用ddH2O代替模板DNA做阴性对照。反应在PTC100或PTC200型PCR仪上进行,具体扩增程序如下:A: 95℃预变性4min,B: 94℃变性40sec,C: 58℃退火45sec,D: 72℃延伸1min,E: 重复步骤B—D45次;F:最后72℃延伸10min。PCR及测序所用引物均为通用引物L14724和H15915,由上海英骏生物技术有限公司合成,其序列分别为:L14724:5′-GACTTG AAA AACCAC CGTTG- 3′;H15915:5′-CTCCGATCTCCGGATTACAAGAC- 3′。PCR产物用1%琼脂糖电泳检验目的片段后,将PCR产物送上海生工生物工程技术服务有限公司纯化并测序。
1.3 数据分析
对测得的序列使用Clustal X 1.81 软件进行排序比对并辅以人工校对。用软件MEGA 5.0[20]计算所分析序列的碱基组成。采用Kimura′s two-parameter模型计算遗传距离,并采用该软件中的邻接法(Neighbor-joining method,NJ),以似鮈(Pseudogobiovaillanti)作为外类群,构建分支系统树。用软件DNAsp 5.0[21]对各种群序列的多样性进行分析,统计核苷酸多样性(Nucleotide diversity,π)与单倍型多样性(Haplotype diversity,h),并以此估计不同水系种群的遗传多样性;并利用该软件进行错配分布(Mismatch-distribution)分析及Tajima′s D和Fu and Li′s检验,以检验种群是否发生过扩张。使用Network 4.6 软件,以Median-joining法构建各单倍型之间网络关系图,并对图中各个单倍型进行群体对应关系分析。利用Arlequin Ver 2000[22]软件进行分子变异分析(AMOVA),测试种群间与地理区间遗传变异程度。
2 结果与分析
2.1 Cyt b 基因的序列变异
本研究共得到148尾唇鱼骨与间鱼骨的Cytb基因全序列,序列长1140bp,无碱基的插入或缺失,Cytb基因所有序列中,共128个变异位点,占全序列的11.23%,其中14个为单个多态位点,114个为简约信息位点。大多数的变异发生在密码子第3位(82.81%),第1位(14.02%)和第2位(3.12%)的变异较低。唇鱼骨与间鱼骨在Cytb序列中A、C、T、G平均含量分别为27.5%、28.4%、28.4%和15.6%,G的含量明显低于其他3种碱基含量,表现出很强的碱基组成偏向性。其中A+T的含量55.9%,G+C的含量为44.0%,A+T的含量明显高于G+C的含量。
2.2 Cyt b 基因的单倍型多样性和遗传多样性
在唇鱼骨56尾样本中,检测出19个单倍型,其中17个为特有单倍型,2个为与间鱼骨共享的单倍型;间鱼骨92尾样本,检测出24个单倍型,其中22个为独有单倍型,2个为与唇鱼骨共享的单倍型(表1)。在全部148尾样本中,共检测出了41个单倍型,单倍型多样性为0.954。
在一些不同的种群中,存在共享单倍型,表明这些种群的亲缘关系十分密切。其中海南岛三大水系之一南渡江(NAN)、广东西部独立入海水系漠阳江(MOY)及珠江水系第二大支流北江(BEI)的种群共享单倍型NAN1-MOY1-BEI5;西江支流桂江(GUI)和柳江(LIU)的间鱼骨种群与长江水系支流湘江(XIA)的唇鱼骨种群共享单倍型GUI1-LIU1-XIA1。
单倍型多样性(h)和核苷酸多样性(π)分析表明(表1),148尾唇鱼骨和间鱼骨样本的单倍型多样性为0.954,核苷酸多样性为0.02153,遗传多样性较高。核苷酸多样性(π)分析表明(表1),湘江、桂江、北江、东江、九龙江、闽江种群的核苷酸遗传多样性较高,均在0.002以上。
2.3 种群间遗传距离及遗传分化
统计表明,唇鱼骨和间鱼骨之间的遗传距离为3.2%,两者遗传差异不大。表2分别显示了不同水系的唇鱼骨与间鱼骨基于Cytb基因的遗传距离和及遗传分化指数。由表2可知,在各地理区(如海南岛地区、东南地区等)和水系内部(如长江水系和珠江水系)的遗传距离、遗传分化指数较低;珠江水系和长江水系的遗传距离、遗传分化指数亦较低。在唇鱼骨和间鱼骨各个种群之间,韩江、九龙江和闽江种群与其他各种群的遗传距离较大,遗传分化指数较高,而余下各种群之间的遗传距离和遗传分化指数则较低。
2.4 系统发育分析
为更好地了解中国南方地区唇鱼骨与间鱼骨各种群之间的亲缘关系,以似鮈为外类群,对148尾样品的Cytb基因中的41个单倍型进行系统发育分析,利用最大邻接法(NJ)构建分子系统发育树(图1)。
在我国南方的唇鱼骨与间鱼骨种群间,聚成Ⅰ和Ⅱ两支。韩江和九龙江的全部样本组成了Ⅰ支,而其他水系的样本则组成了Ⅱ支,支系Ⅰ和Ⅱ之间的遗传距离为5.1%,这说明韩江和九龙江种群已和其他种群发生了一定程度的遗传分化。在Ⅱ支中,又可分为A和B个两姐妹群。A群包含了海南岛三大水系、漠阳江、柳江、贺江、北江、钱塘江和瓯江的全部样本及桂江、东江、湘江和闽江的部分样本;B群则包含了沅江的全部样本及桂江、湘江和闽江的部分样本。在支系Ⅱ的A群中,又可分为A1和A2两个姐妹群。A1有两个分支,分别为海南岛三大水系、漠阳江的全部样本和北江水系一尾样本组成一个分支,说明海南岛三大水系种群与漠阳江水系种群的亲缘关系较近;而贺江、柳江的全部标本及湘江、北江和东江的部分样本组成另一支,这则说明珠江水系三大支流之间的遗传差异不大,而珠江水系与湘江水系之间的遗传差异亦较低。A2则包含了钱塘江、瓯江的全部样本及闽江部分样本和东江的一尾样本。
就唇鱼骨与间鱼骨这两个物种而言,除了支系Ⅰ全部为唇鱼骨、A1其中的一个分支全部为间鱼骨之外,其余均含有唇鱼骨与间鱼骨两个物种,这也说明两者间遗传差异不大。
2.5 单倍型网络分析
图2显示了中国南方唇鱼骨和间鱼骨基于Cytb基因的单倍型网络亲缘关系,大多数单倍型之间的变异为1—7步,遗传差异不大。但是桂江和湘江种群的共享单倍型GUI2-XIA2与韩江和九龙江种群之间的变异近40步;桂江与钱塘江、瓯江与闽江种群的变异达约20步,表明这些种群的单倍型间存在一定的遗传分化。

物种Species水系Riversystems采集地Samplelocations样品数Samplesize单倍型(个体数)Haplotypes(numberofindividuals)变异位点数Numberofpolymorphicsites(S)单倍型数Numebrofhaplotypes单倍型多样性Haplotypediversity(h)核苷酸多样性Nucleotidediversity(π)间鱼骨H.medius昌化江(CHJ)五指山10CHJ1(3)、CHJ2(2)、CHJ3(1)、CHJ4(1)、CHJ5(2)450.8670.00121南渡江(NAN)屯昌9NAN1-MOY1-BEI5*(9)010.0000.00000万泉河(WAN)琼海9WAN1(7)、WAN2(2)120.3890.00034漠阳江(MOY)阳春11NAN1-MOY1-BEI5(10)、MOY2(1)120.1820.00016东江(DON)河源10DON1(1)、DON2(1)、DON3(5)、DON4-HEJ1(3)*、2940.7110.00532北江(BEI)连州9BEI1(1)、BEI2(10)、BEI3(1)、BEI4(1)、1750.5060.00224始兴5NAN1-MOY1-BEI5(1)贺江(HEJ)贺州11DON4-HEJ1(4)、HEJ2(7)120.5090.00045桂江(GUI)桂林6GUI1-LIU1-XIA1(4)*、GUI2-XIA2(1)*、GUI3(2)、3050.8060.00614荔浦3GUI4-LIU2(1)*、GUI5(1)柳江(LIU)从江3GUI1-LIU1-XIA1(3)、GUI4-LIU2(2)、LIU3(4)430.6670.00137永福6唇鱼骨H.labeo韩江(HAN)上杭10HAN1(8)、HAN2(1)、HAN3(1)330.3780.00053九龙江(JIU)漳平5JIU1(2)、JIU2(3)120.6000.03072闽江(MIN)邵武9MIN1(2)、MIN2(1)、MIN3(1)、MIN4(2)、MIN5(3)4250.8610.01652湘江(XIA)全州9GUI1-LIU1-XIA1(6)、GUI2-XIA2(3)2720.5000.01184沅江(YUA)锦屏7YUA1(7)010.0000.00000信江(XIN)上饶3XIN1(2)、XIN2(1)120.6670.00058瓯江(OUJ)丽水9OUJI(4)、OUJ2(5)220.5000.00088钱塘江(QIA)开化4QIA1(3)、QIA2(1)120.5000.00044合计Total148128410.9540.02153
﹡表示此单倍型为不同河流共享单倍型
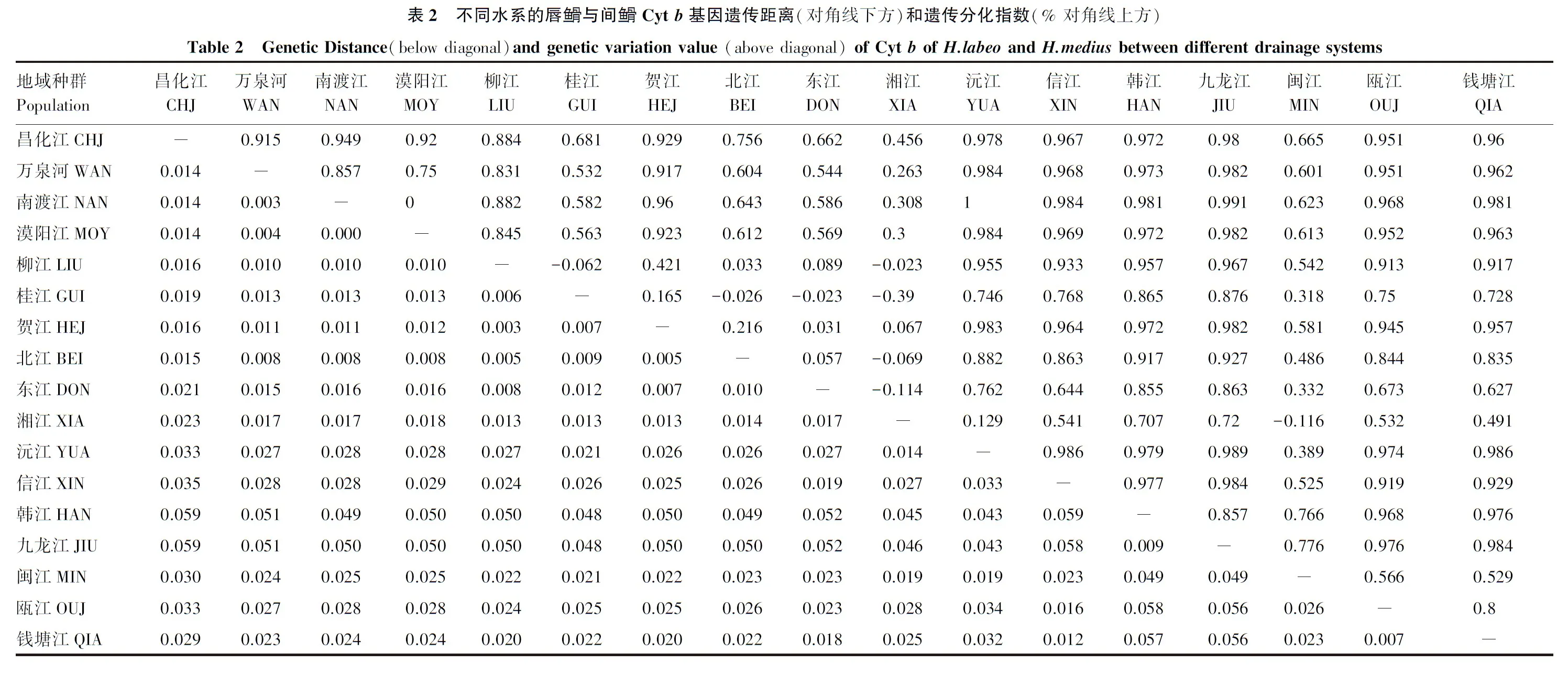
表2 不同水系的唇鱼骨与间鱼骨Cyt b基因遗传距离(对角线下方)和遗传分化指数(% 对角线上方)
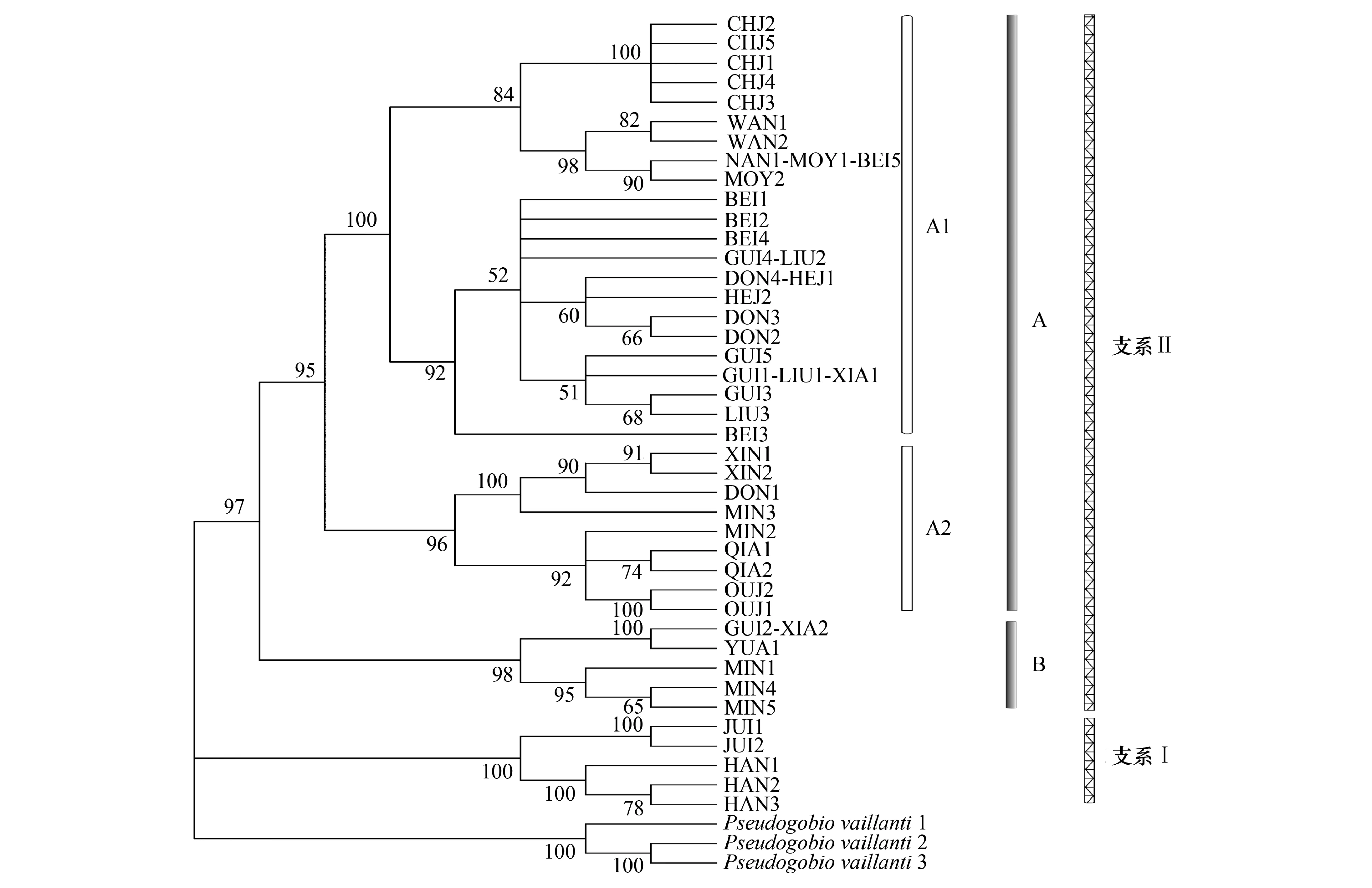
图1 唇鱼骨与间鱼骨中国南方种群基于Cyt b基因的最大邻接NJ树Fig.1 Neighbor-joining tree of H.labeo and H.medius populations of south China based on Cyt b gene

图2 唇鱼骨与间鱼骨中国南方种群基于Cyt b基因的单倍型网络图Fig.2 Minimum spanning network of Cyt b sequences of H.labeo and H.medius populations of south China
单倍型网络图还揭示,桂江及柳江水系种群与长江水系支流湘江水系种群的亲缘关系十分密切,两者具有共享单倍型且各个单倍型之间的变异不大;海南岛三大水系的种群与漠阳江种群的亲缘关系比较密切;钱塘江、瓯江及闽江种群的亲缘关系亦较为密切;韩江与九龙江种群的亲缘关系较近;而我国东南部水系闽江的种群不仅与长江水系支流湘江、沅江的关系较近,且与珠江水系支流东江、长江水系支流信江种群的关系亦较密切。这与NJ树的结果相似。从单倍型网络图推测,西江可能为珠江水系、漠阳江水系和海南岛水系间鱼骨种群的扩散中心,其中一支往东向北江和东江扩散;另一支往南向海南岛扩散,海南岛种群尔后在第四纪冰期海退时向北扩散至漠阳江水系及珠江水系。
2.6 分子变异分析(AMOVA)
为了解唇鱼骨和间鱼骨种群分子变异的分布模式,根据系统发育分析及单倍型网络分析的结果,将唇鱼骨和间鱼骨17个水系的种群分成5个地理区,进行分子变异分析(AMOVA)。地理区的划分主要根据各种群亲缘关系的亲疏及地理位置,其中海南岛的南渡江、万泉河、昌化江和漠阳江为一地理区;珠江水系为一地理区,包括西江支流柳江、桂江、贺江、珠江另外两条支流北江及东江;长江水系为一地理区,包括湘江、沅江及信江;韩江和九龙江为一地理区;闽江、瓯江和钱塘江为一个地理区。AMOVA分析分析表明,唇鱼骨和间鱼骨地理区之间变异约占54.50%,地理区内种群间约占18.64%,种群内的变异占26.86%(表3)。这说明,唇鱼骨和间鱼骨种群Cytb的遗传分化主要是来自地理区之间。
2.7 种群动态分析
除了昌化江、桂江、北江、东江、闽江等种群外,其他种群的单倍型数目未达到4,故无法计算Fu and Li′s D和Tajima′s D值。对唇鱼骨和间鱼骨的全部种群、唇鱼骨种群和间鱼骨种群进行错配分析发现,全部种群、唇鱼骨及间鱼骨种群均呈现多峰分布,说明其均没有发生过明显的扩张。而中性检验也显示,全部种群、唇鱼骨及间鱼骨种群的Fu and Li′s D和Tajima′s D值均没有呈现显著的负值,表明其在历史上均没有发生过明显的扩张(表4)。表4还表明,两个支系的Fu and Li′s D和Tajima′s D值均没有呈现显著的负值,这说明两个支系亦未发生过扩张。

表3 唇鱼骨和间鱼骨分子变异分析

表4 唇鱼骨与间鱼骨种群基于Cyt b基因的Tajima′s D 和 Fu and Li′s D检验
就各个水系的种群而言,桂江、北江、东江、闽江等种群的Fu and Li′s D和Tajima′s D均不为显著的负值,说明这几个种群亦相对稳定,没有发生过扩张;而昌化江(CHJ)的Fu and Li′s D为显著的负值,而Tajima′s D则不显著,但其错配分析图为单峰分布(图3),所以可以推测昌化江种群曾发生过种群扩张。

图3 昌化江种群的歧点分布分析图(其中实线代表期望值,虚线代表观察值)Fig.3 Mismatch-distribution analysis of H.medius of Changhuajiang population of mtDNA haplotype sequences(solid lines represent the distribution expeted under constant population size, and dotted lines represent the observe distribution)
3 讨论
3.1 间鱼骨物种有效性
在本研究中,遗传距离分析表明,唇鱼骨和间鱼骨之间的遗传距离为3.2%,低于唇鱼骨种内各种群间的最大遗传距离(韩江与信江,5.9%)。系统分析显示,间鱼骨并未形成单系群,而是与部分唇鱼骨种群组成一支,而韩江和九龙江的唇鱼骨组成了另一支。单倍型分布分析显示,湘江唇鱼骨种群的所有单倍型均与桂江或柳江的间鱼骨种群共享,湘江、桂江和柳江种群的遗传差异极小。系统发育分析及单倍型网络图还显示,除了唇鱼骨的湘江、沅江种群与间鱼骨的桂江、柳江种群的亲缘关系较近外,唇鱼骨的信江和闽江种群与间鱼骨的东江种群亦有着较近的亲缘关系。此外,蓝昭军基于多变量形态度量学的研究亦表明,唇鱼骨和间鱼骨存在一定的形态差异,但各个种群间存在梯度变异,差异并不显著,无法截然分开[23];而林龙峰基于线粒体CO I和ND5基因分别对中国南方唇鱼骨与间鱼骨的种群遗传分化进行了研究,结果均表明间鱼骨与唇鱼骨之间的遗传差异较小,两者存在共享单倍型,且间鱼骨不能单独构成单系群,而是与唇鱼骨部分样本构成一个分支[24]。因此,综合考虑基于线粒体Cytb、CO I和ND5基因和多变量形态度量学的分析结果,我们认为唇鱼骨和间鱼骨之间的遗传差异未达到种级水平,间鱼骨应为唇鱼骨的次定同物异名。
3.2 韩江、九龙江种群与其他种群间的遗传分化
系统发育分析显示,在我国南方的唇鱼骨与间鱼骨种群间,可以分成Ⅰ和Ⅱ两支。韩江和九龙江种群遗传差异不大,两条江的全部样本组成了Ⅰ支,而其他种群的样本则组成了Ⅱ支,两支系之间的遗传距离为5.1%,这说明韩江和九龙江种群已和其他种群发生了一定程度的遗传分化。林弘都[25]和梁晓旭等[26]对部分淡水鱼类的研究亦表明,华南大陆东部的莲花山脉是粤东地区的一个重要地理屏障,而庆宁等[27]对华南地区黑眶蟾蜍(BufoMelanostictus)的研究亦得出了相似的结果。
韩江是广东省东部地区的最大河流,其有东西两源,东源称梅江,发源于莲花山山脉北麓;西源称汀江,发源于武夷山南麓。莲花山脉位于广东省东北部,其山势由粤北部的大埔向西南一直延伸到香港附近,最高峰为铜鼓障,高1559 m; 整个山脉高度基本在980—1 170 m之间[28]。九龙江为福建省第二大水系,发源于福建玳瑁山南麓。由此可知,韩江和九龙江被莲花山、武夷山、玳瑁山等较高的山脉围绕,将其与珠江水系、长江水系及闽江水系隔离。据此,我们推测:一方面,由于莲花山、武夷山、玳瑁山等山脉的隔离,韩江和九龙江的种群无法与其他种群进行基因交流,因而产生了相对较大的遗传分化;另一方面,韩江和九龙江在冰期海退时,可能曾发生过连接,使得两种群之间得以基因交流,因而遗传差异不显著。
3.3 珠江及长江种群间的遗传分化
分子系统发育分析显示,除湘江与桂江和柳江种群的亲缘关系较近以及东江少数样本与信江、闽江种群的亲缘关系较近外,唇鱼骨和间鱼骨剩下的绝大部分单倍型则分别归入了不同的分支之内。这表明,在唇鱼骨和间鱼骨分布区之间,可能存在地理障壁,造成其不同的分布范围,而这一地理障壁可能为长江水系和珠江水系的分水岭之一——南岭山脉。南岭山脉由越城岭、都庞岭、萌渚岭、骑田岭和大庾岭5条主要山岭所组成。其横亘在湘桂、湘粤、赣粤之间,向东延伸至闽南,东西长约600km,南北宽约200km。广义的南岭还包括苗儿山、海洋山、九嶷山、香花岭、瑶山、九连山等。有研究表明,南岭山脉在11.06—8.04百万年前已经形成[29],但在隆起初期,其高度相对较低,可能不足以阻隔两侧的淡水鱼类的基因交流。而在青藏高原隆起的时期,南岭山脉也呈加速隆起之势[25]。南岭的加速隆起,可能使其成为了南岭以北水系与南岭以南水系间的地理障壁,因而限制了南北两侧水系种群的基因交流,使得其两侧的种群产生了遗传分化,进而形态上也发生了一定程度的分化。
在本研究中,多种分析结果亦显示,长江水系支流湘江、沅江及信江的唇鱼骨种群与珠江水系间鱼骨种群的亲缘关系较近,其中湘江与沅江的种群在系统发育树中与桂江和柳江的亲缘关系均较近;而东江的部分样本则与信江种群的亲缘关系较近。在Li等对马口鱼(Opsariichthysbidens)的研究[30]及Yang等对大鳍鳠(Hemibagrusmacropterus)的研究[31]中,其结果均显示珠江水系的种群与长江水系的种群亲缘关系较近。
我们推测,造成这种情况的原因可能有二,一是由于地壳运动、洪水泛滥等原因,使长江水系和珠江水系在历史上曾发生过袭夺事件或连接事件,使长江南部支流上游的部分支流被珠江袭夺或与珠江水系支流相连接,从而使两水系种群得以基因交流;二是水利枢纽工程的影响,在湘江水系与桂江水系上游,有一条建成已有2200多年人工运河——灵渠将两江联通[32],这也可能促进长江水系与珠江水系种群的基因交流。
3.4 海南岛种群的起源、扩散及隔离
从唇鱼骨和间鱼骨单倍型的分布可知,海南岛的南渡江水系、广东西部水系漠阳江及北江水系共享一个单倍型,表明三种群间亲缘关系较近。在单倍型网络图中,单倍型WAN1与桂江、柳江和湘江的共享单倍型GUI1-LIU1-XIA1及桂江的单倍型GUI3之间的变异均较小,约为10步,表明这些单倍型间有着较近的亲缘关系;万泉河的单倍型WAN1与南渡江、漠阳江和北江的共享单倍型NAN1-MOY1-BEI5只有3步,两者之间亦有着很近的亲缘关系。此外,单倍型网络图还显示,海南岛中部山脉以东的南渡江和万泉河种群与西边的昌化江种群之间关系相对较远(16步)。
有关华南沿海地质构造的研究显示,在第四纪时,琼州海峡至少经历过4次海侵与海退[33];而在第四纪冰期,由于海平面下降,华南沿海的海岸线在海南岛以南,海南岛北部均为辽阔的滨海平原[34];在更新世,在海南岛和越南之间是一片陆地,其间有一条联系西江、广西、越南沿海和海南岛诸水系的古河道[35]。有鉴于此,结合本研究系统发育分析及单倍型网络图等研究结果,海南岛的间鱼骨种群有可能为西江水系的种群沿着上述这一古河道扩散而来,然后进一步在海南岛内扩散。随后,由于海平面的上升,海南岛与大陆隔离,因而使海南岛种群与大陆种群的基因交流受到了限制,发生了遗传分化。而到了晚更新世冰期时,由于海退等原因,雷州半岛与海南岛连成一片山地丘陵[36],这使得海南岛的种群得以向北扩散,到达雷州半岛,进而扩散至漠阳江水系,并重新回到珠江水系。间鱼骨的这一扩散途径,与海南纹胸鮡(Glyptothoraxhainanensis)[37]及中间黄颡鱼(Pelteobagrusintermedius)[38]有相似之处。
在林宗键和Lin等对唇鱼骨的亲缘地理研究中,基于线粒体控制区序列的分析结果显示,海南岛昌化江种群(实为间鱼骨)与长江中游种群的亲缘关系较其与广东东部水系榕江种群的关系近,而昌化江与长江的距离远大于其与榕江的距离,他们认为其原因是长江和海南岛的水系曾通过古红河水系发生过连接[17- 18]。值得指出的是,在Lin等的研究中,并没有采集珠江水系的样本,而海南岛也只有昌化江水系的样本。在本研究中,也发现海南岛三大水系种群与长江水系种群的亲缘关系近于其与韩江和九龙江水系种群的亲缘关系。由于韩江与榕江的地理位置很近,故此该结果与Lin等的相似。可以认为,造成本研究及Lin等所述之结果的另一重要原因是海南岛的种群由西江水系种群沿着古河道扩散而来,而西江曾与长江水系发生过袭夺或连接事件,其种群与长江水系种群亲缘关系较近。因此,这一现象进一步印证了我们对海南岛种群来源及扩散之推测。
另一方面,在海南岛内部,单倍型网络图显示昌化江种群与万泉河及南渡江种群的变异达到16步,说明昌化江种群与其他两种群之间,发生了一定的遗传分化。地质研究表明,在第三纪末期,海南岛中部山地已经形成,在多雨山区发源的河流也四散分流,独自入海,不相联系汇合[39]。在间鱼骨扩散至海南岛各主要水系后,可能由于海南岛中部山地,如五指山等的隆起,将海南岛西部的昌化江种群与东部的万泉河及南渡江种群隔离,进而使昌化江种群产生了分化。而左艳玲等基于线粒体DNA控制区序列对拟平鳅(Liniparhomalopteradisparis)的研究也表明:拟平鳅的昌化江种群与南渡江和万泉河的种群亦存在较大的遗传分化[40]。因此,本研究的结果进一步说明了海南岛中部山脉可能对海南岛的淡水鱼类存在着较为广泛的隔离。
致谢:华南师范大学陈湘粦教授和庆宁教授帮助实验方案设计及修改,林弘都博士和张雄同学参与了部分样品的采集,Radhakrishnan博士帮助写作,特此致谢。
[1] Hewitt G. The genetic legacy of the quaternary ice ages. Nature, 2000, 405(6789): 907- 913.
[2] Angers B, Magnan P, Plante M, Bernatchez L. Canonical correspondence analysis for estimating spatial and environmental effects on microsatellite gene diversity in brook charr (Salvelinusfontinalis). Molecular Ecology, 1999, 8(6): 1043- 1053.
[3] Keyghobadi N, Roland J, Strobeck C. Influence of landscape on the population genetic structure of the alpine butterflyParnassiussmintheus(Papilionidae). Molecular Ecology, 1999, 8(9): 1481- 1495.
[4] Castric V, Bonney F, Bernatchez L. Landscape structure and hierarchical genetic diversity in the brook charr,Salvelinusfontinalis. Evolution, 2001, 55(5): 1016 - 1028.
[5] Cassel A, Tammaru T. Allozyme variability in central, peripheral and isolated populations of the scarce heath (Coenonymphahero: Lepidoptera, Nymphalidae); implications for conservation. Conservation Genetics, 2003, 4(1): 83- 93.
[6] Costello A B, Down T E, Pollard S M, Pacas C J, Taylor E B. The influence of history and contemporary stream hydrology on the evolution of genetic diversity within species: an examination of microsatellite DNA variation in bull trout,Salvelinusconfluentus(Pisces: Salmonidae). Evolution, 2003, 57(2): 328- 344.
[7] Hewitt G M. Some genetic consequences of ice ages, and their role in divergence and speciation. Biological Journal of the Linnean Society, 1996, 58: 247- 276.
[8] 乐佩琦. 鱼骨和间鱼骨属鱼类的分类整理(鲤形目: 鲤科). 动物分类学报, 1995, 20(1): 116- 123.
[9] 陈宜瑜. 中国动物志硬骨鱼纲鲤形目(中卷). 北京: 科学出版社, 1998: 239- 241.
[10] 伍献文. 中国鲤科鱼类志(下卷). 上海: 上海人民出版社, 1977: 439- 537.
[11] 广西壮族自治区水产研究所, 中国科学院动物研究所. 广西淡水鱼类志. 南宁: 广西人民出版社, 1981: 112- 113.
[12] 中国水产科学研究院珠江水产研究所等. 海南岛淡水及河口鱼类志. 广州: 广东科学技术出版社, 1986: 93- 94.
[13] 郑慈英. 珠江鱼类志. 北京: 科学出版社, 1989: 119- 121.
[14] 中国水产科学研究院珠江水产研究所等. 广东淡水鱼类志. 广州: 广东科技出版社, 1991.
[15] Yang J Q, He S P, Freyhof J, Witte K, Liu H Z. The Phylogenetic Relationships of the Gobioninae (Teleostei: Cyprinidae) Inferred from Mitochondrial CytochromebGene Sequences. Hydrobiologia, 2006, 553(1): 255- 266.
[16] 广西壮族自治区水产研究所, 中国科学院动物研究所. 广西淡水鱼类志(第二版). 南宁: 广西人民出版社, 2006, 193- 195.
[17] 林宗键. 唇鱼骨和间鱼骨的亲缘地理研究. 台湾:国立成功大学, 2009.
[18] Lin C J, Lin H D, Wang J P, Chao S C, Chiang T Y. Phylogeography ofHemibarbuslabeo(Cyprinidae): secondary contact of ancient lineages of mtDNA. Zoologica Scripta, 2010, 39(1): 23- 35.
[19] 庆宁, 丘城锋, 廖伟群, 马天峰, 梁晓旭, 列金妮. 华南沿海西部美丽小条鳅基于线粒体控制区的种群遗传变异及亲缘地理格局. 生态学报, 2010, 30(1): 258- 264.
[20] Kumar S, Nei M, Dudley J, Tamura K. MEGA: a biologist-centric software for evolutionary analysis of DNA and protein sequences. Briefings in Bioinformatics, 2008, 9(4): 299- 306.
[21] Librado P, Rozas J. DNASP v5: a software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 2009, 25(11): 1451- 1452.
[22] Excoffier L, Smouse P E, Quattor J M. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data. Genetics, 1992, 131(2): 479- 491.
[23] 蓝昭军. 中国南方唇鱼骨和间鱼骨的种群分化、亲缘地理及间鱼骨的生物学特征[D]. 广州: 华南师范大学, 2011.
[24] 林龙峰. 基于COI和ND5序列的中国南方唇鱼骨和间鱼骨种群遗传变异与亲缘地理分析[D]. 广州: 华南师范大学, 2014.
[25] 林弘都. 台湾与中国大陆地区鲤科鱼类之亲缘地理研究[D]. 台湾: 国立成功大学, 2008.
[26] 梁晓旭, 庆宁, 杨柯林, 万彩霞, 赵俊, 陈湘粦. 广东地区宽鳍鱲种群遗传变异和亲缘地理. 水生生物学报, 2010, 34(4): 806- 814.
[27] 庆宁, 马天峰, 梁晓旭, 林弘都, 卢文华, 盐司橹. 华南地区黒眶蟾蜍的遗传变异和地理分化. 动物分类学报, 2011, 36(2): 356- 367.
[28] 曾昭璇, 黄伟峰. 广东自然地理. 广州: 广东人民出版社, 2001.
[29] 地质矿产部《南岭项目》构造专题组. 南岭区域构造特征及控岩控矿构造研究. 北京: 地质出版社, 1988.
[30] Li G Y, Wang X Z, Zhao Y H, Zhang J, Zhang C G, He S P. Speciation and phylogeography ofOpsariichthysbidens(Pisces: Cypriniformes: Cyprinidae) in China: analysis of the cytochrome b gene of mtDNA from diverse populations. Zoological Studies, 2009, 48(4): 569- 583.
[31] Yang L, Mayden R L, He S P. Population genetic structure and geographical differentiation of the Chinese catfishHemibagrusmacropterus(Siluriformes, Bagridae): evidence for altered drainage patterns. Molecular Phylogenetics and Evolution, 2009, 51(2): 405- 411.
[32] 宗凤书. 灵渠地质地貌初步研究. 中国岩溶, 1990, 9(1): 88- 93.
[33] 赵焕庭, 王丽荣, 袁家义. 琼州海峡成因与时代. 海洋地质与第四纪地质, 2007, 27(2): 33- 40.
[34] 张虎男, 陈伟光. 华南沿海新构造运动与地质环境. 北京: 地震出版社, 1990.
[35] Harold K V. Maps of Pleistocene sea levels in Southeast Asia: shorelines, river systems and time durations. Journal of Biogeography, 2000, 27(5): 1153- 1167.
[36] 中国科学院南海海洋研究所海洋地质研究室. 华南沿海第四纪地质. 北京: 科学出版社, 1978.
[37] Chen X L, Chiang T Y, Lin H D, Zheng H S, Shao K T, Zhang Q, Hsu K C. Mitochondrial DNA phylogeography ofGlyptothoraxfokiensisandGlyptothoraxhainanensisin Asia. Journal of Fish Biology, 2007, 70(S): 75- 93.
[38] 庆宁, 吕凤义, 廖伟群, 赵俊, 丘城锋. 中间黄颡鱼群体遗传变异与亲缘生物地理. 动物学报, 2007, 53(5): 845- 852.
[39] 曾昭璇, 曾宪中. 海南岛自然地理. 北京: 科学出版社, 1989.
[40] 左艳玲, 林岳光, 梁晓旭, 马天峰, 庆宁. 基于mtDNA控制区序列的拟平鳅遗传变异和种群分化. 水产学报, 2009, 33(6): 925- 931.
Population diversity and phylogeography ofHemibarbuslabeoandHemibarbusmediusin South China
LAN Zhaojun1,2, FAN Mingjun1,3, HUANG Xiaolin1,4, ZHAO Jun1,*
1GuangdongProvincialKeyLaboratoryforHealthyandSafeAquaculture,KeyLaboratoryofEcologyandEnvironmentScienceinGuangdongHigherEducation,GuangzhouKeyLaboratoryofSubtropicalBiodiversityandBiomonitor,SchoolofLifeScience,SouthChinaNormalUniversity,Guangzhou510631,China2ShaoguanFisheriesResearchInstitute,Shaoguan512006,China3ShenzhenBGIFisheriesScience&Technologycorporation,Ltd,Shenzhen518083,China4SouthChinaSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Guangzhou510300,China
HemibarbuslabeoandHemibarbusmedius(Cypriniformes: Cyprinidae: Gobioninae:Hemibarbus) are primary freshwater fish species, and their wide distribution makes them ideal models for phylogeographical studies. In this study, variations in the population genetics and phylogeographical patterns of 148 specimens belonging to 8 populations ofH.labeoand 9 populations ofH.mediuscollected from 17 drainage systems in south China were investigated using the nucleotide sequences of the mtDNA Cytochromebgene (1140 bp). The results reveal 128 variable sites (11.23%) within the gene sequences ofH.labeoandH.medius. A total of 41 haplotypes were identified, with the haplotype diversity (h) and nucleotide diversity (π) being 0.954 and 0.02153, respectively. This indicates a high level of genetic diversity and evolutionary potential in both species. The results of the neighbor-joining tree demonstrate thatH.labeoandH.mediusindividuals fall into two major clades (clade I and clade II): clade I is composed of all specimens collected from the Hanjiang and Jiulongjiang Rivers, all of which were identified asH.labeo. Meanwhile, all remaining populations fell into clade II, which includes specimens of bothH.labeoandH.medius. The genetic distance between clade I and clade II was 5.1%, while that betweenH.labeoandH.mediuswas 3.2%. Our results indicate that the specimens collected from these sampling localities may not be differentiated into two or more subspecies. The haplotype network indicates that the populations of the Hanjiang and Jiulongjiang Rivers exhibit a relatively high level of genetic variation compared to that of the rest of the rivers in the region, and that the populations from Hainan Island and Moyangjiang River were genetically close to those from the Pearl River System, but not to those from the Yangtze River System,Hanjiang River, Jiulongjiang River, Minjiang River, Oujiang River and Qiantangjiang River. TheH.mediuspopulations of south China seem to have originated from the Xijiang River and reached south China by one of two routes: one route may be through the Xijiang River to the Beijiang and Dongjiang rivers; and the other may be though the southern Guangxi drainages to Hainan Island, and then to the Moyangjiang and Beijiang rivers through the Qiongzhou Strait. According to the neighbor-joining tree and the haplotype network, five regions of genetic distribution were defined: Hainan Island and the Moyangjiang River region; the Pearl River region; the Yangtze River region; the Hanjiang and Jiulongjiang river region; and the Minjiang, Oujiang, and Qiantangjiang river region. An analysis of molecular variance (AMOVA) showed that the genetic variation of populations among regions was 54.50%; conversely, the genetic variation among populations within regions was 18.64%, and that within the populations of different regions was 26.86%. This indicates that the greatest genetic variation is found among the populations of the different regions. Mismatch distribution and tests of neutrality taking populations ofH.labeoandH.mediusinto account both together and separately were all multimodal types, and the value of Fu, Li′s D, and Tajima′s D for all comparisons were all negative but non-significant or positive. The results reveal relatively stable populations ofH.labeoandH.medius. Mismatch distribution and tests of neutrality also showed that both clade I and clade II were relatively stable; however, the population of the Changhuajiang River has undergone an obvious population expansion.
Hemibarbuslabeo;Hemibarbusmedius; population diversity; phylogeography;Cytochromebgene; South China
国家自然科学基金项目(31372178);公益性行业(农业)科研专项经费资助(201303048);广东省科技计划项目(2015A070706009)
2014- 11- 04;
日期:2016- 01- 15
10.5846/stxb201411042169
*通讯作者Corresponding author.E-mail: zhaojun@scnu.edu.cn
蓝昭军,范明君,黄小林,赵俊.基于线粒体Cytb基因的中国南方唇鱼骨(Hermibarbuslabeo)和间鱼骨(Hermibarbusmedius)种群分化及亲缘地理研究.生态学报,2016,36(19):6091- 6102.
Lan Z J, Fan M J, Huang X L, Zhao J.Population diversity and phylogeography ofHemibarbuslabeoandHemibarbusmediusin South China.Acta Ecologica Sinica,2016,36(19):6091- 6102.
