玉叶金花属植物化学成分及药理作用研究进展
2016-11-26李嘉卢覃培张颖
李嘉+卢覃培+张颖
【摘 要】玉叶金花属植物全世界约120种,分布于热带亚洲、非洲和太平洋诸岛,该属植物多为民间习用药,广泛用于感冒、中暑发热等疾病的防治。其主要化学成分为三萜皂苷、环烯醚萜苷、黄酮类、挥发油等化合物,具有抗病毒、抗炎、抗菌、抗氧化、抗胆碱、抗肿瘤、保肝、抗生育等药理作用。目前关于该属有关文献综述报道鲜见,本文在检索国内外相关文献的基础上,对玉叶金花属的植物资源、化学成分及药理作用进行综述,以期为玉叶金花属植物进一步研究和开发利用提供参考。
【关键词】玉叶金花属;植物资源;化学成分;生物活性
【中图分类号】R282.6 【文献标志码】A【文章编号】1007-8517(2016)15-0039-10
玉叶金花属(Mussaenda Linn.)隶属于茜草科(Rubiaceae)金鸡纳亚科 (Cinchonoideae) 玉叶金花族 (Isertieae),是茜草科中的一个古热带大属,由Linnaeus于1753年命名。全世界约120种,分布于热带亚洲、非洲和太平洋诸岛。中国约有31种、1变种、1变型,产于西南部至东部以及西藏和台湾地区[1]。玉叶金花属植物既可供药用,也可供观赏。具有清热利湿、解毒消肿等功效,主要用于感冒、中暑发热、咳嗽、喉咙肿痛,泄泻,痢疾,肾炎水肿,湿热小便不利,疮疡肿毒,毒蛇咬伤等症。除此之外,民间有作抗生育药用,以及解断肠草、木薯、野菌中毒[2-3]。从本属植物可分离出三萜皂苷、环烯醚萜苷、黄酮和挥发油等化学成分,具有抗病毒、抗炎、抗菌、抗氧化等生物活性。目前关于该属有关文献综述报道鲜见,为全面系统了解玉叶金花属植物,本文从其植物资源、化学成分、药理活性等方面进行综述。
1 中国玉叶金花属植物的资源分布
玉叶金花属植物一般为缠绕藤本、灌木和小乔木,生于背阴的山坡、沟谷、溪旁及灌木丛中。主要特征为具有扩大的花叶,浆果不开裂。玉叶金花中所谓的“玉叶”其实指的是它的萼片变形,一朵玉叶金花的花萼有五枚萼片,其中一枚变形为叶片状,有些栽培品种的五片萼片都会变形成为叶片状。它的花形小而且是金黄色,故名“金花”。我国玉叶金花属植物主要分布在西南部至东部以及西藏和台湾地区。其中异形玉叶金花、黐花玉叶金花、南玉叶金花、广西玉叶金花、广东玉叶金花等15种为我国特有种,目前研究发现玉叶金花、楠藤、展枝玉叶金花、黐花玉叶金花、广西玉叶金花等可供药用[1,4]。植物资源分布见表1。
2 化学成分研究
近年来,中外学者对玉叶金花属植物的化学成分进行了大量研究,从其叶、根皮、花、茎等部位分离得到多种化合物,主要有三萜皂苷、环烯醚萜苷、黄酮类、挥发油等。具体化合物结构有以下几个类型。
2.1 三萜皂苷 三萜皂苷也是该属的特征性成分之一,目前从玉叶金花属植物中分离出大约三十多个三萜皂苷,所含的糖基基本为葡萄糖(glc)、木糖(xyl)及鼠李糖(rha)。从得到的三萜皂苷的皂苷元基本骨架可以分为环菠萝蜜烷型、乌苏烷型及齐墩果烷型皂苷。
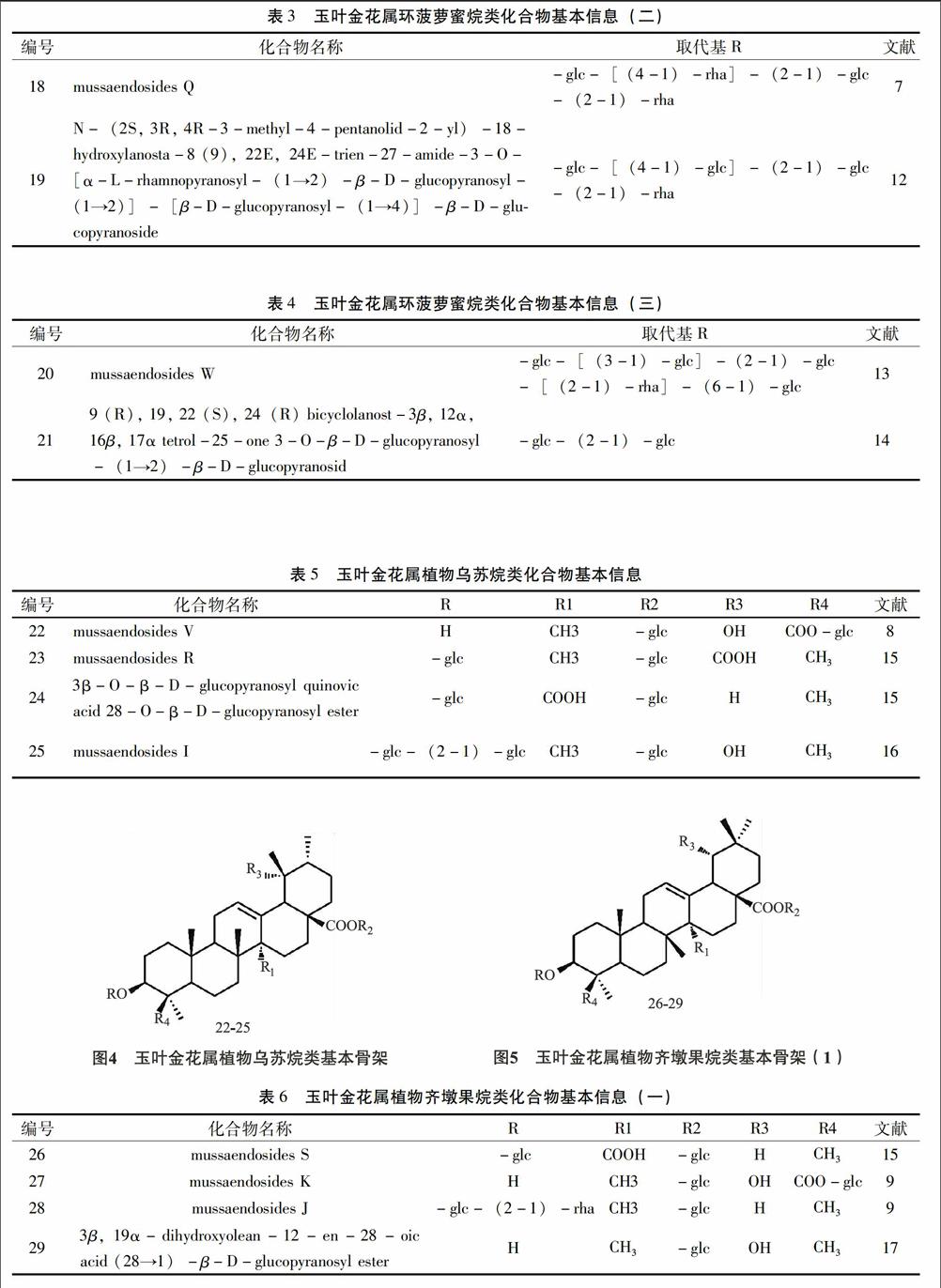
2.1.1 环菠萝蜜烷(cycloartane)型 这个类型的主要特征为10位甲基与9位脱氢形成三元环以及其他变形结构,且大部分在侧链上都还有含有酰胺并五元内酯环,一般都在3位碳上连糖,苷水解后的皂苷元基本为Heinsiagenin A。见图1~3,表2。
2.1.2 乌苏烷(ursane)类 又称为α-香树脂烷(α-amyrane)型,主要的基本骨架为乌苏烷,连糖的部位主要在3位、28位碳上,有时也在24位碳上。见图4,表5。
2.1.3 齐墩果烷(oleanane)类 又称为β-香树脂烷(β-amyrane)型,主要的基本骨架为齐墩果酸,连糖的部位与乌苏烷型一致。见图5~6,表6。
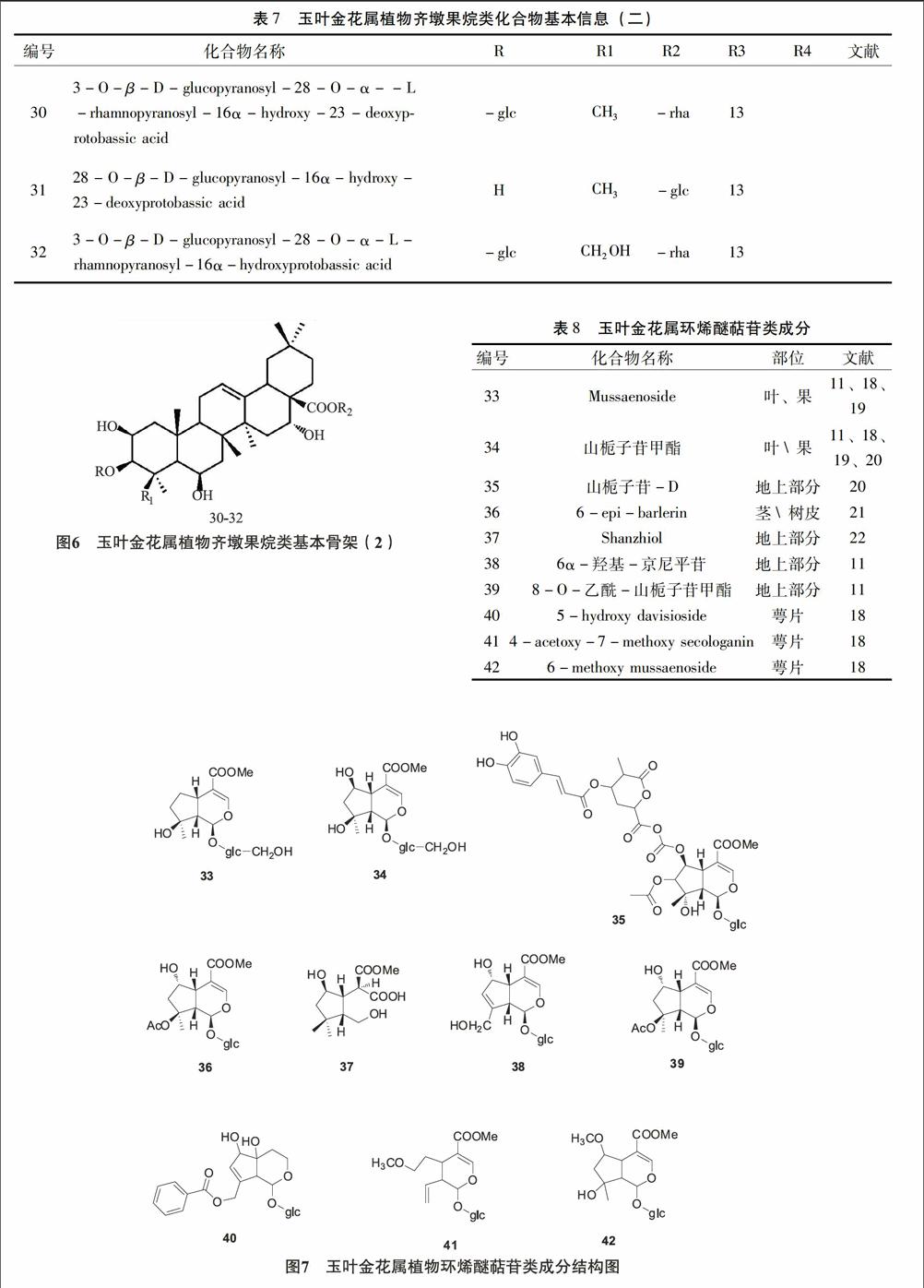
2.2 环烯醚萜苷类 玉叶金花属植物中还含有环烯醚萜苷化合物,该类型也是该属的特征性成分之一,多在1位碳上连上葡萄糖。目前所报道的化合物名称及其结构见图7,表8。
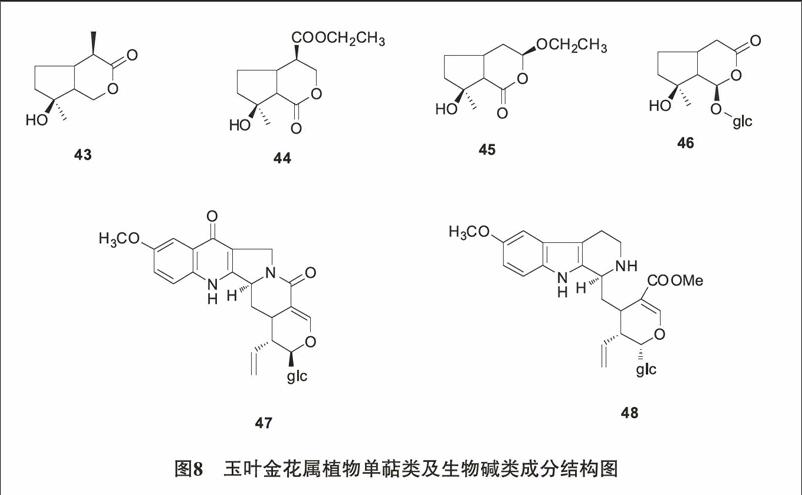
2.3 单萜类及生物碱类 Zhao[23]从玉叶金花的地上部分分离得到四个单萜化合物mussaenins A(43)、B(44)、C(45)、argyol (46)。Shaymaa[14]等在M. luteola中分到2个单萜吲哚生物碱10-methoxy pumiloside(47) 和10-methoxy strictosidine(48) 。结构见图8。
2.4 黄酮及其苷类 已报道中,玉叶金花属植物中含有多种黄酮类化合物[18,20,24]。已报道的成分主要有槲皮素、异槲皮素、鼠李素、芦丁、5,7,4′,-trihy droxy-3′-methoxy flavone、5,7-dihydroxy-6,3′,4′-trimethoxy flavone,还含有黄芪苷、异槲皮苷和kaempferol-3-O-β-D-rutinoside等黄酮苷成分。
2.5 挥发油类 Wang[25]从玉叶金花的叶子中分离鉴定了29个挥发性成分,占总成分的97.2%,挥发油的主要成分是(E)-己烯酸-2-丁酯,(E,E)-2-己烯酸-2己烯酯,β-紫罗酮;还发现玉叶金花的主要芳香成分为β-紫罗酮、芳樟醇、柠檬烯。Wen[26]分别用固相微萃取(HS-SPME)技术和水蒸气蒸馏法(SD)提取海南玉叶金花M. hainanensis茎中的挥发油,采用GC-MS对挥发油进行分析,结果HS-SPME法共鉴定了37个挥发油成分,占总馏分的97.45%,主要成分是2,3-二醇-1,4-二氧己烷和4-羟基-2-丁酮;SD法得到的43个挥发油成分,占总馏分的93.29%,主要成分是1,4-二氧己环-2,3二醇和丙二酸,两种方法提取得到的主要成分有所不同。Hu[27]采用GC-MS法对黐花M. esquirolii脱色和未脱色叶子的石油醚提取物进行挥发油成分测定,共鉴定35个成分,其中主要化学成分是叶绿醇、角鲨烯、亚麻酸和β-谷甾醇醋酸盐。
2.6 其他成分 除以上成分之外,文献报道[14,28,29,30,31]从玉叶金花属植物中还分离得到β-谷甾醇、β-谷甾醇-D-葡萄糖苷、豆甾醇、乌苏酸、齐墩果酸、羽扇豆醇、咖啡酸、对羟基桂皮酸、丁子香酚、阿魏酸、桂皮醛、对苯二酚、7α-morroniside, 7-epiloganin, (7β)-7-O-methylmorroniside等化合物。
3 药理研究
玉叶金花属化学成分多样性及成分的特异性使得此属植物的药理活性广泛,涉及抗炎、抑菌、镇痛、抗胆碱、抗氧化、保肝等作用,表现出较好的药用前景。其植物提取物及其化学成分的主要药理作用包括以下几个方面。
3.1 抗炎、抑菌、镇痛作用 潘利明以及邢文善等[32-33]研究玉叶金花水提物的抗炎、抑菌作用,以二甲苯致小鼠耳肿胀模型、角叉菜胶致大鼠足趾肿胀模型及大鼠棉球肉芽肿模型观察其抗炎作用,并通过体外抑菌试验观察抑菌作用,结果表明玉叶金花水提物对急、慢性炎症有明显的抑制及体外抑菌作用,玉叶金花提取液明显抑制小鼠耳廓肿胀(P<0.05)、大鼠棉球肉芽肿以及大鼠足跖肿胀的形成(P<0.05);玉叶金花水提物对金黄色葡萄球菌、大肠埃希菌、肺炎球菌、链球菌、痢疾杆菌均有明显的抑菌作用,其最小抑菌浓度(MIC)分别为125,31.3,15.7,62.5,62.5 mg/kg-1。潘利明等[34]筛选玉叶金花水提物不同萃取部位抗炎活性部位,结果玉叶金花水提物乙酸乙酯萃取部位、正丁醇萃取部位及水溶性部位均可显著减轻二甲苯致炎小鼠的耳肿胀度(P<0.05)及由角叉菜胶引起的大鼠1、2、3h的足肿胀度(P<0.05), 为玉叶金花水提物抗炎活性部位,有抑制急性炎症的作用。潘利明等[35]研究玉叶金花苷酸甲酯的抗炎、镇痛、抑菌作用,以二甲苯致小鼠耳肿胀模型观察其抗炎作用;通过醋酸致小鼠扭体实验及热板法实验观察其镇痛作用;采用纸片扩散法观察抑菌圈直径, 研究玉叶金花苷酸甲酯对7种常见细菌的抑制效果。结果表明玉叶金花苷酸甲酯具有明显的抗炎、镇痛及抗菌作用,玉叶金花苷酸甲酯的中、高剂量(0.10, 0.15g/kg)能显著减轻二甲苯致炎小鼠的耳肿胀度(P<0.05);对热刺激引发的小鼠痛反应时间有明显的延长作用;对金黄色葡萄球菌、大肠杆菌、肺炎克雷伯菌、伤寒杆菌、痢疾杆菌、铜绿假单胞菌、阴沟肠杆菌均有抑制作用,其MIC分别为2.5、10、0.3125、1.25、1.25、10、0.625mg/mL。潘利明等[36]研究玉叶金花苷酸甲酯对LPS诱导RAW264.7巨噬细胞NO分泌量的影响,采用LPS诱导RAW264.7细胞建立细胞炎症反应模型,利用NO试剂盒检测NO分泌量。结果玉叶金花苷酸甲酯能够显著减少LPS诱导的RAW264.7细胞NO的产生和释放,这可能是其发挥抗炎作用的机制。 Kim等[13]从大叶玉叶金花M.macrophylla根皮中分离得到4个三萜皂苷和2个三萜化合物,并进行对2种口腔致病菌的抑制实验,结果表明6个化合物对牙龈卟啉单胞菌的活性较强,对致龋细菌变形链球菌活性较弱。Jayasinghe等[37]从斯里兰卡13种茜草科和2种楝科植物的90种提取物中筛选抗菌活性成分,发现M.frondosa对6种微生物均显示具有较宽抗菌谱。Chowdhury等[38]采用纸片扩散法评价孟加拉国五种药用植物的抗菌活性,结果M. macrophylla四氯化碳提取物对甲型副伤寒沙门氏菌的抑制圈为15.0mm,对黑曲霉的抑制圈为13.0mm。Islam等[39]研究M.roxburghii叶子的不同提取物对13病原微生物抗菌效果,其中甲醇提取物四氯化碳和氯仿萃取部位均显示最高的抗菌活性。氯仿萃取物显示对芽孢杆菌的最大抑菌环为16.0mm,MIC和 MBC分别为7.81μg/mL和250μg/mL。Pedersen等[40]筛选毛里求斯7种茜草科植物的27种提取物的抗菌活性,发现M.arcuata果实提取物对革兰氏阳性细菌(金黄色葡萄球菌),革兰氏阴性细菌(大肠杆菌、铜绿假单胞菌和伤寒沙门氏菌)均有抑菌作用。Basavaraja等[41]筛选M.frondosa树皮不同溶剂提取物的抗菌和镇痛活性,结果甲醇提取物表现出与环丙沙星几乎相等的抗菌活性,比克霉唑更强的抗真菌活性;氯仿提取物表现出与阿司匹林相同的镇痛活性。De等[22]从M.roxburghii.的地上部分分离了1个新的环烯醚化合物shanzhiol,并发现其对金黄色葡萄球菌和大肠杆菌有中等抑制活性。Chowdury等[42]报道M.roxburghii 叶子甲醇提取物有抗炎作用, 通过离体人红细胞膜稳定的实验来进行研究,结果表明抗炎活性与提取物浓度成依赖性,甲醇提取物在浓度为31.25μg/mL和1000μg/mL时,分别显示53.79%和86.93%抗炎活性。Suni等[43]研究M.roxburghii根部提取物的体外抗炎活性,结果显示乙酸乙酯提取物的抗炎抑制百分比最高为48.43%。
3.2 抗胆碱作用 徐任生等[44]从玉叶金花M.pubescens中分离得到三萜皂苷mussaendoside O, 实验表明其为M胆碱受体拮抗剂,可以显著抑制加兰他敏引起的泪腺和唾液腺的分泌, 也可以抑制由卡巴胆碱诱发的豚鼠回肠肌收缩,并推测它是其解蘑菇毒的活性成分。曾宪彪等[45]研究玉叶金花皂苷U对M胆碱能神经支配器官(回肠平滑肌、瞳孔、唾液腺)的影响, 以阿托品为对照,观察玉叶金花皂苷U对不同终浓度溴化乙酰胆碱引起肌收缩力和对毛果芸香碱造成M胆碱能神经兴奋的影响,实验结果表明玉叶金花皂苷U能抑制M胆碱能神经兴奋。
3.3 抗氧化作用 Li等[29]研究海南玉叶金花的化学成分及其乙酸乙酯、正丁醇、水和70%乙醇提取物清除DPPH自由基的能力,结果70%乙醇提取物和分离出的9个化合物均具有清除自由基的能力。Islam等[46]研究M.roxburghii甲醇提取物的抗氧化活性,试验结果表明甲醇提取物以剂量依赖的方式表现出中等的抗氧化性能。Vidyalakshmi等[47]报道M.dona aurora的乙酸乙酯萃取物具有较高的抗氧化活性。Vidyalakshmi等[48] 报道M.glabra的白色和粉色花均有较强的清除自由基的活性,IC50分别为92.79和122.45μg/mL。Siju等[49] 对M.Frondosa乙醇和水提取物进行体外抗氧化活性测试,结果表明乙醇提取物有良好自由基清除活性,自由基清除活性随着提取物浓度增加而增大。
3.4 保肝作用 Kandulva等[47]报道从M.dona aurora萼片的乙酸乙酯萃取物中分离得到两个环烯醚萜苷sanshiside D 和lamalbide,其中sanshiside D表现出大于水飞蓟素的保肝活性,可降低血清中ALT和AST酶水平。Eswaraiah等[50]以水飞蓟素作对照,口服给药CCl4诱导肝脏损伤的纯种白化病老鼠, 结果老鼠血清中SGOT、 SGPT、ALP和总胆红素显著降低,并观察了肝脏的各种病理切片,证明M.erythrophylla茎的乙酸乙酯和甲醇提取物对CCl4诱导的肝脏损伤老鼠具有保肝活性。Rojin等[51] 研究M.erythrophylla叶子提取物对乙酰氨基酚诱导的大鼠急性肝损伤的保肝作用, 保肝活性程度大小依据测量生化指标如血清谷草酸盐转氨酶(SGOT)、血清谷丙转氨酶(SGPT)、总胆红素(TBL)等的水平。结果叶提取物(200mg/kg)显著降低了SGPT、SGOT、TBL的提升水平,并增加GSH、SOD,GPx的、血浆铜蓝蛋白的水平,显示叶子乙醇提取物提取物具有显著保肝活性。Rojin等[52]通过使用测量相关生化指标的水平,评估M.erythrophylla叶乙醇提取物对酒精诱导的大鼠急性肝损伤的保护作用,结果叶提取物(200mg/kg)显著地降低SGPT、SGOT、总胆红素提升水平,增加GSH、SOD、GPx和TAC,也表明了M. erythrophylla叶的乙醇提取物具有显著保肝活性。
3.5 抗癌及细胞毒性作用 Islam等[46]通过观察艾氏腹水癌(EAC)细胞凋亡,研究M. roxburghii甲醇提取物的抗癌活性,选用三个不同剂量(20、40和60mg/kg)给药接种了EAC细胞的小鼠,观察不同的参数,如肿瘤重量, EAC小鼠存活时间,EAC细胞生长抑制,EAC细胞的形态变化和癌细胞核损害等。实验结果显示每天腹腔注射甲醇提取物60mg/kg抗癌活性最高。细胞生长抑制率为81.4%,肿瘤负荷为78.5%(P<0.01)。其还使EAC老鼠的寿命显著增加(73.5%, P<0.01)。Hariharan等[53]报道M.erythrophylla具有抗子宫颈癌细胞的活性,作用机制是干扰破坏细胞分裂时DNA的基因组的排序。Chowdury等[42]报道M.roxburghii 叶子甲醇提取物有抗癌活性,其最小抗癌活性LC50值是282.03μg/mL,相当于硫酸长春新碱(12.59μg/mL)。Vidyalakshmi等[54]实验发现M.queensirkit鲜花的70%甲醇提取物具有细胞毒性。Akter等[55]筛选19种孟加拉国药用植物提取物细胞毒性,结果M. glabrata叶子提取物对胃癌细胞有细胞毒活性,IC50为1.15mg/mL。Islam等[39]报道M.roxburghi叶子石油醚和四氯化碳萃取部位有很强的细胞毒性,LC50分别为0.52和0.62μg/mL。
3.6 抗血栓作用 Chowdury等[42]评估M.roxburghii叶子甲醇提取物的溶栓活性,结果显示其溶栓活性为49.09%。Suni等[43]研究M.roxburghii的根提取物体外抗血栓活性,乙酸乙酯提取物显示显著血栓溶解活性为(48.85±7.38)%。
3.7 抗惊厥作用 Kar DM等[56]研究M.philippica叶子和萼片的醇提物的抗痉挛的作用,结果表明浓度为100、200mg/kg的提取物能显著控制在MES,PTZ、马钱子碱和picrotoxin-induced发作,并显示惊厥剂量依赖性,表明M.philippica叶子和萼片醇提物可能帮助控制大、小癫痫病发作。
3.8 抗病毒作用 Li等[57]对中国南方21种传统中药材水提物抗病毒筛选实验中发现从玉叶金花M. pubescens水提物具有抑制人类的呼吸道合胞体病毒(RSV)的作用,IC50为12.5~32μg/mL。
3.9 抗生育作用 徐俊平等[5]用60%,95%乙醇提取玉叶金花,提取物进行大鼠抗早孕药理实验,结果显示受孕率均为28.6%;刘星堦等[28]对玉叶金花M.pubescens抗早孕化学成分筛选研究表明,玉叶金花水煎液和81%乙醇沉淀物为抗早孕活性的有效部位。
4 结语
我国玉叶金花属植物的药用资源十分丰富,从玉叶金花属植物中分离出来的主要化学成分为三萜皂苷、环烯醚萜苷、黄酮类、挥发油等化合物,具有抗炎、抗菌、抗病毒、抗氧化、抗胆碱、抗肿瘤、保肝等药理活性,以玉叶金花为原料开发出来的中成药主要有玉叶解毒颗粒、玉叶清火片、三金感冒片等。目前国内研究和应用最多的品种是玉叶金花(M.pubescens),功能主治集中在抗炎抗菌抗病毒方面,其他药效活性没能充分开发出来,而且我国玉叶金花属植物有31种,分布在我国西南部至东部的大部分省市地区,资源优势非常明显,应该加强对其他品种化学成分、药效、毒理研究,使得玉叶金花属植物得到进一步的开发和应用。
参考文献
[1] 中国科学院中国植物志编辑委员会. 《中国植物志》71(1)卷[M].北京:科学出版社,1999:283.
[2] 王国强. 《全国中草药汇编》(卷二)[M].北京:人民卫生出版社,2014:304.
[3] 南京中医药大学.《中药大辞典》(上)[M].2版.上海:上海科学技术出版社,2014:202.
[4] 广西壮族自治区中医药研究所.广西药用植物名录[M].南宁:广西人民出版社,1986:391-392.
[5] 徐俊平, 徐任生, 骆姿, 等. 抗生育药山甘草的新三萜皂苷[J]. 化学学报, 1991, 49(6): 621-624.
[6] Xu J P, Xu R S, Luo Z, et al. Mussaendosides M and N, new saponins from Mussaenda pubescens[J]. Journal of Natural Products, 1992, 55(8): 1124-1128.
[7] Zhao W M, Xu J P, Qin G W, et al. New triterpenoid saponins from Mussaenda pubescens[J]. Journal of Natural Products, 1994, 57(12): 1613-1618.
[8] Zhao W M, Wolfender J L, Hostettmann K, et al. Triterpenes and triterpenoid saponins from Mussaenda pubescens[J]. Phytochemistry, 1997, 45(5): 1073-1078.
[9] Zhao W M,Xu R S, Qin G W, et al. Saponins from Mussaenda pubescens[J]. Phytochemistry, 1996, 42(4): 1131-1134.
[10] Zhao W M, Wang P, Xu R S, et al. Saponins from Mussaenda pubescens[J]. Phytochemistry, 1996, 42(3): 827-830.
[11] Zhao W M., Xu R S, Qin G., et al. Chemical constituents from Mussaenda pubescens, Nat[J].Prod.Sci.1,1995:61-65.
[12] Mohamed S M, Bachkeet E Y, Bayoumi S A, et al. Potent antitrypanosomal triterpenoid saponins from Mussaenda luteola[J]. Fitoterapia, 2015, 107: 114-121.
[13] Kim N C, Desjardins A E, Wu C D, et al. Activity of Triterpenoid Glycosides from the Root Bark of Mussaenda macrophylla against Two Oral Pathogens[J]. Journal of Natural Products, 1999, 62(10): 1379-1384.
[14] Mohamed S M, Backheet E Y, Bayoumi S A, et al. New cycloartane saponin and monoterpenoid glucoindole alkaloids from Mussaenda luteola[J]. Fitoterapia, 2016, 110: 129-134.
[15] Zhao W M, Xu J P, Qin G W, et al. Saponins from Mussaenda pubescens[J]. Phytochemistry, 1995, 39(1): 191-193.
[16] Zhao W M, Yang G J, Xu R S, et al. New saponins from Mussaenda pubescens[J]. Natural Product Letters, 1996, 8(2): 119-126.
[17] 张颖, 李嘉, 姜平川. 玉叶金花化学成分研究[J].中药新药与临床药理, 2013, 24(3):278-281.
[18] Kamurthy H, Viddae J, Dontha S, et al. Phytochemical Screening on Mussaenda Philipica Sepals—Isolation of Iridoid Glycosides and Flavones[J]. JPC-Journal of Planar Chromatography-Modern TLC, 2014, 27(2): 93-96.
[19] Takeda Y, Nishimura H, Inouye H. Two new iridoid glucosides from Mussaenda parviflora and Mussaenda shikokiana[J]. Phytochemistry, 1977, 16(9): 1401-1404.
[20] Vidyalakshmi K S, Rajamanickam G. An iridoid with anticancer activity from the sepals of Mussaenda dona aurora[J]. Indian Journal of Chemstry -Section B, 2009, 48: 1019-1022.
[21] Dinda B, Majumder S, Arima S, et al. Iridoid glucoside and sterol galactoside from Mussaenda macrophylla[J]. Journal of Natural Medicines, 2008, 62(4): 447-451.
[22] De Utpal C, Ghosh R, Chowdhury S, et al. New iridoid from aerial parts of Mussaenda roxburghii[J]. Natural Product Communications, 2012, 7(1): 1-2.
[23] Zhao W M, Yang G J, Xu R S, et al. Three monoterpenes from Mussaenda pubescens[J]. Phytochemistry, 1996, 41(6): 1553-1555.
[24] Ranarivelo Y, Skaltsounis A L, Andriantsiferana M, et al. Glycosides from Mussaenda arcuata Lam. ex Poiret leaves[C]. Annales Pharmaceutiques Fran aises. 1990, 48(5): 273-277.
[25] Wang J M, Kang W Y. Aroma volatile compounds in Mussaenda pubescens[J]. Chemistry of Natural Compounds, 2013, 49(2): 358-359.
[26] Qiao W T, Liu Y H, Yuan K. Extraction and Analysis of Volatile Oil of Mussaenda hainanensis Merr. by GC/MS[J]. Asian Journal of Chemistry, 2009, 21(4): 2887-2892.
[27] Hu X Q, Yang Y, Su Z D, et al. GC-MS Analysis of Petroleum Ether Extracts in Resource Plant of Mussaenda esquirolli Levl. Leaves[J]. Asian Journal of Chemistry, 2014, 26(4): 1195-1198.
[28] 刘星堦, 梁国建, 蔡雄, 等. 山甘草化学成分及其抗生育活性研究[J]. 上海医科大学学报 (医学版), 1986, 13(4): 273-276.
[29] Li Y X, Qiao W T, Yuan K. Isolation and structural elucidation of chemical constituents of Mussaenda hainanensis Merr[J]. Journal of Medicinal Plants Research, 2011, 5(8): 1459-1465.
[30] Dinda B, Debnath S, Majumder S, et al. Chemical constituents of Mussaenda incana[J]. Indian Journal of Chemstry -Section B, 2005, 44(11): 2362-2366.
[31] Yuan K, Qiao W T, Yin M. Phytochemical Studies of Mussaenda hainanensis Merr[J]. Asian Journal of Chemistry, 2009, 21(9): 7138-7142.
[32] 潘利明, 林励, 胡旭光. 玉叶金花水提物的抗炎抑菌作用[J]. 中国实验方剂学杂志,2012, 18(23): 248-251.
[33] 邢文善, 李艳华, 朱玉花, 等. 玉叶金花提取液对动物模型抗炎抑菌作用研究[J]. 中国实验方剂学杂志,2013, 19(19): 267-270.
[34] 潘利明, 林励. 玉叶金花水提物不同萃取部位的抗炎活性研究[J]. 广东药学院学报,2013, 29(5): 530-532.
[35] 潘利明, 林励. 玉叶金花苷酸甲酯抗炎、镇痛、抑菌作用研究[J].中成药,2015, 37(3): 633-636.
[36] 潘利明, 林励. 玉叶金花苷酸甲酯对LPS诱导RAW264.7巨噬细胞NO分泌量的影响[J]. 中医药导报,2014, 4: 58-60.
[37] Jayasinghe U L B, Jayasooriya C P, Bandara B M R, et al. Antimicrobial activity of some Sri Lankan Rubiaceae and Meliaceae[J]. Fitoterapia, 2002, 73(5): 424-427.
[38] Chowdhury S R, Akter S, Sharmin T, et al. Antimicrobial Activity of five medicinal plants of Bangladesh[J]. Journal of Pharmacognosy and Phytochemistry, 2013, 2(1): 164-170.
[39] Islam F, Kuddus R, Latif F, et al. Preliminary antimicrobial activity and cytotoxicity of leaf extracts of Mussaenda roxburghii Hook. f[J]. Bol. latinoam. Caribe Plantas Med. Aromát, 2013, 12(6): 612-617.
[40] Pedersen O, Gurib-Fakim A, Subratty H, et al. Pharmacological properties of seven medicinal plants of the Rubiaceae from Mauritius[J]. Pharmaceutical Biology, 1999, 37(3): 202-207.
[41] Basavaraja B M, Vagdevi H M, Srikrishna L P, et al. Antimicrobial and analgesic activities of various extracts of Mussaenda frondosa L. bark[J]. Journal of Global Pharma Technology, 2011, 3(2): 14-17.
[42] Chowdury M I A, Alam M N, Chowdhury S, et al. Evaluation of Ex-vivo Anti-arthritic, Anti-inflammatory, Anti-cancerous and Thrombolytic Activities of Mussaenda roxburghii Leaf[J]. European Journal of Medicinal Plants, 2015, 10(4): 1-7.
[43] Suni F A, Ansari P, Sikder B, et al. Investigation of the Different Ethnopharmacological Activity of Fractional Root Extracts of Mussaenda roxburghii in in vitro Model[J]. European Journal of Medicinal Plants, 2015, 10(2): 1-9.
[44] Xu R S, Zhao W M, Xu J P, et al. Studies on bioactive saponins from Chinese medicinal plants[J]. Advance in Experimental Medicine and Biology, 1996, 404: 371-382.
[45] 曾宪彪, 李嘉, 韦桂宁,等. 玉叶金花皂苷U对M胆碱能神经支配器官的影响[J]. 中国实验方剂学杂志,2015, 20:159-162.
[46] Islam F, Raihan O, Chowdhury D, et al. Apoptotic and antioxidant activities of methanol extract of Mussaenda roxburghii leaves[J]. Pak. J. Pharm. Sci, 2015, 28(6): 2027-2034.
[47] Vidyalakshmi K S, Nagarajan S, Vasanthi H R, et al. Hepatoprotective and Antioxidant Activity of Two Iridoids from Mussaenda ‘dona aurora[J]. Zeitschrift für Naturforschung C, 2009, 64(5-6): 329-334.
[48] Vidyalakshmi K S, Dorni A I, Vasanthi H R, et al. Free radical scavenging activity of Mussaenda glabra[J]. Journal of Applied Sciences, 2006, 6: 2251-2256.
[49]Siju E N, Rajalakshmi G R, Kavitha V P, et al. In Vitro antioxidant activity of Mussaenda Frondos[J]. International Journal of PharmTech Research, 2010, 2: 1236-1240.
[50] Chinna-Eswaraiah M, Satyanarayana T. Hepatoprotective activity of extracts from stem of Mussaenda erythrophylla lam. against carbon tetrachloride-induecd toxicity in rats[J]. Asian Journal of Pharmaceutical Research and Health Care, 2010, 2(1): 23-31.
[51] Rojin T S, Shetty S, Holla R. Determination of hepatoprotective effect of Mussaenda erythrophylla in paracetamol induced hepatotoxicity[J]. International Journal of Basic & Clinical Pharmacology, 2015, 4(6): 1124-1128.
[52] Rojin T S, Shetty S, Holla R. Hepatoprotective Effect of Mussaenda Erythrophylla and Aegle Marmelos in Ethanol Induced Rat Hepatotoxicity Model[J]. International Journal of Applied Biology and Pharmaceutical Technology, 2015, 6(3): 223-228.
[53] Hariharan M, Rajan A. Biomarker for genotoxicity—evaluation of the antineoplastic activity of Mussaenda erythrophylla in cultured HeLa cells[J]. New Biotechnology, 2009, 25: S284.
[54] Vidyalakshmi K S, Dorni A C, Vasanthi H R. Anti-Mitotic and Cytotoxic Effect of Mussaenda queensirkit[J]. Journal of Pharmacology and Toxicology, 2007, 2(7): 660-665.
[55] Akter R, Uddin S J, Grice I D, et al. Cytotoxic activity screening of Bangladeshi medicinal plant extracts[J]. Journal of Natural Medicines, 2014, 68(1): 246-252.
[56] Kar D M, Rout S K, Moharana L, et al. Evaluation of anticonvulsant activity of hydroalcoholic extract of Mussaenda philippica on animals[J]. Journal of Acute Disease, 2014, 3(1): 46-50.
[57] Li Y L, Ooi L S M, Wang H, et al. Antiviral activities of medicinal herbs traditionally used in southern mainland China[J]. Phytotherapy Research, 2004, 18(9): 718-722.
(编辑:熊金富)
