乳头管灌注LPS对家兔血液中NO和NOS含量的影响
2016-11-25袁曦曹随忠杨齐
袁曦 曹随忠 杨齐
摘 要:目的:探讨急性乳腺炎对家兔血液中一氧化氮(NO)含量和一氧化氮合酶(NOS)活力的影响,为临床治疗家兔乳腺炎提供依据。方法:通过家兔乳头管灌注LPS建立家兔乳腺炎模型,在灌注内毒素前后不同时间点分别测定健康家兔和患病家兔血清中NO的含量和NOS活力,判定乳头管灌注LPS对家兔血液中NO含量和NOS活力的影响。结果:乳头管灌注LPS之后,有明显的体温变化,乳房先稍有肿胀,12h后变红肿,48h变坚硬,5d硬度下降。NO含量和NOS活力均在灌注LPS后上升并在6h达到最高值,NO含量在24h时开始下降,72h时基本下降到接种前水平;NOS活力在12h开始下降,48h时又开始增加。结论:乳头管灌注LPS对家兔血液中NO含量和NOS活力有影响,NO和NOS在乳腺炎的发展过程中有一定的作用,为临床治疗提供理论依据。
关键词:LPS;家兔;NO;NOS
中图分类号 S858.291 文献标识码 A 文章编号 1007-7731(2016)19-0085-04
Abstract:[Objective]To explore the effect of acute mastitis on nitric oxide (NO) content and nitric oxide synthase (NOS) activity in rabbit blood , provide the basis for clinical treatment of mastitis.[Methods]Through the rabbits nipple tube perfusion LPS to establish rabbit mastitis model.at different time pointsbefore and after the infusion of endotoxin,determination of NO content and NOS activity in serum of healthy and diseased rabbits,to determine the effect of nipple tube perfusion LPS on NO content and NOS activity in rabbit blood.[Results]NippletubeafterLPSinfusion, showing significant changes in body temperature,Breast to slightly swollen, 12 hours later become inflamed,48hours become hard,5 days later decreased hardness,NO content and NOS activity were increased after LPS perfusion,And reached the highest value in the 6 hours,NO content began to decline in 24 hours,dropped to the level before vaccination in 72 hours;NOS activity began to decline in 12 hours,began to increase again in 48 hours.[Conclusion]Nipple tube perfusion LPS on rabbit blood NO content and NOS activity, NO and NOS have a certain role in the development process of mastitis, providing a theoretical basis for clinical treatment.
Key words:LPS;Rabbits;NO;NOS
乳腺炎又名乳房炎,是当今世界各国奶牛业中最常见也是造成经济损失最严重的疾病之一。奶牛患上乳腺炎后,不仅会影响牛奶的产量,降低牛奶的品质,还易延长产后发情和妊娠的时间,甚至使病牛失去生产性能,使处于产奶高峰期的奶牛过早被淘汰,给奶牛行业带来了巨大的经济损失[1]。乳腺炎主要是由多种非特定的病原微生物引起,目前已发现约有130多种,常见的有23种,其中细菌14种,霉形体2种,真菌及病毒7种,给乳腺炎的防治带来了很大的困难[2],其中大肠杆菌和金黄色葡萄球菌是最常见的分离菌株。脂多糖(LPS)作为革兰氏阴性菌的细胞壁的主要成分,是导致炎症和感染的重要原因。炎症、感染、创伤后早期,病变部位的血管包括微循环血管中即出现白细胞黏附现象。黏附的白细胞释放炎症介质、活性氧等,使组织损伤加重[3]。NO参与炎症反应,作用比较复杂,有广泛的生物活性[4]。
一氧化氮(NO)是一种由血管内皮细胞分泌的内源性血管舒张因子[5]。一氧化氮为气体自由基,易于氧分子、超氧自由基等反应,在体内极不稳定,生物半衰期短,只有3~5s,微溶于水,具有亲脂性,能透过生物膜扩散,发挥信息功能[6]。NO在生物体内主要由一氧化氮合酶催化合成,在NADPH和/或BH4存在的条件下,NOS催化L-精氨酸末端胍基中的一个氮原子和氧分子反应生成NO和胍氨酸[7]。NO在循环系统中有着广泛的生理作用:血管内皮释放的NO通过升高血管平滑肌cGMP水平,使血管平滑肌松弛,引起血管扩张,血压下降,调节血管张力等;NO抑制淋巴细胞、中性粒细胞和单核细胞及血小板凝集和黏附到内皮细胞上;NO对血管通透性的影响与血管的性质有关,在大血管中降低通透性,在微血管中则促进[8]。
一氧化氮合酶(NOS)包括三个酶家族,神经元型一氧化氮合酶(NOS-Ⅰ),诱导型一氧化氮(NOS-Ⅱ)和内皮一氧化氮合酶(NOS-Ⅲ),神经元内和内皮细胞内的一氧化氮合酶统称结构型一氧化氮合酶(TNOS)[9]。TNOS可源源不断的产生,而iNOS只在受到感染或其他方面的刺激才产生。NOS可以催化L-精氨酸生成氨甲酰鸟氨酸,同时伴随着NADPH的氧化,从而生成游离的NO[10]。微量LPS刺激成纤维细胞可引起细胞增殖,并增加细胞内诱导型一氧化氮合酶(iNOS)的表达[11]。
本研究通过乳头管灌注LPS建立家兔急性乳腺炎模型[12,13],测定乳腺炎发展过程中NO含量和NOS活性,根据其变化,探究乳腺炎过程中NO和NOS的作用,为临床治疗提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 5只健康的怀孕15d左右的家兔(购于四川省名山县),均为初产兔,体重4.0kg左右,常规饲养。
1.1.2 试验试剂 试剂盒:一氧化氮试剂盒、一氧化氮合酶试剂盒(均购于南京建成生物试剂研究所)。药品:大肠杆菌内毒素(Sigma公司)、灭菌生理盐水、75%酒精。
1.1.3 试验仪器 Varioskan 酶标仪(Thermo公司,美国)、血常规检测仪、注射器、头皮针、EP管、真空采血管、移液枪、96孔板、温度计。
1.2 试验方法
1.2.1 LPS灌注液的配制及灌注方法 LPS(Sigma公司)由O55:B5血清型大肠杆菌分离提纯,灭菌生理盐水配成1mg/mL,-20℃避光保存备用。灌注LPS剂量按150μg/kg体重剂量从第三对乳腺乳头管注入。灌注LPS之前的泌乳母兔作为对照组,灌注LPS之后的为实验组。母兔分娩后仔兔自然哺乳,于第7天将母兔与仔兔分离。用75%的酒精对第三对乳腺区域进行消毒,然后用1mL的注射器轻轻刺破皮肤沿乳头管插入,注入一定量的LPS。
1.2.2 血样的采集 采血的时间点为灌注LPS之前2h,灌注后6h、12h、24h、48h、72h和5d。采集母兔耳缘静脉血2mL,将全血分成2份,一份全血抗凝用于血常规的测定;另一份全血于2 000r/min离心15min分离血清,-20℃保存,用于血清NO含量和NOS活力的测定。
1.2.3 测试指标及方法
1.2.3.1 体温的测定 在采血时间点灌注LPS前2h,灌注后6h、12h、24h、48h、72h和5d,在采血前测直肠体温,并观察乳房局部变化。
1.2.3.2 血清一氧化氮NO含量测定 采用硝酸还原酶法,按南京建成生物工程研究所提供的NO试剂盒说明测定。
1.2.3.3 血清一氧化氮合酶(NOS)活力的测定 采用显色反应法,按南京建成生物工程研究所提供的NOS测定试剂盒说明测定。
1.2.3.4 母兔血液白细胞(WBC)、淋巴细胞(LYM)、单核细胞(MID)的总数的测定 每次采血后,用其中一份全血进行血常规检测。
1.3 数据统计分析 在采血后立即做血常规检测,NO和NOS的数据应用Excel 2003软件整理,SPSS1 3.0软件对所得数据进行一维方差分析、t检验,所有数据均用平均数±标注差(X±SD)表示,组间用t检验其差异显著性[14-15]。
2 结果与分析
2.1 评价乳房炎模型指标的变化
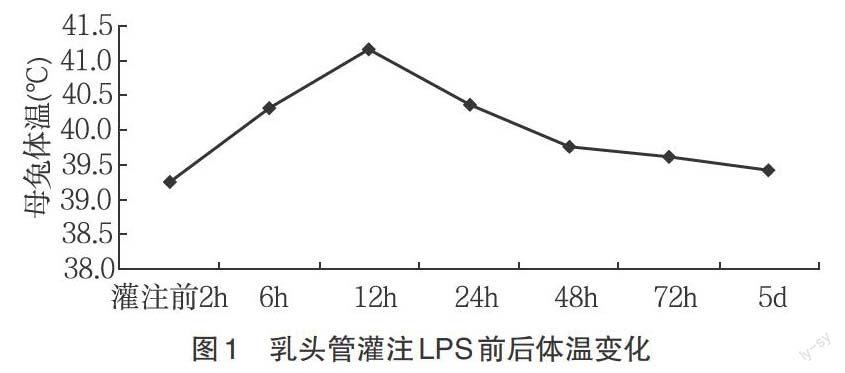
2.1.1 母兔的体温变化 母兔均在灌注LPS后6~12h内的温度显著高于对照组(P<0.05),12h时体温均上升到41℃,分别于24h、48h时体温恢复到对照组水平(图1)。
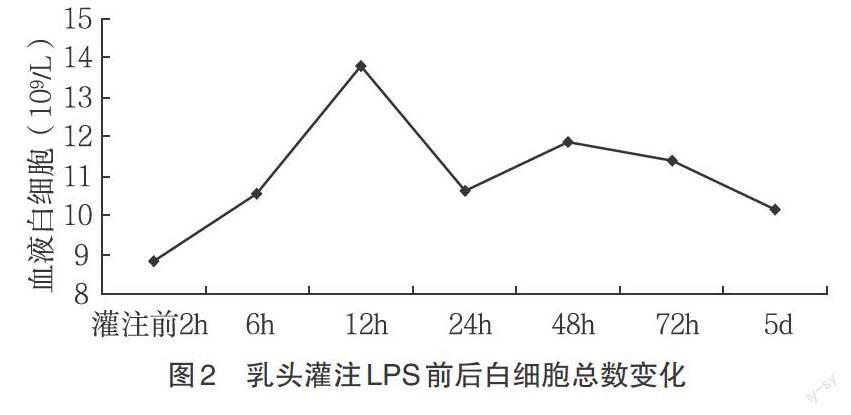
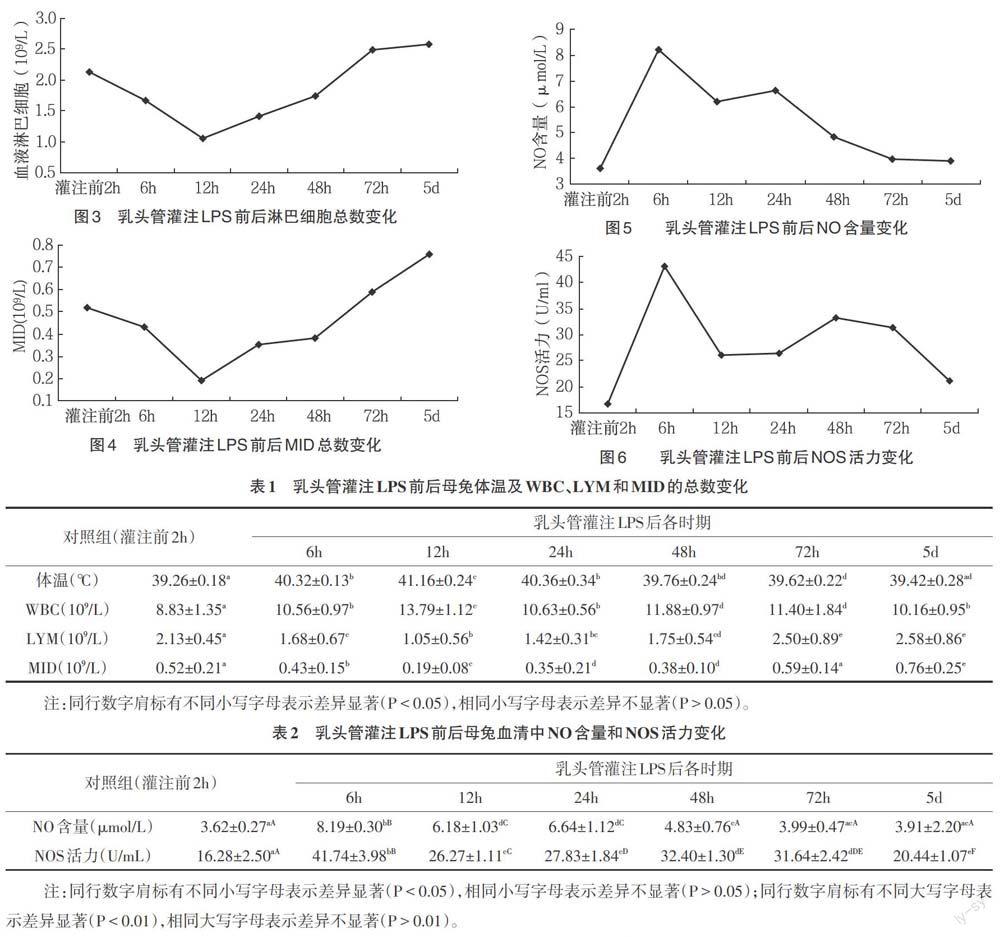
2.1.2 母兔血液白细胞(WBC)、淋巴细胞(LYM)、中间细胞(MID)的总数动态变化 灌注LPS后6h,白细胞总数升高,72h后开始降低,到第5d是恢复到对照组水平(图2)。淋巴细胞和中间细胞(包括单核细胞、嗜酸性细胞和嗜碱性细胞)在灌注LPS后6h总数逐渐降低,24h后逐渐升高,72h时恢复到对照组水平(图3、图4)。
2.2 NO含量和NOS活力的变化 乳头管灌注LPS后,NO含量先稍有升高,24h时开始下降,72h时基本下降到接种前水平。NOS活力在6h时稍有上升趋势,12h开始回降,48h时又开始增加(图5、图6、表1、表2)。
3 讨论与结论
3.1 讨论
3.1.1 对乳房炎模型的评价 乳房内注入内毒素后,动物体温升高,乳房局部的临床变化等全身症状是急性期病理反应的一种表现[16]。乳房局部变化先稍有肿胀,12h后变红肿,48h变坚硬,5d坚硬降低。体温的变化虽然不是乳房炎诊断的特征性指标,但可反应疾病发生时的全身反应。血液中炎性细胞总数的动态变化进一步证实乳房炎的发展过程及动物机体对灌注LPS后的反应及抵御能力。中性粒细胞增多常见于感染性疾病和一般炎性疾病,淋巴细胞减少见于中性粒细胞绝对增多的疾病,单核细胞减少见于急性传染病的初期及各种疾病的垂危期[17]。本实验中的乳房炎模型各指标的变化与文献[1,10,12-13]中变化相同。
3.1.2 乳头管灌注LPS对家兔血液中NO含量和NOS活力有影响 通过本试验,乳头管灌注LPS后,NO含量和NOS活力均在灌注后6h达到最高值,NO含量先稍有升高,24h时开始下降,72h时基本下降到接种前水平,灌注后6h与灌注前2h和灌注后12h差异显著(P<0.05)。NOS活力在6h时稍有上升趋势,12h开始回降,48h时又开始增加,灌注后6h与灌注前2h和灌注后12h差异显著(P<0.05)。与文献[5,18-19]报道相同。由试验结果可见,血液中NO含量和NOS活力的变化对急性乳腺炎有一定的治疗作用。NO是独立存在于血管、巨噬细胞和神经系统中的生理性调节因子[20]。NO由NOS催化生成,适量NO可发挥舒张血管、抑制血小板凝集和黏附以及PMN的聚集等作用;还可弥散作用于突触前、后膜上的受体,发挥神经信号传递功能;而过量NO可破坏酶活性,产生细胞毒作用。一氧化氮合酶(NOS)包括结构型一氧化氮合酶(TNOS)和诱导型一氧化氮合酶(iNOS),TNOS可源源不断的产生,而iNOS只有在受到感染或其他刺激是才产生[9]。在许多组织中NOS活性有其组织特异性,某一种组织以表达一种类型测同工酶为主,如神经元主要表达(NOS-Ⅰ),内皮细胞相对特异性地表达(NOS-Ⅲ)等[21]。内毒素可直接导致内皮细胞合成和释放NO[22]。
微血管内皮细胞在炎症反应中起着关键性的作用,可以激活白细胞,使进入组织的循环白细胞增加,并趋化白细胞到达炎症部位。而血管内皮分泌的NO可以维持血管动态平衡,抑制白细胞贴壁,控制炎症的发生和发展[23]。
NOS是生成NO的关键环节,一方面在结构型一氧化氮合酶(TNOS)的作用下参与生理性调节血管张力过程,另一方面它又在其他一些细胞因子的刺激下,激活诱导型一氧化氮合酶(iNOS),介导血管内皮细胞的损伤,参与机体的病理反应[24]。
通过本试验结果可见,乳头管灌注LPS后6h时NOS活力显著升高,之后开始降低,48h时又有升高趋势。乳头管灌注LPS后,机体马上做出反应,促使NOS的活性提高,NOS的活性提高之后可以催化产生更多的NO,一氧化氮生成量的增加可加快血流速度[22],血流速度的加快,加快炎性物质的带走,带来更多的抗炎物质,有利于快速的抗炎。NO含量在6h与12h组间差异显著,可见NO含量的升高速度很快,NO的含量在6h时达到最高值[19],说明此时机体的抗炎达到最大程度,NO对急性炎症有较大效果。NO达到一定含量是反而抑制了NOS的活力,使NOS的活力下降[8]。TNOS可源源不断的产生,而iNOS只有在受到感染或其他刺激是才产生。至于乳头管灌注LPS后机体所产生的NO主要由TNOS还是iNOS催化合成,还尚待探究。
3.2 结论 通过本试验可得出,乳头管灌注LPS造成家兔的急性乳腺炎后,家兔血液中NO含量和NOS活力明显增加,随着NO含量和NOS活力的变化,说明NO和NOS在乳腺炎的发展过程中有一定的作用。
参考文献
[1]曹随忠,杨德英,余树民,等.乳头管灌注脂多糖诱发兔实验性乳房炎模型的建立[J].中国兽医杂志,2010,46(11):26-27.
[2]包红朵,王恬.乳腺炎病原菌的致病机理与防治的研究进展[J].饲料博览,2009,1:34-36.
[3]倪俊,于宝军,顾海峰,等.一氧化氮在中性粒细胞与激活的内皮细胞间黏附中介导的作用[J].中国微循环,2006,10(6):419-420.
[4]Moncada S,Palmer RMJ.Nitric oxide[J].pathophysiology and pharmacology,1991,43:109-142.
[5]段慧琴,乔健,张永东,等.LPS对大鼠肠粘膜微血管内皮细胞分泌NO的影响[J].畜牧兽医学报,2005,36(9):974-976.
[6]Ishibashi Y,Takahashi N,Tokumaru A,et al.Activation of Inducible NOS in peripheral vessels and Outcomes in Heart Failure Patients[J].Journal of Cardiac Failure,2008,9(14):724-731.
[7]周健.安君康心胶囊对冠心病患者ET、NO、NOS、SOD及血液流变学的影响[J].中国中医药科技,2006,13(3):139-140.
[8]郑荣梁,黄中洋.自由基生物学[M].北京:高等教育出版社,2007:27-30.
[9]侯丽.一种特殊的生物信使分子一氧化氮[J].齐齐哈尔医学院学报,1999,20(4):402-403.
[10]孙忠人.王振宇,华金双.艾灸预处理对全脑缺血再灌注大鼠模型一氧化氮合酶活性的影响[J].针灸临床杂志,2011,27(1):52-54.
[11]闻平,王平,温旺荣,等.一氧化氮在细菌脂多糖促成纤维细胞增殖中的作用[J].世界感染杂志,2001,1(2):112-114.
[12]伍杰,刘娟,陈跃红,等.家兔临床型乳腺炎病理模型的制备[J].中国畜牧兽医,2010,37(2):223-225.
[13]钟凯,王艳玲,邹思湘,等.乳头管灌注内毒素诱发大鼠实验性乳房炎模型的建立[J].农业生物技术学报,2005,13(5):654-658.
[14]张勤.生物统计学[M].北京:中国农业大学出版社,2008:289-293.
[15]朱永平.生物统计学实验教程[M].昆明:云南科技出版社,2006:17-20:762-766.
[16]李楚杰.急性期反应的病理生理[J].中国病理生理杂志,1997,13(6):762-766.
[17]王俊东,刘宗平.兽医临床诊断学[M].北京:中国农业大学出版社,2009:200-204.
[18]苗晋锋,马海田,邹思湘,等.内毒素对山羊乳腺组织中与乳腺炎相关的酶和细胞因子的影响[J].福建农林大学学报,2007,36(6):608-613.
[19]张永东,李玉冰,魏晓军,等.不同剂量内毒素对小鼠血浆中NO分泌的影响[J].黑龙江畜牧兽医,2011,1:95-96.
[20]张翠华,郑永芳.血管内皮舒张因子与一氧化氮[J].生理科学进展,1995,26(2):172-174.
[21]陈晋文,孙长凯,黄远桂.一氧化氮合酶的若干研究进展[J].生物化学与生物物理进展,1996,23(4):297-293.
[22]王新,谭建华,刘金玲,等.内毒素对肠粘膜微血管内皮细胞内分泌一氧化氮和内皮素的影响[J].中国农学通报,2006,22(1):4-6.
[23]厉晓,蔡英年,宿双宁.脂多糖诱导地鼠肺泡巨噬细胞中一氧化氮对肿瘤坏死因子的调节作用[J].基础医学与临床,2000,20(2):41-43.
[24]张弘,刘建华,查冬青,等.慢性肾炎血清SOD、NO/NOS和T淋巴细胞亚群检测意义[J].中华全科医学,2008,6(11):1145-1146.
(责编:张宏民)
