钒胁迫下枸杞和芥菜幼苗蛋白的分子分布研究
2016-11-16侯明赵军平李明沅甘焕辉
侯明,赵军平,李明沅,甘焕辉
(桂林理工大学化学与生物工程学院,广西桂林 541004)
钒胁迫下枸杞和芥菜幼苗蛋白的分子分布研究
侯明,赵军平,李明沅,甘焕辉
(桂林理工大学化学与生物工程学院,广西桂林541004)
通过G-75凝胶层析结合电泳分析,研究了不同V(吁)浓度胁迫下枸杞和芥菜的蛋白分子分布。经过凝胶层析后出现两个紫外吸收峰,第一峰主要集中在8号至15号管,第二峰集中在25号至33号管。对第一紫外吸收峰的电泳分析表明,V胁迫下植物蛋白的分子分布发生了变化:当V浓度为10 mg·L-1时,枸杞根产生了分子量为58.6 KD蛋白,茎产生了分子量分别为64.5、46.9 KD两种蛋白;当V浓度增大到20 mg·L-1,叶产生了分子量为20 KD蛋白。随着V胁迫浓度增大,芥菜中分子量为33.9 KD和36 KD两入蛋白入带逐渐变浅,而27.3 KD蛋白入带逐渐加深。枸杞幼苗第一洗脱峰蛋白中V含量随V胁迫浓度增大而增加,而芥菜叶在V逸10 mg·L-1时V含量降低。这与不同植物蛋白结合V的能力有关,因枸杞幼苗蛋白结合V的能力较强,生成的植物螯合肽较多,故对V有较强的耐受能力。
钒胁迫;枸杞;芥菜;分子分布;蛋白质
侯明,赵军平,李明沅,等.钒胁迫下枸杞和芥菜幼苗蛋白的分子分布研究[J].农业环境科学学报,2016,35(4):634-639.
HOU Ming,ZHAO Jun-ping,LI Ming-yuan,et al.Distribution of protein molecular in seedlings of Lycium barbarum and Brassica juncea under vanadium stresses[J].Journal of Agro-Environment Science,2016,35(4):634-639.
重金属污染是全球性环境问题,它不仅威胁生态安全,而且通过食物链的生物富集和传递危及人类健康[1-2]。随着分子生物学技术的迅猛发展,关于蔬菜作物重金属富集的分子机制研究也有了一定的进展。大多数重金属离子是通过原生质膜上的转运蛋白进入植物细胞[3-4],分子分布是研究重金属元素进入植物体后,在各种蛋白质中的积累以及与蛋白质发生的化学行为。从分子水平上解释植物重金属中毒与解毒机理,有助于理解重金属污染下的植物吸收、累积、耐性和解毒机制[5-6]。Li和王芳[7-8]等研究了Cd处理对小麦和水稻蛋白的影响,Cd进入植物根和叶片中与不同分子量蛋白结合,降低Cd的毒害。张静等[9]研究水稻根中PCs可螯合一定量的Cd,也可影响到Cd在水稻中的积累和运转。Weigel等[10]进行凝胶层析显示,细胞可溶部分中Cd大多与分子量为5~10 KD的蛋白物质结合,属于肽类或低分子量蛋白。江行玉等[11]研究Pb在芦苇体内蛋白中的分布发现,在Pb胁迫下,出现了一种Pb诱导的新蛋白质,而另一种蛋白质则由于受到Pb影响而消失。Estrella-G佼mez等[12]研究了Pb在香根草中的分子分布,结果表明香根草根部维管组织细胞能够响应Pb胁迫表达植物螯合态(PCs)蛋白,并与Pb结合形成Pb-PC蛋白复合体。目前,对钒(V)胁迫下枸杞和芥菜的分子分布研究还未见报道。
V在自然界中分布极为广泛,过量V不仅妨碍植物从土壤和营养液中吸收一些必需元素,引起植物营养缺乏和枯萎,植物中积累过量V也会导致植物中毒甚至死亡[13-16]。蛋白质是生物功能的执行者和主要体现者,从蛋白组学分子水平开展植物对V胁迫的响应研究,能揭示V对植物生命活动的影响,也可以为了解植物的生理病理现象提供重要方法[17]。本研究探讨了V(吁)胁迫下枸杞和芥菜幼苗不同器官蛋白的分子分布,掌握了不同植物内部蛋白的分子分布规律,试图揭示V在植物分子水平上的结合位置,为阐明植物对V的解毒机制提供理论基础。
1 材料与方法
1.1试验材料
供试枸杞(Lycium barbarum)种子为宁杞一号种。盆栽试验使用河沙,经酸处理后洗至中性,风干后过0.8 mm筛,备用。供试芥菜(Brassica juncea)品种为大坪铺包心芥菜。配制营养液的试剂和所选用的V(NH4VO3)均为分析纯,试验所用水为超纯水。
1.2试验设计和来理
用10%H2O2(含少量CaSO4)消毒过的种子30益恒温催芽,播种于装有经过处理的河沙塑料盆中培育。幼苗长至2片叶时,用Hoagland全营养液每天浇灌1~2次。
待芥菜幼苗长出4~6片叶时,每盆选取长势一致的幼苗定株5株,用含V的营养液浇灌,试验设计5个处理水平,V(吁)浓度为0、1、5、10、20 mg·L-1,每个处理设定6个重复,胁迫10 d后采集样品。
待沙培枸杞幼苗长出3~5对叶时用一次性塑料水杯(规格150 mL)定株3株进行水培胁迫试验,设置V(吁)浓度为0、5、10、20 mg·L-1,每个浓度梯度设置10个重复,每个杯子装含有V(吁)的营养液100 mL,每3 d换一次营养液,胁迫12 d收样。
将植物样品分成叶片、叶柄和根系分别洗净晾干。植株根系先用自来水冲洗,再用20 mmol·L-1Na2-EDTA交换20 min,以除去根表面吸附的V。所有鲜样置于-20益冰箱供分析测定。
1.3试验方法
1.3.1植物蛋白的凝胶层析分离
参照Guo等[18]方法,分别取枸杞根、茎、叶和芥菜叶各4 g,用8 mL预冷的匀浆液匀浆化。匀浆液组成为:Tris-HCl(pH 7.5)15 mmol·L-1,NaCl 0.1 mol·L-1。将植物组织匀浆放入冷冻离心机,控制转速为12 000 g,离心45 min,浓缩、过滤后,用葡聚糖凝胶G-75细粒(Sephadex G-75,1×100 cm,分子量3~80 KD)进行凝胶过滤。上柱样品1 mL,流速2.4 mL·10 min-1,平衡及洗脱液为20 mmol·L-1Tris-HCl(pH 7.5),自动部分收集器每管2.4 mL收集洗脱液,采用紫外分光光度计在280 nm处扫描测定各洗脱液的吸收峰,合并每个吸收谱线范围内的洗脱液,并冷冻浓缩干燥,以备电泳分析。
1.3.2蛋白分子量的测定
(1)SDS-PAGE电泳操作:取冷冻干燥浓缩后的研磨离心液和层析后的收集液与样品缓冲液按1颐2混合均匀。样品缓冲液组成:SDS 100 mg+巯基乙醇0.1 mL+溴酚蓝2 mg+甘油2 g+0.05 mol·L-1pH 8 Tris-HCl 2 mL。恒温水浴锅中100益煮沸5 min,冷却备用。配置12%和5%分离胶,加入样品和标准液电泳,直到分离胶中蓝色入带距离下沿1 cm左右时切断电源,染色、洗脱得到蛋白质入带电泳图。
(2)标准曲线的制作:测量标准蛋白各入区带中心距离加样端的长度,利用下面公式计算各种标准蛋白质的相对迁移率,再以相对迁移率为横坐标,各标准蛋白质分子量的对数为纵坐标制做标准曲线图。
相对迁移率=蛋白质样品距加样端迁移距离/溴酚蓝区带中心距加样端的距离
(3)样液中主要蛋白质分子量的计算:测量各个蛋白质样液中各入主要蛋白质区带中心距离加样端的长度,计算出相对迁移率,根据标准曲线方程得出各蛋白质分子量的对数,进而可得知各蛋白质的分子量。
1.3.3蛋白溶液中V含量的测定
按样品与匀浆液的比例1颐2(g·mL-1)用玛瑙研钵冰浴研磨,将凝胶层析后的收集液置于电热板上蒸至近干,加入H2O2-HNO3(1颐5,V/V)消煮至澄清,加入1 mL 2.5%的EDTA摇匀,水定容10 mL,用石墨炉原子吸收分光光度法(GFAAS,novAA400P,Analytik Jena AG)测定V含量。
1.3.4数据处理
采用DPS数据处理系统和Microsoft Excel 2007对数据进行分析,Duncan多重比较法对显著性差异(P<0.05)进行多重比较,试验结果以平均值依标准差(Mean依SD)表示。
2 结果与分析
2.1V(吁)胁迫植物蛋白凝胶层析结果
图1显示植物样品凝胶层析洗脱液中蛋白质紫外吸收结果。由图可见,洗脱液出现2个明显紫外吸收峰,不同浓度V(吁)胁迫下枸杞不同部位和芥菜叶洗脱液的出峰位置大致相同,但是吸收峰值不同。V(吁)胁迫浓度不同,各峰表现出不规则变化,第一峰尖锐,第二峰变化平缓。通过对第一吸收峰分析发现,枸杞根和茎的吸收峰值均随着V(吁)胁迫浓度的增大表现出先增高后降低的趋势,根在V(吁)胁迫浓度为10 mg·L-1时峰值达到最大,而茎在其浓度为5 mg·L-1时峰值最大,叶的吸收峰值则一直呈增大趋势。蛋白质主要集中在第一吸收峰,在V(吁)处理下植物蛋白的种类或含量发生了变化。植物的不同吸收峰范围内洗脱液管数不同,枸杞根、茎和叶的第一峰均在8至15管,第二峰均在25至33管(图1 A、图1B、图1C);而芥菜叶的第一峰在12至17管,第二峰在27至35管(图1D),两个吸收峰之间都相隔10管,且无吸收峰重叠,说明两个吸收峰分离较彻底。合并两个峰对应管数的洗脱液进行多次电泳试验发现,第一个峰电泳入带明显,而第二个峰并无入带,可能是第二个峰的蛋白分子量太低(为一些小分子量的多肽),不能在电泳图上显示出来,因此主要通过对第一个峰内包含的收集液进行电泳分析,研究V(吁)胁迫下植物不同器官蛋白的分子分布,同时测定峰面积内V含量。
2.2植物不同部位蛋白的分子量分布
对枸杞根、茎、叶的电泳分析(图2)表明,根和茎的蛋白种类较少,叶的蛋白种类较多。实验发现未受V(吁)胁迫时枸杞根蛋白的表观分子量为33.1 KD,受V(吁)胁迫诱发了一种分子量为30.1 KD新蛋白质;当V(吁)胁迫浓度达10 mg·L-1时,又诱发产生了一种分子量为58.6 KD的蛋白,当V(吁)胁迫浓度达20mg·L-1时,58.6 KD蛋白消失(图2a)。未受V(吁)胁迫时枸杞茎蛋白表观分子量主要为42.1、37.9 KD,当V(吁)胁迫浓度为10 mg·L-1时,诱发产生两种新蛋白,其分子量分别为64.5、46.9 KD(图2b)。未受V(吁)胁迫的枸杞叶蛋白表观分子量主要有84.8、49.8、46.8、33.3、23.7、18 KD,明显多于根和茎(图2c)。而受V影响枸杞叶分子量为84.8、49.8、46.8 KD的三种蛋白消失,当V(吁)浓度增大到20 mg·L-1时,诱导产生了一种分子量为20 KD的蛋白(图2c)。以上数据表明,受V(吁)胁迫影响,枸杞根和茎产生了新的蛋白,而叶中一些原有的蛋白质消失。图2(d)表明,芥菜叶蛋白表观分子量有53、48、14.2 KD三种,通过凝胶层析后,随着V(吁)胁迫浓度增大,分子量为33.9、36 KD的两入蛋白入带逐渐变浅,而27.3 KD的蛋白质入带逐渐加深,表明植物在受到金属胁迫时,会诱发体内形成某种螯合肽或一些金属结合蛋白,而蛋白质入带的深浅表明新诱导出来的蛋白质的含量不同,与V(吁)的胁迫浓度有关。通过研究在V(吁)胁迫下枸杞和芥菜蛋白变化,表明金属V(吁)胁迫下会诱导植物表达不一样蛋白质。
2.3凝胶层析后植物蛋白中V含量
表1为枸杞幼苗根、茎和叶经过凝胶层析后第一洗脱峰中V的含量分布。可见,随着V胁迫浓度的增大,经过凝胶分离后的蛋白中V含量逐渐上升,可能是由于植物的一种自适调节能力,通过产生一些新的金属结合蛋白质来降低金属的毒害。以相同方法对芥菜叶凝胶层析后第一峰浓缩样进行测定可知,芥菜的V含量不同于枸杞,在胁迫浓度为5 mg·L-1时,V含量最高为0.124滋g·g-1,当胁迫浓度增大到10 mg·L-1时,V含量(0.081滋g·g-1)开始下降。可能是由于芥菜的耐受能力不如枸杞幼苗,当V浓度达到一定程度时,芥菜叶内的V对蛋白表现出一定的毒性,蛋白与V结合能力下降,或者蛋白部分失活。
3 讨论
蛋白质不仅是生物有机体的重要组成部分,而且作为生物催化反应的酶类,在各种生理功能中发挥重要作用。通过研究发现,V能在分子水平影响植物蛋白质表达,不同植物体内的蛋白质分子量分布不同,同种植物体内不同部位的蛋白分布也不相同。凝胶层析结果表明,在未受V胁迫时,枸杞根、茎、叶蛋白分别对应1、2、5入亚基,叶的蛋白种类居多。可能是植物的正常代谢需要一系列的光合和呼吸作用来维持,而叶是光合作用和呼吸作用的主要场所,其相关酶类越多,氨基酸种类就越丰富,含有的蛋白种类也越多。有毒金属进入植物体内时,能够影响光合作用的酶,还能与蛋白质上的SH结合,从而影响蛋白质的活性,干扰植物的正常新陈代谢[19]。
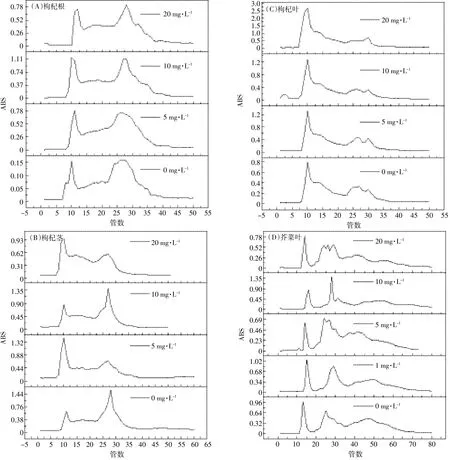
图1 枸杞根、茎、叶和芥菜叶凝胶柱层析的紫外谱图Figure 1 UV spectrum of gel chromatography of Lycium barbarum roots,stems and leaves and Brassica juncealeaves
蛋白质组成变化的原因可能是蛋白质降解为小分子量多肽,或者通过呼吸作用,寓同化于异化过程中而合成,也有可能是基因表达的产物。植物为了适应不同生长环境,体内的各种代谢过程也不断发生变化,这样长期适应的结果,使其遗传物质发生了一定变异,而遗传物质的变异主要通过蛋白质上氨基酸变化呈现出来。研究认为,外源胁迫入件下植物可通过调节不同基因的表达来增强一系列胁迫蛋白的合成以适应各种不良环境,但同时会抑制其他许多正常蛋白质的合成[20]。通过对V(吁)胁迫下枸杞和芥菜植物体内蛋白变化的研究发现,枸杞根、茎、叶都会被诱导产生新的蛋白质,根和叶分别产生了一种分子量为58.6、20 KD的蛋白,而茎产生了分子量为64.5、46.9 KD的两种蛋白。V(吁)胁迫浓度过大时,会使植物叶中一些参与光合作用的蛋白质发生降解和碎裂片段化,以及初级碳代谢蛋白下降,从而使某些蛋白质消失。如当V(吁)胁迫时,枸杞叶分子量为84.8、49.8、46.8 KD的三种蛋白消失,而芥菜叶内分子量为33.9、36 KD的两入蛋白入带逐渐变浅,27.3 KD的蛋白入带逐渐加深,说明蛋白质代谢的这种变化可能是植物的一种适应性反应,它有利于植物抵抗外界的伤害[21-23]。
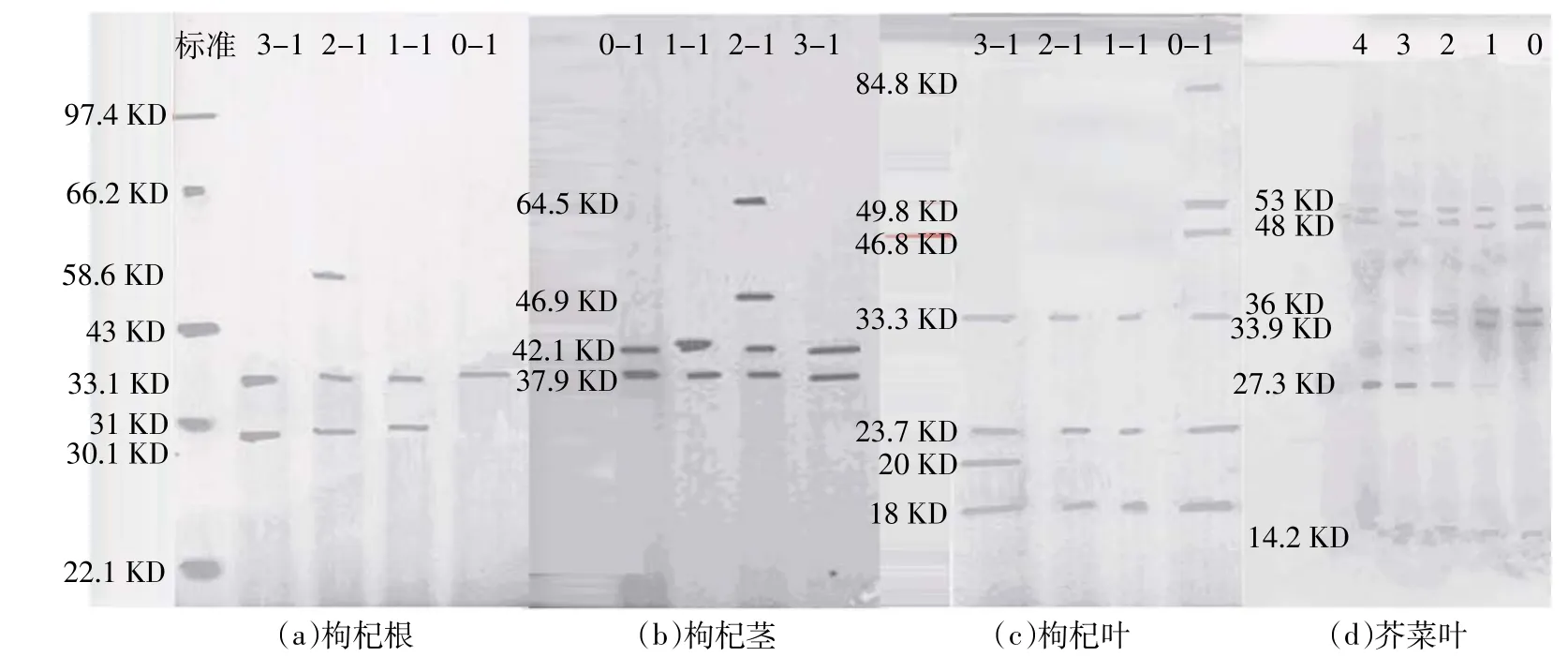
图2 枸杞幼苗的根、茎和叶及芥菜叶电泳图Figure 2 Electrophoretogram of roots,stems and leaves from Lycium barbarum seedling and of Brassicajuncea leaves
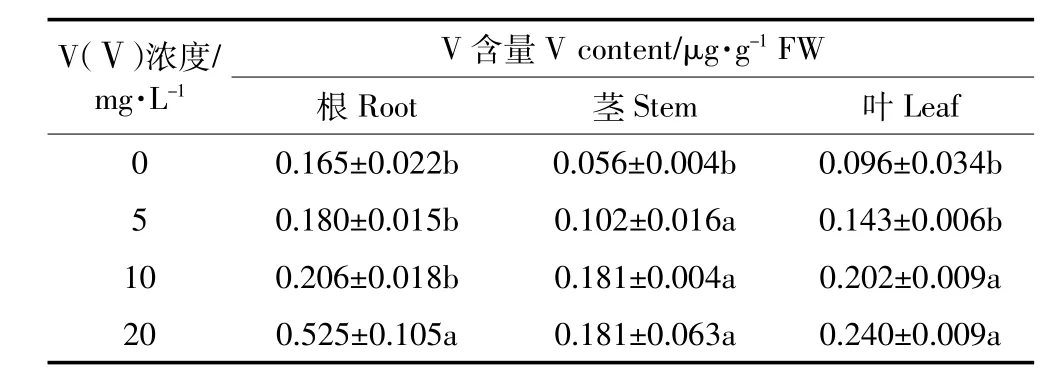
表1 凝胶层析后枸杞幼苗在第一洗脱峰中V含量Table 1 Concentrations of V in the first peak elution of Lycium barbarum seedlings after gel chromatography
凝胶层析电泳结果表明,在不同V(吁)胁迫浓度下,植物不同部位在调节自身防御机制以降低逆境伤害时的蛋白变化是不一样的。对于枸杞根存在分子量为33.1 KD和新产生的30.1、58.6 KD三种蛋白,枸杞茎存在分子量为37.9、42.1 KD和新产生的46.9、64.5 KD四种蛋白,叶则有18、23.7、33.3 KD和新产生的20 KD四种蛋白,结合植物相应的V含量分布结果,表明在枸杞不同部位V可能与这些分子量的蛋白结合。随V(吁)胁迫浓度增大,第一个洗脱峰内枸杞根、茎和叶中蛋白结合V量逐渐增大,说明枸杞不同部位中不同蛋白质对V的结合能力不同,使其根部产生新的蛋白,叶和茎除产生新蛋白外还伴随一些蛋白消失。这与Zhang等[21]对Cu胁迫下水稻幼苗中分子量为12 KD和20 KD的两入蛋白入带颜色逐渐加深的结果类似。植物根部有很大一部分空间用来吸收营养元素和可溶物质,当重金属进入植物根部后,会诱导植物细胞质壁分离,细胞间隙扩大,进而结合部分重金属离子[24-26],还有一大部分金属会以螯合态的可溶形式固定于植物根部[27],产生较多金属结合蛋白起到解毒作用。随着V(吁)胁迫浓度升高,芥菜叶的第一洗脱峰内V含量升高,当V(吁)逸10 mg·L-1时,V含量下降,表明芥菜叶与蛋白结合的V量有所降低,可见芥菜对V的耐受能力小于枸杞。
4 结论
(1)V(吁)胁迫浓度不同,枸杞和芥菜的凝胶层析紫外吸收峰位置相同但峰值不同。对第一峰进行蛋白分子分布研究表明,在V(吁)浓度增大到10 mg·L-1时,枸杞根产生了分子量为58.6 KD蛋白,茎产生了分子量为64.5、46.9 KD两种蛋白;当V(吁)浓度增大到20 mg·L-1,叶产生了分子量为20 KD蛋白。
(2)随着V(吁)胁迫浓度增大,芥菜中分子量为33.9 KD和36 KD两入蛋白入带逐渐变浅,而分子量为27.3 KD蛋白质入带逐渐加深,表明受V(吁)胁迫影响,植物的蛋白合成发生变化,蛋白分子分布发生改变。
(3)枸杞幼苗第一洗脱峰蛋白中,V含量随V(吁)胁迫浓度增大而增加,其分布规律为根>叶>茎,而芥菜叶在V(吁)逸10 mg·L-1时表现为V含量降低。受V影响枸杞中蛋白与V结合生成的植物螯合肽较多,而芥菜叶蛋白结合V能力下降或蛋白失活,枸杞对V有一定的解毒作用。
[1]邬飞波,张国平.植物螯合肽及其在重金属耐性中的作用[J].应用生态学报,2003,14(4):632-636.
WU Fei-bo,ZHANG Guo-ping.Phytochelatin and its function in heavy metal tolerance of higer plants[J].Chinese Journal of Applied Ecology,2003,14(4):632-636.
[2]Stankovic S,Kalaba P,Stankovic A R.Biota as toxic metal indicators[J]. Environmental Chemistry Letters,2014,12(1):63-84.
[3]Meharg A A.Mechanisms of plant resistance to metal and metalloid ions and potential biotechnological applications[J].Plant and Soil,2005,274(1):163-174.
[4]Delhaize E,Ryan P R.Aluminum toxicity and tolerance in plants[J]. Plant Physiology,1995,107(2):315.
[5]郁建栓.浅谈重金属对生物毒性效应的分子机理[J].环境污染与防治,1996,18(4):28-31.
YU Jian-shuan.Discussion on the molecular mechanism of biological toxic effects of heavy metals[J].Environmental Pollution and Control,1996,18(4):28-31.
[6]Clemens S.Molecular mechanisms of plant metal tolerance and homeostasis[J].Planta,2001,212(4):475-486.
[7]王芳,丁杉,张春华,等.不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J].农业环境科学学报,2010,29(4):625-629.
WANG Fang,DING Shan,ZHANG Chun-hua,et al.Non-protein thiols,subcellular and molecular distribution of cadmium in two rice cultivars with difference tolerance[J].Journal of Agro-Environment Science,2010,29(4):625-629.
[8]Li D D,Zhou D M,Wang P,et al.Subcellular Cd distribution and its correlation with antioxidant enzymatic activities in wheat roots[J].Ecotoxicology and Environmental Safety,2011,74(4):874-881.
[9]张静,常青晓,孙传范,等.HPLC法测定镉、砷胁迫下水稻根系的植物螯合肽[J].环境科学学报,2011,31(7):1550-1555.
ZHANG Jing,CHANG Qing-xiao,SUN Chuan-fan,et al.HPLC assay of phytochelatins in rice root under cadmium or arsenic stress[J].Acta Scientiae Circumstantiae,2011,31(7):1550-1555.
[10]Weigel H J,J覿ger H J.Subcellular distribution and chemical form of cadmium in bean plants[J].Plant Physiology,1980,65(3):480-482.
[11]江行玉,赵可夫.铅污染下芦苇体内铅的分布和铅胁迫相关蛋白[J].植物生理与分子生物学学报,2002,28(3):169-174.
JIANG Xing-yu,ZHAO Ke-fu.The distribution of Pb and Pb-stressed relative proteins in Pb-polluted phragmites australis seedlings[J].Journal of Plant Physiology and Molecular Biology,2002,28(3):169-174.
[12]Estrella-G佼mez N,Mendoza-C佼zatl D,Moreno-S佗nchez R,et al.The Pb-hyperaccumulator aquatic fern Baker,responds to Pb2+by increasing phytochelatins via changes in expression and in phytochelatin synthase activity[J].Aquatic Toxicology,2009,91(4):320-328.
[13]Pyrzy俳ska K,Wierzbicki T.Determination of vanadium species in environmental samples[J].Talanta,2004,64(4):823-829.
[14]Khan S,Kazi T G,Kolachi N F,et al.Sequential extraction of vanadium in different soil samples using conventional and ultrasonic devices[J]. Journal of AOAC International,2013,96(3):650-656.
[15]Smith P G,Boutin C,Knopper L.Vanadium pentoxide phytotoxicity:Effects of species selection and nutrient concentration[J].Archives of Environmental Contamination and Toxicology,2013,64(1):87-96.
[16]Hou M,Hu C J,Xiong L,et al.Tissue accumulation and subcellular distribution of vanadium in Brassica juncea and Brassica chinensis[J]. Microchemical Journal,2013,110:575-578
[17]薛亮,刘建锋,史胜青,等.植物响应重金属胁迫的蛋白质组学研究进展[J].草业学报,2013,22(4):300-311.
XUE Liang,LIU Jian-feng,SHI Sheng-qing,et al.A review on the progress of proteomic study on plant responses to heavy metal stress[J]. ActaPrataculturae Sinica,2013,22(4):300-311.
[18]Guo Y,Marschner H.Uptake,distribution,and binding of cadmium and nickel in different plant species[J].Journal of Plant Nutrition,1995,18(12):2691-2706.
[19]Chien H-F,Kao C H.Accumulation of ammonium in rice leaves in response to excess cadmium[J].Plant Science,2000,156(1):111-115.
[20]吴娟,施国新,夏海威,等.外源钙对汞胁迫下菹草(Potamogeton crispus L.)叶片抗氧化系统及脯氨酸代谢的调节效应[J].生态学报,2014,33(2):380-387.
WU Juan,SHI Guo-xin,XIA Hai-wei,et al.Effects of exogenous calcium on antioxidant system and proline metabolism of Potamogeton crispus L.leaves under mercury stress[J].Chinese Journal of Ecology,2014,33(2):380-387.
[21]Zhang H,Lian C,Shen Z.Proteomic identification of small,copper-responsive proteins in germinating embryos of Oryza sativa[J].Annals of Botany,2009,103(6):923-930.
[22]Ahsan N,Lee D-G,Lee S-H,et al.Excess copper induced physiological and proteomic changes in germinating rice seeds[J].Chemosphere,2007,67(6):1182-1193.
[23]Ahsan N,Lee S-H,Lee D-G,et al.Physiological and protein profiles alternation of germinating rice seedlings exposed to acute cadmium toxicity[J].Comptes Rendus Biologies,2007,330(10):735-746.
[24]Rascio N,Dalla Vecchia F,La Rocca N,et al.Metal accumulation and damage in rice seedlings exposed to cadmium[J].Environmental and Experimental Botany,2008,62(3):267-278.
[25]Eapen S,D忆souza S.Prospects of genetic engineering of plants for phytoremediation of toxic metals[J].Biotechnology Advances,2005,23(2):97-114.
[26]Saco D,Mart侏n S,San Jos佴P.Vanadium distribution in roots and leaves of Phaseolus vulgaris:Morphological and ultrastructural effects[J].BiologiaPlantarum,2013,57(1):128-132.
[27]王俊丽,任建国.镉在不同类型蕹菜(Ipomoeaaquatica Forsk.)中的积累及其化学形态和分子分布[J].生态学杂志,2014,33(6):1594-1600.
WANG Jun-li,REN Jian-guo.Accumulation,chemical forms and molecular distribution of Cd in two water spinach genotypes[J].Chinese Journal of Ecology,2014,33(6):1594-1600.
Distribution of protein molecular in seedlings of Lycium barbarum and Brassica juncea under vanadium stresses
HOU Ming,ZHAO Jun-ping,LI Ming-yuan,GAN Huan-hui
(College of Chemistry and Bioengineering,Guilin University of Technology,Guilin 541004,China)
Protein molecular distribution in Lycium barbarum and Brassica juncea under different vanadium(V)stress levels was studied by G-75 gel chromatography and electrophoresis analysis.After gel chromatography,two UV peaks appeared,with the first peak occurring in No.8~No.15 tubes,and the second peak in No.25~No.33 tubes.Results of electrophoresis analysis from the first UV peak indicated that the molecular weight distribution changed under the V stresses.At 10 mg V·L-1,Lycium barbarum produced a kind of protein with molecular weight of 58.6 KD in roots,while in stems two kinds of protein with molecular weight of 64.5 and 46.9 KD.At 20 mg V·L-1,the leaves produced a kind of protein with molecular weight of 20 KD.With V stress levels increasing,two protein bands with 33.9 KD and 36 KD in Brassica juncea gradually changed to shallow,but that with 27.3 KD was deepened progressively.The V concentrations in the protein of the first elution peak in Lycium barbarum seedlings increased with increasing V stress levels,while the V concentrations in leaves of Brassica juncea decreased when V stress levels逸10 mg·L-1.This may be due to differences in V-binding capacity of different plant proteins.The V-binding ability of Lycium barbarum seedlings was greater than that of Brassica juncea,and thus more phytochelatins were generated,resulting in stronger tolerance of Lycium barbarum seedlings to V.
vanadium stress;Lycium barbarum;Brassica juncea;molecular distribution;protein
X503.23
A
1672-2043(2016)04-0634-06
10.11654/jaes.2016.04.004
2015-11-15
国家自然科学基金项目(41161076,41561077)
侯明(1957—),山东济宁人,博士,教授,主要从事生态毒理和植物修复研究。E-mail:glhou@glut.edu.cn
