长白山核桃楸分离蛋白缓解小鼠体力疲劳的作用
2016-11-14崔玲玉闵伟红苗欣宇刘景圣
崔玲玉,闵伟红*,刘 威,毛 晶,苗欣宇,刘景圣
(小麦和玉米深加工国家工程实验室,吉林农业大学食品科学与工程学院,吉林 长春 130118)
长白山核桃楸分离蛋白缓解小鼠体力疲劳的作用
崔玲玉,闵伟红*,刘 威,毛 晶,苗欣宇,刘景圣
(小麦和玉米深加工国家工程实验室,吉林农业大学食品科学与工程学院,吉林 长春 130118)
为探究长白山核桃楸分离蛋白(Juglans mandshurica Maxim kernel protein isolate,JMKP)缓解体力疲劳的作用,通过小鼠负重游泳实验,以游泳时间为疲劳指标,并测定血乳酸(blood lactic acid,BLA)、肝糖原(hepatic glycogen,GLU)和丙二醛(malondialdehyde,MDA)含量及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活力等生化指标。结果表明:2 周后,JMKP高剂量组小鼠的游泳时间比对照组增加了38.66%,4 周后,JMKP低、中、高剂量组小鼠的游泳时间比对照组分别延长了24.10%、42.17%和64.46%;2 周后,JMKP高剂量组小鼠的血乳酸含量与对照组相比下降了21.44%,4 周后,JMKP中、高剂量组小鼠的血乳酸含量与对照组相比分别下降了13.02%和23.48%;2 周和4 周后,JMKP中、高剂量组小鼠的肝糖原含量与对照组相比分别升高了15.41%~16.29%和18.35%~20.81%;2 周和4 周后,JMKP高剂量组小鼠血清中的MDA含量与对照组相比分别下降了20.41%和28.59%;JMKP能够提高小鼠体内GSH-Px、CAT和SOD活力,特别是在灌胃高剂量的JMKP 4 周后,与对照组相比均有极显著差异(P<0.01)。实验结果表明JMKP具有显著缓解小鼠疲劳的作用。
长白山核桃楸;分离蛋白;体内实验;缓解疲劳;抗氧化性
随着现代社会工作生活节奏的日益加快,人们体力劳动和脑力劳动强度不断增强,越来越多的人感觉到疲劳每日伴随,一旦疲劳产生,人的工作效率就会下降,甚至会危害人体正常生理机能,进而导致疾病,随着健康生活意识的增强,人们越来越期望找到能够延缓疲劳的新型食品。
长白山核桃(Juglans mandshurica Maxim)又名核桃楸,系胡桃科(Juglandaceae)核桃属植物,落叶阔叶乔木树种,东北地区三大珍贵阔叶树种之一,主要分布于小兴安岭、完达山脉、长白山区及辽宁东部[1]。核桃楸是重要的药食同源植物,种仁富含对人体有益的不饱和脂肪酸、蛋白质、碳水化合物、维生素、微量元素,还有少量酚酸和黄酮等,具有补气养血、乌发健脑等功能[2-3]。核桃仁营养美味,是一种深受人们喜爱的坚果类食品,核桃蛋白作为众所周知的优质植物源蛋白,是一种具有经济、食用及开发价值的植物蛋白,目前以核桃仁为原料的加工产品主要为核桃油,副产物核桃粕却未能很好的利用,而核桃粕中蛋白质含量高达45.30%[4],富含18 种氨基酸,如能对核桃粕中的蛋白质进一步开发利用,不仅提高了核桃的经济价值,并且可为其他油料作物的综合利用提供借鉴[5-6]。有研究表明,西洋参分离蛋白具有显著的缓解小鼠体力疲劳的作用[7],因此本实验拟通过负重游泳实验建立小鼠体力疲劳模型,并对小鼠灌胃长白山核桃楸分离蛋白(Juglans mandshurica Maxim kernel protein isolate,JMKP),以力竭游泳时间为主要指标,测定小鼠血液中血乳酸(blood lactic acid,BLA)、肝糖原(hepatic glycogen,HG)、丙二醛(malondialdehyde,MDA)含量及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活力等生化指标,研究JMKP是否也具有缓解小鼠体力疲劳的作用。
1 材料与方法
1.1 动物、材料与试剂
180 只4~6 周龄清洁级昆明雄性小鼠,体质量(20±2) g,购自长春生物制品研究所有限责任公司,许可证号SCXK(吉)2011-0003。小鼠生长和实验符合《中国食品药品检定研究院实验动物福利伦理审查指导原则(试行)》[8]。实验小鼠于动物饲养室中5 d进行环境适应。小鼠饲养条件:室温22~25 ℃,相对湿度55%~70%,食物和水可随意获得。
BLA检测试剂盒、HG检测试剂盒、MDA检测试剂盒、GSH-Px检测试剂盒、CAT检测试剂盒、SOD检测试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 方法
1.2.1 JMKP的制备
采用碱溶酸沉法制备JMKP[9-10]:脱脂核桃楸种仁与蒸馏水以1∶14(m/V)比例混合,用1 mol/L NaOH溶液调pH值至9.0,60 ℃水浴90 min,5 000 r/min离心10 min,用1 mol/L盐酸调上清液pH值至4.9,酸沉30 min,5 000 r/min离心,水洗3 次,调pH值至7.0,冷冻干燥。
1.2.2 JMKP蛋白质含量测定及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
JMKP的蛋白质含量依据GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》[11]测定,换算系数为6.25。在Kasran[12]和Tan[13]等方法的基础上稍作修改:样品溶解在100 μL磷酸盐缓冲液(50 mmol/L、pH 7.5)中,离心取80 μL上清液,加入20 μL 5×SDS蛋白电泳上样缓冲液混匀,100 ℃金属浴10 min,冷却离心,每孔取20 μL上清液上样,进行SDS-PAGE分析。
1.2.3 动物分组及处理
将180 只昆明雄性小鼠按体质量随机分成4 组,其中对照组60 只,JMKP低剂量组(PrL组)、JMKP低剂量组(PrM组)和JMKP高剂量组(PrH组)各40 只。将JMKP冻干粉溶于去离子水,分别对PrL组、PrM组、PrH组的小鼠按照200、400、800 mg/(kg·d)的剂量进行灌胃,对照组小鼠灌胃等量的去离子水。各组小鼠均自由摄取饲料及水;每日定时称量小鼠体质量并补充饲料饮水。在第0周(即实验开始,未对小鼠进行处理)时从对照组随机取20 只小鼠均分为两组各用于负重游泳实验和生化指标测定;分别在第2、4周时,再分别从每组随机取20 只小鼠,其中10 只用于负重游泳实验,另外10 只用于生化指标测定,记录并整理测定结果。
1.2.4 小鼠负重游泳实验
负重游泳实验在Uthayathas等[14]方法的基础上做一定修改:饲养一定时间后,从各组均取10 只小鼠进行负重游泳实验。在末次灌胃30 min后,给小鼠尾部负重其体质量5%的铅丝,在恒温水槽中(50 cm×140 cm×40 cm)进行游泳,水温控制在(30±2)℃。在实验过程中,使每只小鼠四肢保持运动,如果小鼠漂浮在水面四肢不动,用玻璃棒在其附近搅动,使其运动。记录从小鼠开始进入水中游泳至头部全部没入水中后10 s无法浮出水面的时间,即为游泳力竭时间,泳池水每次实验结束后进行更换。
1.2.5 小鼠血液生化指标测定
灌胃JMKP 30 min后,将小鼠放在恒温水槽中游泳30 min,游泳结束后眼眶取血,将全血3 000 r/min离心15 min,吸出上清液即为血清,置于-20 ℃冰箱中保存。用试剂盒测定血清中BLA、MDA含量以及SOD、GSH-Px和CAT活力,并取小鼠肝脏测定其HG含量。
1.3 数据分析
2 结果与分析
2.1 JMKP的蛋白质含量和SDS-PAGE分析

根据1.2.2节方法测得核桃楸分离蛋白的纯度可高达90.85%。由图1可知,核桃分离蛋白分子质量主要集中在18~24 ku和30~40 ku。
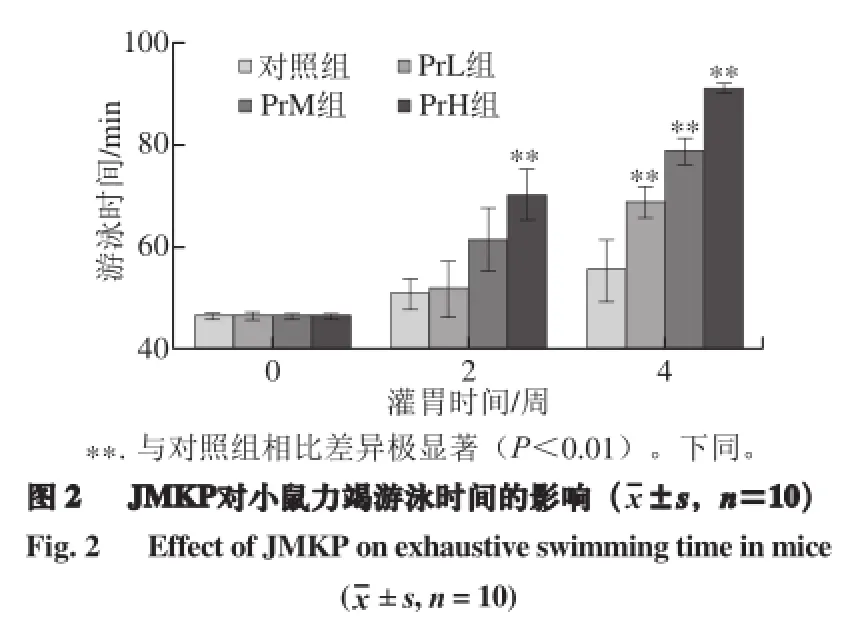
2.2 JMKP对小鼠力竭游泳实验的影响
力竭游泳实验是评价物质缓解动物体力疲劳功效的一种最有效实验[15]。由图2可知,灌胃JMKP 2 周和4 周后,PrH组小鼠的负重游泳时间均极显著延长(P<0.01),并且这种效果会随灌胃时间的延长而增加。2 周后,随着JMKP剂量的增加,小鼠负重游泳时间也在延长,与对照组相比,PrH组小鼠负重游泳时间增加了38.66%。4 周后,随着JMKP剂量的增加,小鼠负重游泳时间同样在延长,JMKP各剂量组小鼠负重游泳时间均极显著高于对照组(P<0.01),与对照组相比,PrL、PrM和PrH组小鼠负重游泳时间分别增加了24.10%、42.17%和64.46%。以上结果说明JMKP中可能存在能缓解小鼠体力疲劳的物质,并表现出明显的时间与剂量效应。
2.3 JMKP对小鼠血乳酸含量的影响

乳酸是机体在缺氧条件下糖酵解的产物,是剧烈运动时机体的主要供能方式。因此,血液中的乳酸含量是判断机体疲劳程度的重要指标之一[16-17]。乳酸本身不会引起疲劳,但乳酸分子中的氢离子解离出后引起了pH值的变化,从而导致身体机能下降,进而使机体产生了疲劳感[18]。如果某种物质能够抑制乳酸的积累或促进乳酸的清除,就会有缓解疲劳的作用。如图3所示,在小鼠负重游泳实验后,测定小鼠血液中乳酸的含量,结果表明在灌胃JMKP 2 周后,PrH组小鼠血液中的乳酸含量与对照组相比下降了21.44%;在灌胃JMKP 4 周后,PrM和PrH组小鼠血液中的乳酸含量与对照组相比分别下降了13.02%和23.48%。
2.4 JMKP对小鼠肝糖原含量的影响

血糖是稳定机体运行唯一能量来源,血糖浓度的维持主要依靠食物和肝脏糖原的分解,因此肝糖原是机体运动过程中的重要能量来源,当体内肝糖原不足时,便会产生疲劳感,所以说肝糖原是评定疲劳水平的一个敏感指标[19]。如图4所示,在灌胃JMKP 2 周和4 周后,与对照组相比,PrM组与PrH组小鼠的肝糖原含量均显著或极显著升高(P<0.05或P<0.01),分别比对照组升高了15.41%~16.29%和18.35%~20.81%,而PrL组与对照组相比无明显差异(P>0.05),以上结果说明中、高剂量的JMKP能够起到维持小鼠肝糖原水平的作用。
2.5 JMKP对小鼠血清中丙二醛含量的影响
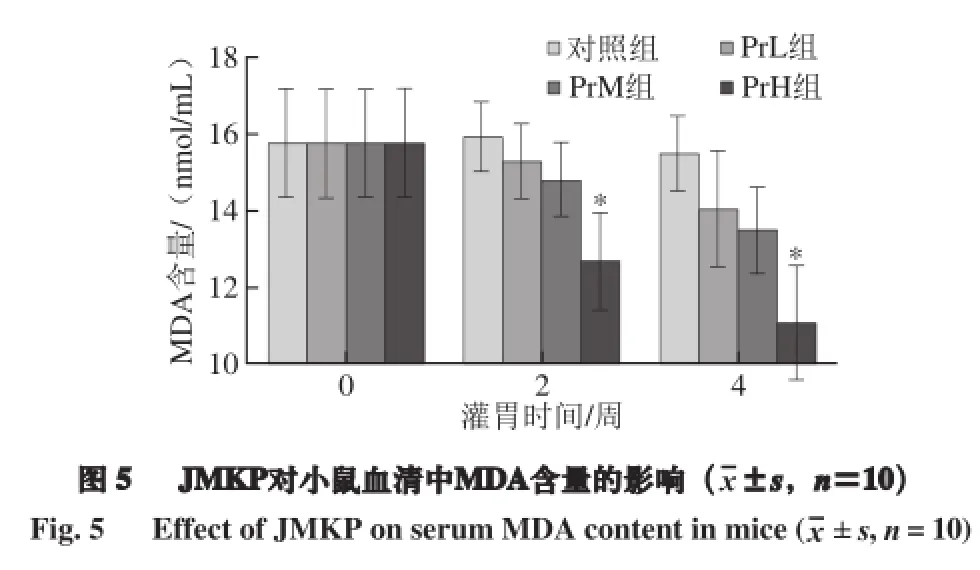
丙二醛是机体细胞质膜氧化后的产物,它在某种意义上代表了细胞的受损程度,正常情况下,体内氧化系统与抗氧化系统间呈现动态平衡[20]。当剧烈运动时,运动所需要的供氧量突然增加,一方面氧化-抗氧化系统间动态平衡遭到破坏,自由基产生增多,另一方面,局部氧气供应不足会损伤线粒体的氧化功能,引发自由基损伤[16]。在以有氧代谢为主的长时间力竭运动过程中,MDA 水平的高低反映了积累的自由基对组织细胞的损伤程度。由图5可知,在灌胃JMKP 2 周和4 周后,PrH组小鼠血清中的MDA含量与对照组相比分别下降了20.41%和28.59%,这说明高剂量的JMKP对于降低小鼠体内MDA含量具有显著影响。
2.6 JMKP对小鼠SOD、GSH-Px和CAT活力的影响
机体在剧烈或长时间运动后会产生疲劳感,这是因为当剧烈或长时间运动时,体内腺苷三磷酸(adenosine triphosphate,ATP)迅速被消耗,需氧量急剧增加,氧气不能及时抵达各个细胞组织时,机体内的糖类则不能彻底氧化分解,产生不完全分解产物——乳酸,乳酸的产生导致体内环境pH值发生变化,各类酶活性受到影响,进而使机体产生疲劳感[21]。疲劳与氧化之间有密切关系,当机体剧烈运动后,体内的氧化作用大幅度增加,剧烈运动肌肉群耗氧量增加,机体代谢副产物也相应增加,而体内抗氧化酶的数量一定,不能及时被分解或排出的代谢副产物必然对机体造成伤害,产生过多自由基,攻击生物膜上不饱和脂肪酸,引起脂质过氧化,使生物膜通透性增加,导致肌纤维兴奋收缩偶联,钙离子进入肌质网的速率减慢,线粒体功能紊乱,呼吸机能减弱,ATP生成量减少,机体能量供应不足,引发疲劳,因此体内的抗氧化酶活性在一定程度上反映了缓解疲劳的能力[22]。

SOD是生物体内重要的抗氧化酶,SOD在生物体内活性的高低是细胞衰老与死亡的直观指标,它可对抗与阻断氧自由基对细胞造成的损害[23-24],并及时修复受损细胞,修复自由基造成的伤害。由表1可知,在灌胃JMKP 2 周和4 周后,与对照组相比,PrH组小鼠体内的SOD活力均极显著升高(P<0.01);4 周后,随着JMKP灌胃剂量的增加,小鼠体内的SOD活力也逐渐升高,这表明JMKP能够提高小鼠体内的SOD活力,对于抗衰老具有潜在的功效。
GSH-Px是体内广泛存在的一种过氧化物分解酶,它特异地催化还原型谷胱甘肽(glutathione,GSH)对氢过氧化物的还原反应。一般认为GSH-Px在细胞内可清除有害的过氧化物代谢产物,阻断脂质过氧化物连锁反应,从而起到保护细胞结构和功能完整的作用。由表1可知,在灌胃JMKP 2 周和4 周后,与对照组相比,PrM组小鼠体内的GSH-Px活力显著增加(P<0.05),而PrH组小鼠体内的GSH-Px活力极显著增加(P<0.01),这说明在2 周时,随着JMKP灌胃剂量的增大,小鼠体内的GSH-Px活力增加不显著;而在灌胃高剂量JMKP的条件下,随着灌胃时间的延长,GSH-Px活力明显增强。
羟自由基(·OH)是化学性质活泼的活性氧,它几乎与细胞内的每一类有机物如糖、氨基酸、磷脂、核苷酸和有机酸都能反应,并且有非常高的速率常数,因此它的破坏性极强。但·OH可以被CAT分解,保护机体细胞稳定的内环境及正常状态,因此测定CAT活力的高低有重要意义[25]。由表1可知,PrL、PrM组小鼠体内CAT活性与对照组均无显著差异;在灌胃JMKP 2 周后,PrH组小鼠血清中的CAT活力与对照组相比显著升高(P<0.05),而到4 周时则达到极显著水平(P<0.01),这说明JMKP可以提高小鼠体内的CAT活力,但只有在长时间灌胃高剂量JMKP的情况下效果明显。
3 结 论
本研究初步证实了JMKP能使小鼠负重游泳时间明显延长,并且随着灌胃剂量的增加和时间的延长,小鼠负重游泳时间增加较为明显。JMKP能够降低小鼠体内肝糖原的消耗和MDA的生成,同时,JMKP还能够提高小鼠体内GSH-Px、CAT和SOD的活力,特别是在灌胃高剂量的JMKP 4 周后,小鼠体内以上3 种抗氧化酶的活力与对照组相比均极显著升高(P<0.01)。本实验结果表明,JMKP能够起到缓解小鼠体力疲劳和提高机体抗氧化能力的作用,这为研发缓解疲劳的新型食品提供了一定理论基础,为进一步开发核桃楸提供了参考依据。
[1] 张丽鹏, 杨雨春, 赵珊珊, 等. 环境因子对长白山区天然核桃楸林生长的影响[J]. 中国农学通报, 2014, 30(4): 34-41.
[2] 李敏, 刘媛, 孙翠, 等. 核桃营养价值研究进展[J]. 中国粮油学报,2009, 24(6): 166-170.
[3] 王晓飞, 闵伟红, 朱运明, 等. 长白山核桃球蛋白的提取, 分离纯化及其功能性质研究[J]. 现代食品科技, 2015, 31(4): 234-241. DOI:10.13982/j.mfst.1673-9078.2015.4.038.
[4] 孙琳琳. 长白山核桃楸种仁蛋白功能性质及其酶解产物的抗氧化活性研究[D]. 长春: 吉林农业大学, 2014: 17.
[5] 刘艳萍, 翟光喜, 臧恒昌. 核桃楸化学成分及药理活性研究进展[J]. 齐鲁药事, 2010, 29(1): 33-38. DOI:10.3969/ j.issn.1672-7738.2010.01.018.
[6] SZE-TAO K W C, SATHE S K. Walnuts (Juglans regia L.): proximate composition, protein solubility, protein amino acid composition and protein in vitro digestibility[J]. Journal of the Science of Food and Agriculture, 2000, 80(9): 1393-1401. DOI:10.1002/1097-0010(200007)80:9<1393::AID-JSFA653>3.0.CO;2-F.
[7] QI B, LIU L, ZHANG H, et al. Anti-fatigue effects of proteins isolated from Panax quinquefolium[J]. Journal of Ethnopharmacology, 2014,153(2): 430-434. DOI:10.1016/j.jep.2014.02.045.
[8] 中国食品药品检定研究院. 中国食品药品检定研究院实验动物福利伦理审查指导原则(试行)[EB/OL]. (2011-05-24) [2015-05-08]. http://www.nicpbp.org.cn/directory/web/WS07/CL0238/2741.html.
[9] ZHANG T, JIANG B, MU W, et al. Emulsifying properties of chickpea protein isolates: influence of pH and NaCl[J]. Food Hydrocolloids,2009, 23(1): 146-152. DOI:10.1016/j.foodhyd.2007.12.005.
[10] LIU Y, ZHAO G, REN J, et al. Effect of denaturation during extraction on the conformational and functional properties of peanut protein isolate[J]. Innovative Food Science & Emerging Technologies, 2011,12(3): 375-380. DOI:10.1016/j.ifset.2011.01.012.
[11] 中华人民共和国卫生部. GB 5009.5—2010 食品中蛋白质的测定[M].北京: 中国标准出版社, 2010.
[12] KASRAN M, CUI S W, GOFF H D. Emulsifying properties of soy whey protein isolate-fenugreek gum conjugates in oil-in-water emulsion model system[J]. Food Hydrocolloids, 2013, 30(2): 691-697. DOI:10.1016/j.foodhyd.2012.09.002.
[13] TAN S H, MAILER R J, BLANCHARD C L, et al. Extraction and characterization of protein fractions from Australian canola meals[J]. Food Research International, 2011, 44(4): 1075-1082. DOI:10.1016/ j.foodres.2011.03.023.
[14] UTHAYATHAS S, KARUPPAGOUNDER S S, TAMER S I, et al. Evaluation of neuroprotective and anti-fatigue effects of sildenafil[J]. Life Sciences, 2007, 81(12): 988-992. DOI:10.1016/j.lfs.2007.07.018.
[15] TANG W, ZHANG Y, GAO J, et al. The anti-fatigue effect of 20(R)-ginsenoside Rg3 in mice by intranasally administration[J]. Biological and Pharmaceutical Bulletin, 2008, 31(11): 2024-2027. DOI:10.1248/ bpb.31.2024.
[16] DING J F, LI Y Y, XU J J, et al. Study on effect of jellyfish collagen hydrolysate on anti-fatigue and anti-oxidation[J]. Food Hydrocolloids,2011, 25(5): 1350-1353. DOI:10.1016/j.foodhyd.2010.12.013.
[17] YOU L, ZHAO M, REGENSTEIN J M, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach (Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry, 2011, 124(1): 188-194. DOI:10.1016/ j.foodchem.2010.06.007.
[18] WANG L, ZHANG H L, LU R, et al. The decapeptide CMS001 enhances swimming endurance in mice[J]. Peptides, 2008, 29(7):1176-1182. DOI:10.1016/j.peptides.2008.03.004.
[19] JUNG K, KIM I H, HAN D. Effect of medicinal plant extracts on forced swimming capacity in mice[J]. Journal of Ethnopharmacology,2004, 93(1): 75-81. DOI:10.1016/j.jep.2004.03.022.
[20] 樊永波, 陶兴无, 马琳, 等. 核桃饼粕对大鼠学习, 记忆和抗氧化功能的影响[J]. 食品科学, 2013, 34(17): 323-326. DOI:10.7506/ spkx1002-6630-201317068.
[21] 李永超. 肉苁蓉有效部位抗疲劳作用机制研究[D]. 北京: 北京协和医学院, 2007: 14-16.
[22] SÖZMEN E Y, SÖZMEN B, GIRGIN F K, et al. Antioxidant enzymes and paraoxonase show a co-activity in preserving low-density lipoprotein from oxidation[J]. Clinical and Experimental Medicine,2001, 1(4): 195-199. DOI:10.1007/s102380100003.
[23] 马振华, 杨红强, 杨琼. 超氧化物歧化酶(SOD)的功能及应用[J]. 新学术, 2008(4): 316-319.
[24] 田景花, 王红霞, 张志华, 等. 低温逆境对不同核桃品种抗氧化系统及超微结构的影响[J]. 应用生态学报, 2015, 26(5): 1320-1326.
[25] 刘灵芝, 钟广蓉, 熊莲, 等. 过氧化氢酶的研究与应用新进展[J]. 化学与生物工程, 2009, 26(3): 15-18. DOI:10.3969/ j.issn.1672-5425.2009.03.004.
Effect of Juglans mandshurica Maxim Kernel Protein Isolate on Alleviating Physical Fatigue in Mice
CUI Lingyu, MIN Weihong*, LIU Wei, MAO Jing, MIAO Xinyu, LIU Jingsheng
(National Engineering Laboratory on Wheat and Corn Further Processing, College of Food Science and Engineering,Jilin Agricultural University, Changchun 130118, China)
To explore the anti-fatigue effect of Juglans mandshurica Maxim kernel protein isolate (JMKP), weight-loaded swimming test of mice was carried out and exhaustive swimming time as an indicator of fatigue, blood lactate (BLA)content, hepatic glycogen (HG) content, malondialdehyde (MDA) content, and the activities of glutathione peroxidase(GSH-Px), catalase (CAT) and superoxide dismutase (SOD) were determined. The results showed the exhaustive swimming time of mice gavaged for 2 weeks with JMKP at high dose increased by 38.66% compared with controls, and 4-week administration at low, medium and high doses resulted in a 24.10%, 42.17% and 64.46% compared with controls,respectively. The BLA content of mice in the high-dose JMKP group administered for 2 weeks decreased by 21.44%, and that of mice from the medium-dose and high-dose JMKP groups administered for 4 weeks decrease by 13.02% and 23.48%,respectively, compared with controls. The GLU content of mice from the medium-dose and high-dose JMKP groups administered for 2 and 4 weeks increased by 15.41%-16.29% and 18.35%-20.81%, respectively compared with controls. High-dose administration of JMKP for 2 and 4 weeks led to a 20.41% and 28.59% in serum MDA content, respectively. The levels of GSH-Px, CAT and SOD activity could be significantly improved by JMKP administration, especially for 4-week high-dose JMKP compared with controls (P < 0.01). Therefore, JMKP could evidently alleviate physical fatigue in mice.
Juglans mandshurica Maxim; protein isolate; in vivo tests; fatigue relief; antioxidant activity
10.7506/spkx1002-6630-201609038
TS255.1
A
1002-6630(2016)09-0203-05
崔玲玉, 闵伟红, 刘威, 等. 长白山核桃楸分离蛋白缓解小鼠体力疲劳的作用[J]. 食品科学, 2016, 37(9): 203-207. DOI:10.7506/spkx1002-6630-201609038. http://www.spkx.net.cn
CUI Lingyu, MIN Weihong, LIU Wei, et al. Effect of Juglans mandshurica Maxim kernel protein isolate on alleviating physical fatigue in mice[J]. Food Science, 2016, 37(9): 203-207. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609038. http://www.spkx.net.cn
2015-07-02
国家高技术研究发展计划(863计划)项目(2013AA102206)
崔玲玉(1990—),女,硕士研究生,主要从事发酵工程研究。E-mail:45451642@qq.com
*通信作者:闵伟红(1971—),女,教授,博士,主要从事发酵工程、粮油科学与深加工技术研究。E-mail:minwh2000@163.com
