不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制
2016-11-14潘丽华冯美琴徐幸莲周光宏
潘丽华,冯美琴,孙 健,*,徐幸莲,周光宏
(1.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;2.金陵科技学院动物科学与技术学院,江苏 南京 210038)
不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制
潘丽华1,冯美琴2,孙 健1,*,徐幸莲1,周光宏1
(1.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;2.金陵科技学院动物科学与技术学院,江苏 南京 210038)
本实验研究了不同加热温度下,添加亚麻籽胶对肌原纤维蛋白保水性、凝胶强度、流变特性、二级结构、微观结构的影响及其作用机制。结果表明,随着温度升高,肌原纤维蛋白凝胶保水性显著下降(P<0.05),凝胶强度显著上升(P<0.05),加热温度高于50 ℃时添加亚麻籽胶显著提高了肌原纤维蛋白凝胶保水性(P<0.05),同时显著降低了凝胶强度(P<0.05);拉曼光谱结果表明随着温度从30 ℃上升至80 ℃,凝胶α-螺旋含量显著下降,β-折叠含量显著上升;添加亚麻籽胶使得肌原纤维蛋白存在α-螺旋含量下降,β-折叠含量上升现象,影响凝胶的形成及性质。流变学特性结果显示高于50 ℃时添加亚麻籽胶后肌原纤维蛋白储能模量G'下降。从微观结构发现,添加亚麻籽胶后肌原纤维蛋白在50 ℃出现更多凝胶孔洞,且在70、80 ℃时形成的凝胶三维网络结构更为致密均一。
温度;肌原纤维蛋白;亚麻籽胶;二级结构;凝胶性质;凝胶机制
为了改善肉制品品质,在生产加工过程中,常添加具有乳化、增稠、保水等性质的亲水胶体,如卡拉胶、海藻胶等,可改善肌原纤维蛋白(myofibrillar protein,MP)凝胶特性。亚麻籽胶(flaxseed gum,FG)是一种具有弱凝胶性、乳化性、亲水性等性质的天然亲水胶体[1]。在食品工业中可代替果胶、阿拉伯胶、海藻胶等。研究表明,亚麻籽胶添加到肉制品中可以减少蒸煮过程中脂肪和肉类风味损失[2-3]。Chen Haihua等[4]对其与肉蛋白间相互作用研究结果表明添加亚麻籽胶能够增加蛋白热变性温度,增加其保水性和硬度。Sun Jian等[5]研究表明亚麻籽胶可以显著增加肌原纤维蛋白凝胶保水性,且它们间主要作用为静电作用及氢键作用。目前研究仅限于单一理化条件下亚麻籽胶与肌原纤维蛋白间的影响,但是凝胶过程是一个蛋白变性和蛋白相互凝集形成三维网状结构的动态的过程,还会受到外界环境的影响,如pH值、离子强度、加热温度等的影响[6]。
加热是肌原纤维蛋白分子在pH值高于等电点5.3条件下发生变性、展开、折叠形成凝胶的重要方式。Sharp等[7]通过透射电镜观察不同加热温度(30~60 ℃)加热30 min对肌球蛋白凝胶形成的影响,得出50 ℃加热后肌球蛋白尾部难以辨认,60 ℃加热后尾部全部消失,形成复杂的聚集结构。而加热温度为30 ℃和35 ℃时,仅有少数肌球蛋白通过头头聚集形成二聚体;40 ℃加热后,肌球蛋白分子大部分尾巴成辐射状向外散布的聚合物。Ishioroshi等[8]也指出pH值为6.0时,肌球蛋白的热诱导最佳温度为60~70 ℃。
本实验研究不同加热温度下,添加亚麻籽胶对肌原纤维蛋白保水性、凝胶强度、流变特性、二级结构和微观结构的影响及其作用机制,以期为亚麻籽胶在肉制品中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
猪背最长肌:购自双汇冷鲜肉专柜,宰后48 h内进行实验。
亚麻籽胶 新疆绿旗企业(集团)生物科技有限公司;氯化钠、氯化钾、氯化镁、牛血清白蛋白(bovine serum albumin,BSA)(生化试剂)、乙二醇双(2-氨基乙醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、磷酸氢二钠、磷酸二氢钠、磷酸二氢钾、磷酸氢二钾、Triton X-100(均为分析纯) 南京化学试剂设备有限公司。
1.2 仪器与设备
8010ES型实验室用搅拌机 美国Waring公司;Ultra-Turrax T25 basic数显型高速分散机 德国IKA公司;78-1型磁力加热搅拌器 常州金坛市杰瑞尔电器有限公司;AR64型高速冷冻离心机 美国Beckman-Coulter公司;M2e多功能酶标仪 美国MD公司;AUY120型天平 日本岛津公司;ZKSY-600智能恒温水箱 南京科尔仪器设备有限公司;TA-XT2i质构仪 英国Stable Micro Systems公司;JY Labram HR 800显微激光拉曼光谱仪 法国Jobin-Yvon公司;MCR301流变仪 奥地利Anton Paar公司;S-3000N扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参照Han Minyi等[9]的方法并进行改进,在4 ℃条件下进行。剔除肌肉的结缔组织和脂肪后称取100 g,用搅拌机低档搅碎,搅7 s,间隔10 s重复两次,间隔时用冰浴以防止蛋白质变性及钻头发热;加入4 倍体积的提取液(100 mmol/L KCl,20 mmol/L K2HPO4/KH2PO4,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0),1 000×g离心10 min后弃上清液收集沉淀,重复两次,两次离心之间用匀浆机分散约30 s。沉淀重新分散在4 倍体积的提取液,添加质量分数1% Triton X-100,玻棒搅动10 min后1 500×g、4 ℃离心10 min后弃上清液收集沉淀。沉淀加入4 倍体积0.1 mol/L KCl,1 500×g、4 ℃离心10 min后弃上清液收集沉淀,重复两次。最后沉淀加入4 倍体积0.1 mol/L NaCl,于1 500×g、4 ℃离心10 min后弃上清液收集沉淀,得到纯化的肌原纤维蛋白,用双缩脲法测其蛋白质量浓度,密封置于4 ℃保存备用。
1.3.2 肌原纤维蛋白-亚麻籽胶(MP-FG)混合物的制备
肌原纤维蛋白与亚麻籽胶用匀浆机混合均匀,加入磷酸缓冲液致使肌原纤维蛋白含量为4%,亚麻籽胶含量为0.4%,即MP-FG混合物,对照组(MP)不含亚麻籽胶。
1.3.3 流变特性的测定
参照Westphalen等[10]的方法进行修改,使用流变仪测MP和MP-FG混合体系流变特性。采用50 mm平行板,分别取制备好的MP和MP-FG混合物样品于测试平台。测试参数为:频率为1 Hz,应变为0.3%,上下板狭缝为0.5 mm,从20 ℃升温至80 ℃,升温速率2 ℃/min,随后4 ℃/min降温至20 ℃,使用液体石蜡封住平行板外蛋白与空气接触处部分,防止加热过程中蛋白溶液蒸发。各处理测定3 个重复。
1.3.4 MP及MP-FG混合物诱导凝胶的制备
将制好的MP及MP-FG混合物样品分装于小离心管和10 mL小烧杯中,放置于水浴锅中以1 ℃/min的速率加热,从20 ℃分别升温到30、40、50、60、70、80 ℃,保温20 min。保温结束后立刻取出放在0~4 ℃的冷藏室中平衡12h后,进行保水性、凝胶强度、二级结构和微观结构测试。
1.3.5 二级结构的测定
分别将MP和MP-FG混合物样品平摊于载玻片。拉曼光谱所用功率约为100 mW,使用50 倍长焦距镜头对样品进行激光聚焦,光谱的获得条件[11]为:200 µm开孔,600 g/mm光栅,3 次扫描,积分时间60 s,分辨率为2 cm-1,数据获取速率为120(cm·min)-1,拉曼光谱获取范围在400~3 050 cm-1。测试完成后用Labspec软件对拉曼光谱数据进行处理。不同蛋白质二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)含量用Alix等[12]的方法进行计算得到。每个处理进行3 次重复。
1.3.6 凝胶保水性(water-holding capacity,WHC)的测定
根据常辰曦等[13]方法测定保水性。将制备的凝胶称质量后,在10 000×g、4 ℃条件下离心10 min,离心后用吸水纸将离心出的水分吸出,离心前后称质量测保水性,每个样做3 个平行样。根据如下公式计算凝胶保水性。

式中:m1为离心前质量/g;m2为离心后去除水分的质量/g;m0为离心管质量/g。
1.3.7 凝胶强度的测定
形成的热诱导凝胶用TA XT Plus 质构仪进行凝胶强度测定,测定在10 mL小烧杯中直接进行,参数设定为:探头型号:P/5;测前速率:1 mm/s,测定速率:0.5 mm/s;距离:4 mm;数据获得速率:200 pps。每个样品做3 个平行样。
1.3.8 微观结构的观察
参照Han Minyi等[9]方法将凝胶切成约2 mm薄片放入2.5%的戊二醛缓冲液固定制样,将处理后的样品放入超临界点干燥仪中干燥、喷金后用扫描电镜观察并拍照,加速电压为7 kV,分别放大500、1 500、3 000、5 000 倍。
1.4 统计分析
每个样品测定至少3 次重复。用SAS 9.2进行方差分析,使用邓肯式多重比较进行多重比较。显著性用t检验进行比较。P<0.05为显著性差异。
2 结果与分析
2.1 不同加热温度条件下亚麻籽胶对肌原纤维蛋白保水性的影响
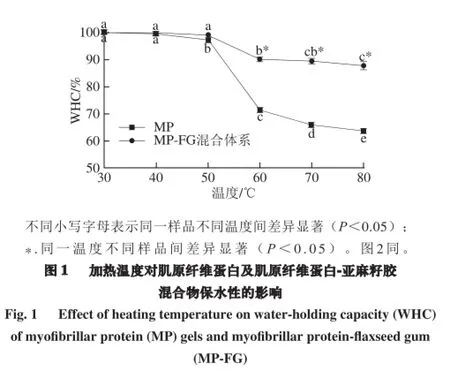
加热温度对MP凝胶保水性影响如图1所示,在较低温度(30~40 ℃)条件下凝胶保水性接近100%,无显著性变化(P>0.05),随着温度进一步升高,保水性显著下降(P<0.05),80 ℃时达到最低,为63.75%,其趋势与前人研究相似[14]。不同加热温度下,添加亚麻籽胶对MP凝胶保水性不尽相同:在30~50 ℃,添加亚麻籽胶对其保水性无明显影响,当温度升到60、70、80 ℃时,添加亚麻籽胶显著提高了MP保水性(P<0.05),80 ℃时,其保水性达87.65%。可能是因为亚麻籽胶含有大量酸性多糖,大量的带负电荷的羧基基团和带正电荷的蛋白质中氨基酸侧链间产生相互作用力,其是形成和稳定蛋白亚麻籽胶凝胶的主要推动力,在30、40 ℃条件下,蛋白尚未发生变性聚集[7],亚麻籽胶对其蛋白结构作用极小,所以,添加亚麻籽胶对其保水性没有显著性影响。加热温度升高到50 ℃时,肌球蛋白变性凝集[7],亚麻籽胶与蛋白分子发生相互作用,影响蛋白凝集结构,所以MP-FG混合物保水性高于同温度MP样品,可能由于作用尚少,差异不显著。当温度升到60 ℃,肌球蛋白变性完全,尾部消失,形成复杂的凝胶网络结构[7],亚麻籽胶与肌原纤维蛋白形成的三维结构,改变了凝胶结构,孔径细而均匀,大大提高了肌原纤维蛋白热诱导凝胶的保水性,因此60、70、80 ℃添加亚麻籽胶显著增加了肌原纤维蛋白凝胶的保水性。
2.2 不同加热温度条件下亚麻籽胶对肌原纤维蛋白凝胶强度的影响不同的温度对MP凝胶强度的影响见图2,温度从

30 ℃升至40 ℃ 时,其凝胶强度没有显著性变化,当温度继续上升至50、60 ℃时,其凝胶强度显著上升,当温度由60 ℃持续上升至80 ℃时,其凝胶强度继续缓慢增加,80 ℃时达到最大值,变化趋势与文献报道相似[15]。这可能是因为在30~40 ℃,其蛋白尚未发生明显变性,体系属于溶胶状态,因此其凝胶强度极低且没有显著性差异。在40~60 ℃,体系中蛋白发生大量变性,因此其凝胶强度显著增加,随着温度上升至60 ℃,体系蛋白的变性及聚集均已完成。在60、70、80 ℃条件下添加亚麻籽胶会使蛋白凝胶强度显著下降,但在30、40、50 ℃条件下并无显著性差异(图2)。可能是由于在30、40 ℃条件下,其为溶胶状态,添加亚麻籽胶只是使其溶胶更加黏稠,50 ℃时,主要发生的是蛋白变性,亚麻籽胶与蛋白间的交联作用尚少,因此添加亚麻籽胶其凝胶强度无显著性变化,随着温度持续上升,蛋白变性后发生聚集,亚麻籽胶参与其中,对其体系结构产生影响,导致凝胶强度显著下降(P<0.05)。且从保水性结果看到,在60、70、80 ℃添加亚麻籽胶凝胶保水性显著增加,体系中水分含量增加,这可能也是同温度下添加亚麻籽胶其凝胶强度下降的原因之一。
2.3 不同加热温度条件下亚麻籽胶对肌原纤维蛋白二级结构的影响

研究表明蛋白的构象变化与其凝胶特性密切相关[16-18]。α-螺旋的展开以及β-折叠的形成在蛋白凝胶形成过程中起关键作用。温度对MP及MP-FG混合体系二级结构的影响见图3,MP和MP-FG样品随着加热温度的改变其变化趋势相似:随着温度上升,α-螺旋结构减少且伴随着β-折叠和无规卷曲结构的增加。变化的原因可能是随着温度的上升α-螺旋结构展开,通过氢键、分子暴露的疏水残基等分子作用力相互作用形成了β-折叠和β-转角和无规卷曲结构。这与前人研究温度对肌原纤维蛋白热诱导蛋白结构的变化结论相似[16,19],在升温过程中α-螺旋结构解开,β-折叠的形成可能是普遍现象。
相同加热温度条件下,添加亚麻籽胶肌原纤维蛋白α-螺旋结构含量有所下降,β-折叠结构含量增加,且温度高于50 ℃时变化显著(P<0.05)。氨基酸间的静电荷作用维持蛋白二级结构,多肽链的羰基氧和氨基氢形成的氢键维持蛋白的α-螺旋[20]。添加亚麻籽胶后,多糖与肌原纤维蛋白间的静电作用可能使蛋白α-螺旋展开,并形成β-折叠、无规卷曲,随着温度升高至肌球蛋白、肌动蛋白发生变性,内部疏水基团暴露[21],与亚麻籽胶的静电作用、疏水作用、氢键作用增强,导致肌原纤维蛋白构象发生变化[22],所以加热温度高于50 ℃时,添加亚麻籽胶显著降低肌原纤维蛋白α-螺旋结构含量,增加β-折叠结构含量。
2.4 不同加热温度条件下亚麻籽胶对肌原纤维蛋白流变学特性的影响

储能模量G'又称弹性模量,反映样品的弹性。由图4可知,在加热过程中G'有两个峰值。随着温度的上升,第一个峰值出现在50.9 ℃,随后下降,超过60 ℃后又稳步上升直至70~80 ℃到达峰顶。目前被普遍接受的解释是G'的两次改变是MP的两次热变性阶段,G'的第一个峰值最高温度为50.9 ℃,G'增大来自于肌球蛋白头部的接合[23],在此阶段,松散的凝胶结构初步形成。随着温度的进一步升高,致使G'下降[24],是由于肌球蛋白尾部逐渐展开,导致半凝胶流动性大幅度增加,从而导致已形成的网络结构被破坏;随后G'又随温度上升而上升,在温度超过60 ℃后,随着肌球蛋白分子展开,形成无规卷曲结构,使得现有的蛋白质网络中蛋白聚集体与新增的变性蛋白聚集体的相互交联作用增加,凝胶骨架加强,从而形成不可逆凝胶。损耗模量G''又称黏性模量,反映材料黏性大小,升温过程中损耗模量的变化趋势和G'相似。
实验结果显示,在20~47.9 ℃ 升温过程中,MP-FG混合体系的G'略高于MP,G''显著高于MP,这可能是由于添加亚麻籽胶,亚麻籽胶与蛋白间的静电作用使得体系弹性增加,这也解释了在较低温度加热条件下MP-FG混合体系的凝胶强度大于MP。随着温度从47.9 ℃升至57 ℃,添加亚麻籽胶对G''无显著性影响,但是显著降低了肌原纤维蛋白G',说明添加亚麻籽胶与肌原纤维蛋白间存在相互作用,可能是由于添加亚麻籽胶的变化引起体系二级结构、疏水作用、极性的变化,使得肌原纤维蛋白在热诱导变性过程中G'较低,在宏观指标表现出其凝胶强度较MP低。陈海华等[4,25]在研究亚麻籽胶与盐溶性蛋白(salt-soluble meat protein,SSMP)间相互作用实验中发现,添加2%的亚麻籽胶使SMP的变性温度T1和变性温度T2温度分别升高了9 ℃和14 ℃,但本实验中并未发现此现象,可能是因为本实验亚麻籽胶添加量较低,因此对其蛋白变性温度影响不显著。
2.5 不同加热温度条件下,亚麻籽胶对肌原纤维蛋白凝胶微观结构的影响


由图5可知,在40 ℃时,蛋白尚未发生大量变性,几乎没有形成凝胶孔径,随着温度升高至50 ℃,MP与MP-FG样品表面均出现凝胶孔洞,添加亚麻籽胶,凝胶孔洞形成更多,这可能是由于亚麻籽胶与蛋白分子受热变性后暴露的反应基团间发生相互作用,使得亚麻籽胶与肌原纤维蛋白间发生交联,这种交联有助于凝胶孔洞的形成。随着温度继续上升,肌原纤维蛋白变性聚集完成,MP-FG混合体系凝胶三维网络结构孔径较MP凝胶孔径更细小、结构更致密。在MP-FG样品电镜图中可以看到一些薄膜结构(箭头标出),该膜结构可能是亚麻籽胶与肌原纤维蛋白相互作用形成的矩阵结构。一些亲水胶体(黄原胶、刺槐豆胶、水溶性壳聚糖)也曾被报道在电镜图发现类似的亲水胶体与肉蛋白相互作用的结构[26-27]。具有凝胶性质的亲水胶体比如卡拉胶会分散在凝胶孔洞中,形成一种连续的结构;阴离子亲水胶体会通过与蛋白的交互作用贯穿于蛋白基质中[28]。添加亚麻籽胶形成更加致密的网络结构可能也是因为亚麻籽胶与蛋白基质的物理填充作用,以及它们间的交互作用。
凝胶三维网络结构影响肉制品保水性和质构特性,致密的三维网络结构会产生毛细现象,有利于水分的滞留,对水分束缚力强,因此其保水性强[5]。从电镜图看到添加亚麻籽胶后肌原纤维蛋白所形成的凝胶结构更加致密,与其高保水性相符合。
3 结 论
不同加热温度条件下,添加亚麻籽胶对肌原纤维蛋白凝胶特性影响不尽相同。在较低加热温度(<40 ℃)条件下,添加亚麻籽胶对肌原纤维蛋白并无显著性影响。在较高加热温度(>50 ℃)条件下,添加亚麻籽胶显著增强肌原纤维蛋白凝胶的保水性,减弱其凝胶强度(P<0.05);并使肌原纤维蛋白α-螺旋含量下降,β-折叠含量上升现象。由此可以得出结论:亚麻籽胶对肌原纤维蛋白凝胶特性影响的作用机制是在高于50 ℃条件下亚麻籽胶影响肌原纤维蛋白变性聚集从而影响其凝胶特性。
[1] 陈海华. 亚麻籽胶的功能性质结构及其应用[D]. 无锡: 江南大学,2005.
[2] 陈海华, 许时婴, 王璋, 等. 亚麻籽胶在低脂午餐肉中的应用[J]. 农业工程学报, 2007, 23(1): 254-258. DOI:10.3321/ j.issn:1002-6819.2007.01.050.
[3] 孙健. 亚麻籽胶对肉制品保水性, 乳化性, 淀粉糊化和老化特性影响及其应用[D]. 南京: 南京农业大学, 2011.
[4] CHEN Haihua, XU Shiying, WANG Zhang. Interaction between flaxseed gum and meat protein[J]. Journal of Food Engineering, 2007,80(4): 1051-1059. DOI:10.1016/j.jfoodeng.2006.08.017.
[5] SUN Jian, LI Xu, XU Xinglian, et al. Influence of various levels of flaxseed gum addition on the water-holding capacities of heat-induced porcine myofibrillar protein[J]. Journal of Food Science, 2011, 76(3):472-478. DOI:10.1111/j.1750-3841.2011.02094.x.
[6] 夏秀芳, 孔保华, 张宏伟. 肌原纤维蛋白凝胶形成机理及影响因素的研究进展[J]. 食品科学, 2009, 30(9): 264-268. DOI:10.3321/ j.issn:1002-6630.2009.09.062.
[7] SHARP A, OFFE G. The mechanism of formation of gels frommyosin molecules[J]. Journal of the Science of Food and Agriculture, 1992,58(1): 63-73. DOI:10.1002/jsfa.2740580112.
[8] ISHIOROSHI M, JIMA K S, YASUI T. Heat-induced gelation of myosin: factors of pH and salt concentrations[J]. Journal of Food Science, 1979, 44(5): 1280-1284. DOI:10.1111/j.1365-2621.1979. tb06419.x.
[9] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[10] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2005, 70(2): 293-299. DOI:10.1016/j.meatsci.2005.01.015.
[11] 韩敏义, 李伟锋, 王鹏, 等. 拉曼光谱研究NaCl浓度对猪肉肌原纤维蛋白凝胶硬度的影响[J]. 核农学报, 2014(12): 2192-2199. DOI:10.11869 /j.issn.100-8551. 2014. 12.2192.
[12] ALIX A, PEDANOU G, BERJOT M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band[J]. Journal of Molecular Structure, 1988,174: 159-164. DOI:10.1016/0022-2860(88)80151-0.
[13] 常辰曦, 邹玉峰, 曹锦轩, 等. 谷氨酸螯合钙替代部分食盐对兔肉肌原纤维蛋白热凝胶和乳化特性的影响[J]. 食品科学, 2014, 35(7):1-6. DOI:10.7506/spkx1002-6630-201407001.
[14] 韩敏义. 肌原纤维蛋白结构与热诱导凝胶功能特性关系研究[D]. 南京: 南京农业大学, 2009.
[15] 孔保华, 王宇, 夏秀芳, 等. 加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2011, 32(5): 50-54.
[16] LIU Ru, ZHAO Siming, XIONG Shanbai, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639. DOI:10.1016/ j.meatsci.2008.02.014.
[17] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170. DOI:10.3864/j.issn.0578-1752.2010.01.019.
[18] LIU Ru, ZHAO Siming, LIU Youming, et al. Effect of pH on the gel properties and secondary structure of fish myosin[J]. Food Chemistry,2010, 121(1): 196-202. DOI:10.1016/j.foodchem.2009.12.030.
[19] 杨玉玲, 游远, 彭晓蓓, 等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014, 47(10): 2013-2020. DOI:10.3864/j.issn.0578-1752.2014.10.015.
[20] SANO T, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Science, 1994, 59(5): 1002-1008. DOI:10.1111/j.1365-2621.1994. tb08177.x.
[21] FERR J D. Protein gels[J]. Advances in Protein Chemistry, 1948, 4(1):1-78.
[22] TURGEON S, SCHMITT C, SANCHEZ C. Protein-polysaccharide complexes and coacervates[J]. Current Opinion in Colloid and Interface Science, 2007, 12(4): 166-178. DOI:10.1016/ j.cocis.2007.07.007.
[23] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural and Food Chemistry, 2000,48(4): 1016-1023. DOI:10.1021/jf9900332.
[24] SANO T, NOGUCHI S F, TSUCHIYA T, et al. Dynamic viscoelastic behavior of natural actomyosin and myosin during thermal gelation[J]. Journal of Food Science, 1988, 53(3): 924-928. DOI:10.1111/j.1365-2621.1988.tb08987.x.
[25] 陈海华, 许时婴, 王璋. 亚麻籽胶与盐溶肉蛋白的作用机理的研究[J]. 食品科学, 2007, 28(4): 95-98. DOI:10.3321/ j.issn:1002-6630.2007.04.018.
[26] MONTERO P, SOLAS T, PÉREZ-MATEOS M. Pressure-induced gel properties of fish mince with ionic and non-ionic gums added[J]. Food Hydrocolloids, 2001, 15(2): 185-194. DOI:10.1016/S0268-005X(00)00064-3.
[27] PÉREZ-MATEOS M, SOLAS T, MONTERO P. Carrageenans and alginate effects on properties of combined pressure and temperature in fish mince gels[J]. Food Hydrocolloids, 2002, 16(3): 225-233. DOI:10.1016/S0268-005X(01)00086-8.
[28] MONTERO P, HURTADO J L, PÉREZ-MATEOS M. Microstructural behaviour and gelling characteristics of myosystem protein gels interacting with hydrocolloids[J]. Food Hydrocolloids, 2000, 14(5):455-461. DOI:10.1016/S0268-005X(00)00025-4.
Effect and Mechanism of Flaxseed Gum on Thermal Gelling Properties of Porcine Myofibrillar Protein at Different Heating Temperatures
PAN Lihua1, FENG Meiqin2, SUN Jian1,*, XU Xinglian1, ZHOU Guanghong1
(1. National Center of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University,Nanjing 210095, China; 2. College of Animal Science and Technology, Jinling Institute of Technology, Nanjing 210038, China)
The objective of the study was to explore the effect and mechanism of action of heating temperature and addition of flaxseed gum (FG) on water-holding capacity (WHC), gel strength, rheological properties, secondary structure and 3-dimensional network structure of heat-induced gels of pork myofibrillar protein (MP). The results revealed that increasing temperature could significantly decrease gel WHC (P < 0.05), and increase gel strength (P < 0.05). The addition of FG significantly enhanced WHC and decreased gel strength at temperature higher than 50 ℃ (P < 0.05). Raman spectroscopic analysis revealed that increasing the temperature from 30 to 80 ℃ induced partial transformation of α-helices into β-sheets. At the same heating temperature, the addition of FG led to the transformation of α-helices into β-sheets, thus affecting the formation of gels. The rheological tests showed that storage modulus (G') values during MP gelation were declined with addition of FG (P < 0.05) when temperature was higher than 50 ℃. Gel holes of MP appeared at 50 ℃, and MP-FG formed a fine dense network at both 70 and 80 ℃ as shown by scanning electron microscopy images.
temperature; myofibrillar protein; flaxseed gum; secondary structure; gel properties; gelling mechanism
10.7506/spkx1002-6630-201609001
TS251.5
A
1002-6630(2016)09-0001-06
潘丽华, 冯美琴, 孙健, 等. 不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制[J]. 食品科学, 2016, 37(9): 1-6.
DOI:10.7506/spkx1002-6630-201609001. http://www.spkx.net.cn
PAN Lihua, FENG Meiqin, SUN Jian, et al. Effect and mechanism of flaxseed gum on thermal gelling properties of porcine myofibrillar protein at different heating temperatures[J]. Food Science, 2016, 37(9): 1-6. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201609001. http://www.spkx.net.cn
2016-02-22
国家自然科学基金青年科学基金项目(31401516);中央级公益性科研院所基本科研业务费专项资金项目(Y0201400114)
潘丽华(1992—),女,硕士,研究方向为畜产品加工与质量控制。E-mail:panlihua1576@163.com
*通信作者:孙健(1973—),男,副教授,博士,研究方向为畜产品加工与质量控制。E-mail:sunjian01@njau.edu.cn
