NF-κB荧光素酶报告基因系统的构建及验证
2016-11-14郭志兰车路阳李晶哲孙震晓刘长振
郭志兰,车路阳,李晶哲,孙震晓,刘长振
NF-κB荧光素酶报告基因系统的构建及验证
郭志兰1,2,车路阳3,李晶哲2,孙震晓1,刘长振2
1 北京中医药大学中药学院,北京 100102;2 中国中医科学院医学实验中心北京市重点实验室,北京 100700;3 中国人民解放军总医院骨科,北京 100853
为了定量检测NF-κB的活化效果及筛选与NF-κB活化调控相关的药物,通过去除逆转录病毒载体pQCXIP原有的CMV启动子,并分别插入NF-κB增强子序列及荧光素酶NanoLuc报告基因序列,构建了一种新的含有NF-κB增强子序列和NanoLuc (NLuc) 报告基因序列的表达载体,并进一步建立受NF-κB调控的稳定表达NLuc荧光素酶的细胞系。酶切鉴定及测序结果表明成功构建了重组质粒pQCXIP-NF-κB-NLuc;NF-κB信号通路的刺激物肿瘤坏死因子TNF-α作用于构建的稳定表达NLuc的细胞系后出现特异性的荧光素酶反应,且该酶反应与TNF-α的刺激呈良好的时间、剂量依赖性,该结果表明受NF-κB调控的稳定表达NLuc荧光素酶的细胞系构建成功。实例验证中,NF-κB抑制剂雷公藤甲素对此细胞系NLuc荧光素酶表达的抑制呈剂量效应。综上,本实验构建的受NF-κB调控的稳定表达NLuc荧光素酶的报告基因系统可用于NF-κB的活化效果的定量检测及筛选与NF-κB活化调控相关的药物,具有研究和应用价值。
NF-κB,荧光素酶NanoLuc,报告基因系统
NF-κB (Nuclear factor-κB) 作为一种核转录因子能够与多种基因启动子区的特定核苷酸序列结合从而启动下游基因转录,在免疫、炎症、氧化应激、细胞增殖与凋亡等生理病理过程中起重要调控作用[1]。NF-κB蛋白家族包括p50、p52、p65 (RelA)、RelB、c-Rel 五个亚基,其功能状态通常为这些亚基形成的同源或异源二聚体,其中最常见的NF-κB二聚体为p65与p50组成的异二聚体。在胞浆中,这些NF-κB二聚体常常以与IκB结合的形式存在,处于非活性状态,在上游信号促使IκB降解后进入细胞核参与下游基因的表达调控。另外胞浆中还存在一些非活性的NF-κB前体蛋白二聚体。这些前体蛋白通过非经典途径剪切成相应有活性的NF-κB二聚体,进而入核参与下游基因的表达调控[2-3]。研究表明,人体许多疾病如阿尔兹海默症、糖尿病、风湿性关节炎、哮喘及一些癌症等均与NF-κB的失调相关[4-10],因此,NF-κB蛋白家族及其在人类疾病的发生发展与预防治疗中所扮演的角色等一直是研究的热点。
报告基因 (Reporter gene) 是一种编码易于被检测的蛋白质或酶的基因。该基因序列可以插入到基因表达调节序列 (如启动子、增强子) 之后形成嵌合基因,或与其他目的基因序列相连接形成融合蛋白的基因序列,进而通过检测该报告基因的表达来定性或定量测定目的基因的表达情况。常用的报告基因有氯霉素转乙酰酶、β-半乳糖苷酶、荧光素酶以及荧光蛋白等[11]。本实验室选用的NanoLuc (NLuc) 是一种人工改造的荧光素酶,其分子量小 (19.1 kDa,171个氨基酸),热稳定性高,没有翻译后修饰或二硫键;其发光强度与萤火虫荧光素酶或海肾萤光素酶相比强100倍,且其反应不依赖ATP[12]。这些优点使得NLuc成为目前较理想的报告基因之一。
本实验室期望通过对现有逆转录病毒载体的改造,构建一种新的含有NF-κB增强子序列和NLuc报告基因序列的表达载体,并进一步构建受NF-κB调控的稳定表达NLuc荧光素酶的细胞系。该细胞系可被用于NF-κB活化状态定量检测和与NF-κB活化调控相关的药物的筛选之中。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞株和质粒
感受态大肠杆菌DH5α购自天根生化科技 (北京) 有限公司;人胚肾上皮包装细胞GP2-293、人宫颈癌细胞系HeLa由本实验室保存;pQCXIP载体购自Clontech公司;NF-κB增强子序列、NLuc序列及TATA box序列由北京普尔普乐生物科技有限公司合成。
1.1.2 主要试剂
限制性内切酶、连接酶购自Fermentas 公司;肿瘤坏死因子TNF-α购自Peprotech公司;雷公藤甲素(Triptolide) 购自南通飞宇生物科技有限公司;腔肠素购自Sigma公司;质粒小提试剂盒、琼脂糖凝胶回收试剂盒均购自天根生化科技 (北京) 有限公司;DMEM培养基购自Gibco公司、胎牛血清购自HyClone公司。
1.2 方法
1.2.1 逆转录病毒载体pQCXIP-NF-κB-NLuc的构建及其鉴定
逆转录病毒载体pQCXIP原有CMV启动子的去除、NF-κB增强子和TATA box序列的装入,以及荧光素酶NLuc基因序列的装入如图1所示。首先将pQCXIP利用Ⅱ、Ⅰ进行双酶切,去除pQCXIP原有CMV启动子,然后将合成的含有转录因子NF-κB增强子和TATA box序列 (序列如表1所示,两端含有Ⅱ和Ⅰ的酶切位点) 的DNA片段经Ⅱ、Ⅰ双酶切装载入改造后的pQCXIP质粒上。NanoLuc (序列如表1所示,两端含有Ⅰ和R Ⅰ的酶切位点) 与上述得到的pQCXIP-NF-κB质粒分别用Ⅰ、R Ⅰ进行双酶切,连接并转化获得重组的逆转录病毒载体pQCXIP-NF-κB- NLuc。本实验合成的NanoLuc序列的N端部分含有分泌信号肽,可帮助蛋白分泌到细胞外的培养基中。同时,我们构建了去除NF-κB增强子 (保留TATA box) 的质粒pQCXIP-TATA- NLuc作为对照载体。构建的质粒经华大基因测序表明序列正确。
1.2.2 质粒转染与病毒制备
人胚肾上皮包装细胞GP2-293用含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2条件下培养、传代。构建的pQCXIP-NF-κB-NLuc质粒及对照质粒pQCXIP-TATA-NLuc与pVSV-G病毒包装质粒利用lipofectamine 2000转染试剂按操作说明共转染入GP2-293细胞,其中质粒与lipofectamine 2000质量体积比在预实验后选用转染效果较好的1∶2。转染5 h后培养基更换成新鲜DMEM+10% FBS完全培养基继续培养,48 h后收集含病毒上清,经0.45 μm滤膜过滤,分装。

图1 pQCXIP-NF-κB-NLuc的构建示意图

表1 NF-κB-TATA box和NanoLuc序列
1.2.3 病毒侵染
人宫颈癌细胞HeLa以2×105/孔接种于6孔板中,在DMEM+10% FBS培养基,37 ℃、5% CO2条件下培养。24 h后,将上述制备的含病毒上清1 mL与2 mL新鲜完全培养基及polybrene (8 μg/mL) 加至HeLa细胞,并于32 ℃、1 800×(Beckman Allegra X15R) 水平离心机中离心 90 min,37 ℃静置5 h,再更换成新鲜DMEM+10% FBS培养基继续培养。
1.2.4 稳定表达单克隆的筛选
病毒侵染48 h后,HeLa细胞中加入3 μg/mL嘌呤霉素 (Puromycin) 进行筛选。24 h后将嘌呤霉素浓度降低到1 μg/mL维持抗性。4 d后,将存活细胞计数并按1个细胞/孔分配至96孔板中。两周后,将其中的单克隆细胞株继续放大培养。所获得的细胞株记为PP-NF-κB- NLuc-HeLa以及PP-TATA-NLuc-HeLa。
1.2.5 稳定表达细胞系有效性验证
将上述获得的稳定表达细胞分别进行细胞计数,以2×104/孔加入96孔板中。24 h后加入NF-κB信号通路的刺激物肿瘤坏死因子TNF-α,浓度分别为0、5和10 ng/mL,每组设5个复孔。加药24 h后,取培养基上清,加入3 μmol/L底物腔肠素(Coelenterazine),使用化学发光仪 (BioTek Synergy 2) 检测发光值。此外,针对PP-NF-κB-NLuc-HeLa细胞系进行了0.1、0.5和2.5 ng/mL三个浓度的TNF-α分别刺激3、6、9、12和24 h的效果检测。
1.2.6 阳性药物雷公藤甲素的抑制
稳定表达的PP-NF-κB-NLuc-HeLa细胞系计数,以2×104/孔加入96孔板中。24 h后加入2.5 ng/mL TNF-α (除空白组) 刺激8 h,再分别加入0、0.25、1、4 ng/mL雷公藤甲素共刺激12 h,取培养基上清检测发光值。
2 结果与分析
2.1 pQCXIP-NF-κB-NLuc质粒的构建
理论上逆转录病毒载体pQCXIP的CMV启动子部分的长度为 (680 bp)。在本研究中,pQCXIP经Ⅱ、Ⅰ双酶切后,琼脂糖电泳结果表明 (图2A),680 bp位置处出现一条明显的核酸条带,而其上的核酸条带位置与理论去除CMV启动子部分的pQCXIP位置 (6.5 kb) 相近,因此可以判断获得了去除CMV启动子的逆转录病毒载体pQCXIP。接下来我们将Ⅱ、Ⅰ双酶切后的NF-κB增强子/TATA box序列与改造的pQCXIP进行连接和转化。利用Ⅱ、Ⅰ双酶切鉴定表明 (图2B),双酶切得到的核酸条带与理论插入的NF-κB增强子/TATA box序列条带 (242 bp) 大小吻合,说明已构建获得重组质粒pQCXIP-NF-κB。随后将NLuc与重组质粒pQCXIP-NF-κB经Ⅰ、R Ⅰ双酶切、连接和转化,并经Ⅱ、R Ⅰ双酶切鉴定(图2C),结果表明NLuc序列被成功插入pQCXIP-NF-κB中,获得了目标质粒pQCXIP- NF-κB-NLuc。该质粒经测序证明序列完全正确。

图2 pQCXIP-NF-κB-NLuc重组质粒的构建及鉴定
2.2 NF-κB-NLuc稳定表达细胞系的构建
随后,将构建的pQCXIP-NF-κB-NLuc质粒与pVSV-G病毒包装质粒共转染GP2-293细胞获得逆转录病毒,并将该病毒侵染HeLa细胞。经过嘌呤霉素筛选及单克隆分离,成功地获得了NF-κB-NLuc单克隆稳定表达细胞系。按同样方案也成功地获得了对照组细胞TATA-NLuc单克隆稳定表达细胞系。两组细胞系在加入NF-κB信号通路的刺激物TNF-α刺激24 h后进行了NLuc酶活性检测。结果表明 (图3),在5 ng/mL和10 ng/mL TNF-α作用下,NF-κB-NLuc组细胞上清中的酶活性上升,分别为0 ng/mL TNF-α组细胞酶活性的6和11倍,差异有统计学意义 (*<0.05;**<0.01)。而在5 ng/mL和10 ng/mL TNF-α作用下,对照组TATA-NLuc细胞上清中的酶活性与0 ng/mL TNF-α组细胞酶活性相比无显著差异。此外,NF-κB-NLuc组细胞在0.5及2.5 ng/mL浓度的TNF-α刺激不同时间段下呈良好的线性增长趋势 (图4)。这些结果说明,我们成功地构建获得针对NF-κB活化检测的NLuc荧光素酶报告基因系统。
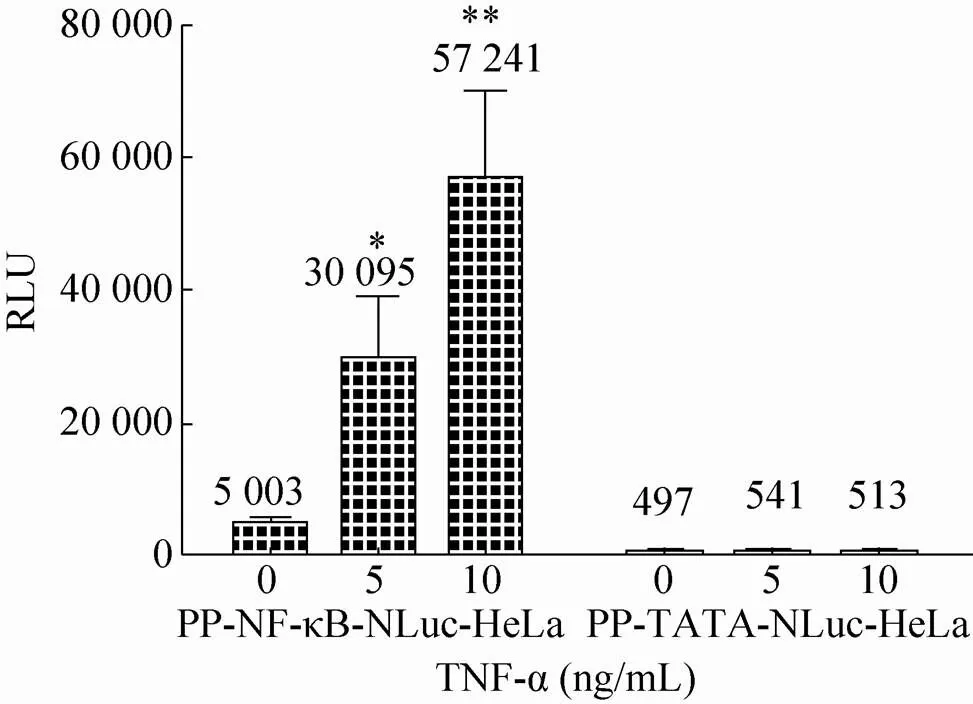
图3 TNF-α对PP-NF-κB-NLuc-HeLa及PP-TATA- NLuc-HeLa细胞系的刺激作用
2.3 NF-κB荧光素酶报告基因系统对药物检测能力的验证
进一步尝试利用已知抑制NF-κB活化的药物雷公藤甲素来验证NF-κB荧光素酶报告基因系统对药物的检测能力。CCK-8检测实验表明 (图5),2.5 ng/mL TNF-α 以及0.25-1 ng/mL雷公藤甲素都未对细胞活力产生明显影响,在雷公藤甲素浓度为4 ng/mL时仅有少量影响。随后荧光素酶活性检测表明 (图6),2.5 ng/mL TNF-α使得细胞上清的酶活性上升了4.3倍,而加入不同浓度的雷公藤甲素均能抑制TNF-α促使的荧光素酶活性增加,在4 ng/mL浓度时对TNF-α诱导活化的NF-κB抑制率为53%,且抑制作用呈剂量效应。
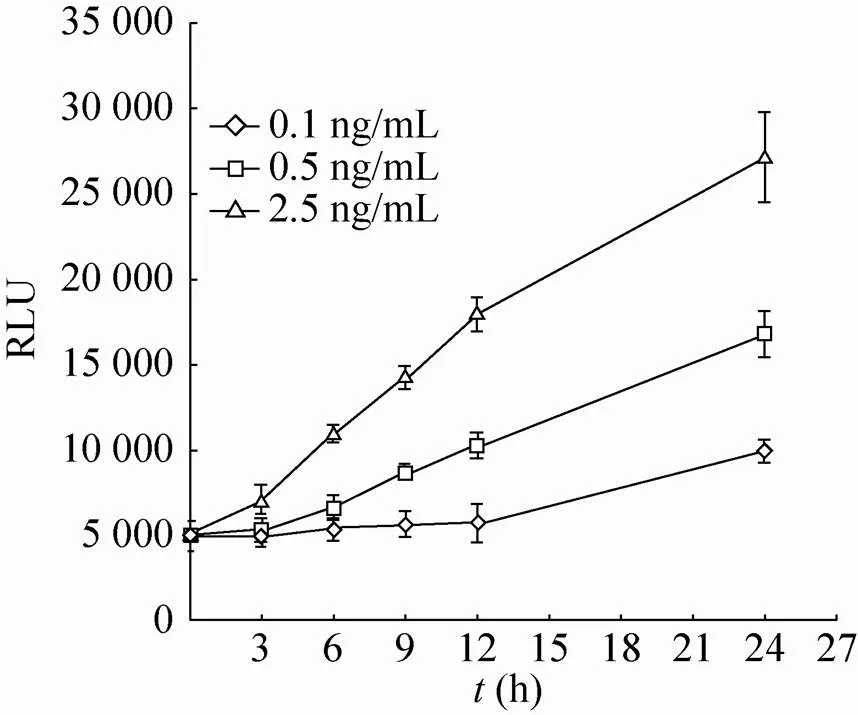
图4 各种浓度TNF-α在不同时间段刺激PP-NF- κB-NLuc-HeLa细胞系的结果

图5 CCK-8法检测TNF-α与各种浓度雷公藤甲素对细胞活力的影响

图6 雷公藤甲素抑制TNF-α诱导的PP-NF-κB- NLuc-HeLa细胞系中NLuc的表达
3 讨论
在本研究中,我们通过对逆转录病毒载体pQCXIP的改造,去除了原有的CMV启动子,并且装载入NF-κB增强子序列和NLuc报告基因序列,成功构建了重组逆转录病毒载体pQCXIP-NF-κB-NLuc。利用该载体包装获得了逆转录病毒,使其侵染HeLa细胞,再经过药物筛选最终获得了NF-κB-NLuc稳定表达细胞系。NF-κB信号通路刺激物TNF-α和NF-κB活化抑制药物雷公藤甲素检测构建细胞的荧光素酶活性变化表明,我们成功地构建获得针对NF-κB活化检测的NLuc荧光素酶报告基因系统。
当前,包括NF-κB信号通路在内的多种信号通路报告基因检测系统主要来源于Promega和Invitrogen等商业公司。这些公司提供的相关质粒、病毒所构建的报告基因系统虽然成熟、稳定,但也因其序列固定限制了研究者对构建的报告基因系统的调整和完善,以及在特定情况下的使用。本研究提供了一套可行的针对NF-κB活化检测的逆转录病毒载体的改造和重组方案,并成功地获得了相应的荧光素酶报告基因系统。研究中对所用的逆转录病毒载体pQCXIP的改造和重组尚无相关报道,具有一定的科研价值。同时本研究中所构建的载体还可根据后续的科研要求对NF-κB反应元件序列、TATA box序列和报告基因NLuc序列进行自由改造,并可引入其他转录因子的反应元件,因此可为后续科研工作提供研究基础,以及为其他研究者的相关载体改造工作提供一定的借鉴。
在发现了RelA/p65与c-Rel以及它的致癌性衍生物v-Rel之间存在同源性后,NF-κB与癌症之间存在关联性的设想就被提出[13]。流行病学研究的大量数据证实了这一设想,并进一步促使研究者们去探究NF-κB与癌症之间的作用机制。基于NF-κB与癌症之间的关联性,以NF-κB及其信号通路为靶标的药物被研制以用于肿瘤的预防与治疗。如DHMEQ (Dehydroxymethylepoxyquinomicin),一种新型的NF-κB抑制剂,在乳腺癌[14-15]、肝癌[16-17]、多发性骨髓瘤[18]的体内外实验中均展现出较好的抑制肿瘤生长及促凋亡效果,并可有效协同化疗药物或放射疗法起到抗肿瘤的作用[19-22]。此外,针对NF-κB设计的一些小分子、单克隆抗体及激动剂等在治疗或预防2型糖尿病、代谢综合征、心血管疾病以及HIV潜伏感染[23-24]等均取得了一定进展。如上所述,研制和筛选新型NF-κB信号通路抑制剂在多种重大疾病的治疗和预防上都具有重要的价值和广阔的应用前景。已有报道表明,NF-κB-NLuc报告基因系统是筛选调节NF-κB活性的药物植物单体或提取物的有力的、便捷的工具。Orlando 等[25]利用Panomics公司的293T/NF-κB-luc细胞系对西班牙国家常用的20种草药抗炎活性进行了初步判断。Ajit等[26]利用DI TNC1 (永生化大鼠星型胶质瘤细胞)/NF-κB-luc细胞系对一系列植物单体或提取物进行了抗炎活性检测。我国中医药文化博大精深,中药等药物植物资源极为丰富。本研究构建的NF-κB-NLuc报告基因系统在提供了一套可行的针对NF-κB活化检测的载体改造、重组方案的同时,还可用于快速、高通量地筛选中药资源库,以便捷的方式获得NF-κB信号通路抑制剂,因此具有一定的研究和应用价值。
REFERENCES:
[1] Su JD, Wu LF. Relationship between nuclear factor-kappa B and cell apoptosis. World Chin J Digestol, 2007, 15(12): 1411–1416 (in Chinese). 苏剑东, 吴灵飞. NF-κB与细胞凋亡. 世界华人消化杂志, 2007, 15(12): 1411–1416.
[2] Gilmore TD. Introduction to NF-κB: players, pathways, perspectives. Oncogene, 2006, 25(51): 6680–6684.
[3] Razani B, Reichardt AD, Cheng GH. Non-canonical NF-κB signaling activation and regulation: principles and perspectives. Immunol Rev, 2011, 244(1): 44–54.
[4] Yang Y, Li JJ, Wang X, et al. Progresses on reporter gene and its application. Life Sci Res, 2011, 15(3): 277–282 (in Chinese). 杨宇, 李江江, 王项, 等. 报告基因及其应用研究进展. 生命科学研究, 2011, 15(3): 277–282.
[5] Gilmore TD. The Re1/NF-κB/IκB signal transduction pathway and cancer. Cancer Treat Res, 2003, 115: 241–265.
[6] Laveti D, Kumar M, Hemalatha R, et al. Anti-inflammatory treatments for chronic diseases: a review. Inflamm Allergy Drug Targets, 2013, 12(5): 349–361.
[7] Granic I, Dolga AM, Nijholt IM, et al. Inflammation and NF-κB in Alzheimer's disease and diabetes. J Alzheimers Dis, 2009, 16(4): 809–821.
[8] Rico-Rosillo G, Vega-Robledo GB. The involvement of NF-κB transcription factor in asthma. Rev Alerg Méx, 2011, 58(2): 107–111.
[9] Zubair A, Frieri M.Role of nuclear factor-κB in breast and colorectal cancer.Curr Allergy Asthma Rep, 2013, 13(1): 44–49.
[10] Wong ET, Tergaonkar V.Roles of NF-κB in health and disease: mechanisms and therapeutic potential.Clin Sci, 2009, 116(6): 451–465.
[11] Okamoto T. NF-κB and rheumatic diseases. Endocr Metab Immune Disord Drug Targets, 2006, 6(4): 359–372.
[12] Hall MP, Unch J, Binkowski BF, et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem Biol, 2012, 7(11): 1848–1857.
[13] Park MH, Hong JT. Roles of NF-κB in cancer and inflammatory diseases and their therapeutic approaches. Cells, 2016, 5(2): 15.
[14] Wang W, Nag SA, Zhang RW. Targeting the NF-κB signaling pathways for breast cancer prevention and therapy. Curr Med Chem, 2015, 22(2): 264–289.
[15] Matsumoto G, Namekawa JI, Muta M, et al. Targeting of nuclear factor κB pathways by dehydroxymethylepoxyquinomicin, a novel inhibitor of breast carcinomas: antitumor and antiangiogenic potential. Clin Cancer Res, 2005, 11(3): 1287–1293.
[16] Nishimura D, Ishikawa H, Matsumoto K, et al. DHMEQ, a novel NF-κB inhibitor, induces apoptosis and cell-cycle arrest in human hepatoma cells. Int J Oncol, 2006, 29(3): 713–719.
[17] Poma P, Notarbartolo M, Labbozzetta M, et al. Antitumor effects of the novel NF-κB inhibitor dehydroxymethyl-epoxyquinomicin on human hepatic cancer cells: analysis of synergy with cisplatin and of possible correlation with inhibition of pro-survival genes and IL-6 production. Int J Oncol, 2006, 28(4): 923–930.
[18] Watanabe M, Dewan MZ, Okamura T, et al. A novel NF-κB inhibitor DHMEQ selectively targets constitutive NF-κB activity and induces apoptosis of multiple myeloma cellsand. Int J Cancer, 2005, 114(1): 32–38.
[19] Pushkarev VV, Starenki DV, Pushkarev VM, et al.Inhibitor of the transcription factor NF-κB, DHMEQ, enhances the effect of paclitaxel on cells of anaplastic thyroid carcinomaand. Ukr Biochem J, 2015, 87(3): 63–74.
[20] Togano T, Nakashima M, Watanabe M, et al.Synergistic effect of 5-azacytidine and NF-κB inhibitor DHMEQ on apoptosis induction in myeloid leukemia cells.Oncol Res, 2012, 20(12): 571–577.
[21] Kozakai N, Kikuchi E, Hasegawa M, et al.Enhancement of radiosensitivity by a unique novel NF-κB inhibitor, DHMEQ, in prostate cancer.Br J Cancer, 2012, 107(4): 652–657.
[22] Gupta SC, Sundaram C, Reuter S, et al.Inhibiting NF-κB activation by small molecules as a therapeutic strategy.Biochim Biophys Acta, 2010, 1799(10-12): 775–787.
[23] Esser N, Paquot N, Scheen AJ. Anti-inflammatory agents to treat or prevent type 2 diabetes, metabolic syndrome and cardiovascular disease. Expert Opin Investig Drugs, 2015, 24(3): 283–307.
[24] Jiang GC, Dandekar S. Targeting NF-κB signaling with protein kinase C agonists as an emerging strategy for combating HIV latency. AIDS Res Hum Retroviruses, 2015, 31(1): 4–12.
[25] Orlando RA, Gonzales AM, Hunsaker LA, et al. Inhibition of nuclear factor κB activation and cyclooxygenase-2 expression by aqueous extracts of hispanic medicinal herbs. J Med Food, 2010, 13(4): 888–895.
[26] Ajit D, Simonyi A, Li RT, et al. Phytochemicals and botanical extracts regulate NF-κB and Nrf2/ARE reporter activities in DI TNC1 astrocytes. Neurochem Int, 2016, 97: 49–56.
(本文责编 陈宏宇)
Construction and verification of NF-κB luciferase reporter gene system
Zhilan Guo1,2, Luyang Che3, Jingzhe Li2, Zhenxiao Sun1, and Changzhen Liu2
1,,100102,2,,,100700,3,,100853,
To quantify the transcriptional activity of NF-κB and to screen drugs related to the regulation of NF-κB activation, we constructed a recombinant plasmid through deleting the original CMV promoter of retrovirus vector pQCXIP and inserting the NF-κB enhancer and NanoLuc luciferase sequence into the vector. Then, using the recombinant plasmid we constructed a cell line in which the expression of NanoLuc luciferase (NLuc) was regulated by NF-κB. The inserted sequences were verified by restriction endonuclease digestion and sequencing. Tumor necrosis factor-α (TNF-α), an NF-κB activator, acted on the constructed NLuc cell line and leaded to the specific luciferase reaction. The luciferase reaction showed a fine time and dose dependence to the TNF-α stimulation, indicating the successful construction of the NF-κB regulated NLuc-expressing cell line. Besides, the NF-κB inhibitor, triptolide, reduced the expression of NLuc in a dose-dependent way. The constructed reporter system in this study could be applied in the quantification of the NF-κB transcriptional activity and in the NF-κB regulation-related drug screening.
NF-κB, NanoLuc luciferase, reporter gene system
May 5, 2016; Accepted:June 20, 2016
s:Changzhen Liu. Tel: +86-10-64089526; E-mail: lcz0220@163.com
Zhenxiao Sun. Tel: +86-10-84738646; E-mail: sunzxcn@hotmail.com
Supported by:National Natural Science Foundation of China (Nos. 31170829, 81171762, 81550017, 81473418), Research Project of CACMS (No. zz2015015).
国家自然科学基金 (Nos. 31170829,81171762,81550017,81473418),中国中医科学院自主选题项目 (No. zz2015015) 资助。
