利用手持技术解决原电池教学中的认知难点
2016-11-11北京宋兆爽指导教师
◇ 北京 宋兆爽 指导教师 王 春
利用手持技术解决原电池教学中的认知难点
◇北京宋兆爽1指导教师王春2
电化学是高中化学的核心知识之一,包括原电池和电解池两大部分.人教版在必修和选修阶段都涉及原电池的内容,而且原电池的教学是安排在电解池之前.所以对于原电池原理的认识是否到位,对于后续电解池的学习以及电化学模型的建立和应用起到了至关重要的作用.人教版教材采用最简单的装置模型帮助学生建立原电池的模型,这样做降低了学生的理解难度,但也容易造成学生认识不全面、不透彻等问题,甚至会形成错误的概念,所以笔者在讲“原电池”时尝试利用手持技术帮助学生正确认识原电池的概念原理,解决原电池教学中的认知难点.
主要仪器:朗威®DISLab8.0数据采集器、电压传感器、电流传感器、氧气浓度传感器、计算机及配套软件.
1 利用手持技术解释原电池中电流产生的驱动力
学生在《必修2》遇到Zn|H2SO4|Cu单液电池时,由于Zn和稀H2SO4直接接触,所以学生对于该装置内能发生氧化还原反应是能够接受的.但在《选修4》遇到Zn|ZnSO4‖CuSO4|Cu双液电池时,学生难以理解既然氧化剂和还原剂已经分隔开了,为什么还是能发生电子的得失而产生电流?氧化还原反应的驱动力在哪里呢?
人教版教材并未提及“电势差”,但在教学中我们深切感受到,如果要将原电池的原理讲解透彻,“电势差”是无法回避的,关键是如何以学生容易接受的方式呈现.其实学生对于“电势差”并不陌生,在初中物理课上学过“电势差”就是“电压”,所以可以利用电压传感器测量原电池两电极之间的电压.首先按照教材中Zn|ZnSO4‖CuSO4|Cu双液电池的装置图连接装置,在正、负极之间连接电压传感器,测得两电极之间的电压为1.01V,然后再将负极区更换为Mg和MgSO4溶液,测得两电极之间的电压为1.63V.可见,原电池的2个电极间确实存在电势差,这就是电流产生的驱动力.那么电势差是如何产生的呢?这就要从化学的角度去认识.人教版教材第72页有这样一句话:“原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力.”这个氧化还原能力也就是电极反应物得失电子的能力.此处可参考鲁科版的相关内容,并联系学生刚刚在第3章学过的沉淀溶解平衡进行讲解.对于Zn-Cu原电池来说,锌片插入ZnSO4溶液中存在溶解与沉积的平衡:ZnZn2++2e-,铜片插入CuSO4溶液中存在溶解与沉积的平衡:CuCu2++2e-,由于锌比铜容易失去电子,在锌片表面积累的电子比铜片表面积累的电子多,其电极电势比铜低,所以两电极之间产生了电势差,将两极接通构成回路时,电子由锌片流向铜片.同样,Mg-Cu原电池的两电极间也会产生电势差,且由于镁比锌更容易失去电子,所以相同条件下,Mg-Cu原电池的电势差大于Zn-Cu原电池的电势差,这与电压传感器测得的结果是一致的.在必修阶段讲原电池时,笔者向学生介绍过世界上最早的电池——伏打电池.事实上意大利物理学家伏特在发明伏打电池时,就是采用不同的金属材料在不同的电解质溶液中进行实验,看哪种组合能够产生较大的电压.
讲到这里时,有学生马上想到,燃料电池2个电极的材料完全相同,它的电势差又是哪来的呢?此时,教师不急于回答学生的疑问,而是将Zn-Cu原电池的正极铜片更换为碳棒,用电压传感器测得两电极之间的电压为1.51V.也就是说,虽然更换为惰性电极,但碳棒与CuSO4溶液接触的界面上仍存在CuCu2++2e-,故两电极间仍有电势差.燃料电池的原理也是相似的.虽然燃料电池用的是铂电极或石墨电极,但吸附在电极上的H2和O2得失电子的能力是不相同的,同样能够产生电势差.这个例子的引出能够帮助学生消除“负极必定要与电解质溶液发生反应”的错误概念,进一步完善了原电池模型.为巩固学生对原电池模型的认识,教师可继续提出学生任务:请根据反应2FeCl3+2KI=2FeCl2+2KCl+I2设计一款能提供稳定电流的原电池.有了之前的认识铺垫,大部分学生在做该任务时能够正确选择出电极材料.
2 利用手持技术比较单双液电池的优势和劣势
笔者在上《选修4》“原电池”这节课时将单液电池和双液电池的装置图同时呈现给学生,提出问题:如果让你自己设计电池,你更喜欢设计成单液还是双液电池?结果不少同学选择单液电池,原因是单液电池构造简单,更加便携.于是,笔者利用电流传感器演示Zn|CuSO4|Cu单液电池和Zn|ZnSO4‖CuSO4|Cu双液电池电流变化的对比实验.
【实验】 将单液原电池和双液原电池装置的正负极分别与电流传感器的正负极相连,连接好数据采集器和计算机,点击运行软件,8min后学生观察到如图1、2所示的2条曲线.
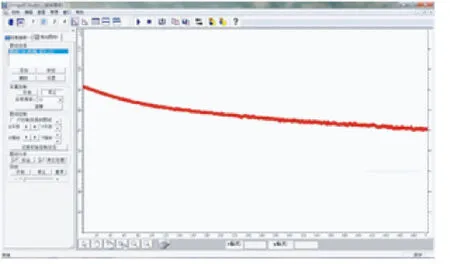
图1 单液电池电流变化曲线
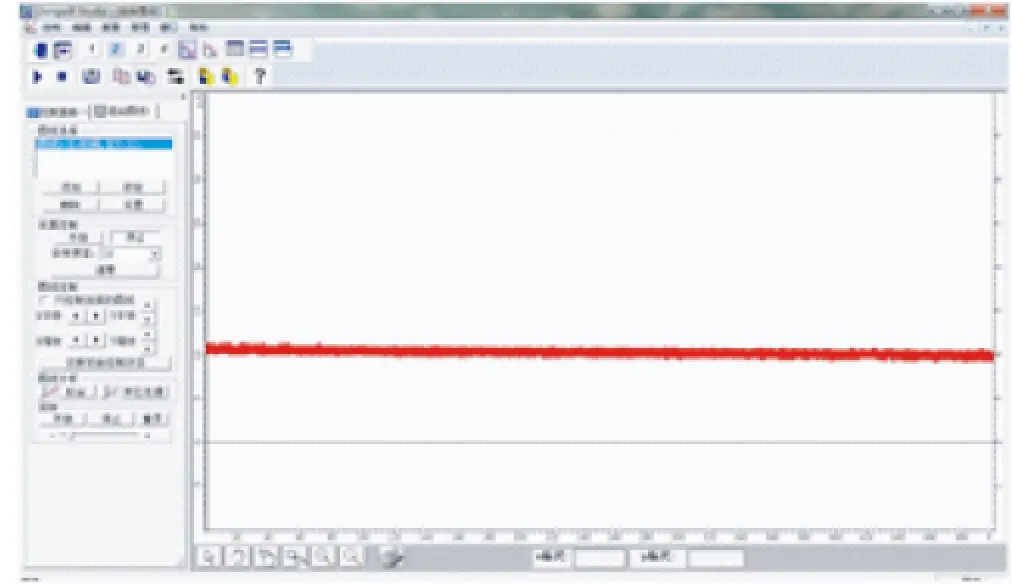
图2 双液电池电流变化曲线
之后笔者分别取出2个原电池装置中的负极锌片,可以看到单液电池的锌片表面覆盖了红色疏松的铜,而双液电池的锌片表面依然光亮如新.
在做单液电池实验时,有一部分学生会观察到一段时间后电流表指针的偏转幅度会减小.但当笔者利用电流传感器呈现出明显的曲线变化差异时,给学生们带来的视觉冲击力是完全不同的.此时无需教师多言,学生们自然能体会到单液电池虽然装置简单,但电流会在短时间内衰减,而双液电池可以为原电池提供更加持续、稳定的电流,电池利用效率更高.在课后调查中,大部分学生表示这一环节给他们留下了深刻的印象,这也体现了手持技术的优势.
笔者在做这个对比实验时希望学生关注的是电流变化趋势,然而课堂上仍有细心的同学发现,双液电池虽然电流稳定性非常好,但纵坐标显示的电流数值只有几毫安,远远小于单液电池的几十毫安,立刻提出质疑.笔者并未回避这个问题,而是引导学生查找原因.学生们很快想到这是由于盐桥内的琼胶内阻太大导致的.那么如何来改进这个问题呢?大家踊跃发言,提出对原电池装置的各种改进方案.其中一位学生提出可以用浸满饱和KCl溶液的面巾纸代替盐桥,笔者请该生到讲台前做演示实验.果然,当该生把KCl-琼胶盐桥换成浸满饱和KCl溶液的面巾纸时,电流传感器中检测到的电流数值明显增大.此时,笔者顺势向学生展示了一个拆开的锂离子手机电池,内部有非常薄的多孔隔膜,这就是真实电池中的盐桥.
实际上,这个拆开的锂离子电池是笔者课前准备好的,目的是想在这节课的尾声由理论原电池模型过渡到真实的电池应用.而学生在课堂上的意外发现和讨论却使得隔膜的作用被非常自然地引出.这种意外生成的教学环节正是课堂精彩之所在.另外,影响原电池电流强度的因素是多样的,在高二下学期的选修课上,笔者组织感兴趣的学生利用手持技术继续分析研究,进一步加深了对原电池原理的认识.
3 利用手持技术再认识金属的电化学腐蚀
人教版教材第84页提到:“不纯的金属与电解质溶液接触时,会发生电化学反应,这种腐蚀叫做电化学腐蚀.钢铁在潮湿空气中生锈,就是电化学腐蚀最典型的例子.”之后在教材的实验4-3中将用食盐水浸泡过的铁钉放入具支试管中,一段时间后观察到右侧导管中水柱上升,证明铁钉发生了吸氧腐蚀.学生在初中时学过铁钉生锈的条件,对钢铁在潮湿空气中容易生锈并不陌生,但对于该现象是吸氧腐蚀、其中发生了电化学反应却心存疑惑.学生认为,实验4-3中导管内水柱上升只能说明试管内气体减少,并未证明就是O2参加反应,而铁失电子后是Fe2+还是Fe3+也无法从实验中观察到.为了解决学生的疑惑,笔者尝试利用手持技术改进实验.
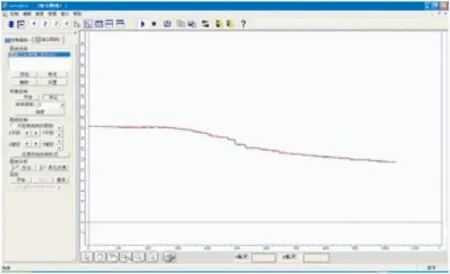
图3
【实验1】 向大试管中放入用饱和食盐水润湿的滤纸,将2g铁粉和1g碳粉混合均匀后用纸槽装入大试管中,与滤纸均匀接触.将大试管与氧气浓度传感器相连,塞紧塞子,连接数据采集器和计算机,点击运行软件,10min后学生观察到如图3所示曲线,体系内氧气含量逐渐减小,说明氧气确实参与了反应.
【实验2】 将U形管固定在铁架台上,加入饱和食盐水,一端塞好插有碳棒的胶塞,另一端滴几滴铁氰化钾溶液后塞好插有铁棒的胶塞.将电流传感器的正极连接碳棒,负极连接铁棒,点击运行软件,观察实验现象.与此同时,在一个大试管中加入饱和食盐水,放入铁棒,让铁棒的一部分暴露于空气中,滴几滴铁氰化钾溶液,观察现象.
点击运行软件后电脑屏幕上立刻有电流示数显示,数值由小到大,最后稳定在36.2mA,铁棒周围的溶液也很快出现蓝色,表示有Fe2+生成.相同时间内大试管内的铁棒周围未看到明显的蓝色,较长时间后溶液中缓慢出现蓝色.该实验说明铁和碳可构成原电池,负极铁发生了电化学腐蚀:Fe-2e-=Fe2+,而电化学腐蚀的速度要比化学腐蚀快得多.
上述几个手持技术实验在帮助学生认识原电池原理的过程中取得了很好的教学效果.然而,先进的技术手段是把双刃剑,用得好能够为教学锦上添花,用不好可能是画蛇添足,喧宾夺主.作为一线教师,我们首先要有清醒的判断,技术手段是为教学内容服务的,在传统实验难以呈现和解决的内容上,大胆尝试新的实验手段,利用手持技术定量、动态、数形结合的特点,使学生对于一些微观的抽象的问题能够有更加直观、准确的认识.

