RNA干扰沉默基质交感分子1减轻H9C2细胞低氧/复氧损伤
2016-11-11郏红静吴继雄王晓晨许邦龙
郏红静,吴继雄,王晓晨,许邦龙
RNA干扰沉默基质交感分子1减轻H9C2细胞低氧/复氧损伤
郏红静,吴继雄,王晓晨,许邦龙
目的 探讨沉默基质交感分子1(STIM1)对H9C2心肌细胞低氧/复氧损伤的影响。方法 培养H9C2心肌细胞,建立心肌细胞低氧/复氧(H/R)模型,STIM1-siRNA转染H9C2心肌细胞以下调STIM1表达。流式细胞术检测各组细胞凋亡率,Western blot法检测各组STIM1及凋亡相关蛋白表达情况。结果 与对照组比较,H/R组的STIM1表达量明显增加(P<0.05),Bax/Bcl-2蛋白比率增高,Caspase-3上调,细胞凋亡率增加(P<0.05)。STIM1-siRNA转染能显著下调STIM1基因的表达(P<0.05),减少细胞内Ca2+浓度,并且Bax/Bcl-2比率降低,Caspase-3表达下调,细胞凋亡率明显下降(P<0.05)。结论 心肌细胞发生缺血再灌注时STIM1表达量明显增加,STIM1-siRNA转染下调STIM1基因的表达可以减轻低氧/复氧引起的心肌细胞凋亡。
H9C2心肌细胞;低氧/复氧;凋亡;基质交感分子1
急性心肌梗死是严重危害人类健康的常见病。再灌注治疗通过恢复缺血组织的供血有效地挽救缺血组织,是治疗心肌梗死的最主要措施。但心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)的存在,一定程度上限制了再灌注治疗的疗效[1-2]。钙超载在MIRI引起的细胞凋亡过程中发挥着重要作用[3]。基质交感分子1(stromal interaction molecule 1,STIM1)是钙库操作性钙离子通道(store-operated calcium entry,SOCE)的主要组成部分,通过调控SOCE从而影响细胞内钙离子浓度的变化,进而调控细胞的生物学行为[4]。该研究利用H9C2心肌细胞建立心肌细胞低氧/复氧模型,从而模拟心肌细胞的缺血再灌注,观察在心肌细胞发生缺血再灌注时STIM1表达量的变化,同时利用siRNA技术沉默STIM1的表达以探讨其对低氧/复氧H9C2心肌细胞凋亡的影响。
1 材料与方法
1.1 材料与试剂 H9C2心肌细胞株(中国科学院上海生命科学研究所细胞资源中心);胎牛血清(杭州四季青生物工程有限公司);DMEM高糖培养基(美国Hyclone公司);胰蛋白酶(中国Biosharp公司);DMEM低糖培养基、Opti-MEM培养基(美国Gibco公司);Annexin V-FITC凋亡检测试剂盒(上海贝博生物技术有限公司);STIM1、含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase 3,Caspase-3)、B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(美国Cell Signaling Technologies公司);β-actin、过氧化物酶标记羊抗小鼠IgG(武汉博士德生物工程有限公司);RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒及超敏ECL化学发光试剂盒(上海碧云天公司);PVDF膜(美国密理博公司);STIM1-siRNA和scramble siRNA(即阴性对照组)(上海吉凯公司);RT-PCR试剂盒、脂质体LipofectamineTM2000(美国Invitrogen公司)。
1.2 siRNA构建及验证 采用Block-iT RNAi Designer系统设计针对STIM1的stealth-siRNA,由上海吉凯公司设计并合成3条siRNA,见表1。该3条siRNA的干涉效率采用Western blot及RT-PCR检测,将细胞随机分成5组(n=8),即空白对照组、scramble siRNA组(阴性对照组)、siRNA1组、siRNA2组、siRNA3组。
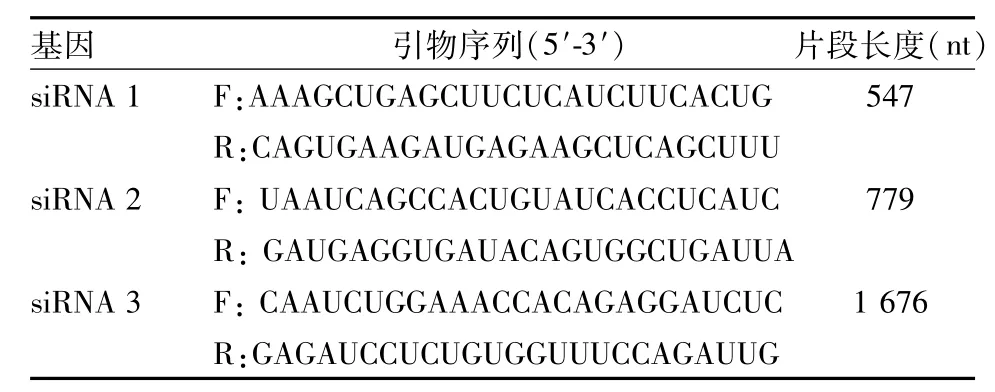
表1 各基因引物序列和基因片段长度
1.3 H9C2心肌细胞的培养及低氧/复氧模型的建立 细胞培养基为含10%胎牛血清(FBS)、100 U/ ml青霉素和100 mg/ml链霉素的DMEM高糖培养基。细胞置于37℃、5%CO2和95%的空气培养箱中,培养48 h换液,以后隔天换液1次,待细胞覆盖率至少达到80%后用于建立低氧/复氧模型。
H9C2细胞更换含0.5%FBS、低糖DMEM培养基后在37℃、含95%N2/5%CO2的低氧培养箱中处理12 h后,更换0.5%FBS的DMEM培养基于37℃、5%CO2培养箱中进行复氧处理6 h以建立低氧/复氧模型[5]。对照组细胞在含10%FBS的DMEM完全培养基中于37℃、5%CO2培养箱中孵育18 h。
1.4 siRNA转染细胞及实验分组 转染前1 d细胞被接种于6孔板中,用无双抗的完全培养基培养,当细胞密度达到约80%时,用LipofectamineTM2000介导转染STIM1-siRNA及scramble siRNA,按说明书操作,后将细胞置于常规37℃、5%CO2培养箱中培养48 h。实验分组:将培养的细胞随机分成4组(n=8):对照组、低氧/复氧组(H/R组)、低氧/复氧+STIM1-siRNA组(STIM1-siRNA组)、低氧/复氧+scramble siRNA组(scramble siRNA组)。
1.5 流式细胞术检测细胞凋亡变化 按照Annexin V-FITC/PI凋亡检测试剂盒提供的方法,收集经siRNA转染48 h处理后的上清悬浮的细胞,同时用不含EDTA的胰酶消化贴壁的细胞后,收集细胞,2 000 r/min离心5 min,弃培养基,用预冷的磷酸盐缓冲液(phosphatebuffered saline,PBS)洗涤2次。使用400 μl 1×Binding Buffer悬浮细胞,浓度约为1 ×106个/ml。在细胞悬浮液中加入5 μl Annexin VFITC,轻轻混匀后于室温避光反应5~15 min。再加入10 μl PI混匀后于室温避光反应5~15 min。在1 h内用流式细胞仪检测各组细胞凋亡率。
1.6 Fluo3-AM荧光探针检测细胞内Ca2+浓度
将H9C2心肌细胞接种在培养皿中培养。将细胞分为对照组、H/R组、STIM1-siRNA组及scramble siRNA组。处理结束后各组加入10 μmol/L的Fluo3-AM,37℃孵育60 min后激光共聚焦显微镜扫描荧光强度(德国Carl-Zeiss公司)。Image-Pro Plus 6.0软件(美国Silver-Spring公司)获取图像并分析荧光强度。
1.7 RT-PCR法检测STIM1 mRNA的水平 TRIzol法提取细胞总RNA,验证其纯度和完整性符合要求后进行逆转录,逆转录条件为30℃、10 min,42℃、60 min以及85℃、10 min。采用逆转录试剂盒(美国Invitrogen公司)以逆转录获得的cDNA为模板,β-actin为内参进行RT-PCR反应。STIM1上游引物:5′-ACTCTCCGGAAGCAGCTAGA-3′,下游引物:5′-CCTTCGACAACCGAAGGTCA-3′。β-actin上游引物:5′-ACGGTCAGGTCATCACTATCG-3′,下游引物:5′-GGCATAGAGGTCTTTACGGATG-3′。逆转录条件为95℃、5 min,95℃、15 s,60℃、15 s,72℃、32 s读板,40个循环。反应体系20 μl,PCR结果采用2-ΔΔCt法进行定量比较,β-actin为内参。
1.8 Western blot法检测STIM1-siRNA转染效率及凋亡相关蛋白的表达情况 总蛋白样本的提取:向每瓶培养的心肌细胞内加入400 μl含PMSF的裂解液,在冰上裂解30 min后于4℃、13 000 r/min离心5 min。将离心后含有蛋白的上清液分装收集放置-20℃冰箱中保存,利用BCA法测定蛋白含量并制作标准曲线。使用10%SDS-PAGE胶电泳分离蛋白质,转膜,5%脱脂奶粉封闭2 h,之后孵一抗4℃过夜。用TBST漂洗后于37℃孵育二抗2 h,洗膜后用ECL试剂盒显影,对胶片进行扫描,凝胶图象处理系统分析结果。
1.9 统计学处理 采用SPSS 13.0软件进行分析,计量资料以±s表示,各组间进行单因素方差分析,组间多重比较采用LSD检验。若方差不齐则进行非参数分析(Kruskal-Wallis H检验),组间多重比较采用Tamhane法。
2 结果
2.1 siRNA对H9C2心肌细胞STIM1 mRNA和蛋白表达的影响 RT-PCR和Wetsern blot结果显示,与空白对照组比较,阴性对照组对H9C2心肌细胞STIM1表达的影响差异无统计学意义。3条siRNA中,以siRNA3对STIM1表达的抑制效率最高,与空白对照组比较,siRNA3使得心肌细胞STIM1 mRNA表达量下降了71%,蛋白表达量减少了69%。见图1。
2.2 各组H9C2心肌细胞STIM1的表达 Western blot结果显示,各组STIM1的表达差异有统计学意义(χ2=26.214,P<0.001)。其中,与对照组比较,H/R组STIM1表达量增加了3.75倍(P<0.05),STIM1-siRNA组的STIM1蛋白表达水平较H/R组和scramble siRNA组明显降低,分别为0.2倍和0.21倍(P<0.001),而scramble siRNA组的STIM1蛋白表达水平与H/R组间的差异无统计学意义(P=0.948)。见图2。
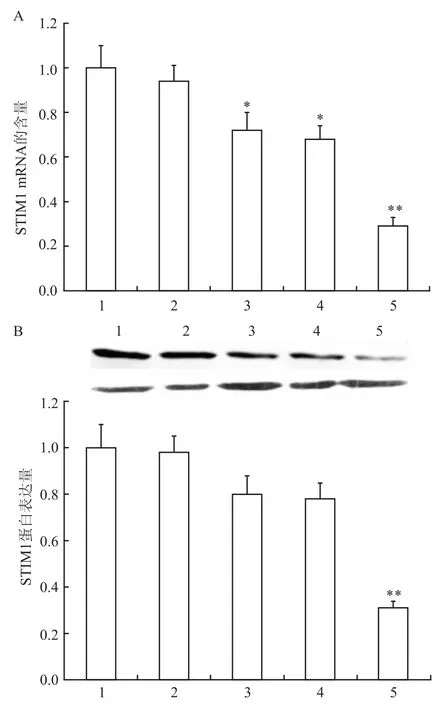
图1 siRNA对H9C2心肌细胞STIM1 mRNA和蛋白表达的影响(n=10)
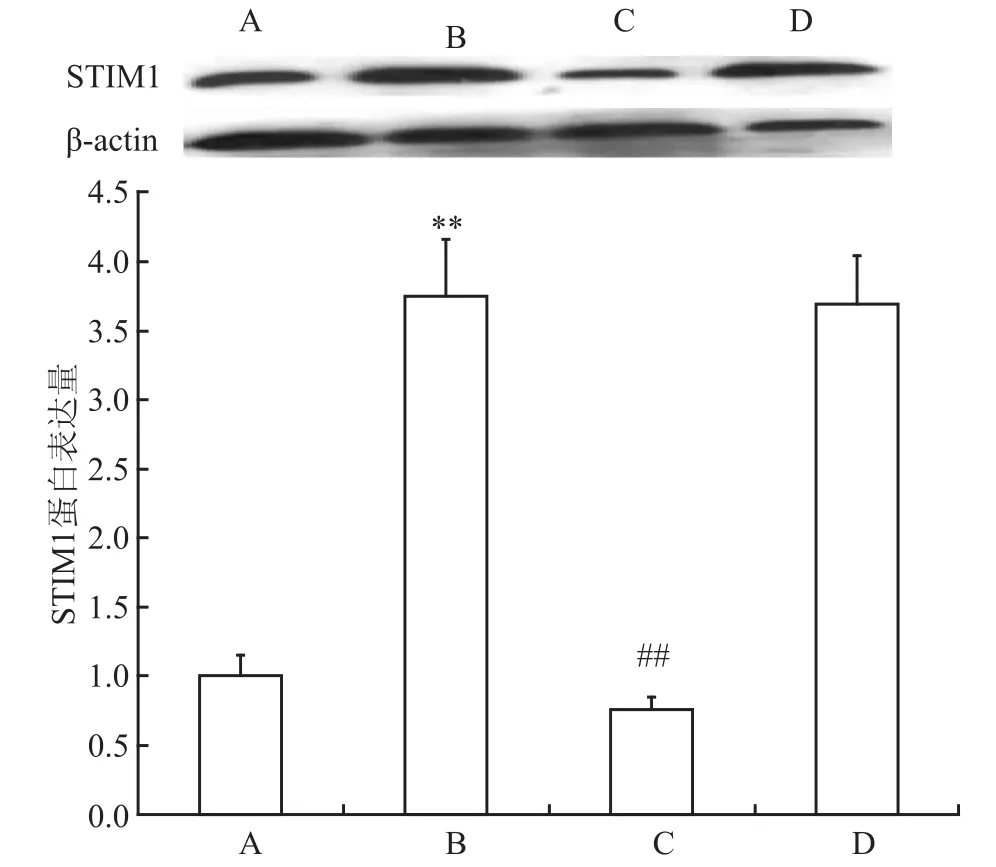
图2 STIM1在各组H9C2心肌细胞中的表达情况(n=8)
2.3 STIM1-siRNA转染后H9C2心肌细胞凋亡的变化 流式细胞术检测细胞凋亡变化提示各组细胞凋亡率差异有统计学意义(χ2=26.591,P<0.001)。对照组细胞凋亡率只有(0.1±0.01)%;与对照组比较,H/R组凋亡的细胞增多,细胞凋亡率达(33.5±5.80)%(P<0.001);STIM1-siRNA组细胞凋亡率为(6.9±0.94)%,较H/R组降低(P<0.001);scramble siRNA组细胞凋亡率为(35.3± 4.10)%,与H/R组比较差异无统计学意义(P= 0.897)。见图3。
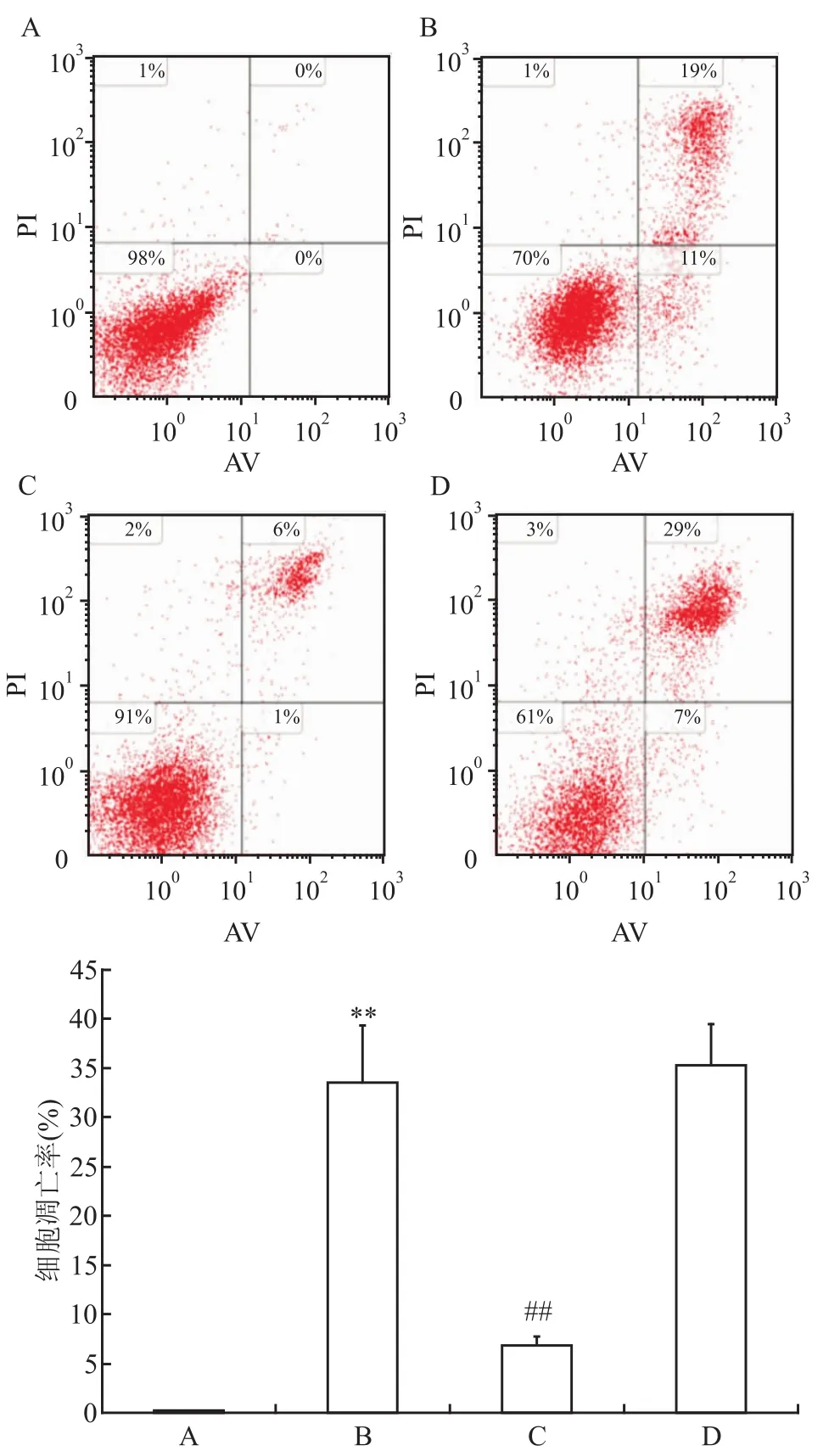
图3 流式细胞术检测各组心肌细胞凋亡变化
2.4 STIM1-siRNA转染对H9C2心肌细胞Ca2+浓度的影响 各组细胞荧光强度差异有统计学意义(F=278.808,P<0.001),Ca2+浓度的差异有统计学意义。与对照组比较,H/R组心肌细胞内Ca2+浓度明显增加(P<0.001),荧光强度是对照组的2.93倍;而通过STIM1-siRNA转染下调STIM1表达后,能抑制低氧/复氧导致的这一作用,荧光强度为H/ R组的0.35倍(P<0.001)。H/R组与scramble siRNA组比较,差异无统计学意义(P=0.948)。见图4。
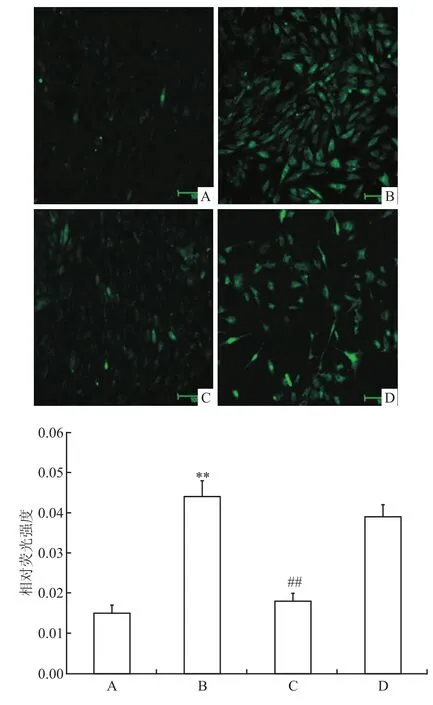
图4 STIM1-siRNA转染对H9C2心肌细胞Ca2+浓度的影响
2.5 STIM1-siRNA转染对H9C2心肌细胞Bax、Bcl-2、Caspase-3表达的影响 Western blot结果显示,各组间Bcl-2(χ2=27.606,P<0.001)、Bax(χ2=26.647,P<0.001)和cleaved-Caspase-3(χ2= 24.589,P<0.001)差异有统计学意义,Bax/Bcl-2(χ2=26.241,P<0.001)差异有统计学意义。其中,与对照组比较,H/R组心肌细胞内Bax(P<0.001)和Caspase-3(P<0.001)的表达明显增加,Caspase-3是对照组的3.75倍。Bcl-2表达下降(P<0.001),Bax/Bcl-2是对照组的5.24倍;而通过STIM1-siRNA转染下调STIM1表达后,能抑制低氧/复氧导致的这一作用,Caspase-3为H/R组的0.22倍(P<0.001),Bax/Bcl-2为H/R组的0.35倍(P<0.001)。H/R组与scramble siRNA组比较,差异无统计学意义(P=0.887)。见图5。
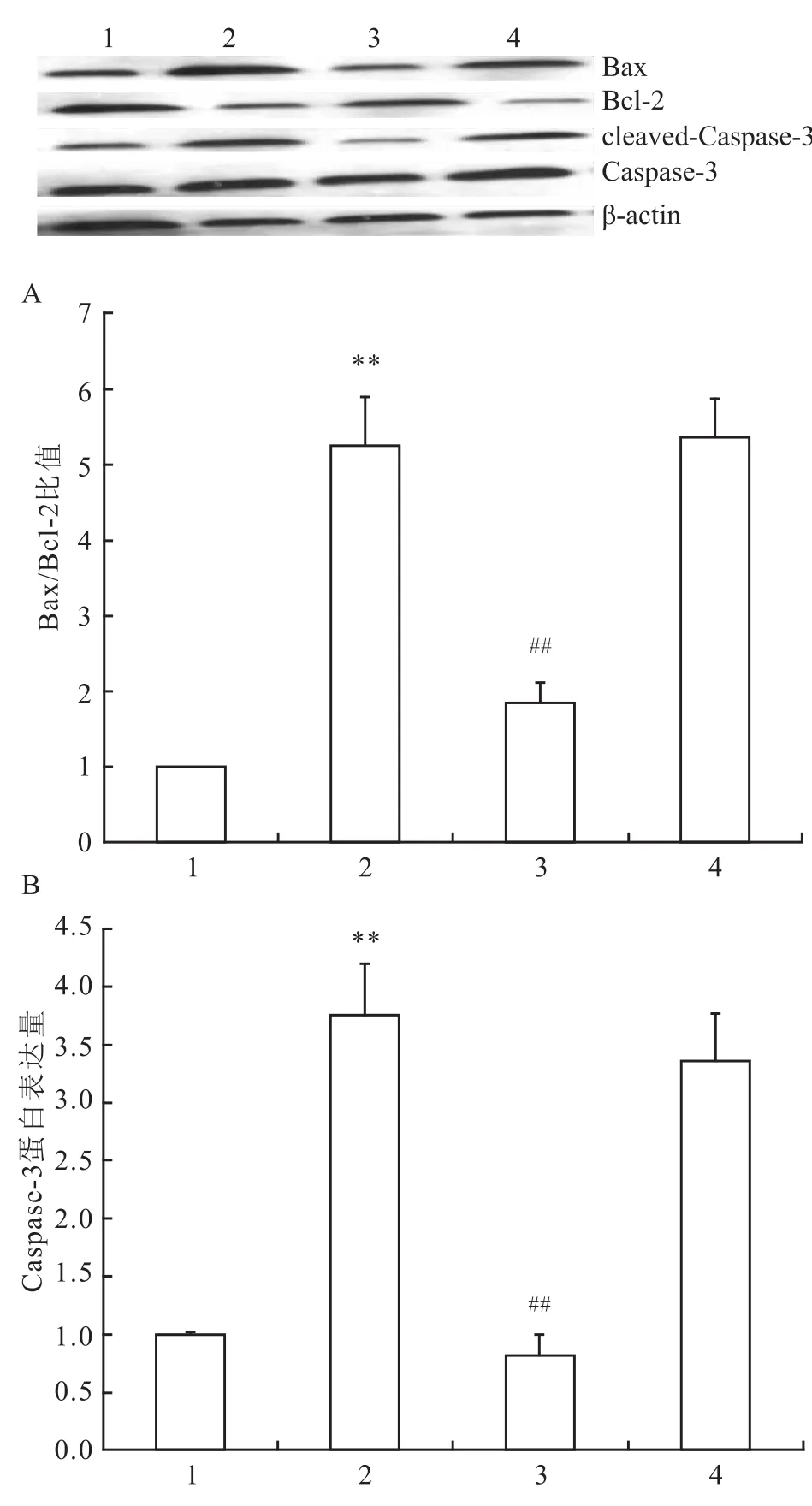
图5 Western blot法检测各组中Bcl-2、Bax和Caspase-3的表达情况(n=8)
3 讨论
本实验利用H9C2心肌细胞株建立心肌细胞低氧/复氧模型,从而模拟心肌细胞的缺血再灌注,观察到心肌细胞发生缺血再灌注时STIM1表达量明显增加,随后用siRNA-STIM1转染沉默STIM1基因的表达后,可见STIM1-siRNA组较H/R组和scramble siRNA组的STIM1表达量明显减少,凋亡率明显减低,凋亡相关蛋白含量明显下降,这与Zhang et al[6]在动物实验脑缺血模型中发现的结果相似,提示STIM1参与了MIRI,而抑制STIM1的表达可以减轻再灌注损伤引起的细胞凋亡。
凋亡是生理性或某些因素诱发的有程序的细胞自主生化过程,在MIRI过程中扮演着重要角色[7]。Bcl-2家族蛋白在调节细胞凋亡中发挥关键作用,这些蛋白质包括促细胞凋亡的Bax和抑制细胞凋亡的Bcl-2等,这些诱导或抑制凋亡的蛋白相互作用,形成了一个复杂的调控网络,而这个网络中促凋亡和抗凋亡蛋白的比率决定细胞的存活或者死亡[8],Bax/Bcl-2比例增高,细胞凋亡明显增加[9]。Caspase-3被认为是细胞凋亡过程中的主要执行者[10]。故Bcl-2、Bax/Bcl-2、Caspase-3是反映凋亡的经典指标。本实验结果表明,与对照组比较,H9C2细胞经历12 h低氧和6 h复氧后凋亡率显著增加,说明体外细胞低氧/复氧模型的建立是成功的。Western blot结果显示Bax/Bcl-2比例增高,cleaved-Caspase-3显著上调。siRNA抑制STIM1基因的表达可以显著降低细胞凋亡率及Bax/Bcl-2的比例,并使Caspase-3表达下调,从而说明了STIM1基因沉默可以抑制低氧/复氧损伤引起的心肌细胞凋亡。
STIM1是存在于内质网膜上的I型跨膜蛋白,是内质网钙离子浓度的感受器和SOCE的核心蛋白之一,其结构中包含一段长约100个氨基酸序列的具有活化功能的结构域即SOAR。当内质网内的Ca2+消耗之后,该结构域能够激活Orai通道,引起SOCE通路的开放及Ca2+内流[4,11-12]。当钙库内的Ca2+得到补充后,STIM1蛋白迅速地从内质网-细胞膜偶联中解离出来,Orai蛋白也随之失活,最终SOCE通路关闭[13]。Zhang et al[6]发现,SOCE参与了脑缺血损伤,在此过程中STIM1和Orai表达均增加,而用siRNA抑制STIM1表达可以下调Orai的含量,减少神经元细胞内Ca2+浓度,改善脑功能。本研究显示低氧/复氧损伤可导致H9C2细胞内Ca2+浓度显著增加,用siRNA抑制STIM1表达可以减少H9C2细胞内Ca2+浓度,与上述研究结果一致。因此,推测抑制STIM1的表达,可能是通过减少Ca2+内流而减轻低氧/复氧损伤中细胞的凋亡的。
综上所述,通过本实验研究显示心肌细胞发生缺血再灌注时STIM1表达明显增加,siRNA沉默STIM1基因的表达可以减少低氧/复氧损伤所致的心肌细胞Ca2+浓度的增加和细胞的凋亡,并下调凋亡相关蛋白的表达。未来将在动物模型中进一步探讨STIM1影响MIRI的机制,希望为临床减少缺血再灌注损伤提供新的思路。
[1] Yellon D M,Hausenloy D J.Myocardial reperfusion injury[J].N Engl J Med,2007,357(11):1121-35.
[2] 位 凯,王 飞,张 瑾,等.天麻素预处理减轻大鼠心肌缺血再灌注损伤的可能机制[J].安徽医科大学学报,2014,49(6):756-8.
[3] Yan W,Zhang F,Zhang R,et al.Adiponectin regulates SR Ca(2 +)cycling following ischemia/reperfusion via sphingosine 1-phosphate-CaMKII signaling inmice[J].J Mol Cell Cardiol,2014,74(9):183-92.
[4] Soboloff J,Rothberg B S,Madesh M,et al.STIM proteins:dynamic calcium signal transducers[J].Nat Rev Mol Cell Biol,2012,13(9):549-65.
[5] Park M,Youn B,Zheng X L,et al.Globular adiponectin,acting via AdipoR1/APPL1,protects H9c2 cells from hypoxia/reoxygenation-induced apoptosis[J].PLoS One,2011,6(4):e19143.
[6] Zhang M,Song J N,Wu Y,et al.Suppression of STIM1 in the early stageafter global ischemia attenuates the injury of delayed neuronal death by inhibiting store-operated calcium entry-induced apoptosis in rats[J].Neuroreport,2014,25(7):507-13.
[7] Mokhtari B,Badalzadeh R,Alihemmati A,et al.Phosphorylation of GSK-3β and reduction of apoptosis as targets of troxerutin effect on reperfusion injury of diabetic myocardium[J].Eur J Pharmacol,2015,765:316-21.
[8] Siddiqui W A,Ahad A,Ahsan H.The mystery of BCL2 family:Bcl-2 proteins and apoptosis:an update[J].Arch Toxicol,2015,89(3):289-317.
[9] Zhang Y,Li H,Zhao G,et al.Hydrogen sulfide attenuates the recruitmentof CD11b+Gr-1+myeloid cells and regulates Bax/Bcl-2 signaling in myocardial ischemia injury[J].Sci Rep,2014,4(7497):560.
[10]Sun Y,Xu Y,Geng L.Caspase-3 inhibitor prevents the apoptosis of brain tissue in rats with acute cerebral infarction[J].Exp Ther Med,2015,10(1):133-8.
[11]Zhao G,Li T,Brochet D X,et al.STIM1 enhances SR Ca2+content through binding phospholamban in rat ventricular myocytes[J].Proc Natl Acad Sci U S A,2015,112(34):E4792-801.
[12]Didiasova M,Zakrzewicz D,Magdolen V,et al.STIM1/ORAI1-mediated Ca2+influx regulates enolase-1 exteriorization[J].J Biol Chem,2015,290(19):11983-99.
[13]Yang X,Jin H,Cai X,et al.Structural and mechanistic insights into the activation of Stromal interaction molecule 1(STIM1)[J]. Proc Natl Acad Sci U S A,2012,109(15):5657-62.
Inhibition of stromal interaction molecule 1 attenuates hypoxia/reoxygenation induced apoptosis in H9C2 cells
Jia Hongjing,Wu Jixiong,Wang Xiaochen,et al
(Dept of Cardiology,The Second Affiliated Hospital of Anhui Medical University,Hefei 230601)
Objective To investigate the role of stromal interaction molecule 1(STIM1)in apoptosis of H9C2 cardiomyocytes after hypoxia/reoxygenation(H/R)injury.Methods H9C2 cardiomyocytes were cultured,the model of H/R injury was established.STIM1-siRNA was transfected into H9C2 cardiomyocytes to implement RNA interference.The apoptotic rate was detected by flow cytometry.Western blot analysis was used to detect the expressions of STIM1 and the apoptosis related proteins in each group.Results Compared with the control group,the expression of STIM1 was markedly increased in H/R group(P<0.05),Bax/Bcl-2 was increased and the expression of Caspase-3 was up-regulated.Meanwhile,the apoptotic rate was increased(P<0.05).However,inhibition of STIM1 through transfection of STIM1-siRNA resulted in significantly decreased expression of STIM1(P<0.05)and reduced influx of calcium,the ration of Bax/Bcl-2 was decreased and the expression of Caspase-3 was down-regulated,the apoptotic rate was also reduced(P<0.05).Conclusion The expression of STIM1 is significantly increased when cardiomyocytes suffered from the H/R injury.Inhibition of STIM1 through transfection of STIM1-siRNA can decrease the myocardial apoptosis after H/R injury.
H9C2 cells;hypoxia/reoxygenation injury;apoptosis;stromal interaction molecule 1
A
1000-1492(2016)08-1136-06
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.028.html
2016-04-19 接收
安徽医科大学临床科学研究项目(编号:2015xkj112)
安徽医科大学第二附属医院心血管内科,合肥 230601
郏红静,女,硕士研究生;
吴继雄,男,主任医师,硕士生导师,责任作者,E-mail:wjx8261@163.com
R 322.11;R 845.22
