富含辅酶Q10红曲固态发酵工艺的优化
2016-11-11黄佳梅蒋雅君郑亚凤吴芳彤郑宝东田玉庭
黄佳梅,蒋雅君,郑亚凤,吴芳彤,郑宝东,田玉庭
(福建农林大学 食品科学学院,福建 福州 350002)
富含辅酶Q10红曲固态发酵工艺的优化
黄佳梅,蒋雅君,郑亚凤,吴芳彤,郑宝东,田玉庭
(福建农林大学 食品科学学院,福建 福州 350002)
【目的】 以籼米为原料,优化富含辅酶Q10红曲的固态发酵工艺。【方法】 采用Box-Benhnken试验设计和响应面分析法,以影响红曲色价和辅酶Q10含量的4个关键固态发酵条件(初始pH、接种量、籼米初始含水率、亚油酸添加量)为自变量,以红曲色价和辅酶Q10含量为响应值对上述4个关键发酵条件参数进行优化,并在此基础上探讨红曲分段控温发酵策略。【结果】 初始pH、接种量、亚油酸添加量对红曲色价和辅酶Q10影响显著(P<0.05),而籼米初始含水率对红曲色价和辅酶Q10影响不显著(P>0.05),优化确定的红曲最佳发酵条件为:初始pH 6.0,红曲霉接种量12%,籼米初始含水率50%,亚油酸添加量64 mg/kg。辅酶Q10红曲固态发酵的温度控制策略为:30 ℃ 6 d→34 ℃ 5 d→28 ℃ 4 d。【结论】 在最佳发酵工艺条件下,所制红曲的色价、辅酶Q10含量分别为 4 521.69 U/g和387.23 mg/kg,较优化前分别提高38.10%和80.01%。
红曲;辅酶Q10;固态发酵;发酵条件;温度控制;响应面分析
红曲又名丹曲、神曲,是我国先民的伟大发明,迄今已有一千多年的历史,为我国宝贵的科学文化遗产。红曲是以红曲霉为主发酵菌所生产的一种独特的紫红色米曲,主要应用于黄酒酿造、食品发酵、色素生产和中医中药等方面[1]。自古以来,因红曲对某些疾病具有良好的治疗功效,故被我国中医视为珍贵的保健营养产品。红曲产地分布于我国福建、浙江、江苏、台湾等省,其中福建省是我国红曲的主要产地,尤以古田红曲最为著名[2]。红曲霉是红曲的主要生产菌种,属于真菌界子囊菌门不整囊菌纲散囊菌目红曲科红曲菌属,红曲霉可代谢合成多种生物活性物质,如红曲色素、洛伐他汀、麦角固醇和γ-氨基丁酸等,从而赋予红曲一定的生理保健功效,对癌症、老年痴呆症、高胆固醇、高血糖及高血压等疾病均有一定的防治功能[3-4]。研究发现,红曲霉还能代谢合成另一种重要保健营养物质辅酶Q10,该物质是呼吸链中的重要递氢体,能抑制线粒体过氧化作用,保护生物膜的完整性,同时也能治疗心血管系统疾病[5-8]。Pyo等[9]以Monascus pilosus K-1140为试验菌株,利用高粱、薏米、荞麦和大豆为混合培养基,采用固态发酵生产辅酶Q10,其产量为240.00 mg/kg,这是目前国内外仅有的有关红曲霉产辅酶Q10的研究报道,但该研究仅在探索固态发酵生产辅酶Q10,并非生产红曲。因此,对富含辅酶Q10红曲固态发酵的研究显得尤为重要。基于此,本研究团队前期从福建黄酒酿造车间成功分离出24株红曲霉菌株,经筛选获得1株高产辅酶Q10红曲霉菌株,命名为N4-5[10],分子生物学鉴定其为红色红曲霉(Monascus ruber)。本研究以N4-5为供试菌株,将其运用到红曲固态发酵研究中,采用单因素试验分析不同前体物质对红曲色价和辅酶Q10含量的影响,运用Box-Benhnken试验设计,结合响应面分析优化红曲最佳固态发酵工艺参数,并在此基础上通过分段控温发酵培养策略,最大限度地提高红曲中辅酶Q10的含量,以期为富含辅酶Q10功能红曲的制备与应用提供理论保障和技术支持。
1 材料与方法
1.1材料
1.1.1菌种来源红曲霉N4-5,由福建省特种淀粉品质科学与加工技术重点实验室从红曲酒厂车间分离筛选获得,经分子生物学鉴定为Monascus ruber,该菌株不产桔霉素。
1.1.2培养基(1)斜面培养基:马铃薯300 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,pH自然,121 ℃灭菌20 min。(2)种子培养基:甘油50 mL,葡萄糖30 g,酵母膏10 g,蛋白胨8 g,KNO32 g,NH4H2PO41 g,MgSO4·7H2O 1 g,籼米粉20 g,加蒸馏水至1 L,pH 6.0,121 ℃灭菌20 min。(3)基础发酵培养基:将市售籼米在室温下浸泡12 h,沥干,保持初始含水率为35%,取100 g装入250 mL三角瓶中,121 ℃灭菌20 min。
1.2菌株的培养
1.2.1斜面培养将冻藏红曲霉菌株接种于斜面培养基上,30 ℃恒温培养7 d,至菌丝长满斜面。
1.2.2种子培养用Tween-20(20 g/L)无菌水将培养好的斜面孢子轻轻洗脱,制备孢子悬液使其密度为108mL-1,其后将孢子悬液转接至种子培养基中,30 ℃、180 r/min摇床培养2~3 d。
1.2.3发酵培养将培养好的种子液转接至基础发酵培养基中,拌匀后于32 ℃下恒温培养15 d,取出70 ℃烘干,粉碎过孔径0.45 mm(40目)的筛,测定色价和辅酶Q10含量。
1.3辅酶Q10的测定
参照文献[11]采用超声波法提取红曲中的辅酶Q10,并采用反相高效液相色谱法测定辅酶Q10含量。样品及辅酶Q10标品HPLC色谱如图1所示。
图 1 样品(A)与辅酶Q10标品(B)的 反相高效液相色谱图Fig.1 RP-HPLC chromatogram of sample (A) and CoQ10 standard (B)
1.4红曲色价的测定
参考国标GB 4926-2008《食品添加剂:红曲米(粉)》[12]中的相应方法和步骤测定红曲色价。
1.5添加物的筛选
在基础发酵培养基中按50 mg/kg的添加量分别添加异戊醇、茄尼醇、对羟基苯甲酸、蛋氨酸和亚油酸,以未添加上述任何化合物为对照固态发酵制备红曲,考察不同添加物对红曲色价和辅酶Q10含量的影响。
1.6发酵条件的响应面优化
在前期研究[10]的基础上,选取初始pH(X1)、接种量(X2)、籼米初始含水率(X3)和亚油酸添加量(X4)4个因子为自变量,以红曲色价(Y1)和辅酶Q10含量(Y2)为响应值,选用Box-Benhnken试验设计[13]对发酵条件进行优化,优化试验的试验因素及水平见表1。
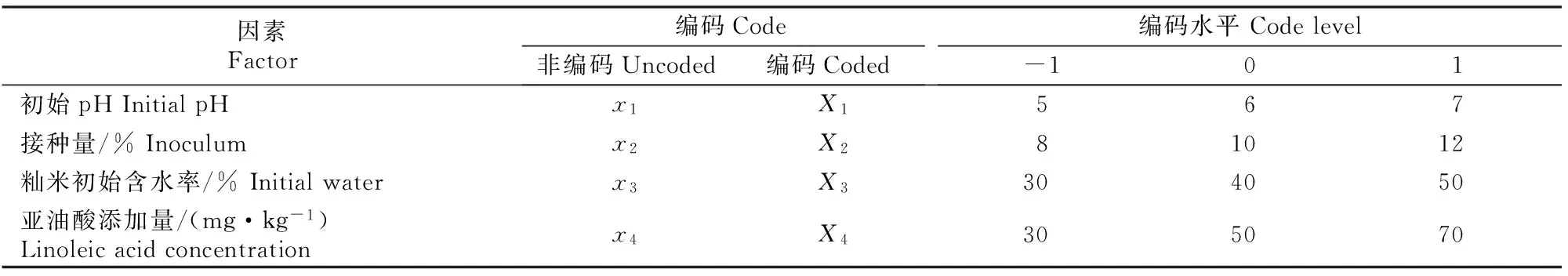
表 1 红曲固态发酵条件的Box-Benhnken优化试验因素、水平及编码Table 1 Factors,levels and codes of Box-Benhnken optimization for solid-state fermentation of red yeast rice
注(Note):X1=(x1-6)/1,X2=(x2-10)/2,X3=(x3-40)/10,X4=(x4-50)/20。
1.7分段控温发酵策略的优化
在1.6节优化确定的发酵条件下,研究不同培养温度(26,28,30,32,34,36,38 ℃)对红曲色价和辅酶Q10含量的影响,并结合红曲霉自身代谢合成规律,采用分段控温培养(发酵前6 h温度控制为30 ℃,之后升温至34 ℃培养5 h,然后降温至28 ℃继续培养7 h)策略,考察红曲色价和辅酶Q10生成随时间的动态变化曲线,确定最佳发酵时间,以非控温培养(即辅酶Q10最适合成温度下恒温培养)作为对照。
1.8统计分析
所有试验均重复3次,结果取平均值;采用SAS(version 9.1,SAS Institute.,Cary,NC.USA)软件进行试验设计和数据分析。
2 结果与分析
2.1不同添加物对红曲色价和辅酶Q10含量的影响
向发酵培养基中添加前体物,利用微生物自身特有的酶系和特殊的代谢网络,可有效促进目标产物的生物合成。前人研究报道,对羟基苯甲酸是辅酶Q10醌环供给前体物[14];辅酶Q10苯环上的甲基基团则由S-腺苷蛋氨酸(SAM)提供,足量蛋氨酸的存在是S-腺苷蛋氨酸形成的基础[15];而茄尼醇与辅酶Q10的侧链,即异戊二烯焦磷酸在结构上具有一定的相似性[16]。因此,选取辅酶Q10常见的生物合成前体物蛋氨酸、茄尼醇、异戊醇和对羟基苯甲酸以及脂氧化物亚油酸作为添加物,研究添加物对红曲色价和辅酶Q10含量的影响,结果如图2所示。
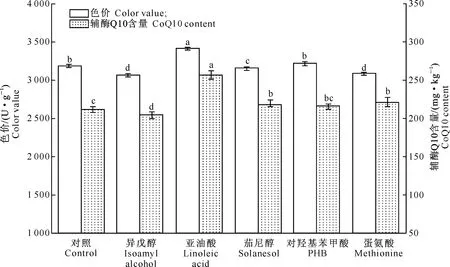
图 2 不同前体物对红曲色价和辅酶Q10含量的影响Fig.2 Effect of different precursors on color value and CoQ10 content of red yeast rice
由图2可见,添加不同前体物对红曲色价和辅酶Q10含量的影响不尽相同。亚油酸、茄尼醇和蛋氨酸有利于红曲霉辅酶Q10的合成,其中以亚油酸对红曲中辅酶Q10增加的影响最为显著,其辅酶Q10含量达257.58 mg/kg,较对照提高近20%。添加对羟基苯甲酸对辅酶Q10含量无显著影响,而异戊醇的添加则会抑制辅酶Q10的合成。由图2还可见,添加亚油酸对红曲色价有显著提高作用(P<0.05),对羟基苯甲酸对红曲色价影响不显著,而异戊醇、茄尼醇和蛋氨酸对红曲色价的合成表现出明显的抑制作用。红曲霉菌色素合成与脂质合成是共存的[17],这些辅酶Q10前体物有可能刺激了脂质生成而削弱或者抑制了色素的合成。
图2表明,亚油酸的添加能有效刺激红曲霉色素和辅酶Q10的合成,显著增加红曲色价和辅酶Q10含量。Sorrentino等[18]也报道,亚油酸的添加可明显促进土曲霉中洛伐他汀的合成,定量PCR分析表明,亚油酸能显著增加洛伐他汀生物合成的转录水平。因此,亚油酸作为脂氧化物的前体物,添加其可调节曲霉菌次生代谢产物的生物合成,是一种新颖、低成本的提高发酵目标产物的潜在手段。
2.2红曲发酵条件的响应面优化
2.2.1二次回归拟合及方差分析红曲发酵条件的Box-Benhnken试验设计矩阵及试验结果见表2。
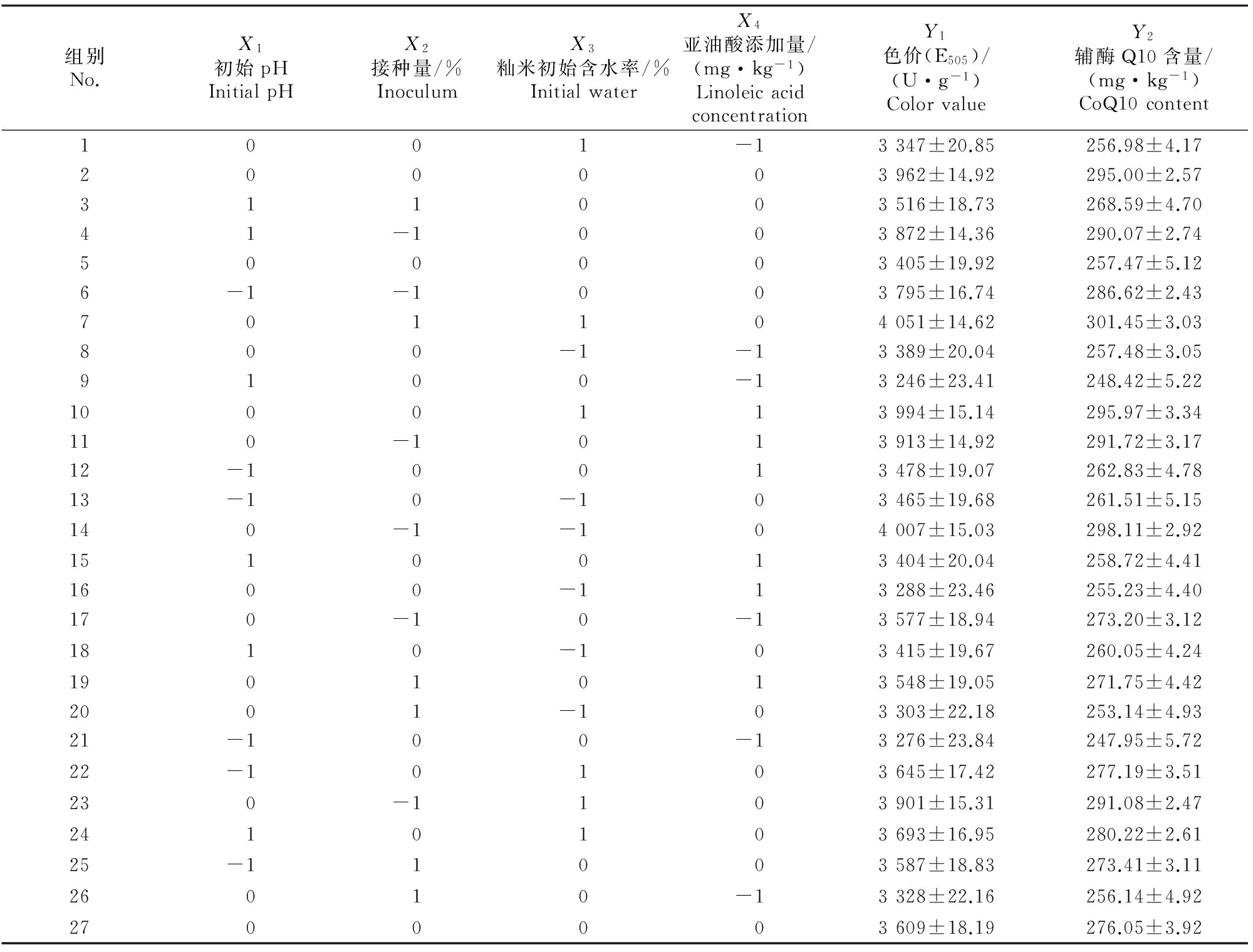
表 2 红曲固态发酵条件Box-Benhnken试验设计与结果Table 2 Box-Benhnken matrix of four variables for solid-state fermentation conditions of red yeast rice
分别以红曲色价和辅酶Q10含量为响应值,利用SAS软件对试验结果(表2)进行多元回归拟合,得到初始pH、接种量、籼米初始含水率、亚油酸添加量分别对红曲色价和辅酶Q10含量的二次多项式回归模型为:
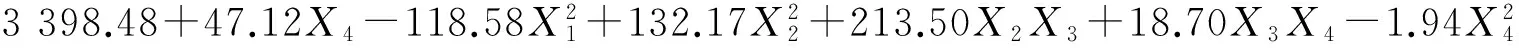
(1)
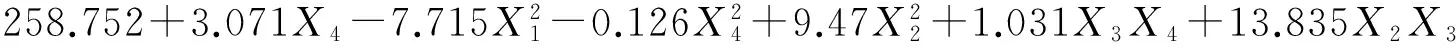
(2)
式中:Y1、Y2分别为红曲色价和辅酶Q10含量的预测值,X1、X2、X3和X4分别为初始pH、接种量、籼米初始含水率、亚油酸添加量的编码值。
对上述各回归模型进行方差分析,结果见表3。各模型的方差分析结果(表3)显示,红曲色价和辅酶Q10含量模型的F值分别为7.49和7.29,模型P<0.05,表明上述两模型均显著;各模型失拟项P值均为1.000,均不显著(P>0.05);同时,各模型的R2都大于0.8,表明试验数据与回归数学模型拟合性良好[19],能够用上述模型较好地预测各指标的实际值。
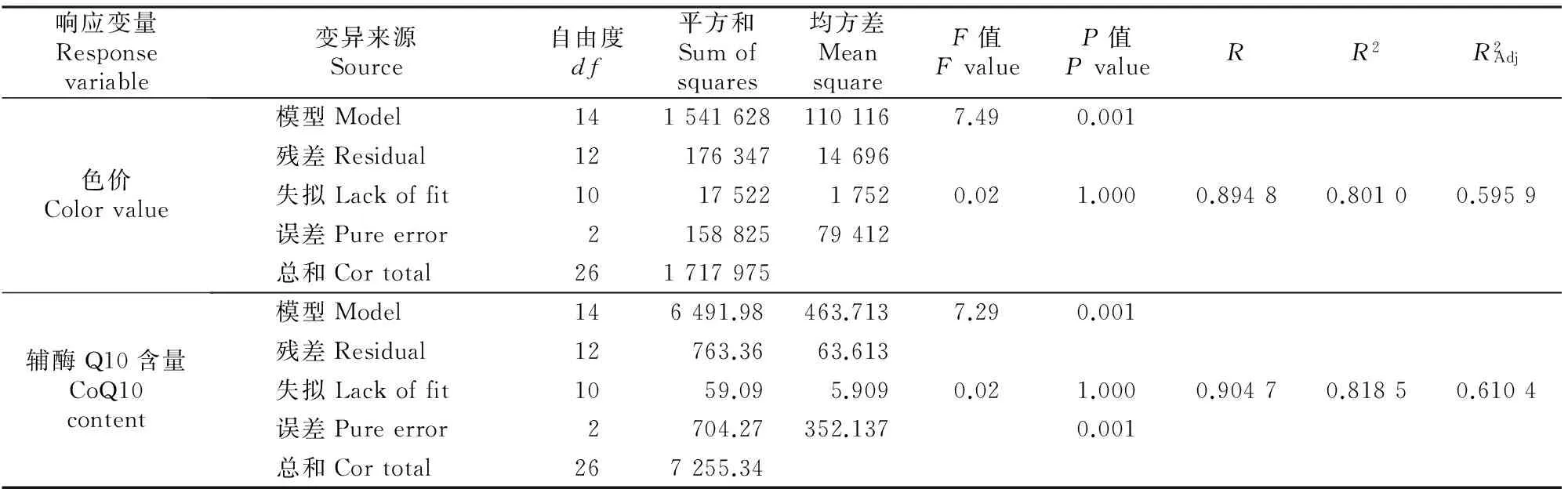
表 3 红曲色价和辅酶Q10含量回归模型的方差分析Table 3 Analysis of variance (ANOVA) for regression equation of color value and CoQ10 content in red yeast rice
各模型回归系数的显著性检验结果见表4。P值可用来检验各模型系数的显著性,同时也可反映变量之间交互作用的大小,P值越小越显著[20]。

表 4 红曲色价和辅酶Q10含量回归方程系数的显著性检验Table 4 Test of significance for regression coefficients of color value and CoQ10 content in red yeast rice
由表4可知,亚油酸添加量对红曲色价和辅酶Q10 2个指标的线性效应均影响显著(P<0.05),而接种量、籼米初始含水率、初始pH对红曲色价和辅酶Q10 2个指标的线性效应均影响不显著(P>0.05);除接种量与籼米初始含水率、籼米初始含水率与亚油酸添加量两两交互作用对红曲色价和辅酶Q10影响显著(P<0.05)外,初始pH与接种量、初始pH与籼米初始含水率、初始pH与亚油酸添加量、接种量与亚油酸添加量两两交互作用均对红曲色价和辅酶Q10影响不显著(P>0.05);初始pH、接种量和亚油酸添加量对红曲色价和辅酶Q10 2个指标的曲面效应影响显著(P<0.05),而籼米初始含水率对红曲色价和辅酶Q10 2个指标的曲面效应影响均不显著(P>0.05)。
2.2.2响应面优化结果分析采用SAS数据处理系统对试验数据进行分析,以辅酶Q10含量最大且色价满足国标要求为优化目的,最终确定红曲发酵的最佳工艺为:初始pH 5.87,红曲霉接种量12%,籼米初始含水率50%,亚油酸添加量63.73 mg/kg。在此条件下,其产品色价和辅酶Q10含量预期分别为4 125.61 U/g和306.24 mg/kg。
2.2.3试验验证为检验模型预测的准确性,对2.2.2中确定的工艺参数进行3次重复验证试验。结果表明,在初始pH6.0、接种量12%、籼米初始含水率50%、亚油酸添加量64 mg/kg下发酵,其红曲色价和辅酶Q10含量分别为4 107.37 U/g和 305.72 mg/kg,与模型预测值较为接近,说明本试验优化的工艺参数可行。
2.3分段控温发酵策略的优化
2.3.1温度对红曲色价和辅酶Q10含量的影响在2.2.3中确定的发酵条件下,选用不同培养温度(26~38 ℃)进行恒温发酵试验,探讨不同发酵温度对红曲色价和辅酶Q10含量的影响,结果见图3。

图 3 温度对红曲色价和辅酶Q10含量的影响Fig.3 Effect of temperature on color value and CoQ10 content in red yeast rice
由图3可知,培养温度对红曲色价和辅酶Q10含量影响显著。在温度为26~38 ℃时,红曲色价和辅酶Q10含量随发酵温度的增加均呈现先增加后降低的变化趋势,温度过高和过低都不利于红曲色素和辅酶Q10的生物合成,最适红曲色价形成温度和最佳辅酶Q10合成温度分别为34和28 ℃。
2.3.2分段控温发酵策略前期研究发现,红曲霉菌N4-5最适生长温度为30 ℃,培养6 d后即达到稳定期[10]。色素与辅酶Q10为红曲霉菌的次级代谢产物,其主要合成时期位于细胞生长的稳定期,且色素的生成早于辅酶Q10的合成。同时,2.3.1节的试验结果也显示,红曲色价和辅酶Q10累积的最适培养温度并不相同。基于此,特采用分段控温与非控温发酵策略对发酵过程进行进一步优化,具体的分段温控条件为:30 ℃培养6 d后转入34 ℃培养5 d,之后转入28 ℃培养至18 d结束,同时以28 ℃下恒温培养作为对照,考察2种不同发酵策略下红曲色价与辅酶Q10含量随时间的变化情况,结果如图4所示。
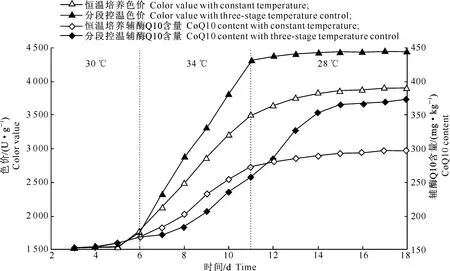
图 4红曲分段控温固态发酵过程中色价与辅酶Q10含量的变化
Fig.4Change of color value and CoQ10 of red yeast rice during three-stage temperature control fermentation
由图4可以看出,红曲固态发酵过程可分为3个阶段:0~6 d为细胞生长期,色素和辅酶Q10几乎没有合成,红曲色价和辅酶Q10含量几乎不变,培养物颜色仅呈现淡红色;7~11 d为色素生成期,该阶段色素大量累积,培养物红色明显加深,红曲色价显著增加至最大(4 308.00 U/g),这期间辅酶Q10含量略有增加;12~15 d为辅酶Q10累积期,该阶段辅酶Q10含量跃变至最高(369.45 mg/kg),色价仅略有下降。当发酵至15 d后辅酶Q10含量达到最大(369.45 mg/kg),而红曲色价略有增加,由此确定发酵周期为15 d。分段控温发酵策略操作简便,可较好地控制红曲色价,并显著促进辅酶Q10的合成,具有较好的工业化生产潜力。
2.4红曲发酵工艺优化前后结果的比较
为检验最终优化所得发酵工艺的稳定性和先进性,在初始pH 6.0、接种量12%、籼米初始含水率50%、亚油酸添加量为64 μmol/L的条件下,采用2.3.2节所述分段控温发酵策略进行5次重复试验,并与文献[9]及优化前工艺进行对比,结果见表5。由表5可知,在优化的最佳发酵工艺条件下,所制红曲的色价和辅酶Q10含量分别为4 521.69 U/g和387.23 mg/kg,较优化前分别提高38.10%和 80.01%,较Pyo等[9]的辅酶Q10含量提高了61.25%。
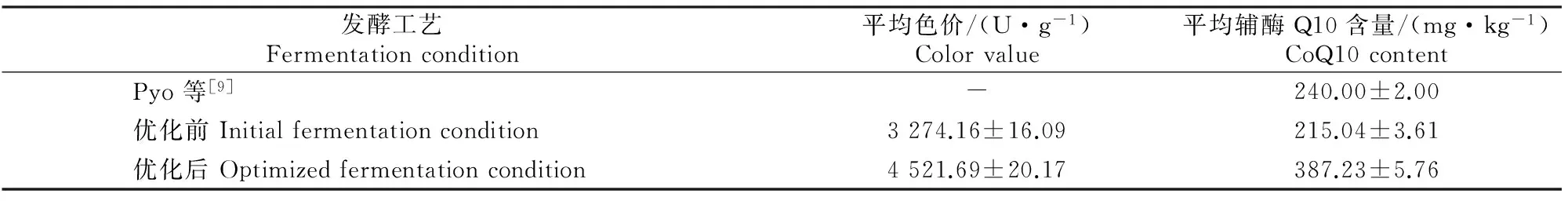
表 5 红曲发酵工艺优化前后发酵结果的对比Table 5 Comparison of optimized fermentation and initial fermentation
3 结 论
本研究以红曲霉N4-5为出发菌株,通过Box-Benhnken试验设计和响应面分析,确定富含辅酶Q10红曲的最优发酵条件为:初始pH 6.0,接种量12%,籼米初始含水率50%,亚油酸添加量64 μmol/L。同时,分段控温发酵有利于红曲色素和辅酶Q10的合成,红曲分段控温发酵策略为30 ℃ 6 d→34 ℃ 5 d→28 ℃ 4 d。在上述工艺条件下,发酵所制红曲的色价和辅酶Q10含量分别为 4 521.69 U/g和387.23 mg/kg,较优化前分别提高了38.10%和 80.01%。
[1]Ma J Y,Li Y G,Ye Q,et al.Constituents of red yeast rice a traditional Chinese food and medicine [J].Journal of Agricultural and Food Chemistry,2000,48:5220-5225.
[2]傅金泉.中国红曲及其实用技术 [M].北京:中国轻工业出版社,1997.
Fu J Q. Monascus and practical technology in China [M].Beijing:China Light Industry Press,1997.
[3]Hong M Y,Seeram N P,Zhang Y,et al.Anticancer effects of chinese red yeast rice versus monacolin K alone on colon cancer cells [J].Journal of Nutritional Biochemistry,2008,19(7):448-458.
[4]Jeon T,Hwang S G,Hirai S,et al.Red yeast rice extracts suppress adipogenesis by down-regulating adipogenic transcription factors and gene expression in 3T3-L1 cells [J].Journal of Life Science,2004,75(26):195-203.
[5]Bentinger M,Brismar K,Dallner K.The antioxidant role of coenzyme Q [J].Journal of Mitochondrion Research Society,2007,7(S):S41-S50.
[6]Dhanasekaran M,Ren J.The emerging role of coenzyme Q-10 in aging,neurodegeneration,cardiovascular disease,cancer and diabetes mellitus [J].Journal of Current Neurovascular Research,2005,2(5):447-459.
[7]Hodgson J M,Watts G F,Playford D A,et al.Coenzyme Q10 improves blood pressure and glycaemic control:a controlled trial in subjects with type 2 diabetes [J].European Journal of Clinical Nutrition,2002,56(11):1137-1142.
[8]Shults C W,Oakes D,Kieburtz K,et al.Effects on coenzyme Q10 in early Parkinson disease:evidence of slowing of the functional decline [J].Journal of Archives of Neurology,2002,59(10):1541-1550.
[9]Pyo Y H,Seo S Y.Simultaneous production of natural statins and coenzyme Q10 byMonascuspilosusfermentation using different solid substrates [J].Food Science and Biotechnology,2010,19(6):1635-1641.
[10]吴芳彤.高产洛伐他汀红曲菌的分离鉴定及其红曲发酵条件的优化 [D].福州:福建农林大学,2014.
Wu F T.Solation and identification of high-yielding monacolin K Monascus and optimization of red yeast rice fermentation conditions [D].Fuzhou:Fujian Agriculture and Forestry University,2014.
[11]田玉庭,岳田利,袁亚宏.根瘤土壤杆菌DK-24生产辅酶Q10发酵培养的优化 [J].西北农林科技大学学报(自然科学版),2010,38(8):182-188.
Tian Y T,Yue T L,Yuan Y H.Optimization of nutrient composition for enhanced production of coenzyme Q10 usingAgrobacteriumtumefaciensDK-24 [J].Journal of Northwest A&F University(Nat Sci Ed),2010,38(8):182-188.
[12]中国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB4926-2008 食品添加剂:红曲米(粉) [S].北京:中国标准出版社,2009:2-3.
General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China(AQSIQ), Standardization Administration of the People’s Republic of China(SAC). GB4926-2008 Food additive:Red kojic rice(powder) [S].Beijing:China Standards Press,2009:2-3.
[13]Zhang Y P,Chen B,Chu J. Medium optimization for meiling-mycin production by streptomyces nanchangensis using response surface methodology [J].Journal of Process Biochemistry,2006,41:405-409.
[14]刘萍,丘卫华,郑亚安,等.前体物质对辅酶Q10生物合成的影响 [J].食品与发酵工业,2005,31(4):1-5.
Liu P,Qiu W H,Zheng Y A,et al.Effect of precursors on coenzyme Q10 bisoynthesis [J].Journal of Food and Fermentation Industries,2005,31(4):1-5.[15]张惠展.途径工程 [M].北京:中国轻工业出版社,2002.
Zhang H Z.Pathway engineering [M].Beijing:China Light Industry Press,2002.
[16]袁静,魏泓.微生物发酵生产CoQ10的研究进展 [J].氨基酸和生物资源,2004,26(1):53-56.
Yuan J,Wei H.Recent progress on the production of CoQ10 by microbial fermentation [J].Journal of Amino Acids & Biotic Resources,2004,26(1):53-56.
[17]Rasheva T,Kujumdzieva A,Hallet J-N.Lipid production byMonascuspurpureusalbino strain [J].Journal of Biotechnology,1997,56:217-224.
[18]Sorrentino F,Roy I,Keshavarz T.Impact of linoleic acid supplementation on lovastatin production inAspergillusterreuscultures [J].Applied Microbiology and Biotechnology,2010,88(1):65-73.
[19]Wu Y,Cui S W,Tang J,et al.Optimization of extraction proc-ess of crude polysaccharides from boat fruited sterculia seeds by response surface methodology [J].Journal of Food Chemistry,2007,105(4):1599-1605.
[20]Hou X J,Chen W.Optimization of extraction process of crude polysaccharides from wild edible BaChu mushroom by response surface methodology [J].Carbohydrate Polymers,2008,72(1):67-74.
Optimizing solid-state fermentation of red yeast rice with CoQ10
HUANG Jiamei,JIANG Yajun,ZHENG Yafeng,WU Fangtong,ZHENG Baodong,TIAN Yuting
(CollegeofFoodScience,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China)
【Objective】 This study optimized production conditions for red yeast rice with CoQ10 in solid-state fermentation using milled as raw material.【Method】 Response surface methodology (RSM) and Box-Benhnken design were employed using color value and CoQ10 content of red yeast rice as response values and initial pH,inoculum,initial water and linoleic acid concentration as independent variables.The optimal parameters and their interactions were obtained.The section based temperature control strategy was also studied.【Result】 Effects of initial pH,inoculum and linoleic acid concentration on color value and CoQ10 content were significantly (P<0.05),while initial water had no significant (P>0.05) influence on color value and CoQ10 content.The optimal process conditions were:initial pH 6.0,inoculum 12%,initial water content 50% and linoleic acid amount 64 mg/kg.The temperature control strategy was optimized as 30 ℃ 6 d→34 ℃ 5 d→28 ℃ 4 d.【Conclusion】 Using the determined optimal conditions,the color value and CoQ10 content in red yeast rice were 4 521.69 U/g and 387.23 mg/kg,increased by 38.10% and 80.01%,respectively.
red yeast rice;CoQ10;solid-state fermentation;fermentation condition;temperature control;response surface methodology
时间:2016-09-0709:03DOI:10.13207/j.cnki.jnwafu.2016.10.021
2015-04-24
国家自然科学基金项目(31401616);高等学校博士学科点专项科研基金项目(20133515120016);福建省教育厅重点项目(JA13095);福建农林大学“校杰出青年科研人才”专项基金项目(xjq201418);福建农林大学科技创新团队支持计划项目(cxtd12009);中国博士后科学基金(2015T80671)
黄佳梅(1989-),女,福建厦门人,在读硕士,主要从事食品发酵与酿造研究。
田玉庭(1979-),男,湖北宜昌人,副教授,博士生导师,主要从事食品发酵与酿造研究。E-mail:tytfst@163.com
TQ926.1
A
1671-9387(2016)10-0150-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0903.042.html
