乌鲁木齐10号泉水体细菌群落的映震分析
2016-11-01殷亚兰
陈 张,林 青,唐 凤,胡 蓉,殷亚兰,高 雁
(1.新疆师范大学生命科学学院,乌鲁木齐 830054;2. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091)
乌鲁木齐10号泉水体细菌群落的映震分析
陈 张1,2,林 青2,唐 凤2,胡 蓉2,殷亚兰2,高 雁2
(1.新疆师范大学生命科学学院,乌鲁木齐830054;2. 新疆农业科学院微生物应用研究所,乌鲁木齐830091)
【目的】对乌鲁木齐10号泉定期采样,并监测水体中细菌总DNA含量变化,结合水文地球化学数据,探究细菌群落与地震的关系。【方法】采用克隆子转化法,制作检测10号泉水体细菌总DNA含量变化的绝对定量PCR标准曲线,采用实时荧光定量PCR技术进行精确定量、定性地监测乌鲁木齐10号泉水体细菌总DNA含量的变化。【结果】乌鲁木齐10号泉水体细菌总DNA含量的标准曲线为Cp= -3.262 4 LgC+25.075,相关系数为r= 0.999 8;监测期内10号泉水体细菌群落密度与CO2呈显著正相关,与HCO3-呈显著负相关。【结论】乌鲁木齐10号泉水体细菌总DNA含量与地震的发生确实存在一定的响应规律:泉水细菌总DNA含量变化基本符合震前高于震后,且随震级的增加其最大恢复值也随之而递增;此外,在地震发生后的5~17 d内,泉水体细菌总DNA含量变化出现极大值;乌鲁木齐10号泉水体细菌群落与该泉水文地球化学因子HCO3-与CO2的含量变化关联紧密,可作为后期重点观测研究对象;10号泉水体细菌总DNA含量变化规律可作为地震预测的参考因素之一。
乌鲁木齐10号泉;地震;实时荧光定量PCR;细菌总DNA含量;水文地球化学
0 引 言
【研究意义】地震灾害是主要自然灾害之一,其孕育过程十分复杂,其形成机制也是多种多样的。有研究表明地震来临前,一些动物会产生异常反应[1],然而,基于断裂带上泉水中的微生物与地震的关系未见报道。生物圈中的微生物占整个原核生物的6%~40%[2,3],是整个生态系统的主要生命力[4],地震发生前,地球内部流体由于板块迁移会随板块裂缝排出,释放出大量的地球化学物质及元素,处于地震断裂带上泉水中的微生物群体会对其生存的环境做出灵敏地反应[5]。研究选取的10号冷泉位于乌鲁木齐南部柳树沟-红雁池断裂带,该泉常年水温变化甚微,且流径相对封闭,几乎不受外界干扰[6],为此次实验研究水体细菌群落密度与水文地球化学和地震之间的关系提供理想条件。【前人研究进展】目前,对于泉水中的微生物群落的变化与地震的响应关系的研究,国内外报道较少,且大多数集中于环境水体的微生物对于某些化学元素关系的研究,例如Mostafa S. Elshahed等[7]研究了含硫泉水中细菌群落的多样性;J.P.Toutain 和Franck Poitrasson等[8]发现在一次里氏5.2的地震前后,泉水中的氯离子含量以及铅浓度均发生突升骤降。国内对于冷泉水的研究多集中于地下流体对于地震的响应模式[9],采用T-RFLP技术[10]检测了10号泉水体细菌在时间尺度上的动态变化及其对地球化学元素的响应,发现细菌类群表现为随机性动态变化。【本研究切入点】以上检测手段耗时较长,无法快速、精确检测泉水中细菌群落的变化。实验采用实时荧光定量PCR技术,操作简便、快速,能精确定性、定量样本,为实验提供准确、可靠的实验数据[11],该技术常见于医学检验等研究[12],运用于微生物的环境群落分析较为罕见。通过检测泉水细菌群落密度,探究其与水文地球化学的关系,进而分析10号泉水体细菌群落的映震特征。【拟解决的关键问题】采用荧光定量PCR分子生物学技术,分析10号泉水体细菌总DNA含量变化与地震发生的相关性,探究该泉水中细菌群落与地震的响应关系。
1 材料与方法
1.1材 料
1.1.1仪器
实时荧光定量PCR仪:LightCyclerR480Ⅱ 罗氏公司。
1.1.2相关主要试剂
T-载体PCR产物克隆试剂盒 (Sangon);SYBR Green I Master荧光染料试剂盒(Roche)。
1.1.3样品采集
自2014年9月23日~2015年3月31日期间,每5 d从乌鲁木齐10号泉站点采集泉水样品。测定HS-、Ar、Rn、HCO3-、F-、CO2、N2、Hg、流量、室压,共10项理化指标。表1
1.2方 法
1.2.1检测期内地震发生情况
表1地震发生时刻记录
Table 1 Records of earthquake occurrence
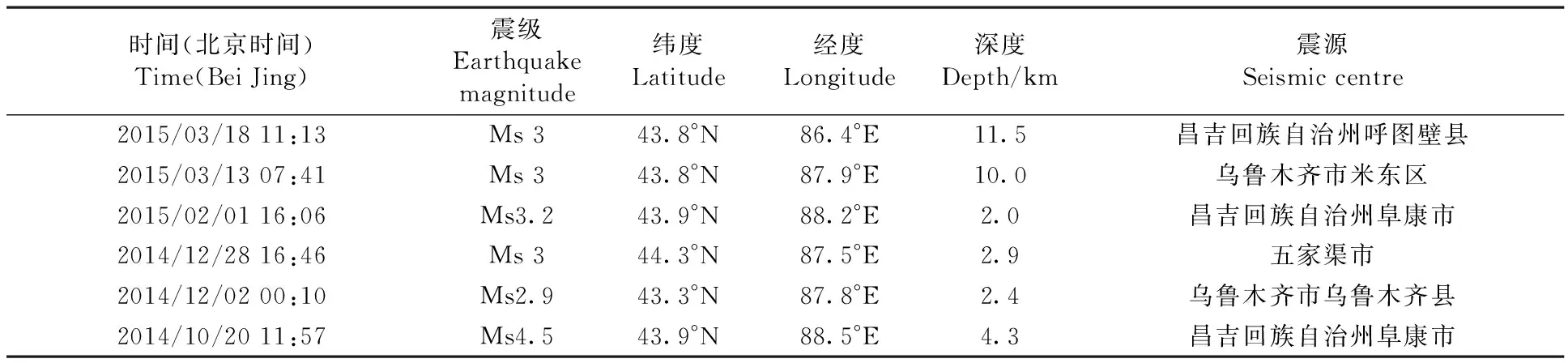
时间(北京时间)Time(BeiJing)震级Earthquakemagnitude纬度Latitude经度Longitude深度Depth/km震源Seismiccentre2015/03/1811:13Ms343.8°N86.4°E11.5昌吉回族自治州呼图壁县2015/03/1307:41Ms343.8°N87.9°E10.0乌鲁木齐市米东区2015/02/0116:06Ms3.243.9°N88.2°E2.0昌吉回族自治州阜康市2014/12/2816:46Ms344.3°N87.5°E2.9五家渠市2014/12/0200:10Ms2.943.3°N87.8°E2.4乌鲁木齐市乌鲁木齐县2014/10/2011:57Ms4.543.9°N88.5°E4.3昌吉回族自治州阜康市
1.2.2泉水细菌总DNA的提取、标准曲线的制备及样本RT-qPCR检测1.2.2.1 泉水细菌总DNA 的提取
泉水细菌总DNA的提取主要参照Shaheen等[13]的方法,稍作改动。
1.2.2 2 标准曲线的制备
随机选取无震时期的样品2015-1-1为标准样品制作材料,采用细菌通用引物338f (5’- ACTCCTACGGGAGGCAG -3’)和518r(5’- ATTACCGCGGCTGCTGG -3’)扩增细菌保守区,将PCR产物用琼脂糖凝胶试剂盒回收,取其中10 μL测序;取10 μL进行克隆子转化,用质粒试剂盒提取转化克隆子的质粒,并将其稀释为10-1,10-2,10-3,10-4,10-5共5个不同浓度梯度的标准品。
1.2.2.3样本Real-Time PCR检测
将泉水样本进行Real- Time PCR检测,每个样本做3组平行,Real- Time PCR检测体系为20 μL,反应程序为:预变性95℃,5min;扩增步骤:变性94℃,20 s;退火60℃,45 s;延伸72℃,1 min;35个循环,在延伸步骤时收集荧光信号。溶解曲线温度设置在65~95℃,每0.11℃读数,其间停留5 s。最后反应程序冷却至40℃。Real-Time PCR检测体系控制软件采用LightCyclerR480Ⅱ Software release1.5.0 (Version1.5.0.39) 。
2 结果与分析
2.1 标准样品的测序结果
经筛选,确定将细菌16 S rDNA序列的A-6号克隆子作为制作标准曲线的标准样品,其16 S rDNA片段序列长度为180 bp。该序列与NCBI 数据库中Sulfurospirillum barnesii SES-3( KM410847 ) 相似性为97% ,属于10号泉的土著菌属[14],可用于实验制作标准曲线的标准品。
测序结果为:-GGGGTCGTTCATGCGAGGT
AACTCTGATGTAGCACGCCGCGTGGAGGATGAC
ACATCTCGGTGCGTAAACTCCTTTTATTAGGGAAGATAATGACGGTACCTAATGAATAAGC
ACCGGCTAACTCCGTGCCAGCAGCCGCGGTAATAGTCCGTG-
2. 2 Real-Time PCR 标准样品与样本测定结果及可信度
2.2.1Real-Time PCR 标准曲线的制备
分别以10 倍浓度梯度的标准样品中DNA 模板浓度与Cp值为横纵坐标绘制标准曲线。为保证样本定量有稳定可重复的试验结果,标准曲线参数需满足以下特点:一致的重复反应、高的线性和高的扩增效率及斜率[15]。该标准曲线扩增效率E=2.038,r= 0.999 8,S= -3.262 4,且重复性好,说明以此标准样品构建的标准曲线是合格的。图1
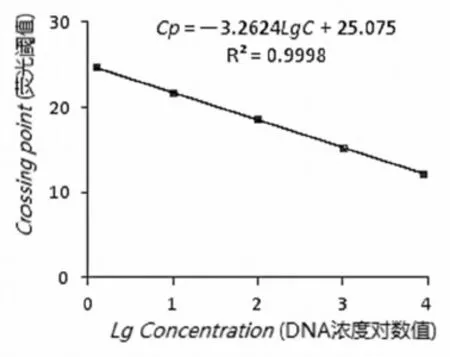
图1Real-Time PCR标准曲线
Fig. 1 Real-Time PCR standard curve
2.2.2Real-Time PCR 溶解曲线
以10 倍浓度梯度的标准样品PCR 过程中溶解温度(84℃)的测定值做溶解曲线,结果表明,可见单一峰值且无杂峰,表明扩增片段长度一致。图2
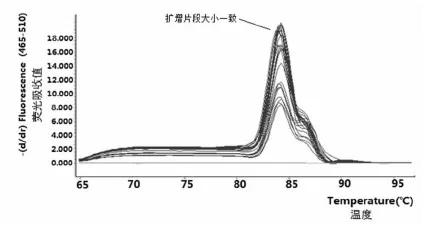
图2Real-time PCR 溶解曲线
Fig. 2 Real-time PCR melting curve
2.2.3Real-Time PCR 样本检测结果
样本Real-Time PCR 扩增曲线显示,每一组样本的扩增曲线均匀而平滑,且每个平行样本间所测的Cp值之差均在要求范围之内,表明样本的扩增曲线平行关系良好,说明实验数据可信度较高[16]。试验检测经过35个循环后样品均到达平台期,扩增效果较好,在第15个循环时进入荧光PCR指数扩增阶段,在此阶段,PCR 产物量的对数值与起始模板量之间存在线性关系,实验一般选择在这个阶段进行定量分析。图3
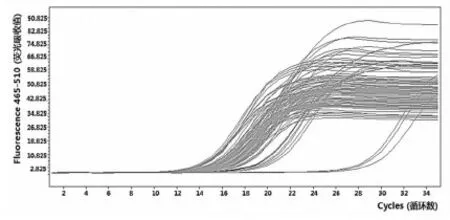
图3Real-time PCR 扩增曲线
Fig.3 Real-time PCR amplification curve
2.310号泉水文地球化学变化趋势
每日测定泉水10项理化性质,测量数据导入基于GIS的地震分析预报系统(Mapsis 2.8.5)绘制理化参数波动折线图,结果表明,检测期内,HS-、N2、流量的变化出现了显著高于其背景值的情况,但与地震发生时刻无响应关系,其他指标均在其背景值内波动。图4
2.410号泉水体细菌总DNA含量变化
经实时荧光定量PCR检测体系,系统自动生成检测结果,数据导入Excel 2010中可得对应细菌总DNA含量变化趋势,可知该泉水细菌总DNA含量变化基本符合震前高于震后的规律,只有2015年3月13日样品震前低于震后;此外,2014年12月2日、2015年2月1日三次地震随着震级依次递增,DNA含量的极大值也随之而依次递增。且在地震发生后的5~17 d内,泉水细菌总DNA含量变化出现极大值。图5
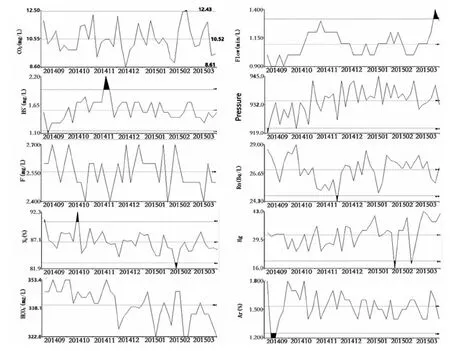
图4检测期内泉水10项水文地球化学变化
Fig.4 Hydrogen chemical changes in monitoring period of the No.10 spring
2. 5泉水细菌总DNA含量与水文地球化学的相关性
采用 SPSS19.0 对试验所得泉水细菌总DNA含量与10项水文地球化学结果做相关性分析,分析结果表明,泉水细菌总DNA含量与泉水中溶解CO2气体存在显著正相关性,而与HCO3-存在显著负相关性,显著相关性P< 0.05。表 2

注:图中虚线处表示地震发生时刻
Note:The dotted tine in the figure represents the earthquake occurrence time
图5检测期内10号泉水细菌总DNA含量变化
Fig.5 DNA concentration of bacteria changes in monitoring period of the No.10 spring
表 2泉水细菌总DNA含量与水文化学相关性
Table 2The correlation analysis between No.10 spring bacteria total DNA concentration and hydrochemistry

F-HCO3-HS-HgRnArN2CO2泉水细菌总DNA浓度Pearson相关性-0.298-0.376*-0.1100.251-0.1150.0210.0290.358*ThetotalDNAconcentration显著性(双侧)0.0650.0180.5050.1240.4860.9010.8590.025
注:*. 在0.05水平(双侧)上显著相关
Note:*. Significant correlation at 0.05 levels (bilateral)
3 讨 论
有研究表明,微生物对环境变化做出生物应答与生物防御的反应十分敏锐,地震所引起的如地下流体、地磁、电离辐射、射线波、地震波等理化因子的环境变化会引起某些对地震敏感的微生物种群急剧变化,而这些敏感微生物可能会比对地震前兆反应敏感的动物更敏感,这也就是说在地震带存在着对地震很敏感的天然敏感菌[17]。项目组对10号泉水体微生物与地震关系的监测持续多年,项目组成员张强等[18]于2010年12月至2011年4月,研究10号泉泉水细菌群落对有感地震的响应时发现部分细菌群落在地震后的丰富度均高于地震前,且都高于无地震时期; 罗娇等[19]在2012年1月至2012年12月的研究表明有感地震发生后可培养细菌菌落数目高于震前。杨红梅等[20]研究发现地震前可培养细菌菌落数目显著高于地震后;诱导泉水微生物系统中细菌群落变化的因素诸多,泉水中细菌群落为了应对由地震带来的环境改变会采取不同的生存策略,从而适应变化的环境。研究继张强、罗娇等持续监测,参考以往研究的结果及结论发现,除2015年3月13日,其余5次地震泉水细菌总DNA含量均为震前高于震后,且在地震发生后的5~17 d内,泉水细菌总DNA含量变化出现极大值;这说明该泉水中微生物对地震带来的环境改变会做出适应性的应答反应。研究还发现在2014年12月2日、2015年2月1日三次地震的震级依次递增,细菌总DNA含量的极大值也随之依次递增。
泉水细菌总DNA含量与CO2有显著的正相关性,分析其原因可能是泉水中的一些水文地球化学元素能够作为电子受体(CO2)和电子供体(H2,CH4)为自养和异养微生物的代谢提供能量[21],例如在自然界中有些细菌能以CO2为碳源,将CO2合成有机物储藏备用,这种代谢方式在碳循环的生物地球化学代谢中起了重要作用[22],这与前人所研究的该泉水中古菌群落的丰度值与CO2含量呈现正相关性相吻合。朱成英等[23]的研究显示来自深、浅源的溶解气体CO2多表现为趋势性高值中短期异常,在恢复背景值的过程中有地震发生,即水中溶解的CO2含量变化可对地震做短期预测。泉水细菌总DNA含量与HCO3-有显著的负相关性,分析其原因可能为CO2在水中溶解,根据化学电离平衡方程可知,若CO2含量增加,HCO3-离子的含量就会减少,故就会呈现显著负相关性。
4 结 论
乌鲁木齐10号泉水体细菌总DNA含量与地震的发生确实存在一定的响应规律:泉水细菌总DNA含量变化基本符合震前高于震后,且随震级的增加其最大恢复值也随之而递增;此外,在地震发生后的5~17 d内,泉水体细菌总DNA含量变化出现极大值。
乌鲁木齐10号泉水体细菌群落与该泉水文地球化学因子HCO3-与CO2的含量变化关联紧密,可作为后期重点观测研究对象。
乌鲁木齐10号泉水体细菌总DNA含量变化规律可作为地震预测的参考因素之一。
References)
[1]孙莉. 正确认识和分析地震前兆[J]. 品牌(理论月刊),2011,(3):160.
SUN Li. (2011). Correct Understanding and Analysis of Earthquake Precursors [J].TheoreticalMonthly, (3):160. (in Chinese)
[2]Danielopol, D. L., Pospisil, P., & Rouch, R. (2000). Biodiversity in groundwater: a large-scale view.TrendsinEcology&Evolution, 15(6):223-224.
[3]Griebler, C., & Lueders, T. (2009). Microbial biodiversity in groundwater ecosystems.FreshwaterBiology, 54(4):649-677.
[4]李政红,张翠云,张胜,等. 地下水微生物学研究进展综述[J]. 南水北调与水利科技,2007, (5):1 672-1 883.
LI Zheng-hong,ZHANG Cui-yun,ZHANG Sheng,et al. (2007). Review on Groundwater Microbiology [J].South-to-NorthWaterTransfersandWaterScience&Technology,(5):1,672-1,883. (in Chinese)
[5]汪成民,车用太,万迪堃,等. 地下水微动态研究[M]. 北京: 地震出版社,1988:4-6.
WANG Cheng-min,CHE Yong-tai, WAN Di-kun,et al. (1988).ResearchonGroundwaterMico-dynamicState[M]. Beijing: Earth-Quake Press: 4-6. (in Chinese)
[6]高小其,许秋龙,张学敏,等. 乌鲁木齐10号泉流体综合观测及映震灵敏性初析[J] . 内陆地震,2000,14(3):243-251.
GAO Xiao-qi,XU Qiu-long, ZHANG Xue-min,et al. (2000). Preliminary analysis on synthetic fluid observation of Urumqi spring No.10 and its earthquake-reflecting sensitivity [J].InlandEarthquake,14(3): 243-251. (in Chinese)
[7]Elshahed, M. S., Senko, J. M., Najar, F. Z., Kenton, S. M., Roe, B. A., Dewers, T. A., & Krumholz, L. R. (2003). Bacterial diversity and sulfur cycling in a mesophilic sulfide-rich spring.AppliedandEnvironmentalMicrobiology, 69(9):5,609-5,621.
[8]Poitrasson, F., Dundas, S. H., Toutain, J. P., Munoz, M., & Rigo, A. (1999). Earthquake-related elemental and isotopic lead anomaly in a springwater.Earthandplanetaryscienceletters, 169(3):269-276.
[9]高小其,陈华静,高国英,等. 新疆地下流体源兆、场兆、大震远兆特征的统计与分析[J]. 地震, 2006,(2):83-94.
GAO Xiao-qi,CHEN Hua-jing,GAO Guo-ying,et al. (2006). Statistics and analysis on characteristics of focal precursors, field precursors and remote precursors of ground fluid for great earthquakes in Xinjiang region [J].Earthquake, (2): 83-94. (in Chinese)
[10]张强,李珊,曾军,等. 乌鲁木齐10号泉水体细菌群落结构的动态变化及响应模式初析[J]. 新疆农业科学,2012,49(3):496-501.
ZHANG Qiang,LI Shan,ZENG Jun,et al. (2012). Preliminary Analysis on Dynamic Change of Bacterial Community and Its Respond Pattern in the No.10 Spring of Urumqi in Xinjiang [J].XinjiangAgriculturalSciences, 49(3):496-501. (in Chinese)
[11]赵洁,马晨,席晓敏,等. 实时荧光定量PCR技术在肠道微生物领域中的研究进展[J]. 生物技术通报,2014,(12):61-66.
ZHAO Jie,MA Chen,XI Xiao-min,et al. (2014). Dances of Real-time PCR Technology in the Field of Gut Microbiota [J].BiotechnologyBulletin. (12):61-66. (in Chinese)
[12]尹兵. 实时荧光定量PCR的原理及应用研究进展[J]. 科技信息,2010,(17): 30,59.
YI Bing. (2010). Principle and application of real time fluorescent quantitative PCR [J].ScientificandTechnologicalInformation,(17):30,59. (in Chinese)
[13]Humayoun, S. B., Bano, N., & Hollibaugh, J. T. (2003). Depth distribution of microbial diversity in Mono Lake, a meromictic soda lake in California.Appliedandenvironmentalmicrobiology, 69(2):1,030-1,042.
[14]吴江超,高小其,曾军,等. 新疆断裂带泉水中细菌群落结构的PCR-DGGE分析 [J]. 生态学报,2011,(2):506-512.
WU Jiang-chao,GAO Xiao-qi,ZENG Jun,(2011). The bacterial community structure in Xinjiang fault belt spring analyzed by PCR-DGGE [J].ActaEcologicalSinica,31(2): 506-512. (in Chinese)
[15]赵传鹏,浦跃朴,尹立红,等. 实时荧光定量PCR法检测环境假单胞菌属细菌丰度[J]. 东南大学学报(自然科学版),2006,(1):143-146.
ZHAO Chuan-peng,PU Yue-pu,YIN Li-hong,et al. (2006). Detection of abundance of Pseudan onas in environmental samples by real-time quantitative PCR [J].JournalofSoutheastUniversity(NaturalScienceEd.), (1):143-146. (in Chinese)
[16]顾卿,许艳丽,魏巍,等. 土壤细菌群落密度实时荧光定量PCR检测体系的建立[J]. 土壤与作物,2012,(2):117-120.
GU Qing,XU Yan-li,WEI Wei,et al. (2012). The Establishment of the Real-Time PCR System For Detecting Soil Bacteria Abundance [J].SoilandCrop,(2):117-120. (in Chinese)
[17]Balaban, N. Q., Jack, M., Remy, C., Lukasz, K., & Stanislas, L. (2004).Bacterialpersistenceasaphenotypicswitch.Science, 305(5690):1,622-1,625.
[18]张强,曾军,娄恺,等.乌鲁木齐10号泉水体细菌群落对地震的响应[J].地震学报,2012,34(5):706-715.
ZHANG Qiang,ZENG Jun,LOU Kai,et al. (2012). Seismic response of bacterial community structure at No.10 Spring in Urumqi [J].ActaSeismologicaSinica,34(5):706-715. (in Chinese)
[19] 罗娇,杨红梅,高小其,等. 乌鲁木齐10号泉泉水细菌群落对有感地震的响应 [J]. 微生物学报,2015,(3):341-350.
LUO Jiao,YANG Hong-mei,GAO Xiao-qi, et al. (2015). Response of bacterial community structures at No.10 Spring in Urumqi to felt earthquakes [J].ActaMicrobiologicaSinica,(3):341-350. (in Chinese)
[20] 杨红梅,欧提库尔·马合木提,曾军,等.新疆乌恰泉华地震前后泉水细菌群落的变化[J]. 生态学报,2011,31(10):2 940-2 946.
YANG Hong-mei,Otkur Mahmut, ZENG Jun,et al. (2011). Variation of a spring bacterial community from Wuqia Sinter in Xinjiang during the pre-and post-earthquake period [J].ActaEcologicaSinica, 31(10): 2,940-2,946. (in Chinese)
[21] Cothern, C. R., & Milvy, P. (1988). Risk assessment of radon in drinking water. Trace Subst. Environ.Health;(UnitedStates), 12(CONF-8805159-).
[22]胡蓉,曾军,高小其,等. 乌鲁木齐地震断裂带泉水古菌群落对水文地球化学元素的响应 [J]. 新疆农业科学,2011,48(3):551-556.
HU Rong,ZENG Jun,GAO Xiao-qi,et al. (2011). Respond of Archaeal Community to Hydro geochemical Elements Changes in the No.10 Cold Spring of Urumqi in Seismic Fault Zone in Xinjiang [J].XinjiangAgriculturalSciences,48(3):551-556. (in Chinese)
[23]朱成英,高小其,李艳萍,等. 新4号泉溶解气CO2异常特征分析[J]. 地震地磁观测与研究,2011,32(3): 95-99.
ZHU Cheng-ying,GAO Xiao-qi,LI Yan-ping,et al. (2011). Analysis of CO2gas anomaly characteristics of new No.10 spring solution [J].SeismologicalandGeomagneticObservationandResearch,32(3): 95-99. (in Chinese)
Fund project:Supported by Hi-tech development project of Xinjiang Uygur Autonomous Region(201216145)
Analysis of the Seismic Response of Bacterial Community in Urumqi No. 10 Spring
CHEN Zhang1, 2, LIN Qing2, TANG Feng2, HU Rong2, YIN Ya-lan2, GAO Yan2
(1.CollegeofLifeScience,XinjiangNormalUniversity,Urumqi830054,China; 2.ResearchInstituteofAppliedMicrobiology,XinjiangAcademyofAgriculturalSciences,Urumqi, 830091,China)
【Objective】 To sample No.10 spring water in Urumqi regularly, monitore the changes of total DNA concentration, and combine them with hydro geological data to explore the relationship between bacterial communities and earthquakes.【Method】Transformation clone method was used to establish the standard curve of absolute quantitative PCR. The density of bacterial communities in No.10 spring water was monitored by real-time fluorescence quantitative PCR.【Result】 The standard curve wasCp=-3.262 4LgC+25.075, Correlation coefficient wasr= 0.999,8; The density of bacterial community of No.10 spring in the monitoring period had a significant positive correlation with CO2, and a significant negative correlation with HCO3-.【Conclusion】 It is true that bacterial communities of the No.10 spring in Urumqi were sensitive to the seismic response. The total DNA concentration and the earthquake had a certain response: The change of total DNA concentration of No.10 spring was higher than that of the post earthquake, and the maximum recovery value increased with the increase of magnitude; The total DNA concentration of the spring water in the 5-17 days after the earthquake occurred, which had a great value, and this change is closely associated with hydrogen chemical factor HCO3-and CO2content change, so it can be used regard as the latter part of the focus of observation and research object. In a word, this might be one of the reference factors for earthquake prediction.
No.10 Spring in Urumqi; earthquake; real-time fluorescence quantitative PCR; bacterial community density; hydro geochemical
10.6048/j.issn.1001-4330.2016.04.019
2015-12-07
新疆维吾尔自治区高新技术发展项目(201216145)
陈张(1989- ),女,新疆人,硕士研究生,研究方向为新疆特色生物分子资源可持续性应用,(E-mail) zihanchenxj@163.com
高雁(1979- ),女,新疆人,副研究员,研究方向为微生物生态学,(E-mail) 47795411@qq.com
S182
A
1001-4330(2016)04-0730-07
