微小RNAs调控低氧诱导因子-1α/2α与低氧肺动脉高压*
2016-11-01余震坤韩永建综述审校
余震坤,韩永建 综述,常 荣 审校
(1.青海大学医学院 810016;2.青海省人民医院心血管内科 810007)
·综述·doi:10.3969/j.issn.1671-8348.2016.26.038
微小RNAs调控低氧诱导因子-1α/2α与低氧肺动脉高压*
余震坤1,韩永建1综述,常荣2△审校
(1.青海大学医学院810016;2.青海省人民医院心血管内科810007)
微小RNAs;低氧诱导因子;低氧肺动脉高压
肺动脉高压(pulmonary hypertension,PH)临床病因复杂,由心血管、呼吸等疾病引起肺血管病理生理紊乱发展而来[1]。PH形成主要的原因是肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)、肺血管内皮细胞(pulmonary artery endothelial cells,PAECs)等血管形成细胞的增殖或迁移而致肺血管管腔进行性狭窄或闭塞、肺血管重建和血管收缩反应增强,最终发展为右心衰竭甚至死亡[1-2]。低氧肺动脉高压(hypoxia-induced pulmonary hypertension,HPH )是肺动脉高压类型之一,由于长期低氧或缺氧引起[3]。研究表明,HPH形成过程中低氧诱导因子-1α及低氧诱导因子-2α(HIF-1α/2α)激活了血管内皮生长因子(vascular endothelial growth factor,VEGF)、内皮素1(endothelin-1,ET-1)等,促使PASMCs、PAECs等血管形成细胞的增殖或迁移[4-5]。因此,HIF-1α/2α在HPH形成中发挥着极其重要的作用。目前,微小RNAs(miRNAs)被广泛研究,它是约22 nt的单链RNA分子,低氧环境中对HIF-1α/2α起到直接或间接的调控作用。本文旨在对该调控与HPH肺血管的重建及收缩这一疾病途径进行综述。
1 miRNAs、低氧诱导因子的生物学特征
1.1微小核糖核酸miRNAs家族于1993年被研究发现,是约22 nt的单链核糖核酸分子[6]。在其后研究中人们发现,miRNAs在高等动物体内精准地调控着mRNAs的转录。由于miRNAs在成熟的不同阶段以及它们靶基因的不同,因而被剪切成不同长度的片段。首先,在细胞核内由RNA聚合酶Ⅱ/Ⅲ转录成发夹样结构双链miRNA前体 (pri-miRNA),其长度约小于33 bp;其次,miRNA前体被转运至细胞质,根据不同的靶基因剪切修饰成长度约20~22 nt单链成熟的miRNA;最后,成熟的miRNA在内质网上同靶基因的mRNA 3′UTR配对,降解或者沉默该mRNA,从而抑制其转录后的生物学功能[7]。miRNA家族种类繁多,据估计,人类基因组中有超过1 000种miRNAs,它们可以调控体内1/3以上的靶mRNA[8]。同一靶基因可以有单个或多个靶点,也可以被多个miRNAs联合调控。同样,一种miRNA可以调控多种靶基因,但生物学效应是不同的。miRNAs在不同组织、细胞分化的不同阶段的表达谱也各不相同。
1.2低氧诱导因子低氧诱导因子是Semenza等[9]于1992年在低氧诱导的细胞核提取物中发现的,当时认为能促进红细胞生成素(EPO)的生成,被命名为HIF-1。HIF-1是由α和ARNT亚单位 (也称β亚单位)组成的异二聚体,分别是功能亚单位(氧调节亚单位)与结构亚单位[10]。两者都具有helix-loop-helix-PAS (bHLH-PAS)结构域,此结构域位于HIF两个亚单位的N端,作用是连接靶DNA。HIF-α亚单位C端有一个独特的氧依赖降解结构域(ODD)和两个反式转录激活结构域(C-TAD,N-TAD主要参与转录激活作用)。HIF-ARNT亚单位具有与HIF-α亚单位反式相似的结构,其功能是在低氧环境中和HIF-α形成HIF-α-ARNT复合体,保持HIF 、结构的稳定性。HIF-α亚单位目前认为有3种同源体:HIF-1α、HIF-2α和HIF-3α,它们均受氧浓度调节,前两者结构及功能相似,但长时间低氧时HIF-2α更为敏感、结构更加稳定[10-11]。HIF-3α目前机制还不明确。常氧下,HIF-α不稳定,很短时间内被脯氨酰羟化酶(PHD)联合泛素蛋白酶所降解[10]。在低氧环境中,HIF-α 稳定性增加,并转移到细胞核,与HIF-ARNT亚单位结合成稳定的HIF-α-ARNT复合体,再与靶基因的缺氧反应元件(HRG,典型的核苷酸序列为5`TACGTG-3 )结合,启动靶基因的转录。目前研究在HPH肺血管细胞中,HIF-1α/2α有大量共同的靶基因,如:ET-1、VEGF、EPO等[12-16]。它们在HPH形成中被HIF-1α/2α靶向激活,促使PASMCs、PAECs的增殖或迁移,导致肺血管狭窄及重建。
2 低氧miRNAs调控HIF与HPH的形成
2.1 低氧miRNAs调控HIF与组织血管增殖与重建低氧与循环呼吸疾病、炎症、肿瘤、缺血性疾病等密切相关。为恢复机体的供氧,组织或器官就重建一些无规则的组织血管。这些改变在缺血性脑卒中或心肌梗死中对机体有利,但重建血管在HPH、肿瘤、青光眼等疾病中对机体有害。低氧会导致体内miRNAs水平变化,这种变化直接影响到HIF,从而促进或抑制血管在组织中的增殖与重建。miRNAs对HIF-α的调控主要有两种:一种是直接以HIF靶基因进行调控;另一种是间接以HIF为靶基因进行调控。直接以HIF-α为靶基因的有:miRNA-17、miRNA-20a、miRNA-145 、miRNA-519c、miRNA-155 等,它们和HIF结合后形成HIF-miRNA复合体,从而沉默HIF,抑制其转录后表达[17-20]。miRNAs间接调控HIF的中间靶基因有很多种:miRNA-130a、miRNA-130b[21],它们是通过沉默ATP依赖RNA解螺旋酶6(DDX6),使HIF免受降解或沉默,促进在核糖体的表达;miRNA-200b、miRNA-200c、miRNA-429沉默PHD,使HIF稳定,免受损害[22];miRNA-424沉默泛素连接酶(CUL2),使HIF1α/2α免受泛素化降解[13]。见表1[13,14-22]。
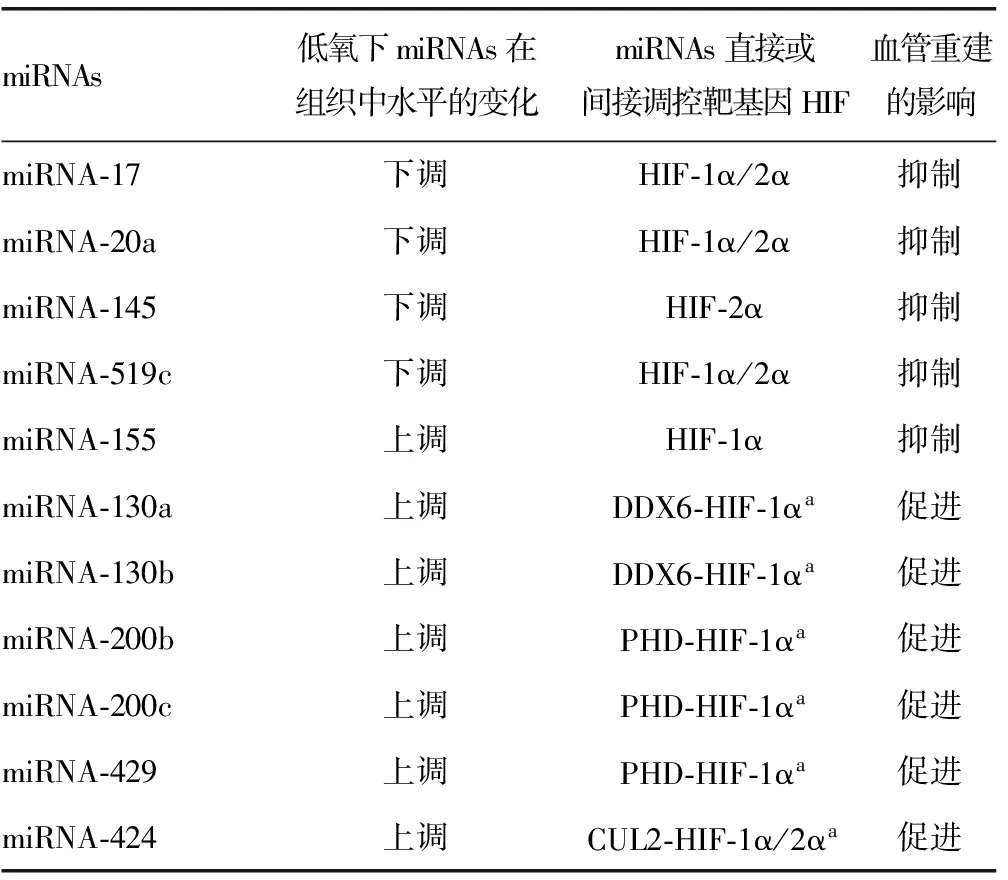
表1 低氧条件下组织中miRNAs水平的变化对HIF的调控影响组织血管的重建
CUL2:泛素连接酶;DDX6:RNA依赖性ATP酶;PHD:脯氨酰羟化酶; 低氧条件下miRNA-155与HIF-1α水平都上调,是反馈循环的结果[20];a:miRNAs间接调控靶基因HIF。
2.2低氧miRNAs调控HIF与HPH肺血管增殖及重建在研究肺动脉高压时,学者常用低氧或野百合碱诱导动物模型。因此,可以将低氧诱导下形成的肺动脉高压动物模型研究得出的结论应用于HPH的生理病理讨论。相关研究已经证实,低氧诱导的肺动脉高压中miRNAs直接或间接调控HIF-α会引起肺血管增殖[13-16]。查阅相关文献,有以下几种: miRNA-124,肺组织中直接靶基因为HIF-2α[14];miRNA-206家族,肺组织中直接靶基因为HIF-1α[15]。前述两种miRNAs在小鼠HPH模型肺组织中水平是下调的,但肺组织中HIF-1α/2α却明显增高,因而PASMCs 、PAECs、成纤维细胞增殖的也很明显,当上调miRNA-124、miRNA-206后,HIF-1α/2α水平得到抑制,进而阻止了HPH的发展。miR-424,在低氧诱导HPH的鼠模型的肺组织中水平是上调的,它联合miRNA-322靶向调控CUL2,稳定HIF免受泛素酶的降解,从而促进肺血管的增生[13];miRNA-21,在HPH肺组织中水平也是上调的,它可以直接抑制骨形成蛋白受体Ⅱ(BMPRⅡ)转录,从而降低BMPRⅡ在组织中水平,稳定HIF,促进HPH肺血管增殖与重建[16]。见表2[13-16]。
2.3miRNAs调控HIF对HPH肺血管收缩影响HPH的形成的另一关键原因是肺血管的收缩。ET-1被认为是肺血管收缩的主要物质之一,具有强烈的收缩肺血管的作用和促进肺淋巴管的新生作用,也是肺血管收缩及重建重要的标志物[23]。研究认为,ET-1基因为HIF-α转录靶基因之一[12]。在HPH模型肺组织中,两者都升高,它们之间存在相互调节的作用(图1)。其机制是:首先,在低氧环境中肺血管内皮细胞分泌ET-1增多。其次,ET-1的增多促进肺动脉平滑肌细胞内Ca2+的迅速增加,Ca2+可刺激肺动脉平滑肌细胞产生活性氧族(ROS),ROS激活细胞调节蛋白激酶(ERK1/2),ERK1/2的激活会导致HIF-1的mRNA水平上调,同时导致PHD2的mRNA的水平下调。最后,由于HIF-1水平上调以及它的抑制酶PHD2下调,HIF-1转录活跃,也增加了对ET-1的转录。最终导致肺血管收缩、增殖与重建而发展成肺动脉高压。在HPH研究中,miRNAs对HIF调控对肺血管收缩产生影响,目前通过动物实验证实的有miRNA-98、miRNA-648,它们靶基因都为ET-1、HIF-1α[24-25]。两种miRNAs在HPH模型肺组织中的水平都是下调的,肺组织中ET-1、HIF-1α因而没有得到有效的抑制,使的肺血管收缩反应增强;当上调miRNA-98、miRNA-648水平后,ET-1的分泌也明显减少,HIF-1α蛋白水平下降,肺血管收缩反应降低。

表2 低氧条件下miRNAs直接或间接调控HIF对HPH的影响
CUL2:泛素连接酶;BMPRⅡ:骨形成蛋白受体Ⅱ。a:miRNAs间接调控靶基因HIF。
2.4miRNAs、HIF、ET-1与HPH之间的关系在长期低氧环境中,肺组织中miRNAs的水平出现上调或下调的变化,而ET-1则为持续的高水平[12]。miRNAs、HIF-α、ET-1它们之间存在相互调节,互相影响的关系(图1):(1)当miRNA(如miRNA-21、miRNA-322、miRNA-424)的靶基因为CUL2、BMPRⅡ、PHD2等HIF-α的抑制酶基因时,由于这些miRNAs在肺组织中水平上调抑制前述基因的表达,从而稳定HIF的结构并使其免受降解或沉默,因而HIF-α水平上调。(2)当miRNAs(如miRNA-124、miRAN-206)的直接靶基因为HIF-α时,长期低氧条件下使它们在肺组织中水平都是下调的,因此HIF-α得不到抑制或降解,其水平也是上调的。(3)长期低氧时,肺组织中ET-1为持续的高水平,而以ET-1为直接靶基因的miRNAs(如miRNA-98、miRNA-648)是下调的,PHD2也随之下调,因此HIF-α水平上调,同时HIF-α的上调也增加了对ET-1的转录。以上几条途径的结果都会引起肺组织中HIF-α水平上调,导致血管形成细胞PASMCs、PAECs增殖和肺血管的重建与收缩,进一步发展为HPH。
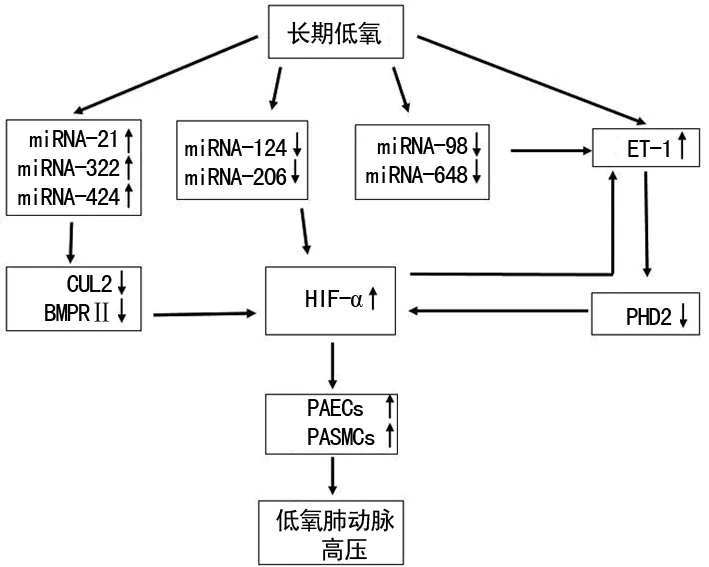
CUL2:泛素连接酶;BMPRⅡ:骨形成蛋白受体Ⅱ;PHD2:脯氨酰羟化酶2;ET-1内皮素1;PASMCs:肺动脉平滑肌细胞;PAECs:肺血管内皮细胞。↑水平上调;↓水平下调。
图1miRNAs、HIF-α、ET-1、HPH之间关系
3 面临的问题及展望
miRNAs与HIF-1α/2α作为HPH肺血管形成过程中转录调控关键分子,大量的研究也表明其水平的变化影响HPH的形成。但目前最大挑战是关于miRNAs调节生命体的其他生理变化还不明确。若将miRNAs调控HIF-1α/2α的途径应用到HPH临床的治疗,可能还需长时间的验证。HPH形成除肺血管的增殖重建及收缩外,还有肺血管内皮细胞的炎症、局部代谢紊乱等病理改变,等等诸多因素交织在一起,才促使HPH病情的发展。尽管miRNAs和HIF-1α/2α在HPH研究中有许多挑战,但外周循环的miRNAs 90%以上都非常稳定,所以将miRNAs作为HPH疾病无创诊断的标志物,未来可能会普遍的应用于临床[26]。并随着miRNAs及HIF-1α/2α研究的深入,也有可能选miRNAs或HIF-1α/2α作为HPH基因治疗的靶点,起到对疾病的预防和治疗作用,让更多的HPH患者从中受益。
[1]Lau EM,Tamura Y,Mcgoon MD,et al.The 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension:a practical chronicle of progress[J].Euro Respirat J,2015,46(4):879-882.
[2]Bienertova-Vasku J,Novak J,Vasku A.MicroRNAs in pulmonary arterial hypertension:pathogenesis,diagnosis and treatment[J].J Am Soc Hypertens,2015,9(3):221-234.
[3]郑泉,袁雅冬,赵靖.雌激素及其代谢产物对去势低氧肺动脉高压大鼠烷烃单加氧酶和低氧诱导因子-1α表达的影响[J].中国循环杂志,2015,30(9):884-888.
[4]Ball MK,Waypa GB,Mungai PT,et al.Regulation of hypoxia-induced pulmonary hypertension by vascular smooth muscle hypoxia-inducible factor-1alpha[J].Am J Respir Crit Care Med,2014(189):314-324.
[5]Shimoda LA,Semenza GL.HIF and the lung role of hypoxia-inducible factors in pulmonary development and disease[J].Am J Respir Crit Care Med,2011,183(2):152-156.
[6]Yates LA,Norbury CJ,Gilbert RJ.The long and short of microRNA[J].Cell,2013,153(3):516-519.
[7]Li S,Liu L,Zhuang X,et al.MicroRNAs inhibit the translation of target mRNAs on the endoplasmic reticulum in Arabidopsis[J].Cell,2013,153(3):562-574.
[8]Berezikov E,Guryev V,Van De Belt J,et al.Phylogenetic shadowing and computational identification of human microRNA genes[J].Cell,2005,120(1):21-24.
[9]Semenza GL,Wang GL.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Mol Cell Biol,1992,12(12):5447-5454.
[10]Wu DL,Potluri N,Lu JP,et al.Structural integration in hypoxia-inducible factors[J].Nature,2015,524(7565):303-308.
[11]Makino Y,Cao R,Svensson K,et al.Inhibitory PAS domain protein is a negative regulator of hypoxia-inducible gene expression[J].Nature,2001,414(6863):550-554.
[12]Pisarcik S,Maylor J,Lu W,et al.Activation of hypoxia-inducible factor-1 in pulmonary arterial smooth muscle cells by endothelin-1[J].Am J Physiol Lung Cell Mol Physiol,2013,304(8):L549-561.
[13]Ghosh G,Subramanian IV,Adhikari N,et al.Hypoxia-induced microRNA-424 expression in human endothelial cells regulates HIF-alpha isoforms and promotes angiogenesis[J].J Clin Investiga,2010,120(11):4141-4154.
[14]Wang D,Zhang H,Li M,et al.MicroRNA-124 controls the proliferative,migratory,and inflammatory phenotype of pulmonary vascular fibroblasts[J].Circ Res,2014,114(1):67-78.
[15]Yue J,Guan J,Wang XY,et al.MicroRNA-206 is involved in hypoxia-induced pulmonary hypertension through targeting of the HIF-1 alpha/Fhl-1 pathway[J].Lab Investiga,2013,93(7):748-759.
[16]Parikh VN,Loscalzo J,Chan SY.MicroRNA-21 Integrates Pathobiological Signaling in Pulmonary Vascular Endothelial Cells:Implications for Pulmonary Arterial Hypertension[J].Circulation,2010,122(21 Supplement):15650.
[17]Poitz DM,Augstein A,Gradehand C,et al.Regulation of the Hif-system by micro-RNA 17 and 20a - role during monocyte-to-macrophage differentiation[J].Mol Immunol,2013,56(4):442-451.
[18]Zhang H,Pu J,Qi T,et al.MicroRNA-145 inhibits the growth,invasion,metastasis and angiogenesis of neuroblastoma cells through targeting hypoxia-inducible factor 2 alpha[J].Oncogene,2014,33(3):387-397.
[19]Cha ST,Chen PS,Johansson G,et al.MicroRNA-519c suppresses hypoxia-inducible factor-1alpha expression and tumor angiogenesis[J].Cancer Res,2010,70(7):2675-2685.
[20]Bruning U,Cerone L,Neufeld Z,et al.MicroRNA-155 promotes resolution of Hypoxia-Inducible factor 1 alpha activity during prolonged hypoxia[J].Mol Cell Biol,2011,31(19):4087-4096.
[21]Saito K,Kondo E,Matsushita M.MicroRNA 130 family regulates the hypoxia response signal through the P-body protein DDX6[J].Nucleic Acids Res,2011,39(14):6086-6099.
[22]Lee ST,Chu K,Jung KH,et al.MicroRNAs induced during ischemic preconditioning[J].Stroke,2010,41(8):1646-1651.
[23]Caprara V,Scappa S,Garrafa E,et al.Endothelin-1 regulates hypoxia-inducible factor-1 alpha and-2 alpha stability through prolyl hydroxylase domain 2 inhibition in human lymphatic endothelial cells[J].Life Sci,2014,118(2):185-190.
[24]Kang BY,Park KK,Sutliff RL,et al.MicroRNA-98 negatively regulates hypoxia-induced endothelin-1 expression in human pulmonary artery endothelial cells [J].FASEB Journal,2012,26(Suppl 1):873.
[25]Li C,Gonsalves CS,Malik P,et al.MicroRNA 648 Targets ET-1 mRNA and is cotranscriptionally regulated with MICAL3 by PAX5[J].Mol Cell Biol,2015,35(3):514-528.
[26]Arroyo JD,Chevillet JR,Kroh EM,et al.Argonaute2 complexes carry a population of circulating microRNAs Independent of vesicles in human plasma[J].Proc Natl Acad Sci U S A,2011,108(12):5003-5008.
国家自然科学基金资助项目(81360301);青海省应用基础研究计划资助项目(2013-Z-743)。作者简介:余震坤(1984-),主治医师,硕士,主要从事心血管疾病科研及临床的研究。△
,E-mail:qhschangrong@126.com。
R34
A
1671-8348(2016)26-3716-04
2016-03-18
2016-06-02)
