雷奈酸锶对卵巢切除大鼠BMSCs成骨分化及BMP-2表达的影响
2016-11-01刘小坡冯云波李晓丽曹国龙
刘小坡,冯云波,李晓丽,曹国龙,张 沛
(河北省唐山市工人医院:1骨外科;2.老年病科;3.神经内科 063000)
雷奈酸锶对卵巢切除大鼠BMSCs成骨分化及BMP-2表达的影响
刘小坡1,冯云波1,李晓丽2,曹国龙1,张沛3
(河北省唐山市工人医院:1骨外科;2.老年病科;3.神经内科063000)
目的探讨雷奈酸锶(SR)对卵巢切除大鼠骨髓基质干细胞成骨分化及骨形态发生蛋白-2(BMP-2)表达的影响。方法3月龄SD大鼠24只,分别接受假手术(Sham组,n=8)和双侧卵巢切除(OVX,n=16)手术,术后8周OVX大鼠分为2组,分别接受安慰剂(OVX+V组)或SR(0.9 g·kg-1·d-1,OVX+SR组)治疗 3个月。实验结束后处死所有大鼠,检测第4腰椎骨密度、最大载荷、弹性模量等生物力学性能,取股骨和胫骨骨髓细胞进行体外培养并向成骨细胞诱导分化,第25天共聚焦显微镜观察BMP-2的表达及分布,第28天提取细胞RNA及蛋白,RT-PCR及Western blot 法检测BMP-2的表达,细胞培养第32天von kossa 染色观察细胞外基质矿化能力。结果(1)骨密度:OVX+V组显著低于Sham组和OVX+SR组(P<0.05),OVX+SR组显著低于Sham组。(2)最大载荷:OVX+V组显著低于OVX+SR组(P<0.05),OVX+SR组显著低于Sham组(P<0.05);弹性模量:OVX+V组显著低于Sham组和OVX+SR组(P<0.05)。(3)共聚焦显微镜观察各组细胞BMP-2的表达及胞内分布无明显差异。(4)RT-PCR及Western blot 法检测BMP-2在各组的表达差异无统计学意义。(5)von kossa 染色观察各组矿化面积百分比差异无统计学意义(P>0.05)。结论SR可部分改善卵巢切除大鼠骨量丢失和力学性能,对其骨髓基质干细胞体外成骨分化能力及BMP-2的表达无显著影响。
卵巢切除术;骨质疏松;骨密度;雷奈酸锶;骨髓基质干细胞;骨形态发生蛋白-2
随着我国人口老龄化的加剧,骨质疏松等骨关节退行性疾病的发病率呈现快速上升的趋势[1],选择行之有效的干预措施显得愈发重要。雷奈酸锶(SR)由一个有机酸及两个非放射性锶原子组成。研究表明,SR同时具有促进成骨细胞增殖和抑制破骨细胞活性的双重生理功能,进而表现出既能促进骨形成,又可以抑制骨吸收的双重功效[2-4]。已有临床和基础研究发现,SR对绝经后骨质疏松具有一定的疗效[5],但作用机制尚有待进一步研究。
骨髓基质干细胞(BMSCs)具有多向分化潜能[6-7],其成骨分化能力可影响甚至决定骨量及骨骼的力学性能。因此,BMSCs可以用来筛选促进骨形成药物或探索个别干预措施促进骨形成的作用机制。本研究拟通过去势手术建立绝经后骨质疏松大鼠模型,并分别给予一定剂量的SR干预,在验证SR对雌激素衰退诱导的大鼠绝经后骨质疏松模型骨密度、生物力学性能影响的基础上,进一步探讨SR对大鼠BMSCs成骨分化及特异性标志蛋白表达的影响,以期明确其作用机制。
1 材料与方法
1.1材料本实验采用雌性3月龄SD大鼠,共计24只,体质量(245±20)g,购自北京维通利华有限公司,于清洁级动物实验室饲养,期间自由进食水。SR[国药准字J20080098,施维雅(天津)制药有限公司]。
1.2方法
1.2.1动物分组及处理所有大鼠分别接受假手术(Sham组,n=8)和双侧卵巢切除(OVX,n=16)手术,术后8周OVX大鼠随机分为2组,分别给予安慰剂(OVX+V组)或SR(0.9 g·kg-1·d-1,OVX+SR组)治疗,持续3个月,实验结束后,采用脱颈法处死动物取材。
1.2.2标本的采集和处理取第4腰椎采用双能X线法检测骨密度,压缩实验检测其最大载荷和弹性模量;取股骨和胫骨骨髓细胞体外培养并向成骨细胞诱导分化,第25天共聚焦显微镜观察骨形态发生蛋白-2(BMP-2)的表达及分布,第28天提取细胞RNA及蛋白,RT-PCR及Western blot法检测BMP-2的表达,细胞培养第32天von kossa染色观察细胞外基质矿化能力。
1.2.3骨密度检测剔除待检测椎体附着肌肉等软组织,采用小动物模式应用Norland-XR36双能X线骨密度测量仪(DEXA,美国)测量第4腰椎骨密度。
1.2.4生物力学检测首先去除第4腰椎横突、上下关节突、椎弓根及椎板等椎体附件,并经手工打磨将椎体制作成高度约为 5 mm 的标准件,椎体上下面保持平行,与椎体纵轴垂直,并根据每个椎体的前后径,计算出标准件的平均直径和体界面积。将椎体下端固定于测试平台上,以 5 mm/min的速度进行椎体轴向压缩,直至椎体出现断裂,记录最大压缩载荷及能量吸收值,根据载荷-位移曲线读取最大载荷,并经公式计算得到弹性模量。
1.2.5BMSCs的提取和诱导培养无菌条件下取大鼠右侧股骨和胫骨,去除两端,暴露髓腔,10 mL注射器吸取用完全DMEM培养液(青霉素100 U/mL,链霉素100 μg/mL,100 mL/L胎牛血清)反复冲洗骨髓腔,收集骨髓细胞,离心重悬后接种于培养瓶中,50 mL/L(体积分数)CO2,37 ℃温箱中培养。24 h后换液,以后每2~3 天更换培养液,弃掉未贴壁的悬浮细胞。第2次换液后加入条件培养基,向成骨细胞(维生素C 50 μg/mL,β-甘油磷酸钠10 mmol/L)诱导。
1.2.6激光共聚焦分析BMP-2的表达分布细胞培养至第25天(第4代细胞接种于共聚焦培养皿中后36 h),行共聚焦显微镜检测,实验过程如下:取出共聚焦皿,用吸管吸出共聚焦培养皿中的培养基,用预冷的磷酸盐缓冲液(PBS)洗3次,每次10 min;用新鲜配制的4%多聚甲醛室温固定1 h;固定并洗涤完毕后,加适量新鲜配制的0.1%的TriTon-x-100打孔液,将共聚焦培养皿置于37 ℃孵箱中打孔15 min;吸出打孔液并洗涤后,将其置于37 ℃孵箱中孵育10 min;吸出过氧化氢,加适量5%的BSA封闭液,于37 ℃孵箱中孵育10 min;倾去后加入50 μL的BMP-2一抗,4 ℃过夜;次日加入FITC标记的二抗50 μL,放于密闭遮光的盒子内,一同置于37 ℃孵箱中孵育30 min;孵育二抗结束前1 min,在避光条件下加入适量碘化丙碇(PI)继续置于密闭遮光的盒子内于37 ℃孵箱中孵育15 min,进行染核;染核完成后,在避光条件下用预冷的PBS洗涤3遍,每次15 min,以将FITC标记的二抗和染核的PI完全清洗干净。最后1次洗涤完成后,在共聚焦培养皿中加上适量的PBS后用共聚焦显微镜进行检测。
1.2.7RT-PCR检测BMP-2的表达细胞培养至第28天(第4代细胞长满),采用Trizol一步法提取细胞总RNA,行RT-PCR反应。PCR反应体系:总体积50 μL,包括:Realtime PCR MasterMix 25 μL,引物各2 μL,cDNA模板5 μL,去DEPC水16 μL。反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃15 s,60 ℃ 1 min,50个循环。溶解曲线法分析产物特异性。通过Rotor-Gene 3000软件运用ΔΔCt法分析OCN mRNA的表达。各组OCN Ct值与管家基因(GAPDH)Ct值之差为ΔCt值,B、C组与A组之间ΔCt值的差为ΔΔCt,基因表达的Fold chang = 2(-ΔΔCt),以比值作统计学处理。引物由北京博麦德生物技术公司合成,序列:GAPDH:上游引物 5′-TGC TGA GTA TGT CGT GGA G-3′,下游引物 5′-GTC TTC TGA GTG GCA GTG AT-3′; BMP-2:上游引物5′-AAG GCA CCC TTT GTA GTG TGT GG-3′,下游引物5′-CAT GCC TTA GGG ATT TTG GA-3′。
1.2.8蛋白印迹法(Western blot)分析BMP-2的表达水平提取第4代细胞总蛋白,喹啉甲酸(BCA)法测定蛋白浓度,根据测得的蛋白含量,计算含30 μg蛋白的溶液体积即为上样量,常规电泳及转膜后,将PVDF膜在TBST中漂洗3次,每次10 min,然后移至含有BSA的平皿中室温摇动封闭2 h,封闭结束后将膜与BMP-2抗体孵育,4 ℃过夜。次日加入二抗(1∶1 000稀释)稀释液中,37 ℃摇床孵育2 h,用TBST缓冲液洗膜后,加入适量BCIP/NBT显色液在避光环境下进行显色。待蛋白条带清晰后立刻取出PVDF膜,置于清水中终止显色。
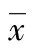
2 结 果
2.1骨密度检测结果各组第4腰椎骨密度:OVX+V组骨密度显著低于Sham组和OVX+SR组(P<0.05),OVX+SR组显著低于Sham组(P<0.05),见表1。
2.2生物力学检测结果经压缩实验分析,OVX+V组最大载荷显著低于OVX+SR组(P<0.05),OVX+SR组最大载荷显著低于Sham组(P<0.05);弹性模量:OVX+V组弹性模量显著低于Sham组和OVX+SR组(P<0.05),Sham组和OVX+SR组比较差异无统计学意义(P>0.05),见表1。
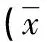
表1 骨密度及生物力学检测结果±s)
a:P<0.05,与Sham组比较;b:P<0.05,与OVX+V组比较。
2.3细胞培养结果第1天悬浮细胞较多,24 h换液后去除大部分悬浮细胞,并有少数细胞贴壁生长,逐渐伸角变形。随培养时间延长和传代,细胞形态由典型梭形或多角形的成纤维细胞样生长,逐渐变为三角形或多边形,且形体逐渐变大,传至第4代时可见有细胞外基质分泌。见图1。
2.4激光共聚焦检测结果细胞培养25 d,各组细胞经共聚焦显微镜检测,BMP-2由FITC标记为绿色荧光,PI标记核为红色荧光,BMP-2在胞质和胞核均有表达,各组间比较无明显差异。见图2。
2.5RT-PCR检测结果Sham组设定为1,OVX+V组1.07±0.24,OVX+SR组1.20±0.40,各组BMP-2 mRNA表达水平差异无统计学意义(P>0.05)。

A:Sham组;B:OVX+V组;C:OVX+SR组。
图1第4代骨髓基质干细胞(×100)

A:Sham组;B:OVX+V组;C:OVX+SR组。
图2激光共聚焦观察BMP-2的表达分布 (×100)

A:Sham组;B:OVX+V组;C:OVX+SR组。
图3Western blot检测BMP-2表达
2.6Western blot 检测结果Sham组0.75±0.16,OVX+V组0.83±0.16,OVX+SR组0.69±0.17,经与内参GAPDH作比后,各组BMP-2表达水平差异无统计学意义(P>0.05)。
2.7von kossa染色经von kossa染色证实,各组细胞培养至35 d,细胞外基质均具有矿化能力,着黑色结节,各组钙化点数量及大小无明显差别。

A:Sham组;B:OVX+V组;C:OVX+SR组。
图4细胞培养32 d von kossa染色结果(×100)
3 讨 论
去势手术建立大鼠骨质疏松模型是目前模拟人类绝经后骨质疏松的最为常用且普遍认可的动物模型[8-10]。该模型卵巢切除后导致雌激素突然衰退,诱使骨转换率增高,而且骨吸收活性大于骨形成能力,导致机体骨量和骨质量的下降,这些改变和表现都类似于人类女性绝经后骨质疏松的病理进程。而通过进一步研究证实,以雌激素替代治疗该模型大鼠,可抑制其骨量丢失,这也与临床试验中绝经后骨质疏松症女性患者接受雌激素替代治疗的表现相吻合。本研究骨密度检测和生物力学分析结果提示,3个月龄大鼠切除双侧卵巢后8周可成功建立大鼠骨质疏松模型。
SR因具有促进骨形成与抑制骨吸收双重作用而备受关注。研究证实,SR可以促进前成骨细胞的分化,增加成骨细胞的功能活性,促进基质分泌和矿化;与此同时,SR可以抑制破骨细胞分化和破骨细胞活性并刺激破骨细胞凋亡[2-5]。本研究证实,SR干预3个月可显著阻止卵巢切除大鼠骨量的丢失,但与健康大鼠相比,其骨密度仍未恢复至正常水平,一方面可能与该剂量下SR药效有限有关,另一方面,为更好模拟人类治疗选择时机,本研究设计药物干预时间为手术后8周,并未选择术后立即给药,干预时间较造模时间滞后也是原因之一。
BMSCs在特定诱导条件下可向多种细胞分化,并表现出一定的特异性生物学行为或表达相关基因。细胞外基质矿化能力的出现是成骨细胞的特异性生物学行为之一。BMPs是转化生长因子超家族成员之一,作为BMPs成员之一,BMP-2是公认的BMSCs成骨分化的关键蛋白。为全面探讨SR对该模型BMSCs成骨分化过程中BMP-2的影响,本研究采用免疫荧光标记并激光共聚焦显微镜、RT-PCR和Western blot技术多层次多角度分析了BMP-2的分布和表达水平。结果发现SR体内干预该模型3个月,并未显著影响BMP-2的表达水平,而通过对BMSCs成骨诱导分化第4代细胞的细胞外基质钙化能力的分析,该模型BMSCs体外分化能力与健康大鼠并无明显差别,SR干预后同样没有显著影响。以往有研究证实,双侧卵巢切除大鼠BMSCs的成骨分化能力会受到一定程度抑制[11]。作者分析,造成结果不同的原因可能是本研究检测时间点较晚,在体刺激经体外多次传代培养后效应减弱,且检测指标时间点单一,难以全面反映其表达水平的变化和差异。
综上所述,本研究证实SR可有效阻止卵巢切除大鼠骨量丢失和骨质量下降,但在本研究选择的观测时间点,体内干预对该模型BMSCs的体外分化能力及BMP-2的表达水平无显著影响,SR对该模型的干预机制是否与调控BMSCs的成骨分化有关,尚有待进一步研究。
[1]Tian FM,Zhang L,Zhao HY,et al.An increase in the incidence of hip fractures in Tangshan,China [J].Osteoporos Int,2014,25(4):1321-1325.
[2]Deeks ED,Dhillon S.Strontium ranelate:a review of its use in the treatment of postmenopausal osteoporosis [J].Drugs,2010,70(6):733-759.
[3]彭亦良,吴雪辉,张彦,等.雷奈酸锶治疗原发性骨质疏松症慢性腰背痛的前瞻性随机双盲对照研究[J].中国骨质疏松杂志,2013,19(12):1269-1272.
[4]马育林,袁妙兰,濮先明,等.雷奈酸锶对小榄地区老年妇女骨质疏松症患者的疗效及安全性[J].中国骨质疏松杂志,2014,20(1):62-66.
[5]郭华杰,范准,孙伟力,等.锶制剂治疗骨质疏松的临床研究进展[J].中国医药指南,2013,11(8):455-458.
[6]Kagami H,Agata H,Tojo A.Bone marrow stromal cells (bone marrow-derived multipotent mesenchymal stromal cells) for bone tissue engineering:basic science to clinical translation[J].Int J Biochem Cell Biol,2011,43(3):286-289.
[7]Al-Nbaheen M,Vishnubalaji R,Ali D,et al.Human stromal (mesenchymal) stem cells from bone marrow,adipose tissue and skin exhibit differences in molecular phenotype and differentiation potential[J].Stem Cell Rev,2013,9(1):32-43.
[8]Liu J,Wang Y,Song S,et al.Combined cral administration of bovine collagen peptides with calcium citrate inhibits bone loss in ovariectomized rats[J].PLoS One,2015,10(8):e0135019.
[9]Ma J,Ma Y,Liu X,et al.Gambogic acid inhibits osteoclast formation and ovariectomy-induced osteoporosis by suppressing the JNK,p38 and Akt signalling pathways[J].Biochem J,2015,469(3):399-408.
[10]许大勇.阿仑膦酸钠联合辛伐他汀对雌性去势大鼠骨质疏松的影响[J].中国老年学杂志,2015,35(13):3542-3543.
[11]Wei N,Yu Y,Schmidt T,et al.Effects of glucocorticoid receptor antagonist,RU486,on the proliferative and differentiation capabilities of bone marrow mesenchymal stromal cells in ovariectomized rats[J].J Orthop Res,2013,31(5):760-767.
Effects of strontium ranelate on the osteogenic differentiation and expression level of BMP-2 in BMSCs from ovariectomized rat
Liu Xiaopo1,Feng Yunbo1,Li Xiaoli2,Cao Guolong1,Zhang Pei3
(1.DepartmentofOrthopaedic;2.DepartmentofGeriatrics;3.DepartmentofNeurology,TangshanWorkers′Hospital,Tangshan,Hebei063000,China)
ObjectiveTo reveal the effects of strontium ranelate on the osteogenic differentiation and expression level of BMP-2 in BMSCs from ovariectomized rat.MethodsA total of 24 SD rats were randomly divided into 3 groups of 8 animals in each:Sham group (n=8),the other 16 rats were subjected to ovariectomized(OVX) groups,8 weeks after ovariectomy operation,OVX rats were administered with strontium ranelate (0.9 g·kg-1·d-1,OVX+SR) or vehicle as control(OVX+V),all rats were sacrificed 3 months later.The bone mineral density and biomechanical properties were analyzed in 4th lumbar vertebrae.Bone marrow cells were harvested and cultured in vitro in osteogenic-differentiation induced medium,the expression and cellular distribution of bone morphometric protein-2 were analyzed by confocal microscope on 25th day,realtime PCR and Western blot were used to assess the expression levels of BMP-2 on 28th day,von kossa staining was performed on 32th day to observe the extracellular minerlization.Results(1)BMD:OVX rats showed markedly decreased BMD comparing to Sham and OVX+SR group(P<0.05).(2)Biomechanical test:The maximal load in OVX+V group was significantly lower than OVX+SR group(P<0.05),and the maximal load in OVX+SR group was significantly lower than Sham group(P<0.05).Elastic modulus in OVX+V group was significantly lower than Sham and OVX+SR groups.(3)No significant difference between any two groups were found of the distribution of BMP-2 by confocal microscope(P>0.05),similar results were found in real-time PCR and Western blot analysis for the expression levels of BMP-2,as well as the detection of extracellular matrix mineralization by von kossa staining.ConclusionStrontium ranelate could partially prevent the bone loss and the deterioration of the biomechanical properties in OVX rat,but could not affect the osteogenic differentiation and expression level of BMP-2 in BMSCs.
ovariectomy;osteoporosis;bone density;strontium ranelate;BMSCs;BMP-2
刘小坡(1980-),主治医师,硕士,主要从事骨质疏松的研究与治疗。
论著·基础研究doi:10.3969/j.issn.1671-8348.2016.26.009
R332
A
1671-8348(2016)26-3627-04
2016-02-22
2016-05-26)
