水飞蓟素保护肾小球内皮细胞氧化损伤的效应与SIRT1及腺苷酸活化蛋白激酶α的作用机制
2016-10-31郝传铮陆芳芳
郝传铮 魏 利 赵 旭 陆芳芳 胡 平
(南通大学附属医院中医科,江苏 南通 226001)
水飞蓟素保护肾小球内皮细胞氧化损伤的效应与SIRT1及腺苷酸活化蛋白激酶α的作用机制
郝传铮魏利1赵旭陆芳芳胡平
(南通大学附属医院中医科,江苏南通226001)
目的研究水飞蓟素对肾小球内皮细胞氧化损伤的保护作用及SIRT1和腺苷酸活化蛋白激酶(AMPK)α在其中的作用机制。方法使用1×105nmol/L H2O2处理肾小球内皮细胞,构建氧化应激细胞模型。MTT实验法检测水飞蓟素对氧化应激造成的肾小球内皮细胞损伤的影响。实时定量RT-PCR法测定水飞蓟素对氧化应激损伤的肾小球内皮细胞SIRT1和AMPKα mRNA水平的影响。Western 印迹法测定水飞蓟素对氧化应激损伤的肾小球内皮细胞SIRT1,AMPK和AMPKα磷酸化蛋白水平的影响。结果1×105nmol/L H2O2处理肾小球内皮细胞后,细胞存活率显著降低,而1 μg/ml和5 μg/ml的水飞蓟素处理可以显著提高细胞存活率。实时定量RT-PCR结果显示,5 μg/ml的水飞蓟素处理显著提高了肾小球内皮细胞SIRT1 mRNA水平,而对AMPKα mRNA水平无显著影响。Western 印迹结果显示,H2O2处理后,细胞的SIRT1蛋白水平和AMPKα磷酸化蛋白水平未出现显著变化,但AMPKα蛋白水平显著降低。1 μg/ml和5 μg/ml的水飞蓟素处理显著提高了细胞SIRT1蛋白水平和AMPKα磷酸化蛋白水平;H2O2处理后细胞的AMPKα蛋白水平显著降低,而1 μg/ml和5 μg/ml的水飞蓟素处理显著提高了AMPKα蛋白水平,和对照组无显著差异。结论水飞蓟素可能通过调节细胞内SIRT1及AMPKα蛋白的表达及AMPKα磷酸化发挥抗氧化损伤作用而保护肾小球内皮细胞。
水飞蓟素;肾小球内皮细胞;氧化应激;SIRT1;AMPKα
由于Sirtuin具有抑制基因转录的功能,因此又称为沉默基因同源蛋白(SIR)〔1〕,其中SIRT1是目前研究的热点。水飞蓟素可以通过激活SIRT1发挥其对紫外线造成的A375-S2 细胞凋亡的保护作用〔2〕。此外,腺苷酸活化蛋白激酶(AMPK)是“细胞能量调节器”,作为一个重要的信号通路,参与细胞蛋白质合成、机体炎症反应和氧化应激等过程〔3〕。由于它和SIRT1存在复杂的调控关系,它是否参与SIRT1保护肾脏的氧化应激也值得深入探讨。水飞蓟素是从菊科植物水飞蓟种子中提取的一类黄酮木脂素类成分,主要成分有水飞蓟宾、异水飞蓟宾、水飞蓟宁、水飞蓟亭等〔4〕。研究发现水飞蓟素具有抗肿瘤、抗炎、降血脂、治疗糖尿病等用途,其机制可能与抗氧化有关〔5〕。本研究以水飞蓟素为研究对象,观察它对肾小球内皮细胞氧化损伤的保护效应,并探索SIRT1和AMPKα在其中的作用机制。
1 材料与方法
1.1细胞株药物及试剂小鼠肾小球内皮细胞株。DMEM培养基及胎牛血清购自Gibco公司。水飞蓟素、MTT试剂盒购自上海生工,总RNA快速提取试剂盒、逆转录试剂盒和定量PCR SYBR Green Master Mix均购自TAKARA公司。蛋白裂解RIPA裂解液、BCA蛋白浓度测定试剂盒和蛋白上样缓冲液均购自生工生物,SDS-PAGE配胶溶液购自碧云天公司。PVDF膜和ECL化学发光液购自Mippore公司。SIRT1一抗:β-actin购自Proteintech公司,SIRT1抗体,AMPKα和p-AMPKα(T172)购自CST公司。二抗:羊抗鼠IgG(H+L)和羊抗兔IgG(H+L)购自Jackson公司。
1.2仪器及耗材定量PCR仪为AB公司ViiA7 Real-Time PCR System。相关耗材(Tip头、EP管等)购自Thermal Scientific Fisher公司,均为无RNase、DNase和无热源的分子生物学耗材。蛋白电泳仪购自Bio-Rad公司,酶标仪(SPECTRA max Plus 384)购自Molecular Devices公司。CCD成像系统:Bio-Rad公司。台式高速冷冻离心机:H1650R,上海卢湘仪。台式低速离心机:TDZ6B-WS,上海卢湘仪。
1.3细胞培养及水飞蓟素处理将胎牛血清和DMEM按1∶9的比例配制成完全培养基用于培养小鼠肾小球内皮细胞,将小鼠肾小球内皮细胞置于37°C,5%CO2的培养箱中进行培养。3 d传代一次,在显微镜下观察,细胞呈多角形或长梭形,核淡,胞膜明显,细胞呈单层。取第3代细胞供实验用。水飞蓟素处理方法:①细胞传至三代,接6孔板,每孔种相同数量的细胞,每孔细胞数量是1×106个。②培养24 h,待细胞贴壁。③构建氧化应激细胞模型,1×105nmol/L过氧化氢溶液处理肾小球细胞,设置对照组,处理12 h。④移去培养基,PBS洗两遍。⑤加入新鲜培养基。⑥水飞蓟素溶于DMSO,分别用1 μg/ml和5 μg/ml浓度的水飞蓟素处理细胞,同时对照组和过氧化氢模型组添加等量的DMSO,控制DMSO终浓度为0.1%。⑦细胞培养24 h。⑧PBS洗两遍,胰酶消化下细胞,收取细胞,PBS洗3遍。
1.4MTT比色法检测水飞蓟素对氧化应激造成的肾小球损伤的影响将细胞传至三代,接板,每孔细胞数量是8×104个。继续将细胞培养24 h,用1×105nmol/L H2O2刺激12 h,PBS洗两次,换成给药完全培养基。培养24 h后,进行MTT实验。向各孔细胞加入20 μl MTT(5 g/L),继续培养4 h,弃去培养液,加入150 μl DMSO溶液,室温下摇床震荡10 min,使结晶物充分溶解后,用酶标仪测定490 nm波长吸光度A490。计算细胞存活率。
1.5实时定量RT-PCR法检测水飞蓟素对氧化应激损伤的肾小球内皮细胞SIRT1和AMPKα mRNA水平定量PCR引物,均合成于生工生物(上海)股份有限公司。Trizol法提取细胞总RNA,核酸蛋白定量检测仪测定RNA浓度,94℃预变性5 min,94℃变性30 s,55℃ 退火30 s,72℃延伸45 s,30个循环后,72℃延伸10 min引物,降至4℃ 反应结束,同时获取荧光,共40个循环,每组重复6次,反应结束后行产物的熔解曲线分析,以GAPDH为内参行结果分析。引物序列:SIRT1反义链5′-ATG GAC TCC TCA CTA ATG GCT TTC-3′,正义链5′-GGTGGAGGAATTGTTTCTGGTAA-3′;AMPK反义链5′-GGCACCCTCACATCATCAAA-3′,正义链5′-TTC GTCCAACCTTCCATTTT-3′;β-actin反义链5′- CCA CAG CTG AGA GGG AAA TC-3′,正义链5′- AAGGAAGGCTGGAAAAGAGC-3′。
1.6Western 印迹法测定各组细胞SIRT1及AMPKα磷酸化蛋白水平的表达药物处理同上。每瓶细胞加2 ml 4℃预冷的PBS,平放轻轻摇动1 min洗涤细胞,然后弃去洗液。用胰酶消化贴壁细胞,并收集至备用的细胞培养液中。4℃离心5 min收集细胞。PBS洗涤一次,吸除上清后加1 ml PBS重悬,将细胞转移到1.5 ml离心管中,4℃离心5 min收集细胞,吸除上清。按1 ml裂解液加10 μl PMSF(100 mmol/L),混合均匀。每瓶细胞加100 μl含PMSF的裂解液,4℃裂解30 min。裂解完后,于4℃下12 000 r/min离心10 min,吸取上清,BCA法测定蛋白浓度。凝胶电泳分离蛋白,电压110 V,加入5×上样缓冲液混匀,沸水中煮沸5 min,迅速冰浴中冷却,上样量为每泳道30 μg;25 mA恒流电泳至溴酚蓝跑完浓缩胶层,时间大约为30 min。分离胶电泳电流为30 mA。200 mA稳流电转移,根据所转蛋白分子量,约1 min/kD。取出PVDF膜,去离子水洗涤。将PVDF膜浸入含5%脱脂奶粉或牛血清白蛋白的封闭液中,置摇床上缓慢摇动,室温封闭1 h。取出已封闭的PVDF膜,浸于1× TBST缓冲液中,于摇床上缓慢洗涤5 min。然后移入含有一抗〔β-actin购自Proteintech公司,SIRT1抗体自备,AMPKα和p-AMPKα(T172)购自CST公司〕的小袋中,4℃孵育过夜。取出PVDF膜,浸于1×TBST缓冲液中,于摇床上缓慢洗涤3次,每次10 min。将PVDF膜转移到含二抗(购自Jackson公司,稀释1 000倍)的玻璃平皿中,于室温摇床上孵育1 h。然后将PVDF膜浸于1×TBST缓冲液中,于摇床上缓慢洗涤3次,每次10 min。用ECL化学发光显影法进行曝光显影,并用Bin软件进行图像灰度分析。
1.7统计学方法采用SPSS17.0统计软件进行单因素方差分析,两两比较采用LSD检验。
2 结 果
2.1水飞蓟素对肾小球内皮细胞的活力的影响模型组为经过双氧水处理的细胞,其活力显著下降(60.835%)和正常对照组相比差异显著(95.52%,P<0.01)。和模型组相比,5 μg/ml和1 μg/ml的水飞蓟素处理皆显著提高了细胞活力(78.081%,69.705%,P<0.05),而0.1 μg/ml的水飞蓟素(68.11%)则未能明显提高细胞存活率,说明水飞蓟素对氧化损伤后细胞的活力影响呈剂量相关关系。
2.2水飞蓟素对氧化应激损伤的肾小球内皮细胞SIRT1 mRNA水平的影响经过双氧水处理的细胞,其SIRT1 mRNA的相对表达量出现升高。和模型组(1.139)相比,5 μg/ml的水飞蓟素处理显著提高了SIRT1 mRNA的相对表达量(1.712,P<0.05),而1 μg/ml(1.052)和 0.1 μg/ml(1.012)的水飞蓟素则未能明显改变SIRT1 mRNA的相对表达量。
2.3水飞蓟素对氧化应激损伤的肾小球内皮细胞AMPKα mRNA水平的影响经过双氧水处理的细胞,其AMPKα mRNA的相对表达量未出现显著变化。和模型组(0.908)相比,各个剂量的水飞蓟素处理皆未能明显改变AMPKα mRNA的相对表达量(1.000,1.050,0.979)。
2.4水飞蓟素对氧化应激损伤的肾小球内皮细胞SIRT1蛋白水平的影响经过双氧水处理的细胞,其SIRT1 蛋白的表达量未出现显著变化。和模型组相比,5 μg/ml和1 μg/ml的水飞蓟素处理显著提高了SIRT1 蛋白的表达量(P<0.05),而1 μg/ml的水飞蓟素则未能明显改变SIRT1 蛋白的表达量。见图1。
2.5水飞蓟素对氧化应激损伤的肾小球内皮细胞AMPKα蛋白水平和AMPKα磷酸化水平的影响经过双氧水处理的细胞,其AMPKα蛋白和AMPKα磷酸化未出现显著变化。和模型组相比,5 μg/ml和1 μg/ml的水飞蓟素处理显著提高了AMPKα磷酸化水平(P<0.05),而0.1 μg/ml的水飞蓟素则未能明显改变AMPKα磷酸化水平。5、1 μg/ml和0.1 μg/ml的水飞蓟素处理皆显著提高了AMPKα蛋白水平(P<0.05)。见图2。

图1 SIRT1蛋白的表达量
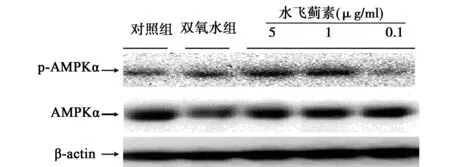
图2 AMPKα蛋白和AMPKα磷酸化的表达量
3 讨 论
年龄老化和能量过剩常导致氧化应激增加和机体的抗氧化功能下降,是引发肾脏病等多种慢性疾病的重要原因。肾脏内的活性氧(ROS)产生过多,超过机体的抗氧化能力,ROS和细胞内的大分子如脂质、蛋白质和DNA发生氧化反应,产生氧化损伤〔6〕。ROS是由氧激发的化学性质十分活泼的分子,是氧化应激的基础环节〔7〕。尽量减少ROS生成和清除过量的ROS是肾脏抗氧化应激的有效策略。然而,对于肾的氧化损伤目前并没有有效的治疗方法。因此,如果能找到一种安全、有效的药物来防治肾的氧化损伤,对人类健康具有重大意义。
人体本身存在强大的抗氧化系统,包括抗氧化酶超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)和一些小分子,如维生素C等〔8~11〕。在正常情况下,这些抗氧化酶和小分子可清除体内过剩自由基,保持氧化应激/抗氧化系统的平衡,保持内环境的稳定〔12〕。但是外界进入的ROS过多,或由于机体自身疾病,产生了过多的ROS时,机体的抗氧化作用被削弱,氧化应激/抗氧化系统发生失衡,就会引起氧化损伤〔13〕。本文显示了水飞蓟素对肾小球内皮细胞的氧化损伤的保护效应。
本文结果验证了水飞蓟素对SIRT1的影响及后者在水飞蓟素的保护作用中的可能作用。研究发现,SIRT1减少可加重氧化应激导致的肾脏损伤和肾脏的纤维化,而给予SIRT1激动剂可减轻由氧化应激引起的肾脏损伤,显示了SIRT1在保护肾脏氧化损伤方面的重要作用〔14,15〕。
研究发现,SIRT1可通过脱乙酰作用使细胞核中的组蛋白乙酰化水平下降,从而调节有关基因,如AMPKα的表达〔16〕。AMPK是细胞能量调节器作为一个重要的信号通路,参与细胞蛋白质合成、机体炎症反应和氧化应激等过程,在细胞保护机制中发挥了重要作用〔17〕。本文结果说明,水飞蓟素的保护效应的机制不是提高了AMPKα mRNA水平,而是激活了AMPKα 的蛋白表达和磷酸化。水飞蓟素提高了肾小球内皮细胞SIRT1 mRNA水平和蛋白水平,后者继而激活了AMPKα 的蛋白表达和磷酸化。 Suchankova等〔18〕研究发现,在高糖条件的作用下,HepG2细胞可以抑制SIRT1的活性,从而抑制AMPK的激活。另一项研究发现,若给予细胞SIRT1的激活剂SRT1720,AMPK也得到激活〔19〕。此外,Ajmo等〔20〕发现,SIRT1的激活剂白黎芦醇可以同时激活SIRT1和AMPK,进而抑制核转录因子甾体调节元件结合蛋白1的活性,有效减轻酒精性肝损伤。 对于SIRT1激活AMPK的机制,研究显示,SIRT1可通过使AMPK上游激酶LKB去乙酰化,从而激活AMPK〔21〕。本研究证实水飞蓟素可能通过调节细胞内SIRT1及AMPKα蛋白的表达及AMPKα磷酸化发挥抗氧化损伤的作用,为水飞蓟素在肾脏疾病方面的应用奠定了基础。
1Lee MJ,Feliers D,Mariappan MM.A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy〔J〕.Am J Physiol Renal Physiol,2007;292(2):617-27.
2Xu D,Chen M,Ren X,etal.Leonurine ameliorates LPS-induced acute kidney injury via suppressing ROS-mediated NF-κB signaling pathway〔J〕.Fitoterapia,2014;97C:148-55.
3Kalyanaraman B.Teaching the basics of redox biology to medical and graduate students:oxidants,antioxidants and disease mechanisms〔J〕.Redox Biol,2013;1(1):244-57.
4Kimura H.The physiological role of hydrogen sulfide and beyond〔J〕.Nitric Oxide,2014;41:4-10
5Zachara BA,Gromadzińska J,Wasowicz W,etal.Red blood cell and plasma glutathione peroxidase activities and selenium concentration in patients with chronic kidney disease:a review〔J〕.Acta Biochim Pol,2006;53(4):663-77.
7Li LH,Wu LJ,Tashiro SI,etal.Activation of the SIRT1 pathway and modulation of the cell cycle were involved in silymarin′s protection against UV-induced A375-S2 cell apoptosis〔J〕.J Asian Nat Prod Res,2007;9(3-5):245-52.
8Sung CC,Hsu YC,Chen CC,etal.Oxidative stress and nucleic acid oxidation in patients with chronic kidney disease〔J〕.Oxid Med Cell Longev,2013;(2012):301982.
9Akyol S,Ugurcu V,Altuntas A,etal.Caffeic acid phenethyl ester as a protective agent against nephrotoxicity and/or oxidative kidney damage:a detailed systematic review〔J〕.Scientific World J,2014;(2013):561971.
10Schieber M,Chandel NS.ROS function in redox signaling and oxidative stress〔J〕.Curr Biol,2014;24(10):R453-62.
11He W,Wang Y,Zhang MZ,etal.Sirt1 activation protects the mouse renal medulla from oxidative injury〔J〕.J Clin Invest,2010;120(4):1056-68.
12Huang XZ,Wen D,Zhang M,etal.Sirt1 activation ameliorates renal fibrosis by inhibiting the TGF-β/Smad3 pathway〔J〕.J Cell Biochem,2014;115(5):996-1005.
13Lai CS,Tsai ML,Badmaev V,etal.Xanthigen suppresses preadipocyte differentiation and adipogenesis through down-regulation of PPARγ and C/EBPs and modulation of SIRT-1,AMPK,and FoxO pathways〔J〕.J Agric Food Chem,2012;60(4):1094-101.
14刘洪玲.水飞蓟素的化学成分及药理作用研究进展〔J〕.中国民族民间医药,2008;17(7):23-5.
15Palipoch S.A review of oxidative stress in acute kidney injury:protective role of medicinal plants-derived antioxidants〔J〕.Afr J Tradit Complement Altern Med,2013;10(4):88-93.
16石玉生,张艳,马金龙,等.水飞蓟素对UVB致人角质形成细胞光老化保护作用的研究 〔J〕.中医药信息,2013;30(6):36-9.
17陈芳,刘东波.中药活性成分降血糖作用机制研究进展〔J〕.中医药学报,2012;40(4):123-6.
18Suchankova G,Nelson LE,Gerhart-Hines Z,etal.Concurrent regulation of AMP-activated protein kinase and SIRT1 in mammalian cells〔J〕.Biochem Biophys Res Commun,2009;378(4):836-41.
19Feige JN,Lagouge M,Canto C,etal.Specific SIRT1 activation mimics low energy levels and protects against diet-induced metabolic disorders by enhancing fat oxidation〔J〕.Cell Metab,2008;8(5):347-58.
20Ajmo JM,Liang X,Rogers CQ,etal.Resveratrol alleviates alcoholic fatty liver in mice〔J〕.Am J Physiol Gastrointest Liver Physiol,2008;295(4):G833-42.
21Lan F,Cacicedo JM,Ruderman N,etal.SIRT1 modulation of the acetylation status,cytosolic localization,and activity of LKB1.Possible role in AMP-activated protein kinase activation〔J〕.J Biol Chem,2008;283(41):27628-35.
〔2014-12-11修回〕
(编辑苑云杰/曹梦园)
南通市社会事业科技创新与示范计划(No.HS2012027)
郝传铮(1960-),女,硕士,主任医师,硕士生导师,主要从事中医肾病、老年病防治研究。
R285.5
A
1005-9202(2016)18-4430-03;doi:10.3969/j.issn.1005-9202.2016.18.012
1南通大学医学院13级研究生
