一种测定植物甾醇的高灵敏度衍生化HPLC-MS/MS方法
2016-10-25孙琪,陈帆
孙 琪,陈 帆
(温州大学 化学与材料工程学院,浙江 温州 325035)
分析测试新方法(169~178)
一种测定植物甾醇的高灵敏度衍生化HPLC-MS/MS方法
孙琪,陈帆
(温州大学 化学与材料工程学院,浙江 温州325035)
建立以丹磺酰肼为柱前衍生试剂,采用Agilent Poroshell 120 EC-C18(50 mm×3.0 mm,2.7 μm)反相色谱柱,甲醇-水(体积比为99∶1)为流动相,流速为 0.3 mL/min,进样量为10 μL,电喷雾电离源,选择反应监测(SRM)方式正离子检测,测定豆甾醇、β-谷甾醇、岩藻甾醇、麦角甾醇的柱前衍生化高效液相色谱串联质谱法. 同时分析测定羊栖菜、海带、紫菜中的甾醇种类及含量. 以胆固醇为内标物,采用内标工作曲线法定量,各甾醇线性范围在0.05~100 μg/mL之间,相关系数在0.990 3~0.998 1之间,检出限(LODs)在0.2~20 ng/mL之间,定量限(LOQs)在0.667~66.7 ng/mL 之间,甾醇类物质灵敏度比高效液相色谱法提高25~500倍.
植物甾醇;高效液相色谱串联质谱法;柱前衍生化;选择反应监测
植物甾醇是一类天然活性物质的总称. 虽然它们在植物性食物中含量很少,却具有较高的食用和药用价值. 药理学研究表明,植物甾醇能有效降低胆固醇,具有抗炎、抗癌、抗氧化的功能,同时还具备调节免疫系统、调节人体甾体激素等作用. 有些甾醇也是维生素D、甾族化合物以及多种激素合成的前体物质[1-6]. 因此,对植物甾醇分析研究具有非常重要的现实意义.
植物甾醇的定量分析方法主要有毛地黄皂苷法、气相色谱法、气相色谱质谱联用、高效液相色谱法、高效液相色谱质谱联用法、高速逆流色谱法等[7-14]. 最早期方法多为毛地黄皂苷法,但因其价格贵、分析耗时、操作繁琐、多干扰因素而逐渐被淘汰. 高效液相色谱法应用较为广泛,但是单一的色谱法有时定性并不完全准确,因此色谱-质谱联用的方法刚好弥补这一缺点.
就目前报道的文献中,鲜有衍生化液相色谱串联质谱法分析植物甾醇. 液相色谱-质谱联用的电喷雾电离(ESI)源远比气相色谱-质谱联用的化学电离(EI)源温和,更容易控制碎裂程度,产生准分子离子峰,方便获得分子结构信息. 因此本研究是一种将衍生与液质联用结合的方法. 首先采用较温和且适合天然产物的戴斯马丁(DMP)[15-16]氧化剂将甾醇氧化成酮,再用丹磺酰肼[17-18]与酮发生腙化反应,最后进样分析. 采用二级质谱,定性能力大大提高,因此液相色谱不必完全分离所有组分. 选择反应监测(SRM)模式提高选择性,大大节省分析时间. 衍生化反应[19]的目的是引入容易离子化的基团,使目标物的离子化效率增强,从而提高仪器检测的灵敏度. 因此,该方法的建立为植物甾醇以及具有相似结构的类固醇、维生素D2(VD2),维生素D3(VD3)等的分析研究提供理论依据.
1 试验部分
1.1仪器与试剂
Milli-Q超纯水处理系统(美国Millipore公司);LCQ DECA XP Plus液相色谱—质谱联用仪(Thermo Finnigan);KQ-250D型超声波清洗器(昆山市超声仪器有限公司);海尔超低温保存箱;FD-IC-50型冷冻干燥机(北京博医康实验仪器有限公司);高速万能粉碎机(上海启前电子科技有限公司);BUCHI Rotavapor R-215型旋转蒸发仪;AL106电子天平(梅特勒-托力多仪器有限公司);可调量程移液器(德国Eppendorf公司).
甲醇、乙醇(色谱纯,北京百灵威科技有限公司),其他试剂均为分析纯;水为超纯水(Milli-Q超纯水制备);丹磺酰肼(98%),戴斯马丁氧化剂,15wt%二氯甲烷溶液 (DMP),麦角甾醇(98%),豆甾醇(95%),β-谷甾醇(98%),岩藻甾醇(98%),胆固醇(98%) ,均购自北京百灵威科技有限公司;羊栖菜采摘自浙江温州洞头海域,紫菜、海带均为市售.
1.2仪器工作条件
高效液相色谱(HPLC)条件:Agilent Poroshell 120 EC-C48反相色谱柱(50 mm×3.0 mm,2.7 μm);流动相:甲醇-水(体积比为99∶1);柱温:室温;流速:0.3 mL/min;进样量:10 μL. 电喷雾离子源(ESI)条件:正离子模式,电喷雾电压为4 kV;加热毛细管温度为350 ℃;氮气(N2)压力为0.65 MPa;氦气(He)压力为0.25 MPa;鞘气流速20 arb;辅助气流速为5 arb.
1.3标准溶液的配制
称取0.005 g植物甾醇标准品和0.005 g胆固醇标准品,分别用二氯甲烷溶解并定容于10 mL容量瓶,摇匀,得质量浓度为0. 5 mg /mL植物甾醇储备液和0. 5 mg /mL胆固醇储备液.
1.4衍生化反应
用0. 5 mg /mL的植物甾醇标准储备液配制一系列浓度的甾醇标准工作液,每个浓度均含10 μL 0. 5 mg /mL的胆固醇储备液作为内标,加入6 μL DMP,35 ℃左右超声40 min,第一步氧化反应完毕. 反应液用N2吹干,加入150 μL丹磺酰肼衍生剂、6 μL对甲苯磺酸,40 ℃左右超声30 min,第二步反应完毕. 用甲醇稀释至1.0 mL,过0.22 μm滤膜后进样分析. 以麦角甾醇为例,植物甾醇衍生反应机理如图1、2所示.

图1 DMP氧化甾醇反应机理Fig.1 Reaction mechanism of phytosterol and DMP

图2 丹磺酰肼衍生甾酮[19]反应机理Fig.2 Dansyl hydrazine derivative reaction mechanism
1.5样品前处理
第一步氧化反应所用的戴斯马丁氧化剂具有较高选择性,较温和的反应条件,能直接有效地将仲醇氧化成酮,更适合天然产物的反应,并且反应后处理简单,不产生有毒有害物质,因此是一种环境友好的氧化剂. 丹磺酰肼与羰基的腙化反应条件简单、快速,反应过程会发生贝克曼重排,这些中间产物也会提高质谱的离子化效率,增加灵敏度.
1.6羊栖菜样品溶液的制备
羊栖菜用蒸馏水洗净,置于超低温冰箱冷冻24 h,冷冻干燥机干燥24 h,将干燥后的羊栖菜粉碎过筛,装瓶待用. 准确称取1.000 g羊栖菜粉末,50 ℃下用40 mL乙醇超声功率90 W提取90 min,减压抽滤,滤液于40 ℃下旋转蒸发至干. 向上述蒸干溶剂的茄形瓶中加KOH-C2H5OH溶液(2 mol/L,20 mL),60 ℃下皂化90 min. 皂化结束,溶液冷却至室温,旋转蒸发有机溶剂,然后向其中加10 mL水溶解,水相分别用10 mL正己烷萃取3次,取正己烷相合并,蒸干溶剂,用二氯甲烷定容10.00 mL,取100 μL按1.4所述进行衍生化反应,最后用甲醇定容1.00 mL,过0.22 μm微孔滤膜进样分析.
2 结果与讨论
2.1衍生化条件优化
2.1.1衍生剂体积的选择
丹磺酰肼与甾醇不会完全反应,同时由于第一步氧化剂剩余,因此需要过量衍生剂对甾醇衍生,尽可能定量转化,所以试验考察了衍生剂的体积分别为0.05、0.1、0.15、0.2、0.5 mL时,产物浓度的变化情况. 试验结果表明,随着衍生剂用量增加,产物浓度增加,当超过0.15 mL时,产物浓度不再增加,故选择衍生剂的体积0.15 mL. 衍生产物峰面积强度随衍生剂用量的变化趋势如图3所示.
2.1.2衍生化时间的选择
保持衍生温度和用量不变,在60 min内,考察时间对衍生效率的影响. 使用相同浓度的甾醇标准品混合液与衍生剂反应不同时间后测定,结果表明,反应30 min后,各甾醇衍生物峰面积达到最大且基本恒定,故选择衍生化时间为30 min. 衍生产物峰面积强度随衍生时间的变化趋势如图4所示.
2.1.3衍生化温度的选择
在20~60 ℃之间,考察温度对衍生效率的影响,结果如图5所示. 由图5可见,随着温度升高,各甾醇衍生物峰面积不断增大,当温度超过40 ℃,衍生效率明显降低,故选择40 ℃作为最佳衍生化温度.

图3 衍生剂体积对衍生化效率的影响Fig.3 Effect of derivative agent volume on efficiency of derivatization

图4 反应时间对衍生化效率的影响Fig.4 Effect of reaction time on efficiency of derivatization

图5 反应温度对衍生化效率的影响Fig.5 Effect of reaction temperature on efficiency of derivatization
2.2液质条件优化
2.2.1液相色谱条件
植物甾醇是一类低极性化合物,亲水性很差,通过查阅文献,考察100%甲醇作流动相,每种待测组分可在10 min内出峰,且峰型较优,各甾醇衍生物色谱图如图6所示. 但由于甲醇较强的洗脱能力使各组分不能较长保留使组分得不到较好分离,因此考察甲醇-水(体积比为99∶1) 作流动相,结果表明,甲醇-水能增加各组分保留值,各甾醇衍生物色谱图如图7所示. 由图7可见,分离较好,因此选择甲醇-水(体积比为99∶1)作为流动相. 本试验选用Agilent Poroshell 120 EC-C18(50 mm×3.0 mm,2.7 μm)反相色谱柱,短柱可以有效减少分析时间.
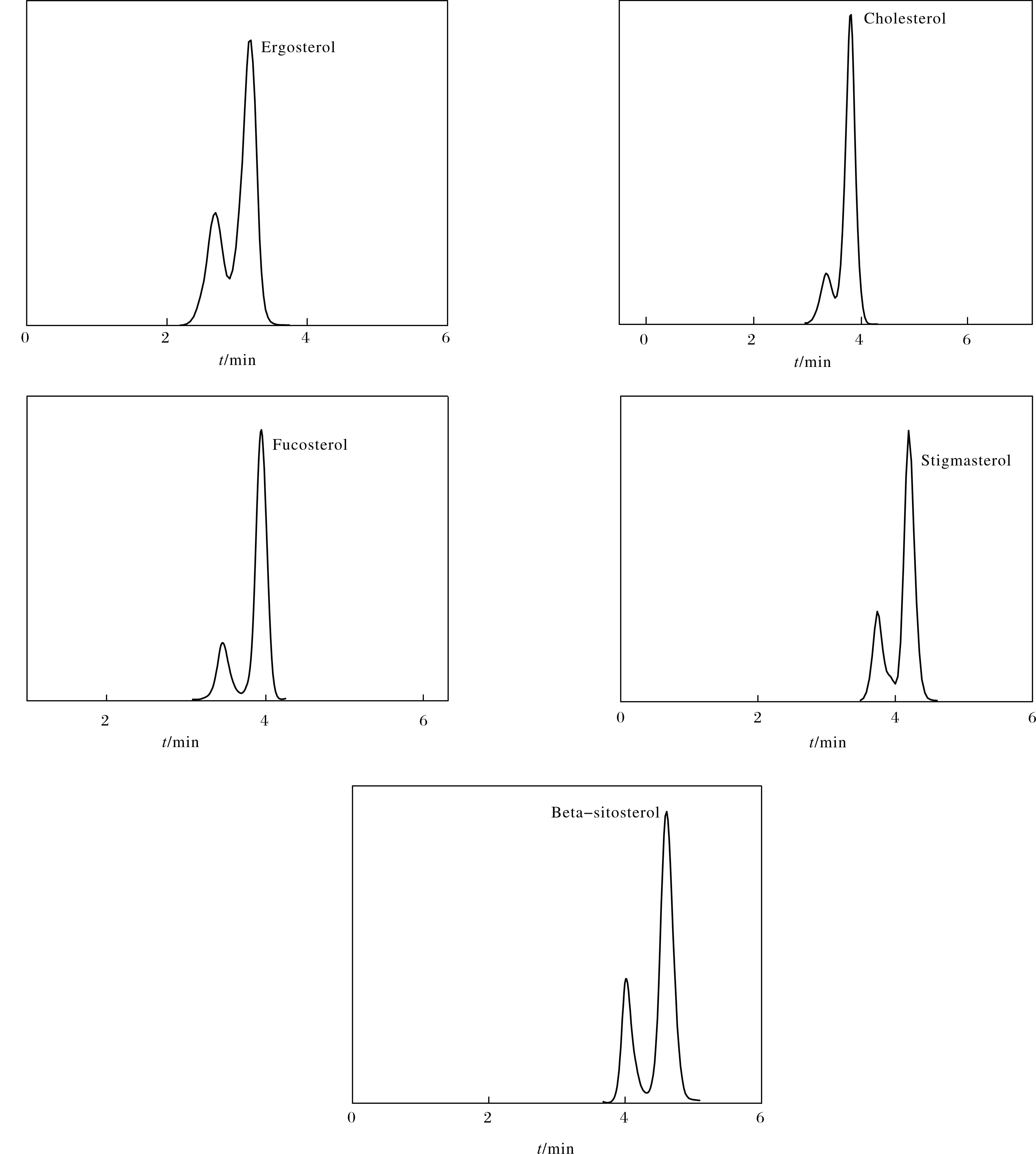
图6 100%甲醇分离甾醇衍生物的色谱图Fig.6 Chromatograms separated phytosterol derivatives by 100% methanol

图7 标准甾醇衍生物的SRM图Fig.7 SRM chromatograms of standard phytosterol derivatives
2.2.2质谱条件优化
在ESI源条件下,分别对待测甾醇标准衍生物做正、负离子模式下的全扫描分析,结果表明,各甾醇衍生物的最佳准分子离子峰均在正离子模式下产生. 在此基础上,进一步对母离子优化至最大响应,然后对相应子离子作全扫描分析,通过对碰撞能量的优化,使子离子丰度达到最优. 将二级质谱子离子峰作为最终定性定量的特征离子. 优化后的质谱参数如表1所列.
2.3方法比较
由于甾醇类物质属于极性很弱的化合物,直接进质谱几乎不离子化,因此在这种情况下对其进行定性定量分析就变得毫无意义. 文献报道对甾醇类物质的分析多采用高效液相色谱法[20]. 该法要求组分全部出峰,对于成分复杂的天然产物的分析不但浪费时间,而且定性不准. 取甾醇标准品配成一系列浓度的工作溶液进高效液相色谱分析,做系列标准曲线,结果如表2所列. 本试验中LODs(信噪比S/N=3)在5~100 ng/mL之间, LOQs(S/N=10)在16.7 ~ 333 ng/mL 之间. 柱前衍生化HPLC-ESI-MS/MS法与高效液相色谱法相比较,4种植物甾醇测定的灵敏度提高了25~500倍.

表1 甾醇质谱分析参数

表2 柱前衍生化HPLC-ESI-MS/MS法与高效液相色谱法比较
2.4标准植物甾醇衍生物的液质分析
按照前述植物甾醇衍生过程将标准品衍生化反应后,采用甲醇-水(体积比为99∶1)在25 min 内对5种甾醇衍生物作二级质谱的定性定量分析. 由于丹磺酰肼的衍生化产物存在同分异构现象(顺式和反式),因此二级质谱显示为双峰,如图7所示.
每一种甾醇衍生物母离子都会在一定的碰撞能量下产生对应的子离子峰,因此使用特定的子离子[M-C12H12NO2S]+作为对植物甾醇衍生物HPLC /SRM/MS 分析的特征离子. 结果表明:灵敏度和选择性大大提高,定性更准确. 各组分经液相色谱分离,质谱定性定量分析鉴定,如衍生后的麦角甾醇的准分子离子峰为640,使用能量碰撞诱导解离,得到406,即化合物相应的二级质谱子离子峰,其质谱图如图8所示.

图8 麦角甾醇衍生物的质谱图和碰撞诱导解离机理Fig.8 Typical product ion spectra from CID of [M]+ion for Ergosterol derivative and collision induced dissociation mechanism
2.5线性方程、检出限、定量限
将植物甾醇按1.3节所述衍生方法进行衍生化反应,在同样的液质条件下,分别进样分析. 以甾醇衍生物质量浓度(ρ,μg /mL) 为横坐标,衍生物与内标的峰面积比(Yi/YI) 为纵坐标,做线性回归分析. 植物甾醇衍生物在总进样质量浓度为0.05~100 μg /mL 时表现出较好的线性,相关系数在0. 990 3以上. 以3倍信噪比(S/N=3)计算检出限(LODs),10倍信噪比(S/N= 10)计算定量限LOQ,确定本试验的LODs在0.2~20 ng /mL之间,LOQs在0.667~66.7 ng/mL之间. 为考察方法重现性,分别对甾醇标准品进行日内和日间衍生化反应,最后进样分析,其相对标准偏差小于1.0%,表现出较好的重现性. 试验结果如表3、4所列.

表3 甾醇衍生物的线性回归方程、相关系数、检出限、定量限
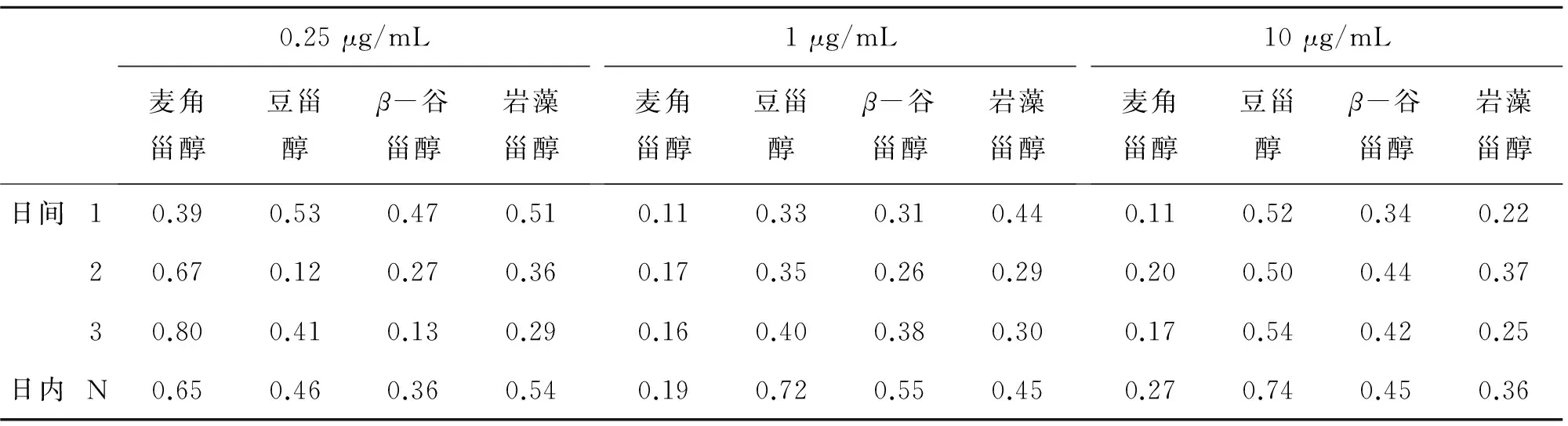
表4 植物甾醇标准品3种质量浓度日内和日间相对标准偏差(n=6)
2.6加标回收率
为考察该方法的准确度,进行了加标回收率试验. 称取18 份等量的羊栖菜粉末,分3组,进行高、中、低水平的加标试验,经提取、皂化、衍生化反应后,采用同样的液质联用条件进行测定. 计算回收率和相对标准偏差( RSD) ,得回收率在82.0% ~107.5%之间,精密度均小于2.0%,结果如表5所列.

表5 高、中、低3种质量浓度下的加标回收率
2.7实际样品测定
将海带、紫菜样品按1. 6 节冷冻干燥、粉碎过筛、提取、皂化,按1. 4 节衍生,平行做6个样,在1.2节的液质条件下进样分析3次. 以甾醇标准品衍生物二级质谱子离子的色谱保留时间做对照,判断海带、紫菜样品中植物甾醇的种类,羊栖菜、海带、紫菜中甾醇平均含量如表6所列. 由表6可知,岩藻甾醇在羊栖菜中含量最多,麦角甾醇、豆甾醇几乎不含,紫菜中这几种甾醇含量最少. 这也说明豆甾醇多存在谷物作物、植物油等物质中,藻类物质含量较少甚至没有. 故在羊栖菜、紫菜、海带研究中,羊栖菜的研究意义更大.
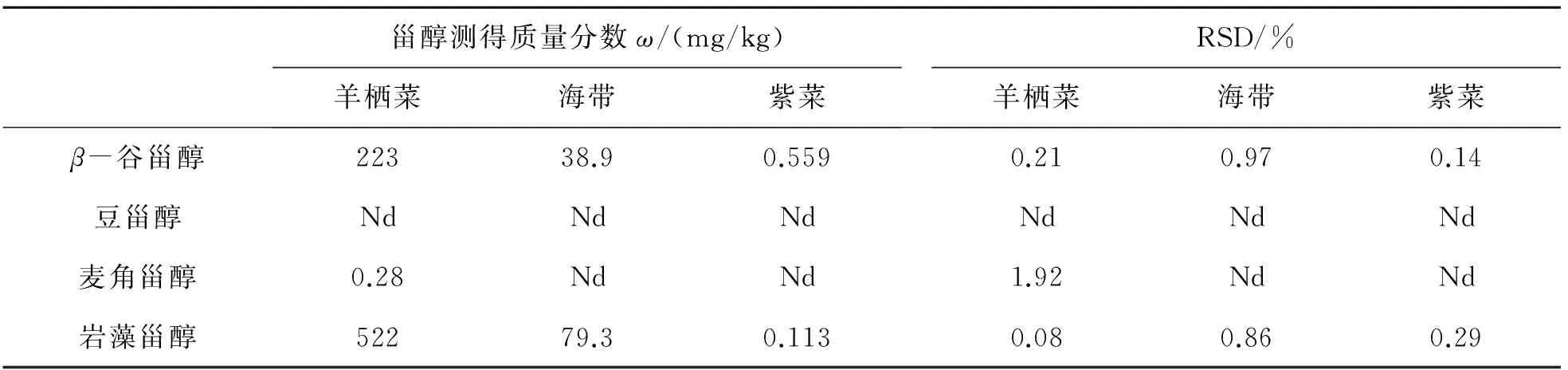
表6 海藻中甾醇的平均含量(n=6)
注:“Nd”为未检出.
3 结论
本试验选用温和的高碘氧化试剂DMP将植物甾醇氧化成酮,以丹磺酰肼作为柱前衍生化试剂,胆固醇为内标物,采用HPLC-ESI-MS/MS法测定了羊栖菜、海带、紫菜中的植物甾醇. 结果表明,羊栖菜中含有岩藻甾醇、β-谷甾醇及少量的麦角甾醇,其中岩藻甾醇含量最高;紫菜、海带中植物甾醇种类同羊栖菜类似,但是每种甾醇含量远远少于羊栖菜,故研究羊栖菜具有很大意义. 由于该方法采用丹磺酰肼作为柱前衍生化试剂,丹磺酰肼的叔氮极易离子化,大大增强了质谱信号,与高效液相色谱法相比,4种植物甾醇的测定灵敏度提高了25~500倍. 同时该方法还具有衍生化条件温和、产物无毒、灵敏度高、重现性良好等特点,为各类谷物、植物性食物、植物油等的分析研究提供参考依据.
[1]Liang Y T, Wong W T, Guan L, et al. Effect of phytosterols and their oxidation products on lipoprotein profiles and vascular function in hamster fed a high cholesterol diet[J].Atherosclerosis,2011,219((1):124-133.
[2]Alemany L, Laparra J M, Barberá, et al. Relative expression of cholesterol transport-related proteins and inflammation markers through the induction of 7-ketosterolmediated stress in Caco-2 cells[J]. Food and Chemical Toxicology, 2013, 56: 247-253.
[3]Valerio M, Awad A B.β-sitosterol down-regulates some proinflammatory signal transduction pathways by increasing the activity of tyrosine phosphatase SHP-1 in J774A.1 murine macrophages[J]. Int Immunopharmacol, 2011,11 (8):1012-1017.
[4]Loizou S, Lekakis I, Chrousos G P, et al.β-sitosterol exhibits anti-inflammatory activity in human aortic endothelial cells [J].Molecular nutrition & food research, 2010 (54): 551-558.
[5]Awad A B, Gan Y, Fink C S. Effect ofβ-sitosterol, a plant sterol, on growth, protein phosphatase 2A and phospholipid D in LNCaP cells[J]. Nutrition and Cancer, 2000, 36:74-78.
[6]Petter Nieminena, Anne-Mar Mustonen. Increased reproductive Success in the white American mink(Neovison vison)with chronic dietaryβ-sitosterol supplement[J]. Animal Reproduction Science, 2010, 119: 287-292.
[7]胡于鲁,刘银燕,谷月卿,等.重量法测定大豆甾醇的含量[J].白求恩医科大学学报,1995,21(l):99-100.
[8]颜鸿飞,李拥军,王美玲,等. 高效液相色谱-串联质谱法测定水果中残留的烯唑醇[J]. 分析测试技术与仪器,2012,18(4):204-207.
[9]黄可可,黄丽英,吴萍萍,等. 液相色谱-电喷雾电离/离子阱质谱法分析金线莲中3-吡啶甲醇[J]. 分析测试技术与仪器,2011, 17(3):4129-133.
[10]杨 飞,孙莹莹,李中皓,等.液液萃取结合分散固相萃取-液相色谱串联质谱检测食品包装纸中的4-氨基偶氮苯[J].分析测试技术与仪器,2016,22(2):74-79
[11]María Menéndez-Carreno, Diny Knol, Hans-Gerd Janssen. Development and validation of methodologies for the quantification of phytosterols and phytosterol oxidation products in cooked and baked food products[J]. Journal of Chromatography A, 2016, 1428:316-325.
[12]Bao-Ling Qi, Ping Liu, Qiu-Yi Wang,et al. Derivatization for liquid chromatography-mass spectrometry[J]. Trends in Analytical Chemistry,2014,59:121-132.
[13]Naoyuki Ishida. A method for simultaneous analysis of phytosterols and phytosterol esters in tobacco leaves using non aqueous reversed phase chromatography and atmospheric pressure chemical ionization mass spectrometry detector[J].Journal of Chromatography A Journal of Chromatography A,2014,1340:99-108.
[14]Xiao-Hua Xiao, Zhi-Quan Yuan, Gong-Ke Li. Preparation of phytosterols and phytol from edible marine algae by microwave-assisted extraction and high-speed counter-current chromatography[J].Separation and Purification Technology,2013,104:284-289.
[15]朱飞艳. 高碘试剂氧化法合成黄体酮的研究[D].南京理工大学,2009.
[16]Gilles Iacazio. Easy access to various natural keto polyunsaturated fatty acids and their corresponding racemic alcohols[J].Chemistry and Physics of Lipids,2003,125:115-121.
[17]Xin Liu, Yan Zhou, Haibin Chen,et al. Detection of carbonyl groups in triterpenoids by hydroxylamine hydrochloride derivatization using electrospray ionization mass spectrometry[J].Rapid communications in mass spectrometry,2008,22:1981-1992.
[18]Tatsuya Higashi, Shoujiro Ogawa. Chemical derivatization for enhancing sensitivity during LC/ESI-MS/MS quantification of steroids in biological samples: a review[J]. Journal of Steroid Biochemistry & Molecular Biology,2015,10:1-11.
[19]刘鑫. 低极性化合物的电喷雾质谱检测方法及几种中藏药材活性成分研究[D].中国科学院研究生院,2009.
[20]Suqin Shao, Marta Hernandez, John K G Kramer, et al. Ergosterol profiles, fatty acid composition, and antioxidant activities of button mushrooms as affected by tissue part and developmental stage[J]. J Agric Food Chem,2010, 58: 11616-11625.
A Highly Sensitive Method for Quantitative Analysis of Phytosterols by HPLC-MS/MS with Pre-Column Derivatization
SUN Qi, CHEN Fan
(CollegeofChemistryandMaterials,WenzhouUniversity,Wenzhou325035,ZhejiangChina)
A sensitive liquid chromatography-electrospray ionization-tandem mass spectrometry (LC-ESI-MS/MS) method for the determination of phytosterols in sargassum fusiforme has been developed and validated. Four kinds of phytosterols were derivatived by dansyl hydrazine and separated on a reversed-phase Agilent Poroshell 120 EC-C18 column(50 mm×3.0 mm, 2.7 μm) with a mobile phase of methanol-water (99∶1,V∶V) at a flow rate of 0.3 mL/min, and the injection volume was 10 μL. An electrospray ionization source was applied and operated in the positive ion mode, confirmed by the selected reaction monitoring (SRM) mode using an internal standard method.Phytosterols showed a wide linearity in 0.05~100 μg/mL, with correlation coefficients between 0.990 3 and 0.998 1.The limits of detection of phytosterols were between 0.2 and 20 ng/mL. This simple, selective and sensitive method can be successfully used for the determinations of different types of matrices, and has a 25~500 fold increase in sensitivity than that in high performance liquid chromatography.
phytosterols;high performance liquid chromatography-electrospray ionization-tandem mass spectrometry;pre-column derivatization;select reaction monitoring
2016-07-25;
2016-09-12.
国家自然科学基金面上项目( 21272178) 资助,Foundation item:NSFC(NO.21272178)
孙琪(1992-),女,硕士研究生,主要从事色质联用分析,Tel:15088919488,E-mail: 15088919488@163.com
陈帆,教授,主要从事色质联用分析,Tel:13906648148,E-mail: fanchen@wzu.edu.cn.
O657.3
B
1006-3757(2016)03-0169-10
10.16495/j.1006-3757.2016.03.008
