七筋姑不同倍型的克隆构型研究
2016-10-21刘昕刘丽赵亮王祎玲
刘昕,刘丽,赵亮,王祎玲
(山西师范大学生命科学学院,山西临汾041000)
七筋姑不同倍型的克隆构型研究
刘昕,刘丽,赵亮,王祎玲
(山西师范大学生命科学学院,山西临汾041000)
七筋姑隶属百合科七筋姑属,多年生草本,具有二倍体和四倍体两种细胞型,可通过根芽的方式进行无性繁殖.本文采用SSR分子标记对其克隆结构进行研究,结果表明:二倍体种群与四倍体种群全为多克隆种群,没有发现单克隆种群,克隆构型均为混合型.两种倍型152个七筋姑个体中出现了117个基因型,其中二倍体包含29.5个基因型,四倍体包含29个基因型,平均每个种群有29.25个克隆.物种水平上Simpson多样性指数(D)为0.992,基因型比率(PD)为0.700,表现出克隆多样性.二倍体克隆多样性(D=0.978,PD=0.846)略高于四倍体(D=0.974,PD=0.805).相关性表明环境因子与克隆多样性无显著相关.多基因型起源、兼性有性生殖和实生幼苗的更新可能是七筋姑不同倍型基因型丰富的来源.
七筋姑;克隆结构;细胞型
1 引言
繁殖是一切生物产生后代延续种族的最基本方式,它是种群形成、进化的基础,更是群落和生态系统演替的根本[1-2].在自然条件下,大多数植物都具有两种繁殖方式:无性繁殖和有性繁殖.无性繁殖是一种非常特殊的繁殖模式[3],直接导致子代的基因与亲本一致,这个模式对具有克隆繁殖的物种遗传多样性和遗传结构有很大的干扰[2].克隆植物一个种群的遗传多样性和遗传结构不能通过对所有植株统计获取,而是由基株数目所定,基株是一个种群内由一个合子演化而来的有一致基因型植株的总称,基株内每个植株称为分株,基株也被看作是一个遗传独立体.克隆构型是克隆植物在进化过程中形成的对环境异质性的利用能力,具体指具有无性繁殖的植物种群内基株和众多分株在空间位置上的分布规律,分为密集型、游离型和一些中间类型的混合型.密集型,分株间距离很短;游离型,基株扩散距离较大;混合型则是密集型和游离型镶嵌构成一种过渡的模式[4].研究克隆构型和多样性能判断物种的繁殖和进化程度,种群的规模、走势及对环境的适应性,可为保护物种多样性提供理论依据[2,4-5].
七筋姑(Clintonia udensis Trautv.et Mey.)是百合科(Liliaceae)黄精族(Polygonateae)七筋姑属(Clintonia Raf.)植物.多年生草本,根状茎;花白色,少有淡蓝色;果实球形至矩圆形.常生长在海拔1 600~4 000 m的高山阴坡树林下[6-8].有二倍体和四倍体两种细胞型,二倍体分布从云南一直延伸到俄罗斯的远东地区,四倍体在东亚除分布于喜马拉雅地区和日本以外,在陕西化龙山和湖北神农架一带有较为狭小的分布.两种细胞型的个体只在种子大小上存在差异:二倍体种子较小,约3 mm×1.5 mm;四倍体种子较大,约4.5mm×2.2 mm[7].野外调查时发现,七筋姑具有出芽生殖情况,具有克隆生长.本文将采用SSR分子标记对七筋姑不同倍型种群进行克隆多样性、克隆结构研究,旨在了解七筋姑不同倍型克隆大小、空间格局,为揭示七筋姑不同倍型的克隆结构、生态适应提供基础资料.
2 材料与方法
2.1材料采集
于2013年7月分别采自于陕西、湖北境内四个地方:陕西化龙山北坡(32‘06 N,109'41 E)、陕西化龙山南坡(32‘01 N,109'35 E)、湖北金猴岭(31‘47 N,110'30 E)、湖北木林子(30‘03 N,110'20 E),其中化龙山北坡和木林子两个种群细胞型为四倍体;化龙山南坡和金猴岭两个种群细胞型为二倍体.
采样策略:合理选取生长比较好的区域作取材样方,共取样方4个.采集新鲜、完整的七筋姑幼嫩叶片,用变色硅胶迅速干燥,待硅胶变色后马上更换,直到叶片变脆,带回实验室整理后,置于冰箱低温保存备用.

表1 七筋姑SSR扩增引物
2.2实验方法
2.2.1基因组DNA的提取
采用改良的2×CTAB法[9-10],所用器皿和试剂除有机溶剂外都经过高压灭菌之后用于提取七筋姑基因组DNA.用紫外分光光度计和0.8%琼脂糖凝胶电泳检测所提DNA质量.
2.2.2SSR-PCR引物筛选
从化龙山北坡、化龙山南坡、金猴岭和木林子4个地方中选取质量较好的DNA样品,对30对SSR引物进行扩增,从中初步筛选出多态性较高、合适的11对引物(表1)进行分析.供筛选的引物由西安科昊生物工程有限责任公司研究开发.
2.2.3PCR产物检测
取8 μl的PCR扩增产物用非变性聚丙烯酰胺凝胶电泳分离.缓冲液为1×TBE,100 V电压下预电泳30 min,点样后,在200 V电压下电泳3~4 h.
用银染强碱法染色:将胶取下用双蒸水洗胶2次,每次2 min;用含0.2%的AgNO3的染色液染色12 min;再用双蒸水清洗30s;用含1.5%的NaOH和0.4%的甲醛显影液显影15 min,在此过程中充分摇动,直到清晰地看到所有条带;最后用双蒸水清洗2次;将其取出观察条带、拍照并记录[11].
2.3数据分析
扩增产物经电泳后获得图谱,在相近迁移位置上有条带的记为“1”,无条带的记为“0”,形成原始的“0,1”矩阵.多个引物扩增结果显示完全一致的样本,可推测为同一个克隆系.分析种群的克隆结构和克隆多样性常见的几种度量标准如下[12]:
(1)基株数目G:是种群中基株的总数,所有扩增位点基因型相同的植株可视为同一个基株.
(2)平均克隆大小NC:表示平均每个基株含有的克隆分株数即N/G,N为样本总数.
(3)不同基因型比率(PD):基株数目/样本总数,即G/N.
(4)Simpson多样性指数(D):表示物种的多样性和均匀度,也可衡量种群内的克隆多样性.D=1-∑{ni(ni-1)/(N(N-1)},其中ni表示第i个基因型的分株数目.D值变动范围0到1,0表示种群所有样本是同一种基因型,1表示所有的样本都是不同的基因型.
(5)基因型分布均匀度Fager指数:E=(D-Dmin)/(Dmax-Dmin);Dmin={(G-1)(2N-G)/N(N-1)};Dmax={N(G-1)/ G(N-1)}.Fager指数表示种群内基因型的均匀度,E=0表示种群内所有个体的基因型都不同或有一个基因型占绝对优势而其他基因型都只有一个个体;E=1表示种群内所有基因型有相同的个数.
(6)局限性基因型:只有一个种群中出现的基因型[13].(7)广布型基因型:75%以上种群中出现的基因型[13].
运用POPGENE V1.31软件对种群进行各项参数的运算,观察等位基因数(na)、有效等位基因数(ne)、Nei's基因多样性指数(h)、Shannon多样性指数(I)和多态位百分率(PPB)、种群总的基因多样性(HT)、种群内的基因多样性(HS)、遗传分化指数(GST)和基因流(Nm)[14].
将所有样本用字母标注:化龙山北坡41个个体用字母A~AO表示,化龙山南坡31个个体用字母DR~EV表示,金猴岭39个个体用字母CE~DQ表示,木林子41个个体用字母AP~CD表示(表2),将数据导入MrBayes软件分析每个个体及种群间的遗传距离,将输出结果用Figtree读取遗传距离图[15].
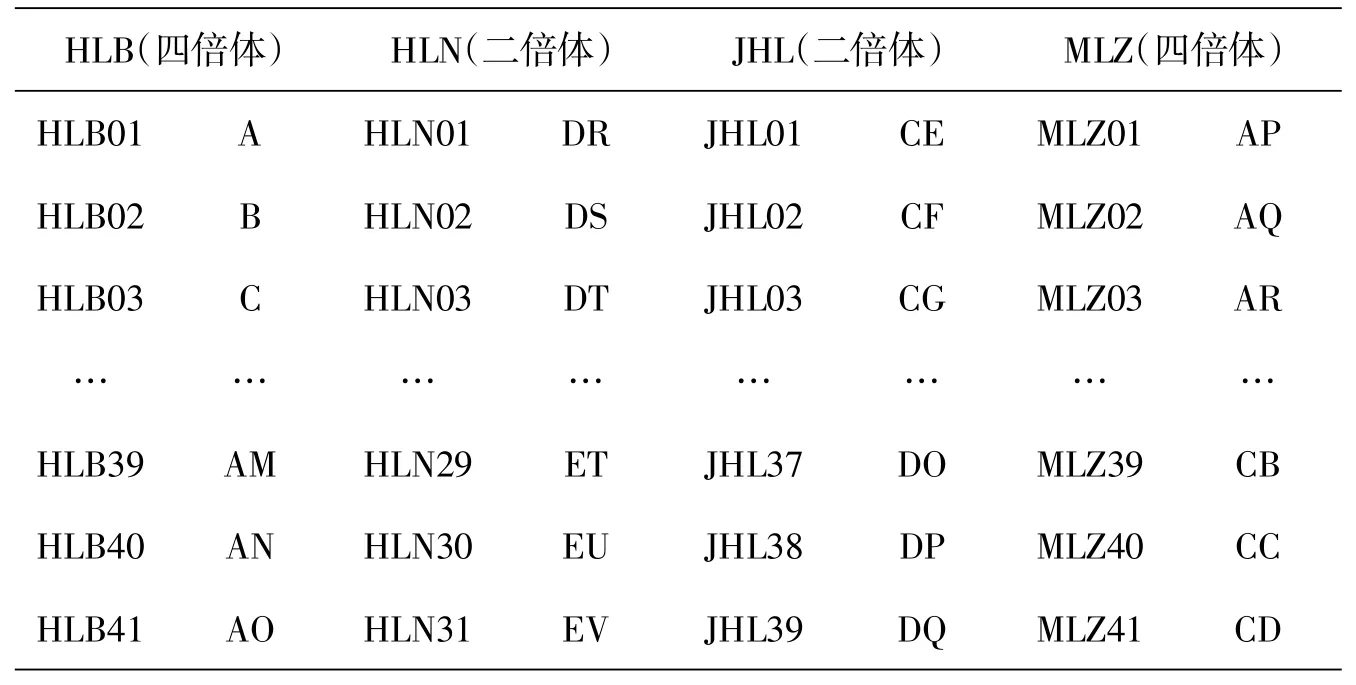
表2 七筋姑样本个体字母标记对照
采用SPSS16.0数据处理系统软件对七筋姑种群克隆结构的各项数据与环境因子进行相关性分析.
3 结果与分析
3.1七筋姑不同倍型的遗传多样性
从30对引物组合中选出扩增条带清晰、稳定性高的11对引物对所有个体进行扩增.结果显示(表3),二倍体种群的遗传多样性较低,其多态位百分率(PPB)为23.69%,观察等位基因数(na)、有效等位基因数(ne)、基因多样性指数(h)、Shannon多样性指数(I)分别为1.236 9,1.202 7,0.108 3,0.153 7.四倍体种群遗传多样性表现出与二倍体相同的趋势,PPB=19.73%,na=1.197 4,ne=1.1405,h=0.077 6,I=0.1126.
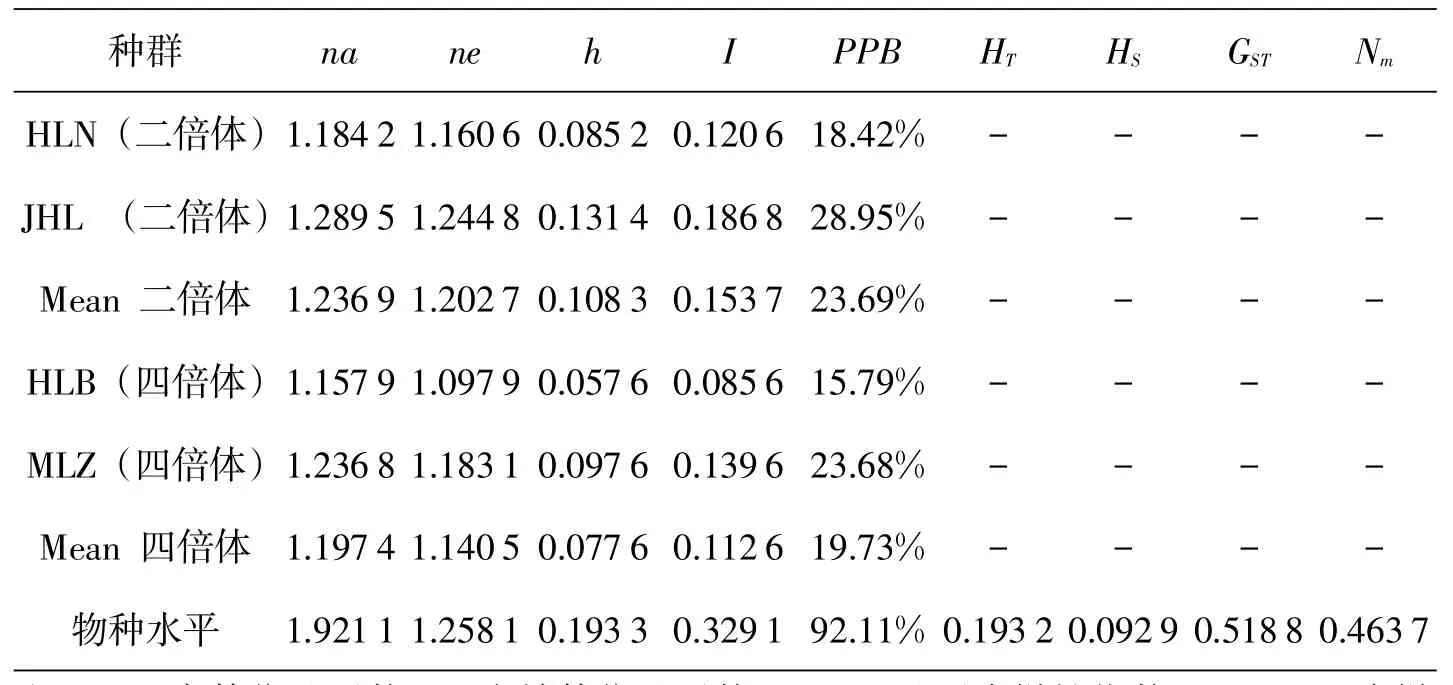
表3 七筋姑两种倍型遗传多样性指数
种群总的基因多样性(HT)为0.193 2,种群内的基因多样性(HS)为0.092 9.遗传分化系数(GST)为0.518 8,表明遗传变异主要存在于种群间.根据遗传分化系数估算的基因流(Nm)为0.467 3,小于1,说明不同种群之间基因交流受到限制.
物种水平上,PPB为92.11%,表现出高的遗传多样性,其他多样性指数分别为na=1.921 1,ne=1.258 1,h= 0.1933,I=0.329 1.物种水平的遗传多样性高于种群水平的遗传多样性.
对两种倍型的不同种群遗传多样性指数比较发现,二倍体种群遗传多样性高于四倍体.其顺序为:化龙山北坡四倍体(HLB)<化龙山南坡二倍体(HLN)<木林子四倍体(MLZ)<金猴岭二倍体(JHL).
3.2七筋姑不同倍型%克隆多样性
二倍体、四倍体种群中克隆基株的数目大小不一,所有种群都是多克隆群体,没有发现单克隆构型的种群(表4),而且在研究的4个种群152个样本中出现了117个基因型,其中二倍体包含29.5个基因型,四倍体包含29个基因型,平均每个种群有29.25个克隆.
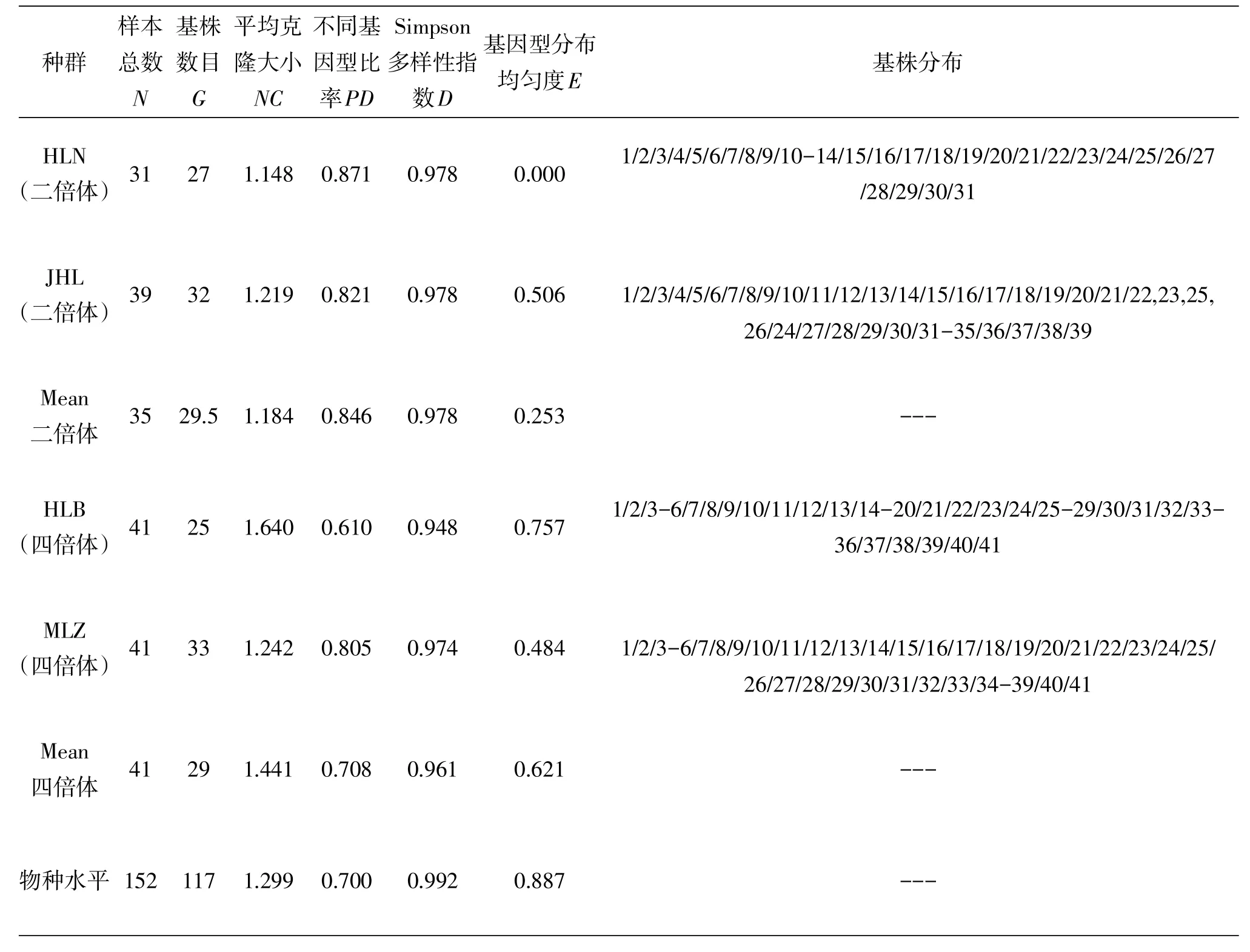
表4 七筋姑两种倍型种群的克隆多样性指数
根据Ellstrand&Roose[13]对局限基因型和广布基因型的标准判断,七筋姑为局限基因型,地域性分布比较明显.二倍体种群平均克隆大小(NC)平均为1.184,四倍体种群平均为1.441,物种水平上为1.299;二倍体种群不同基因型比率(PD)平均为0.846,四倍体种群平均为0.708,物种水平上为0.700;二倍体种群Simpson多样性指数(D)为0.978,四倍体种群平均为0.961,物种水平上为0.992;二倍体种群基因型分布均匀度(E)平均为0.253,四倍体种群平均为0.621,物种水平上为0.887.克隆多样性参数表明二倍体种群的克隆多样性水平高于四倍体种群.
为了进一步了解七筋姑对环境的适应能力,对种群的克隆多样性与环境因子进行相关性分析(表5).结果表明仅海拔与多样性参数呈现出较高的相关性,但并不显著,其中不同基因型比率(PD)、Simpson多样性指数(D)与海拔呈正相关,平均克隆大小(NC)、基因型分布均匀度(E)与海拔呈负相关,说明海拔越高平均克隆大小越小,基因型分布越不均匀,而基因型比率越高,Simpson多样性也越高.
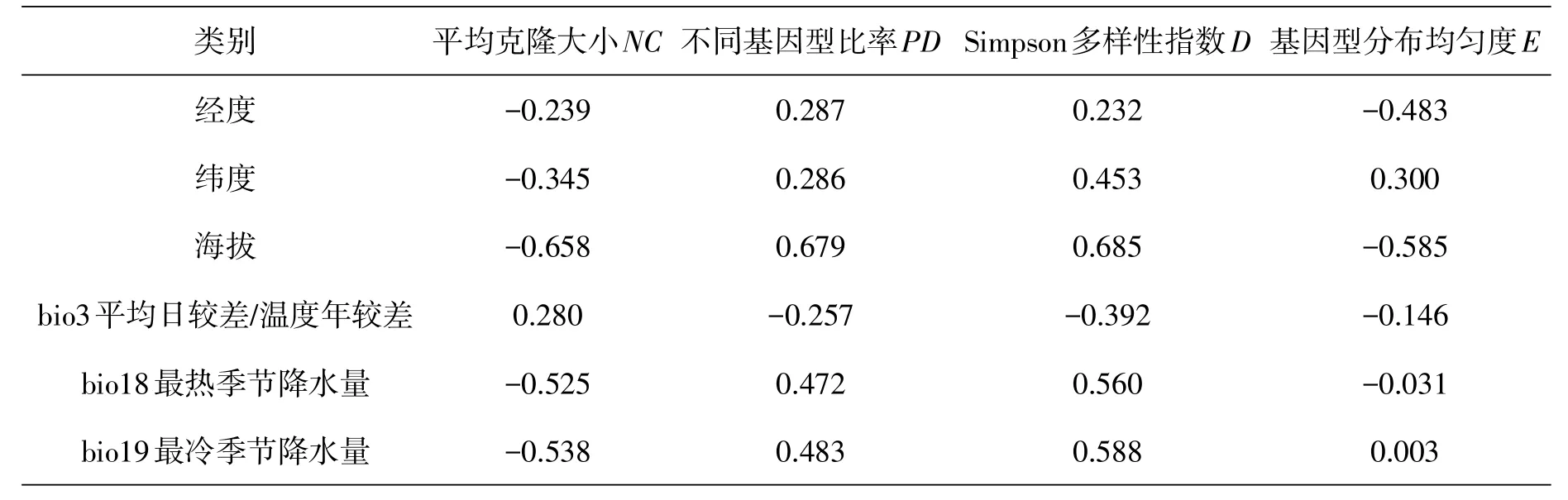
表5 克隆多样性与环境因子的相关性
3.3七筋姑不同倍型的克隆构型
基于贝叶斯法在MrBayes软件中进行聚类分析(图1),结果显示化龙山北坡的四倍体种群所有个体聚为一支,木林子的四倍体种群所有个体聚为一支,化龙山南坡的二倍体种群所有个体聚为一支,金猴岭的二倍体种群所有个体聚为一支.
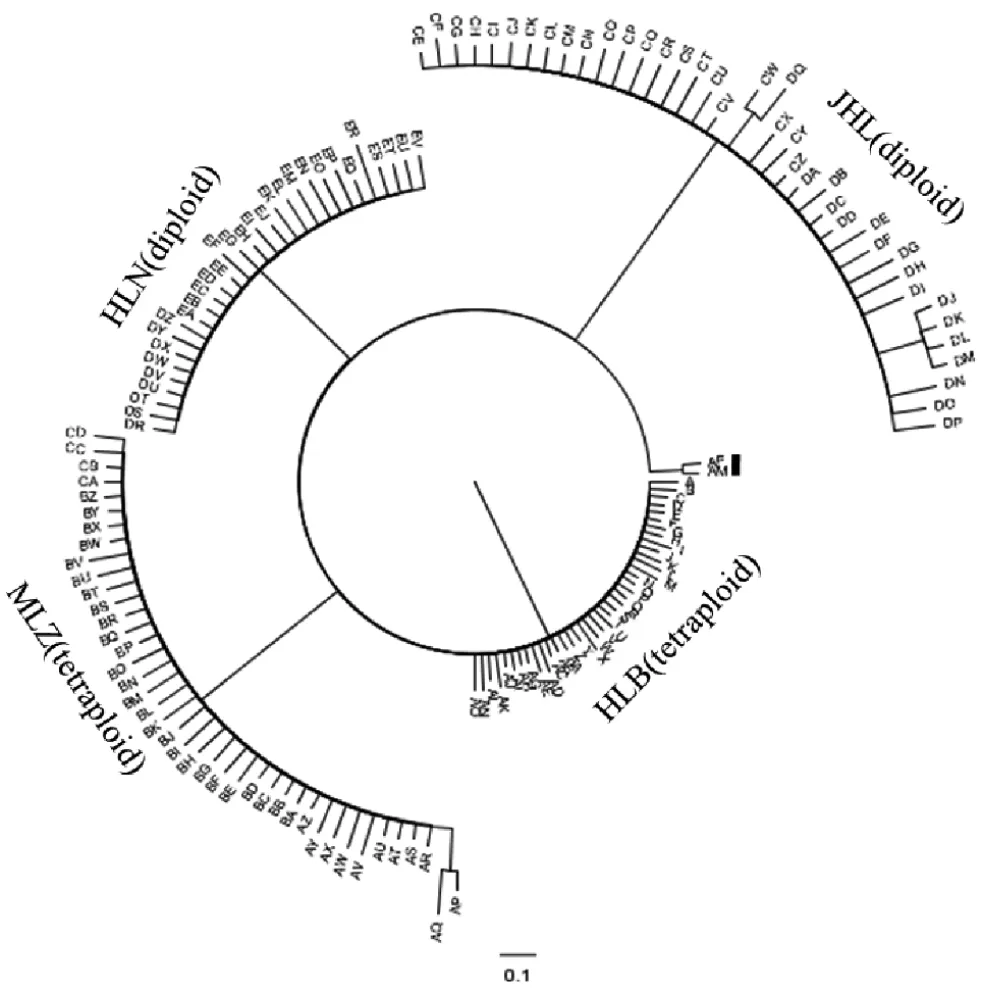
图1 七筋姑样本遗传距离聚类图
两种倍型4个种群之间遗传距离存在差异,同一种群内不同个体间遗传距离也存在不同程度的差异(图2).二倍体种群为多克隆种群,化龙山南坡二倍体种群克隆系仅有1个,金猴岭二倍体克隆系有2个.四倍体种群同样都为多克隆种群,化龙山北坡四倍体出现4个克隆系,木林子四倍体出现2个克隆系.并且不同种群之间没有发现相同的基因型个体.
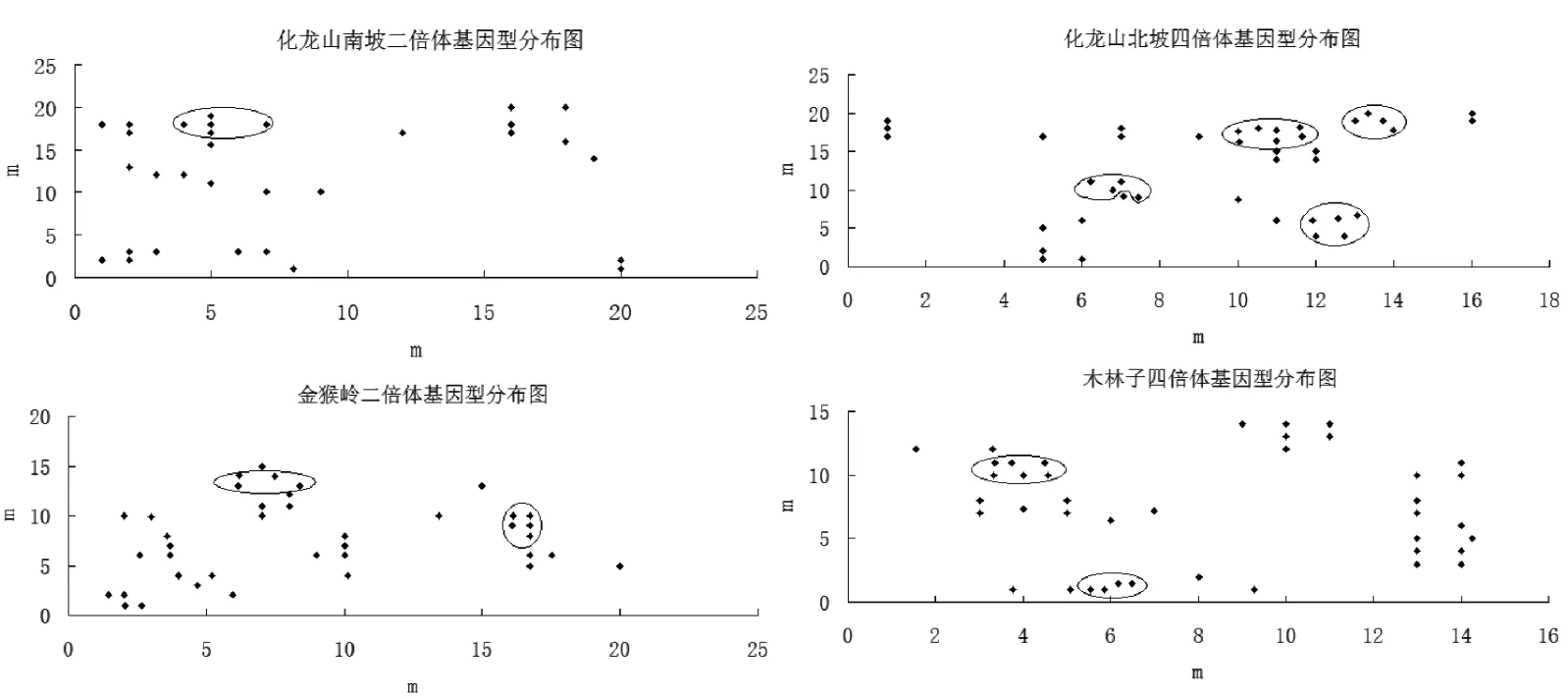
图2 七筋姑不同倍型基因型分布示意图
4 讨论
4.1七筋姑不同倍型的克隆多样性水平
克隆植物通过无性繁殖产生的后代,其基因型与亲本完全相同,一直以来人们都认为在克隆植物种群中遗传多样性很低,近些年随着分子生物学的快速发展,分子遗传标记技术特别是SSR分子标记技术的应用,发现克隆植物种群中的克隆多样性并没有像预估的那么低[16].本文研究发现两种倍型的七筋姑种群都具有较高的遗传多样性,同时陕西和湖北境内的二倍体种群遗传多样性高于四倍体.究其原因可能有以下几点:(1)该物种本身是多基因型起源的,即祖先基因多样性就高,发展到现在仍然保持较高的基因多样性;(2)七筋姑兼性有性生殖,不同个体交配繁育后代的遗传变异为遗传多样性提供了可能;(3)很低的实生幼苗更新和补充都可以维持和增加种群内的多样性水平,文中七筋姑的平均克隆大小为1.299,说明存在幼苗的更新[17].另外,二倍体遗传多样性高于四倍体可能是由于四倍体物种起源时间较短,其种群中还没有积累比较多的遗传变异[18].
4.2七筋姑不同倍型的克隆构型
Simpson多样性指数D是反映植物克隆多样性水平的主要特征值.本研究中七筋姑二倍体种群Simpson多样性指数D平均值为0.978,四倍体平均值为0.961,显示出两种倍型七筋姑都具有较高的克隆多样性,但二倍体种群略高于四倍体,可能因为两种倍型的七筋姑生境都处于高海拔地区,相对贫瘠的环境使得该植物为了适应环境进行有性繁殖更新、补充实生苗,促使不同基因型的植株占据不同生境,增加对异质空间资源的获取能力;同时二倍体种群Simpson多样性指数高于四倍体种群,说明二倍体种群克隆繁殖能力较强,由于二倍体生长海拔普遍高于四倍体克隆,而克隆繁殖对于高寒环境是一种优势,二倍体相对较高的克隆繁殖增加了对环境的适合度.
本研究中两种倍型七筋姑种群均为多克隆种群,没有发现单克隆种群.根据克隆个体在空间上的分布而言,金猴岭二倍体、化龙山北坡四倍体、木林子四倍体都出现多个克隆系,而化龙山南坡二倍体种群克隆系仅有1个,出现了优势基因型,形成了所有的克隆分株.种群中克隆系的数目可能是由于环境异质性决定的,即不同基因型个体对环境适应能力的不同造成了特定的基因型只能集中分布于特定的环境中[19].化龙山南坡二倍体中仅存在1种基因型与环境高度适应,成为优势基因型.两种倍型种群内同一克隆系的分株分布比较密集,不同基因型基株离散分布,说明两种倍型七筋姑种群的克隆构型均为混合型[20-21],同时七筋姑不同倍型间均没有明显的镶嵌现象,说明相同或相近的基因型几乎出自同一个种群,为局限性基因型[17,22].种群间的基因多样性远高于种群内,一方面证明了七筋姑地理分布范围广,种群间克隆分化程度高,另一方面也说明不同克隆种对生态适应性不同.相关性分析发现,仅海拔与各项数据呈现较高的相关性,但并不显著,经纬度、温差与降水量等并没有对七筋姑的克隆多样性产生较大的影响,可能由于上述环境因子并不是影响七筋姑有性繁殖与无性繁殖的相对比例的主要因素[23].
[1]WAN J Z,WANG C J,LIU C X,et al.Climate change may alter genetic diversity of Duchesnea indica,a clonal plantspecies[J]. Biochemicalsystematics and Ecology,2016,66:114-122.
[2]LITRICO I,VIOLLE C.Diversity in plant breeding:a new conceptual framework[J].Trends in Plantscience,2005,20(10):604-613.
[3]WILDOVÁ R,GOLDBERG D E,HERBEN T.The contrasting roles of growth traits and architectural traits in diversity maintenance in clonal plant communities[J].The American Naturalist,2015,180(6):693-706.
[4]葛俊,邢福.克隆植物对种间竞争的适应策略[J].植物生态学报,2012,36(6):587-596.
[5]OUDOT-CANAFFA J,BORNETTEA G,VIRICELA M R,et al.Theshort-term impact of wetland restoration on the genetic diversity of a predominantly clonal plantspecies[J].Aquatic Botany,2013,110:16-23.
[6]中国科学院中国植物志编辑委员会.中国植物志:第15卷[M].北京:科学出版社,1992:24-26.
[7]LIs F,CHANG Z Y,YUAN Y M.The origin and dispersal of the genus Clintonia Raf.(Liliaceae):evidence from its cytogeography and morphology[J].Carylolgia,1996,49:125-135.
[8]李欣.东亚七筋姑分子系统发育地理学研究[D].西安:西北大学,2008.
[9]蔡秀珍,刘克明,龙春林.野生芋属植物干叶片DNA的提取及PCR扩增[J].中国野生植物资源,2008,27(1):51-53,57.
[10]林万明.PCR技术操作指南[Z].北京:人民军医出版社,1993:7-14.
[11]郑书星,张建国,段爱国.等.额尔齐斯河流域银白杨克隆结构及多样性研究[J].林业科学研究,2013,26(4):426-432.
[12]陈云,闫伟红,吴昊,等.干旱胁迫下老芒麦遗传多样性分析[J].草原与草坪,2014,34(2):11-17.
[13]ELLSTRAND N C,ROOSE M L.Pattern of genotypic diversity in clonal plantspecies[J].American Journal of Botany,1987,74: 123-131.
[14]PAPRŠTEIN F,HENYCHOVÁ A,SEDLÁK J.Comparison of genetic diversitystructure analyses ofsSR molecular marker data within apple(Malus×domestica)genetic resources[J].Genome,2012,55(9):647-665.
[15]高阳,高甲荣,温存,等.宁夏盐池沙地土壤水分条件与植被分布格局[J].西北林学院学报,2006,21(6):1-4.
[16]许璐,苏雪,董莉娜,等.青藏高原东缘中国沙棘的克隆多样性及克隆结构[J].草业学报,2012,21(3):117-124.
[17]SAMPAIO M C,PERISSÉ L E,OLIVEIRA G A,et al.The contrasting clonal architecture of two bromeliads fromsandy coastal plains in Brazil[J].Ecology of Plants,2002,197(6):443-451.
[18]郭晶.基于cp-SSR标记东亚七筋姑的遗传多样性及遗传分化[D].西安:西北大学,2007.
[19]WANG Y L,LI X,GUO J,et al.Chloroplast DNA phylogeography of Clintonia udensis Trautv.&Mey.(Liliaceae)in East Asia[J].Molecular Phylogenetics and Evolution,2010,55(2):721-732.
[20]王艾丽.菝葜属和肖菝葜属物种分化的细胞与遗传基础研究[D].杭州:浙江大学,2006.
[21]杨亚珺,李吉宁,巩檑,等.贺兰山丁香自然居群克隆生长格局及遗传多样性的ISSR分析[J].植物科学学报,2013,31(1):85-92.
[22]沈栋伟,李媛媛,陈小勇.植物克隆多样性与生态系统功能[J].植物生态学报,2007,31(4):552-560.
[23]王洪义,王正文,李凌浩,等.不同生境中克隆植物的繁殖倾向[J].生态学杂志,2005,24(6):670-676.
Clonalstructure of Different Cytotypes of Clintonia udensis
LIU Xin,LIU Li,ZHAO Liang,WANG Yiling
(College of Lifesciences,Shanxi Normal University,Linfen 041000,China)
Clintonia udensis is a member of Clintonia(Liliaceae).As a perennial herbaceous plant,thisspecies has two cytotypes which include diploid and tetraploid.Thespecies can reproduce through root buds.In thisstudy,the clonal diversity and clonalstructure of C.udensis was analyzed based onsSR molecular markers.The resultsshowed that the diploid and tetraploid populations were all polyclonal populations,and that none monoclonal populations were found.There is a high clonal differentiation in two cytotypes.All the clonalstructure of C. udensis was“Guerilla”.152 C.udensissamples of four populations had 117 genotypes.The diploid had 29.9 genotypes,while the tetraploid had 29 genotypes.The average clone was 29.25 at the population level.Moreover,Simpson index(D)was 0.992 and genotype ratio(PD)was 0.700 atspecies level,which indicated high clonal diversity within C.udensis.The colnal diversity of diploid wasslightly higher than that of tetraploid.There is nosignificant correlation between clonal diversity and environmental factors based on correlation analysis.In conclusion,multiple origins of genotypes,facultativesexual reproduction and updatedseedlingsshould be thesources for maintaining rich genotypes within the C.udensis populations.
Clintonia udensis;clonalstructure;cytotypes
TU857
A
1008-2794(2015)04-0105-07
2016-04-12
王祎玲,教授,博士,研究方向:分子生态学,E-mail:ylwangbj@hotmail.com.
