抑制α-葡萄糖苷酶活性的啤酒糟多肽的合成与表征
2016-09-28房郁雯吴金鸿王正武何家俊陈珊珊马鸿承史海明
房郁雯 吴金鸿 王正武 甘 李 何家俊 陈珊珊 马鸿承 史海明
(上海交通大学农业与生物学院食品科学与工程系,上海 200240)
抑制α-葡萄糖苷酶活性的啤酒糟多肽的合成与表征
房郁雯 吴金鸿 王正武 甘李 何家俊 陈珊珊 马鸿承 史海明
(上海交通大学农业与生物学院食品科学与工程系,上海200240)
采用以Fmoc为保护基团的固相合成法来合成啤酒糟多肽SS-5(序列:Ser-Pro-Asp-Arg-Ser),以高效液相色谱(HPLC)技术对合成肽粗品进行纯化脱盐,得到纯度95%以上的样品。合成肽SS-55对α-葡萄糖苷酶的抑制作用检测结果表明,合成肽SS-5的活性受所含盐离子浓度的影响,低浓度时抑制率较高。而圆二色谱和荧光猝灭试验结果表明,合成肽SS-5与α-葡萄糖苷酶之间存在相互作用。说明可以通过固相合成法快速大量获得对α-糖苷酶具有一定抑制作用的啤酒糟多肽SS-5。
固相合成;α-葡萄糖苷酶抑制剂;合成肽SS-5;相互作用;啤酒糖多肽
糖尿病是一种慢性代谢紊乱的疾病,分为1型糖尿病和2型糖尿病,主要表现为体内糖代谢异常[1]。如果缺乏正确且及时的治疗,糖尿病会引起很多并发症,包括高血糖症、糖尿病性酸中毒和糖尿病高渗性昏迷。严重的慢性并发症还有心血管疾病、慢性肾衰竭和肾损伤[2]。因此,必须要有适当、有效、及时的治疗。比如,每天服用阿卡波糖、二甲双胍等治疗药物来抑制餐后血糖的过度升高;适当调整饮食、生活习惯和加强锻炼,并通过控制血糖、保持健康体重和戒烟来达到这些目标[1]。另外,通过食用含有α-葡萄糖苷酶抑制剂功效成分的功能性食品来抑制餐后高血糖也是重要的一种预防和治疗的方式。α-葡萄糖苷酶抑制剂,是以延缓肠道碳水化合物吸收而达到治疗糖尿病目的的一类口服降糖药物[3]。其作用机制为:抑制剂抑制肠道的α-葡萄糖苷酶,减慢淀粉类分解为葡萄糖的速度,减缓葡萄糖的吸收,从而降低餐后高血糖[4]。α-葡萄糖苷酶抑制剂会降低餐后胰岛素水平,但不会刺激β细胞使其分泌胰岛素,这说明这种抑制剂可增加胰岛素的敏感性。因此,α-葡萄糖苷酶抑制剂的应用是治疗糖尿病的可替代的选择[5]。
目前在临床上应用的α-葡萄糖苷酶抑制剂主要是人工合成的化合物,例如阿卡波糖、伏格列波糖等,虽然有良好的降低餐后血糖的作用,但价格较高,且对肠胃有一定的副作用,比如肠胃气胀(78%的病患)和腹泻(14%的病患)。从天然产物中筛选出具有治疗潜力的先导化合物的抑制剂,近年来成为了国内外研究的热点。新的研究发现α-葡萄糖苷酶抑制剂可来源于一些天然物质,例如番石榴叶[6]、高粱[7]、发酵豆[8]等。多肽类生物活性物质近年来也被发现有抑制作用。例如,Yu Zhi-peng等[9]证明了鸡蛋白蛋白中提取分离得到的多肽可以抑制α-葡萄糖苷酶的活性;林鸿佳[10]16-28发现酶解后得到的啤酒糟多肽具有抑制α-葡萄糖苷酶作用。崔洁等[11]对山杏整仁进行酶解的得率为26.43%,之后进行超滤、凝胶层析等步骤获得了具有抑制α-葡萄糖苷酶活性的多肽,产物最高抑制率为11.52%。这种通过酶解方法从天然产物中得到生物活性肽的提取分离步骤繁琐,活性成分得率和纯度低,难以实现工业化推广应用。而通过生物或化学合成方法制备的生物活性肽易于纯化,可实现自动化生产,是提高生物活性肽产率和扩宽其应用价值的有效新方法。目前合成肽在生物制剂上的应用非常广泛,比如口蹄疫合成肽疫苗[12]、急性心肌梗塞诊断[13]、乙型肝炎抗体制备[14]等中的应用。
鉴此,本试验依据林鸿佳[10]43-44报道的具有抑制α-葡萄糖苷酶作用的啤酒糟多肽的序列:Ser-Pro-Asp-Arg-Ser,应用Fmoc固相合成法来合成啤酒糟多肽SS-5,并测定其α-葡萄糖苷酶抑制作用,探讨将食源性具有α-葡萄糖苷酶抑制作用的生物活性肽作为一种膳食补充剂或者生物制剂进行开发的可行性和存在的问题,为其开发应用提供理论指导。
1 材料与方法
1.1材料与仪器
1.1.1试验试剂
α-葡萄糖苷酶(EC 3.2.1.20):19.3 U/mg,来源酿酒酵母,美国Sigma-Aldrich 公司;
对硝基苯-α-D-葡萄吡喃糖苷(pNPG):美国Sigma-Aldrich 公司;
其它试剂:分析纯,国药集团化学试剂有限公司。
1.1.2主要仪器设备
离子色谱仪:883 Basic IC plus型,瑞士Metrohm公司;
元素分析仪:Vario MICRO cube型,德国Elementar公司;
旋转蒸发仪:R-205型,瑞士Buchi公司;
冷冻干燥机:FreeZone型,美国Labconco公司;
紫外分光光度计:UV-2802S型,上海尤尼科公司;
数显恒温水浴锅:HH-S型,江苏金坛市岸头国瑞实验仪器厂;
冰箱:BCD-189JB-S型,上海夏普公司;
旋涡混匀器:MS3基本型,上海川翔生物科技有限公司;
pH计:Delta320型,METTLER-TOLEDO仪器(上海)有限公司;
电子分析天平:ME104E型,METTLER-TOLEDO仪器(上海)有限公司;
荧光分光光度计:QM/TM/IM型,美国PTI公司;
圆二色光谱仪:JASCO J-815型,日本分光株式会社。
1.2方法
1.2.1啤酒糟多肽SS-5的合成多肽的固相合成是一个从C端(羧基端)向N端(氨基端)重复添加氨基酸的过程。为了防止副反应的发生,参加反应的氨基酸的侧链都是被9-芴甲氧羰基(Fmoc)保护的,Fmoc在碱性条件下10 min即可完全脱除;而游离的C端在反应之前必须活化[15]。啤酒糟多肽SS-5固相合成的简单过程:首先在固相载体(氯甲基聚苯乙烯树脂)上共价连接一个氨基被封闭基团(Fmoc)保护的氨基酸,在三氟乙酸(TFA)的作用下脱掉α-氨基的保护基Fmoc,这样第一个氨基酸就连接到固相载体上了;然后用N,N’-二环己基碳二亚胺(DCC,Dicyclohexylcarbodiimide)来活化第二个氨基酸的羧基,第二个氨基酸的羧基再与第一个氨基酸的氨基反应形成肽键,从而在固相载体上形成了一个二肽;不断重复上述形成肽键的反应,使得肽链从羧基端向氨基端增长,直至达到的肽链长度符合要求;最后脱去保护基Fmoc,并用氢氟酸(HF)来水解固相载体和肽链之间的酯键,最终得到合成肽SS-5[16]。
1.2.2合成肽SS-5的纯化将合成的多肽SS-5用高效液相色谱法进行分离纯化。色谱柱为制备型反相C18柱(30 mm×250 mm),配紫外检测器;样品浓度50 mg/mL,流速30 mL/min,紫外检测波长220 nm;流动相:A为100%乙腈,B为100%超纯水;梯度洗脱条件:0~20 min,14% A~39% A;20.0~20.1 min,39%~80% A;20.1~60.0 min,80% A。先用2%醋酸平衡,用进样阀进收集的馏分,用纯水平衡,然后2%醋酸铵平衡,再纯水平衡,用醋酸冲20 min(30%~80%),再收集馏分得粗肽样品。
将粗肽样品在HPLC上检验纯度,色谱柱为Kromasil C18-5(4.6 mm×250 mm);上样量10 μL,流速1.0 mL/min,检测波长220 nm;流动相:A为含0.01%三氟乙酸的乙腈溶液,B为含0.01%三氟乙酸的超纯水溶液;梯度洗脱条件:0.01~25.00 min,1%~26% A;25.0~25.1 min,26%~100% A;25.1~30.0 min,100% A。纯度合格的样品进行冷冻干燥。
1.2.3合成肽SS-5的离子色谱分析与元素分析合成离子分析参考JY/T 020—1996《离子色谱分析方法通则》,元素分析参考JY/T 017—1996《元素分析仪方法通则》,检测目标为醋酸根、三氟乙酸根、氮、碳及氢含量。
1.2.4合成肽SS-5体外α-葡萄糖苷酶抑制活性的测定参考文献[17]做部分修改,α-葡萄糖苷酶催化pNPG水解产生对硝基苯酚,并在405 nm处有特征吸收,因此用紫外分光光度计测定在405 nm 处的紫外吸收。
在37 ℃、pH 6.8的磷酸盐(50 mmol/L)缓冲体系中,α-葡萄糖苷酶(0.175 U/mL)和不同浓度的啤酒糟多肽SS-5培养30 min,之后加入pNPG (10 mmol/L)作为底物反应30 min,最后加入250 mmol/L的Na2CO3来终止反应,在405 nm处测定吸光值。样品对α-葡萄糖苷酶活性的抑制率按式(1)计算:

(1)
式中:
R——抑制率,%;
A对照——对照组的紫外吸光度值,
A样品——不同浓度抑制剂组的紫外吸光度值。
1.2.5圆二色谱测定α-葡萄糖苷酶与啤酒糟多肽SS-5混合体系的圆二色谱在200~250 nm波长范围内测量。混合1.4 U/mL的α-葡萄糖苷酶和5 mg/mL的多肽SS-5在37 ℃下进行扫描,扫描速度50 nm/min,响应时间1 s,狭缝宽度1 nm。每个光谱是3次连续扫描的平均值,试验开始用2.5 mmol/L的PBS扫基线。
1.2.6合成肽SS-5对α-葡萄糖苷酶的荧光猝灭作用在荧光猝灭试验中,50 mmol/L、pH 6.8 的PBS缓冲溶液作为空白对照。试验组将1.4 mL 0.5 U/mL的α-葡萄糖苷酶溶液分别与0.7 mL浓度为1.786,0.893,0.446,0.179,0.089 mmol/L的样品溶液混合后进行荧光扫描。设置温度37 ℃,电压参数为400 V,狭缝宽度为5 nm,扫描速度为240 nm/min,以280 nm 为激发波长,记录300~400 nm波长范围内的发射光谱。
2 结果与分析
2.1合成肽SS-5序列与性质
对合成肽SS-5进行序列及性质分析的结果见表1和图1。这是一个氨基酸序列为Ser-Pro-Asp-Arg-Ser的五肽,分子量为560.56,等电点pI为7.4。平均亲水性为1.3,说明合成肽SS-5为疏水蛋白,而亲水残基的比例为80%。这些性质都为之后的合成肽SS-5纯化提供了依据。
2.2合成肽的鉴定
粗肽样品经过进一步纯化,在洗脱时间10.313 min处出现一个色谱分离峰(见图2),由表1积分面积计算,相对含量达到98.4%,说明纯度已达到95%以上。由图3可知,啤酒糟多肽SS-5的分子离子峰为561.58,因此相对分子量为560.58,证实合成的多肽为啤酒糟多肽SS-5。收集该分离峰处合成肽SS-5纯化样品,冷冻干燥,置于冰箱内保存。
2.3合成肽SS-5的离子色谱分析与元素分析
由图4和表3可知,合成肽SS-5中含盐量为12.3%。实际肽含量的确定是由检测的N含量除以理论N含量得到。合成肽SS-5的分子式是C28H44N6O6,其分子量为560.70,则理论N含量为:14×6÷560.70=0.149 8,则肽含量为0.121 1÷0.149 8= 80.84%。

表1 合成肽SS-5序列与性质

图1 合成肽SS-5性质

图2 合成肽SS-5反相高效液相色谱图
Figure 2Reversed-phase high-performance liquid chromatography of synthetic peptide SS-5

表2 合成肽SS-5反相高效液相色谱分析结果
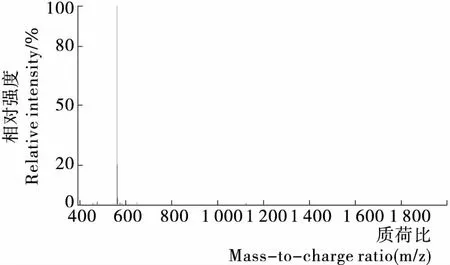
图3 合成肽SS-5质谱分析结果

图4 合成肽SS-5离子色谱图

峰序列号保留时间/min面积/(μS·cm-1·min)高度/(μS·cm-1)浓度/(mg·L-1)组分名称13.8270.23271.00712.092醋酸根 27.4250.10280.2672.373三氟乙酸根

表4 合成肽SS-5盐及元素含量
2.4合成肽SS-5对α-糖苷酶活性抑制的分析结果
通过分光光度法测定的酶抑制剂活性分析结果见表5。由表5可知,合成肽的活性受含盐离子浓度的影响,在低浓度时表现出一定的α-葡萄糖苷酶抑制活性。随着样品浓度降低,即盐离子相对浓度降低,合成肽SS-5对α-葡萄糖苷酶抑制活性增强,当合成肽SS-5浓度为0.5 mg/mL时抑制率达到8.43%。说明应用分光光度法检测合成肽抑制活性时需要对合成肽进行进一步脱盐处理。
2.5圆二色谱(CD)检测结果
蛋白质主链的构象信息可以通过远紫外区的圆二色光谱(CD)来反映,因此通过测定α-葡萄糖苷酶二级结构的变化可以来定性分析其结构变化。α-葡萄糖苷酶与合成肽SS-5相互作用前后的CD谱图见图5。由图5可知,α-葡萄糖苷酶的CD光谱有两个明显的峰分别在209,222 nm处,这是蛋白质α-螺旋结构的特征峰[17-18]。而合成肽SS-5的加入,使得α-葡萄糖苷酶在209,222 nm处的CD光谱强度显著降低(向零水平移动),说明α-葡萄糖苷酶的α-螺旋结构含量减少,合成肽SS-5与α-葡萄糖苷酶相互作用后改变了α-葡萄糖苷酶的空间结构特征,从而对酶的活性产生抑制作用。
表5合成肽SS-5对α-葡萄糖苷酶活性的抑制作用
Table 5The inhibition activity of synthetic peptide SS-5 onα-glucosidase

SS-5浓度/(mg·mL-1)吸光度平均值抑制率/%5.03.921±0.04902.52.887±0.00801.02.692±0.0123.270.52.554±0.0638.21对照组2.783±0.021—

a. α-糖苷酶+合成肽SS-5 b. α-糖苷酶
Figure 5CD spectra ofα-glucosidase with or without synthetic peptide SS-5
2.6合成肽SS-5对α-葡萄糖苷酶的荧光猝灭作用
酶蛋白内源性荧光产生的主要原因是酪氨酸、色氨酸、苯丙氨酸这3种氨基酸残基[19]。在激发波长280 nm,扫描波长范围300~400 nm的条件下,得到酪氨酸和色氨酸共同的荧光发射光谱,可以通过分析探讨荧光光谱的强度及峰位等来推测酶蛋白与其他分子相互作用后的构象变化[10]49。合成肽SS-5与α-葡萄糖苷酶相互作用的荧光光谱图见图6。由图6可知,加入合成肽SS-5后α-葡萄糖苷酶的内源性荧光发生猝灭。随着合成肽SS-5的浓度增加,α-葡萄糖苷酶在334 nm处的荧光强度逐渐下降,表明两者之间存在相互作用。而且,其荧光发射峰没有发生明显的红移或蓝移现象,保持位置一致,说明合成肽SS-5没有改变α-葡萄糖苷酶中酪氨酸和色氨酸所处微环境的极性。
3 结论
采用Fmoc固相合成法来合成啤酒糟多肽SS-5,并采用高效液相色谱法对合成的多肽SS-5进行纯化,并最终得到纯度达到95%以上的多肽。在应用分光光度法进行合成肽SS-5对α-葡萄糖苷酶活性抑制活性的分析试验中发现0.5 mg/mL的合成肽SS-5对α-糖苷酶的抑制率达到8.43%,随着浓度提高,活性反而降低。经过离子色谱和元素分析,合成肽SS-5中含有12.3%盐,可能是造成合成肽检测出的抑制率不高的原因之一。圆二色谱和荧光光谱分析结果证明,α-葡萄糖苷酶与合成肽SS-5之间存在着相互作用,证实通过合成方法可以制备得到具有α-葡萄糖苷酶活性抑制的生物活性肽。但进一步研究还需要对合成肽进行脱盐或转盐(磷酸盐)处理,以增强其抑制活性,提高其应用价值。

a~e. 浓度分别为0.00,0.05,0.10,0.50,1.00 mg/mL的合成肽SS-5
Figure 6Interaction between SS-5 with various concentrations andα-glucosidase investigated by fluore-scence spectra
[1] GUNAWAN-PUTERI M, KAWABATA J. Novel alpha-glucosidase inhibitors from Macarangatanarius leaves[J]. Food Chemistry, 2010, 123(2): 384-389.
[2] 姜丽燕. 2型糖尿病患者大血管并发症与LDL-C的相关性分析[D]. 郑州: 郑州大学, 2013: 1-2.
[3] 屠洁, 李前龙. 天然产物中α-葡萄糖苷酶抑制剂的筛选研究进展[J]. 食品研究与开发, 2010, 31(9): 206-210.
[4] 李玉萍, 白冰, 叶军, 等.α-葡萄糖苷酶抑制剂的制备和活性研究进展[J]. 食品科学, 2008, 29(9): 617-620.
[5] BHANDARI M R, JONG-ANURAKKUN N, GAO Hong, KAWABATA J. Alpha- glucosidase and alpha-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed (Bergeniaciliata Haw.)[J]. Food Chemistry, 2008, 106(1): 247-252.
[6] WANG Hui, DU Yang-ji, SONG Hua-can. Alpha-Glucosidase and alpha-amylase inhibitory activities of guava leaves[J]. Food Chemistry, 2010, 123(1): 6-13.
[7] KIM J S, HYUN T K, KIM M J. The inhibitory effects of ethanol extracts from sorghum, foxtail millet and proso millet on alpha-glucosidase and alpha- amylase activities[J]. Food Chemistry, 2011, 124(4): 1 647-1 651.
[8] CHEN Jing, CHENG Yong-qiang, YAMAKI K, et al. Anti-alpha-glucosidase activity of Chinese traditionally fermented soybean (douchi)[J]. Food Chemistry, 2007, 103(4): 1 091-1 096.
[9] YU Zhi-peng, YIN Yong-guang, ZHAO Wen-zhu, et al. Novel peptides derived from egg white protein inhibiting alpha-glucosidase[J]. Food Chemistry, 2011, 129(4): 1 376-1 382.
[10] 林鸿佳. 具有α-糖苷酶抑制作用的啤酒糟多肽的分离及其作用机理研究[D]. 广州: 华南理工大学, 2013.
[11] 崔洁, 李琳, 张乔会, 等. 山杏整仁的酶法制备条件优化及功能评价[J]. 食品科学, 2015, 36(19): 153-158.
[12] 李婷婷, 王君伟. 口蹄疫合成肽疫苗研究进展[J]. 动物医学进展, 2012, 33(4): 76-79.
[13] 王德芝, 周则卫, 刘鉴峰, 等. 心肌肌钙蛋白I(cTnI)合成肽制备、鉴定及抗体研究[J]. 免疫学杂志, 2013, 9(29): 796-799.
[14] 王秋玲, 张晶. 乙型肝炎病毒PreS1合成肽制备PreS1抗体及其应用[J]. 现代预防医学, 2004, 31(5): 794-795.
[15] 欧阳嘉, 李鑫, 潘宗敏, 等. Fmoc(9-芴甲氧羰基)法固相合成胸腺五肽[J]. 南京工业大学学报, 2005, 27(3): 61-64.
[16] 潘宇, 朱学军, 牟颖. 高效液相色谱法分析纯化合成肽[J]. 生命科学仪器, 2008, 9(6): 13-18.
[17] OHTA T, SASAKI S, OOHORI T, et al.α-Glucosidase inhibitory activity of a 70% methanol extract from ezoishige (Pelvetiababingtonii de Toni) and its effect on the elevation of blood glucose level in rats[J]. Biosci., Biotechnol., Biochem., 2002, 66(7): 1 552-1 554.
[18] DU Zhi-yun, LIU Rong-rong, SHAO Wei-yan, et al.α-Glucosidase inhibition of natural curcuminoids and curcumin analogs[J]. Eur. J. Med. Chem., 2006, 41(2): 213-218.
[19] 杨城, 管骁, 韩飞, 等. 木犀草素抑制酪氨酸酶活性的分子机制[J]. 分析测试学报, 2015, 34(5): 532-538.
Synthesis and characterization of brewer’s grains peptide with α-glucosidase inhibitory activity
FANG Yu-wenWUJin-hongWANGZheng-wuGANLiHEJia-junCHENShan-shanMAHong-chengSHIHai-ming
(FoodScienceandEngineering,SchoolofAgricultureandBiology,ShanghaiJiaotongUniversity,Shanghai200240,China)
Brewer’s grains peptide SS-5(sequence: Ser-Pro-Asp-Arg-Ser) was synthesized by solid-phase synthesis with Fmoc protect group. Then the crude synthetic peptide was purified and desalted by HPLC, and as a result the purity was over 95%. The inhibitory activity of synthetic peptide SS-5 toα-glucosidase was detected, and the results showed that it was influenced by salt ionic concentration and the lower concentration presented higher inhibility. Furthermore, the interaction between synthetic peptide SS-5 andα-glucosidase was confirmed by circular dichroism spectrum(CD) and fluorescence quenching assays.. Therefore, a fast method of obtaining brewer’s grains peptide SS-5 withα-glucosidase inhibitory activity in quantity was proposed in this paper.
solid-phase synthesis; alpha-glucosidase inhibitor; synthetic peptide SS-5; interaction
国家863计划课题(编号:2013AA102207);国家自然科学基金项目(编号:31471623,21276154);国家重点研发计划专项课题(编号:2016YFD0400206)
房郁雯,女,上海交通大学在读硕士研究生。
王正武(1961—),男,上海交通大学教授,博士。
E-mail: zhengwuwang@sjtu.edu.cn
2016-05-09
10.13652/j.issn.1003-5788.2016.08.001
吴金鸿(1978—),女,上海交通大学副研究员,博士。
E-mail: wujinhong@sjtu.edu.cn
