“化学键、分子结构与性质”专题例析与技巧归纳
2016-09-28江苏
◇ 江苏 王 莉
“化学键、分子结构与性质”专题例析与技巧归纳
◇江苏王莉
化学键、分子结构与性质考点是《选修3》的重要组成部分,近年高考对本部分知识的考查频率较高.
1 化学键
化学键是指物质内部相邻的原子之间强烈的相互作用,其本质有2种情况: 静电作用和电子对的共用.因化学键存在于除稀有气体单质以外的所有物质中,因此从化学键的角度上讲化学反应的本质就是“旧键的断裂和新键的形成”.从类型看,主要有共价键、离子键、金属键、配位键等.
1) 静电作用型化学键——离子键与金属键.二者特点:不具有方向性及饱和性.
2) 共价键理论.
a) 共价键含义:原子间通过电子对的共用而形成的化学键,具有饱和性、方向性.
b) 共价键类型.
类型1:σ键、π键.
分类依据:成键电子云重叠方式.σ键:头碰头(重叠程度大),π键:肩并肩(重叠程度小).
判断方法: 通过物质的结构式,可以快速有效地判断键的种类及数目,共价单键全为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键.
类型2: 极性键与非极性键.
分类依据:电子对是否偏移.极性键:偏移,偏向电负性较大的元素;非极性键:不偏移.
判断方法:A—A式为非极性键,A—B为极性键.
类型3: 单键、双键、三键.
分类依据:共用电子对数.单键:共用1对电子;双键:共用2对电子; 三键:共用3对电子.
类型4: 特殊的共价键——配位键
成键的2种微粒(A、B)中,一种(如A)提供孤对电子,另一种(如B)提供空轨道而形成的一种特殊的共价键.它可形象地表示为“A→B”(普通共价键则表示为“A—B”的形式),配位键属于极性键的一种.由金属离子或原子与某些分子或离子(配体)通过配位键结合形成的化合物叫配位化合物.
c) 共价键性质的描述方式,如表1所示.

表1
2 分子的立体构型理论
1) 价层电子对互斥理论.
价层电子对理论指出:分子的立体构型是“价层电子对”相互排斥的结果,价层电子对包括σ键电子对与中心原子上的电子对.中心原子的价层电子对数、杂化类型与粒子的立体构型关系如表2所示.
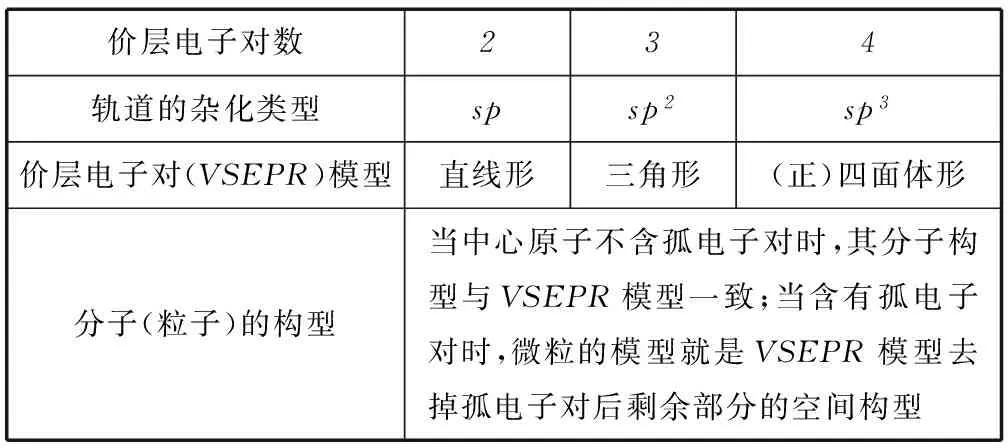
表2
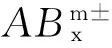


c)σ键电子对数等于中心原子结合的原子数.
2) 杂化轨道理论.
a) 杂化轨道:在形成分子的过程中,中心原子中若干个不同能级、能量相近的原子轨道混合起来,重新组成的新轨道.
b) 杂化轨道的数目与组成杂化轨道的各原子轨道数目相等,各杂化轨道的能量相等,参与杂化的各原子轨道的成分平均分配到各杂化轨道中.
c) 杂化轨道的类型及含义如表3所示.

表3
杂化轨道形成的化学键均是σ键.

(2) 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液.
① [Ni(NH3)6]SO4中阴离子的立体构型是________.
② 在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________.
③ 氨的沸点____(“高于”或“低于”)膦(PH3),原因是____;氨是____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为____.
(3) 单质铜及镍都是由________键形成的晶体:

(3) 铜、镍为金属,故由金属键构成.
复习重要知识的同时,不要忽略本专题其他知识的复习,仅是对知识点要求程度不同而已.
江苏省海安县李堡中学)
