嗜热菌β-葡萄糖苷酶A基因的克隆表达及转化大豆异黄酮糖苷
2016-09-16王锐丽薛业敏
王锐丽,孙 伟,薛业敏
(1.信阳农林学院 生物与制药工程学院,河南 信阳 464000;2.南京师范大学 金陵女子学院,江苏 南京 210097)
嗜热菌β-葡萄糖苷酶A基因的克隆表达及转化大豆异黄酮糖苷
王锐丽1,孙伟1,薛业敏2
(1.信阳农林学院 生物与制药工程学院,河南 信阳 464000;2.南京师范大学 金陵女子学院,江苏 南京 210097)
对嗜热厌氧乙醇菌(Thermoanaerobacter ethanolicus)JW200基因组DNA中β-葡萄糖苷酶A基因(Te-BglA)进行PCR扩增,构建重组质粒pET-20b-Te-BglA,并对纯化的重组酶Te-BglA的酶学性质和动力学参数进行研究。结果表明,基因Te-BglA在Escherichia coli细胞中成功表达,获得重组酶Te-BglA,该酶的最适温度和pH值分别为80℃和7.0。以对硝基苯酚-β-葡萄糖苷(pNPG)为底物时,Km值为(0.78±0.02)mmol/L,Kcat/Km值为(6.86±0.16)×104L/(mol·s);以天然底物水杨苷为底物时,Km值为(5.18±0.10)mmol/L,Kcat/Km值为(2.04±0.02)×104L/(mol·s),两者比较可知,重组酶Te-BglA表现出对pNPG更好的亲和力和更高的催化效率常数。该酶在80℃保温1 h后相对于冰浴中(未保温)的酶活仍有70.1%的残留,在pH 4.5~8.0区间仍保持较高的pH稳定性。酶解大豆粉的结果表明,重组酶Te-BglA在80℃作用3 h后,大豆黄素和染料木素的产量分别达到35.9 mg/g和59.1 mg/g。
β-葡萄糖苷酶;酶学性质;大豆异黄酮糖苷;苷元
大豆异黄酮因具有抗肿瘤作用、缓解更年期综合征、抗辐射、延缓衰老等功效而成为国内外研究热点[1-3]。目前研究发现的12种大豆异黄酮根据结构的不同分为两大类:游离型苷元(染料木素、大豆素和黄豆黄素,占有比例少)和结合型糖苷,约占总量的97%~98%。药理学研究发现,大豆异黄酮的作用特点与虎仗中的白藜芦醇苷等中药类糖苷类似[4-6],即被人体肠道吸收的是它的苷元形式,糖苷形式必须转化为相应的苷元才能真正发挥药效。常用的转化方法有酸水解法、微生物发酵法和酶水解法等。酸水解虽然高效,但污染环境。大豆异黄酮糖苷水解酶(β-葡萄糖苷酶)水解或相关微生物发酵因条件温和而成为一种理想的转化途径[7-9]。虽有很多来源于细菌或真菌转化大豆异黄酮糖苷β-葡萄糖苷酶的报道,但有关耐热性高效水解糖苷的β-葡萄糖苷酶的报道却很少。耐热性酶在生物转化过程中具有减少污染、加快反应速度、提高底物溶解度和易于大规模生产等优势。SUZUKI H等[10]研究发现大豆根含β-葡萄糖苷酶是对异黄酮糖苷专一性最高的,但该酶稳定性不高。来源于嗜热菌ThermoanaerobacterpseudethanolicusATCC 33223的β-葡萄糖苷酶A具有很好的转糖苷活性和热稳定性[11]。嗜热厌氧乙醇菌(Thermoanaerobacter ethanolicus)JW200菌株与T.pseudethanolicusATCC 33223属于同属不同种的菌株,为获得具有高热稳定性和高效转化大豆异黄酮糖苷的β-葡萄糖苷酶,本研究根据GenBank公布的T.pseudethanolicusATCC 33223的BglA基因序列设计引物,利用基因工程的方法实现T.ethanolicusJW200的β-葡萄糖苷酶A在大肠杆菌中的重组表达,并对重组酶(Te-BglA)的酶学性质、动力学参数和酶解大豆粉中大豆异黄酮糖苷作用进行研究,为β-葡萄糖苷酶A的工业应用提供理论基础。
1 材料与方法
1.1材料与试剂
嗜热厌氧乙醇菌(T.ethanolicus)JW200由美国佐治亚大学微生物系分离;大肠杆菌(Escherichia coli)DH10B(用于质粒扩增和分子克隆等过程)、E.coliJM109(DE3)(作为目的基因的表达宿主):均购于普洛麦格生物技术有限公司。
限制酶XbaⅠ、XhoⅠ:日本TAKARA公司;水杨苷(salicin)、对硝基苯酚-β-D-葡萄糖苷(pNPG)、染料木素(genistein,G)、染料木苷(gensitin,Gin)和大豆黄苷(daidzin,Din):美国Sigma公司;丙二酰基染料木苷(6-malonyl-gensitin,M-Gin)、大豆黄素(daidzein,D)、丙二酰基大豆黄苷(6-malonyl-daidzin,M-Din):伊普瑞斯科技有限公司。
液体LB培养基:胰蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L。
1.2仪器与设备
Hybaid聚合酶链反应(polymerasechainreaction,PCR)扩增仪:美国Thermo公司;MicroPulser基因导入电穿孔仪:美国Bio-Rad公司;Scientific Sorvall Stratos高速冷冻离心机:美国Thermo公司;1200系列高效液相色谱(high-performance liquid chromatography,HPLC)仪:美国Agilent公司;DYCP-31CN琼脂糖水平电泳仪:北京新诺立华仪器有限公司。
1.3方法
1.3.1重组质粒pET-20b-Te-BglA的构建
根据GenBank公布的海栖热袍菌(Thermotoga maritime)MSB8基因组序列上的BglB基因序列和Thermoanaerobacter pseudethanolicusATCC 33223的BglA基因序列设计相应引物P1:5′GCTCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGATAAAATTT CCAAAAGA3′和引物P2:5′CCCCTCGAGCTCAATAGA ATTTTTCTGT3′,以T.ethanolicusJW200基因组为模板进行PCR扩增。PCR扩增参数设定为:先在95℃变性5 min,加Pyrobest DNA聚合酶1 μL;然后94℃变性30 s,52℃退火40s,72℃延伸2min,循环30次后,72℃保温10min。PCR产物经回收柱纯化后用XbaⅠ和XhoⅠ双酶切,插入到用XbaⅠ和XhoⅠ双酶切后的质粒pET-20b中,于16℃连接过夜,将连接液电转化感受态细胞E.coliDH10B。挑取阳性克隆,提取质粒,用双酶切验证。送至上海美吉生物技术公司测序,正确的转化子命名为pET-20b-Te-BglA。
1.3.2重组酶的表达和纯化
将重组质粒pET-20b-Te-BglA电转化于E.coliJM109(DE3),挑取单菌落接入含氨苄霉素(Ampicillin,Amp)抗性的液体LB培养基中,37℃培养过夜。然后以1.5%接种量接入到750mL含Amp抗性液体LB培养基中,振荡培养至OD600nm达0.8左右加入异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)至浓度0.05 mmol/L,继续诱导培养5 h后,离心,收集细胞。用Rapid Affinity Purification Kit中的结合缓冲液悬浮细胞,经高压破碎,13 000 r/min离心20 min,取上清液于70℃热处理20 min,离心得粗酶液。粗酶液再经Ni2+亲和层析纯化,快速提取法按Novagen的产品说明进行,以每管1mL收集酶活的峰值部分,纯化的酶液采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测纯度。
1.3.3重组酶活性测定
β-葡萄糖苷酶活性由底物pNPG释放对硝基苯酚(pNP)的量确定,采用分光光度法[10]。一个酶活力单位(U)定义:在一定反应条件下,1 min内催化产生1 μmol pNP所需的酶量。
1.3.4重组酶的酶学性质[11]
最适反应温度的测定:将重组酶液pH值调节为6.2[11],在30~95℃范围内每隔5℃,反应10 min后测定β-葡萄糖苷酶A酶活,以最高酶活为100%,计算相对酶活。
温度稳定性的测定:将重组酶置于最适pH条件下,在65~95℃范围内每隔5℃的温度条件下保温1 h,然后加底物于最适温度和最适pH条件下测定其活性。以保存于冰浴中(未保温)的酶活性为100%,计算酶在不同温度保温1 h后的残留活性,并制作重组酶温度稳定性曲线。
最适pH的测定:将重组酶液置于不同pH条件下,于最适温度条件下测定其活性,以最高酶活为100%,计算相对酶活性。
pH稳定性的测定:将重组酶置于20 μL的100 mmol/L不同pH的邻苯二甲酸氢钾-咪唑缓冲液中,于37℃保温1 h,冷却后补加相应的底物和缓冲液达到200 μL,再于最适条件测定其活性。以保存于冰浴中(未保温)的酶活性为100%,计算酶在不同pH保温1 h后的残留活性,制作重组酶pH稳定性曲线。
1.3.5动力学参数的测定
用pH 7.0邻苯-咪唑缓冲液配制浓度为1.0~10 mmol/L的水杨苷(salicin)作为底物,反应体系为100 μL,包括10 μL不同浓度的水杨苷,酶液10 μL,其余用缓冲液补足。80℃下反应10 min,取出,加75 μL 3,5-二硝基水杨酸(3,5-dinitrosalicylicacid,DNS),煮沸5min,冰水冷却,加1075μL水,混匀,在波长520 nm处测定吸光度值以检测葡萄糖的生成量。配制浓度为0.2~2.0 mmol/L的pNPG作为底物,反应体系为200μL,包括10μLpNPG,酶液10μL,其余用缓冲液补足,于80℃反应5min,冰水冷却后加入600 μL 1 mol/L的Na2CO3溶液终止反应并显色,在波长410 nm处测定吸光度值以检测pNP的生成量。然后采用Lineweaver-Burk双倒数作图法,计算重组酶的米氏常数(Km)、最大反应速度(Vmax)、酶的转换数(Kcat)(Kcat=最大反应速度/蛋白摩尔数)、和催化效率常数(Kcat/Km)等。其中,Km值越小表示酶的亲和力越好;Kcat/Km值越大表示酶的催化效率越高。
1.3.6重组酶Te-BglA转化大豆异黄酮糖苷大豆粉的酶解试验
称取0.1 g脱脂大豆粉,以料液比1∶10(g∶mL)溶于pH 7.0,250 mmol/L的磷酸缓冲液中,加酶量为50 U/g,然后于65℃分别酶解10 min和3 h,在冰浴条件下终止反应,离心,收集上清,冷冻干燥。经干燥后的上清干粉与沉淀分别用1mL80%甲醇重悬,30℃提取2 h,13 000 r/min离心20 min,取上清液,经微孔滤膜过滤后取20 μL进行HPLC分析。以不加酶的试验组为对照组。
重组酶Te-BglA转化大豆异黄酮糖苷大豆粉的活性是由底物Gin、M-Gin释放出G的量,由底物Din、M-Din释放出D的量来确定,采用高效液相色谱(high performance liquid chromatography,HPLC)法[12]分析。色谱条件:Agilent HC-C18色谱柱(250 mm×4.6 mm,5 μm);检测波长260 nm;柱温度30℃;流动相A:0.1%的磷酸水溶液,流动相B:乙腈,45 min内,流动相A由85%降至65%;流速:0.8 mL/min[13]。一个酶活单位(U)定义为:在该条件下,1 min内催化产生1 μmol的苷元类物质(G、D)所需要的酶量。以峰面积(A)与标准品(G、D)的量(B)作标准曲线,分别得线性回归方程A1=11.44B1+317.94(R2=0.999 6)和A2=14.15B2+541.49(R2=0.999 3)。
以反应前后峰面积大小的相对比值表示大豆异黄酮糖苷的转化率,异黄酮苷元产量用100 g脱脂大豆粉产生的异黄酮苷元的质量(mg)表示,以不加酶的试验组为对照组。大豆异黄酮糖苷的转化率计算公式如下所示:
转化率=反应一定时间(10 min或3 h)的峰面积/反应0 min时的峰面积。
2 结果与分析
2.1重组质粒pET-20b-Te-BglA的构建
以嗜热厌氧乙醇菌JW200基因组为模板,利用引物P1和P2扩增的Te-bglA基因片段为1.34 kbp,结果见图1。
由图1A可知,扩增的DNA片段的电泳图中没有明显的非特异性条带,说明所选PCR扩增条件能有效扩增Te-bglA基因片段。由图1B可知,对于已构建的重组质粒pET-20b-Te-BglA采用XbaⅠ和XhoⅠ双酶切,得到线性的pET-20b质粒载体和插入的Te-BglA基因片段,大小分别为3.7kbp和1.34 kbp,与预计结果相同。测序结果表明质粒pET-20b-Te-BglA构建成功。

图1 Te-bglA基因(A)和酶切的重组质粒(B)PCR扩增电泳图Fig.1 PCR amplification electrophoregram of Te-bglA gene(A)and restriction digestion of the recombinant plasmid(B)
2.2重组酶的表达和纯化
将重组质粒pET-20b-Te-BglA电转化于E.coliJM109(DE3)中,挑取E.coliJM109(DE3)单菌落接种于液体LB培养基中经IPTG诱导后,收集细菌经高压破碎,上清液经热处理和Ni2+亲和层析两步纯化操作,所得重组酶经SDSPAGE检测结果见图2。

图2 纯化的重组酶Te-BglA的SDS-PAGE电泳图Fig.2 SDS-PAGE electrophoretogram of purified recombinase Te-BglA
由图2可知,所得重组酶Te-BglA蛋白条带在泳道中单一均匀分布,与预期的蛋白分子质量一致,证明重组酶Te-BglA已成功被纯化。
2.3重组酶的最适反应温度和最适pH以及对温度和pH稳定性
通过在不同温度和pH值条件测定重组酶的相对酶活,确定重组酶的最适反应温度和最适pH以及对温度和pH的稳定性,结果见图3。

图3 重组酶Te-BglA的最适温度(A)、最适pH(B)、热稳定性(C)和pH稳定性(D)的检测结果Fig.3 Detection results of the optimum temperature(A),pH(B),thermostability(C)and pH stability(D)of recombinase Te-BglA
用pNPG作为底物,测得温度和pH值对重组酶β-葡萄糖苷酶相对酶活的影响,由图3A可知,在温度70~80℃之间,酶的相对活性都在80%;当反应温度为80℃,重组酶的相对酶活达到最高,为100%;当温度超过80℃,其相对活性急剧下降。由图3B可知,重组酶的相对酶活随着pH值的增加,先增加后降低;当反应处于pH 5.8~7.8时,重组酶的相对酶活均在70%以上;当pH值为pH 7.0时,重组酶的相对酶活达到最高,为100%。因此重组酶的最适温度和pH值分别为80℃和7.0。
由图3C可知,将重组酶Te-BglA于80℃保温1 h后测得其活性,相对于保存于冰浴中(未保温)的酶活性有70.1%的残留活性,于85℃保温1 h仍有51.7%的残留活性。当把温度提高到为95℃时,酶活性几乎检测不出。在已报道的水解大豆异黄酮糖苷的β-葡萄糖苷酶具有高稳定性的较少,只有来自嗜热拟青霉(Paecilomyces thermophila)的重组β-葡萄糖苷酶在70℃保温1 h,只能保持20%的残存活性[14]。将重组酶Te-BglA置于100 mmol/L不同pH缓冲液中,37℃保温1 h,再测酶的残留活性,由图3D可知,在pH 4.5~8.0范围内重组酶都保持很高的pH稳定性。
2.4动力学参数
重组酶Te-BglA以天然底物水杨苷和人工底物pNPG作为底物,计算重组酶Te-BglA的动力学参数,结果见表1。由表1可知,以pNPG为底物时,Km值为(0.78±0.02)mmol/L,Kcat/Km值为(6.86±0.16)×104L/(mol·s);以水杨苷为底物时,Km值为(5.18±0.10)mmol/L,Kcat/Km值为(2.04±0.02)×104L/(mol·s),两者相比,重组酶Te-BglA表现出对pNPG更好的亲和力和催化效率。重组酶对天然底物水杨苷的Km值要高于来自另一种嗜热菌海栖热袍菌的β-葡萄糖苷酶[11],推测该酶可能也能降解纤维素寡糖和糖苷异黄酮等其它的天然底物。

表1 重组酶Te-BglA的动力学参数Table1 Kinetic parameters of recombinase Te-BglA
2.5重组酶Te-BglA酶解大豆粉试验
重组酶Te-BglA酶解大豆粉试验结果见图4和表2。
由图4的峰型图可知,脱脂大豆粉中主要的四种大豆异黄酮糖苷经重组酶Te-BglA酶解作用后,其含量大幅度减少,而相应的苷元产量增加明显。由表2可知,于65℃作用脱脂大豆粉10 min后,Din和Gin被重组酶Te-BglA完全降解。酶解3 h后,M-Din和M-Gin也被重组酶Te-BglA完全降解,产生相应的异黄酮苷元。重组酶Te-BglA与大豆粉反应10 min之后,Din和Gin的产率就分别达到20.4 mg/g和47.7 mg/g。在不加酶的对照组,反应10 min后,Din和Gin的产率只有0.6 mg/g和1.4 mg/g。可见在重组酶Te-BglA的作用后,苷元产量大幅度增加。
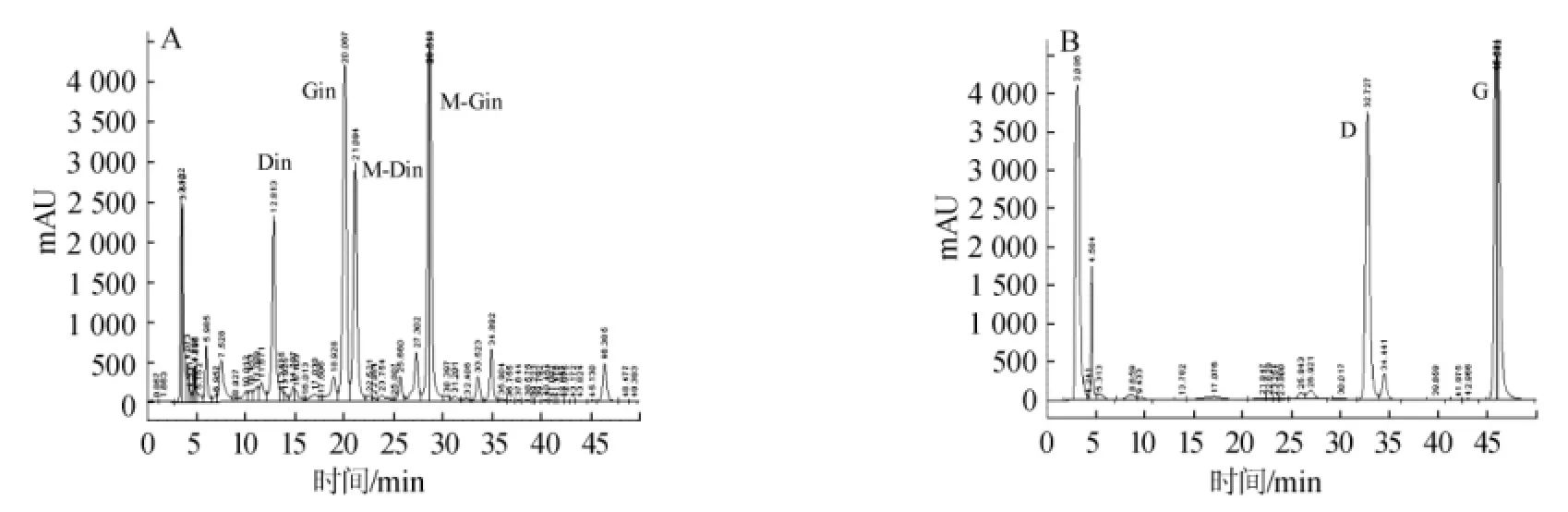
图4 未加酶(A)和酶处理3 h后(B)的脱脂大豆粉中大豆异黄酮成分的HPLC色谱图Fig.4 HPLC chromatogram of soy isoflavone component in soybean meal without enzyme processing(A)and with enzyme processing for 3 h(B)

表2 重组β-葡萄糖苷酶A水解脱脂大豆粉的结果Table 2 Results of defatted soybean meal hydrolysed by the recombinant β-glucosidase A
3 结论
糖苷形式的大豆异黄酮不具有最佳的生理活性状态,须在大豆异黄酮糖苷酶的作用下转化成苷元形式才能被吸收而发挥药效[15-16]。因此,筛选出高效的转化糖苷的β-葡萄糖苷酶成为项目的目标。为获得具有高稳定性和高效转化大豆异黄酮糖苷的β-葡萄糖苷酶A,本研究从T.ethanolicusJW200基因组DNA中PCR扩增β-葡萄糖苷酶A基因(Te-BglA),对其进行重组表达,获得重组酶Te-BglA。该酶经热处理和Ni2+亲和层析纯化,纯化的酶液采用SDS-PAGE检测其纯度,并对纯化的重组酶Te-BglA的酶学性质和动力学参数进行研究。结果表明,本研究成功实现Te-BglA在E.coliJM109(DE3)细胞中的表达,获得重组酶Te-BglA。以pNPG作为底物,重组酶Te-BglA的最适温度和最适pH值分别为80℃和7.0。从动力学参数方面可知,以pNPG为底物时,Km值为(0.78±0.02)mmol/L,Kcat/Km值为(6.86±0.16)×104L/(mol·s);以水杨苷为底物时,Km值为(5.18±0.10)mmol/L,Kcat/Km值为(2.04±0.02)×104L/(mol·s),两者比较可知,重组酶Te-BglA表现出对pNPG更好的亲和力和更高的催化效率常数。将酶在80℃保温1 h后,相对于冰浴中(未保温)的酶活仍有70.1%的残留活性,在pH 4.5~8.0区间重组酶Te-BglA保持较高的pH稳定性。HPLC分析酶解大豆粉的结果表明,重组酶Te-BglA在80℃作用3 h后,大豆黄素和染料木素的产量分别达到35.9 mg/g和59.1 mg/g。
针对重组酶Te-BglA热稳定性高的特点,如将该酶直接用于大豆异黄酮的热提取过程中,使原料中的大豆异黄酮边抽提边转化以制备大豆异黄酮苷元,改善原有的两步法,从而缩短生产周期短和降低成本[17]。可见从T.ethanolicusJW200克隆的重组Te-BglA在开发富含大豆异黄酮苷元的保健食品上具有潜在的应用价值。
[1]WADA K,NAKAMURA K,TAMAI Y,et al.Soy isoflavone intake and breast cancer risk in Japan:From the Takayama study[J].Int J Cancer,2013,133(4):952-960.
[2]LIMA F S,IDA E I.Optimization of soybean hydrothermal treatment for theconversionofβ-glucoside isoflavonesto aglycones[J].Food Sci Tech,2014,56(2):232-239.
[3]翟清燕.高产游离型大豆异黄酮乳酸菌的筛选鉴定及其在发酵豆乳中的应用[D].泰安:山东农业大学硕士论文,2014.
[4]鲁玮,岳冬冬,刘新育,等.黑曲霉产β-葡萄糖苷酶的纯化及对中药糖苷类成分的转化[J].中国医药工业杂志,2014,45(3):220-223.
[5]张琳,武胜奇,雄正英.白藜芦醇的生物学作用及其在运动医学中的应用研究[J].体育学刊,2005,12(3):57-60.
[6]YOO D,HARA T,FUJITA N,et al.Transcription analyses ofGmlCHG,a gene coding for a β-glucosidase that catalyzes the specific hydrolysis of isoflavone conjugates inGlycine max(L.)Merr[J].Plant Sci,2013(208):10-19.
[7]YEOM S J,KIM B N,KIM Y S,et al.Hydrolysis of isoflavone glycosides by a thermostable β-glucosidase fromPyrococcus furiosus[J].JAgr Food Chem,2012,60(6):1535-1541.
[8]孙正博,吴周和,董青,等.大豆异黄酮β-葡萄糖苷酶产生菌的选育及产酶条件研究[J].中国酿造,2006,25(5):7-11.
[9]KIM B N,YEOM S J,KIM Y S.Characterization of a β-glucosidase fromSulfolobus solfataricusfor isoflavone glycosides[J].Biotechnol Lett,2011,34(1):125-129.
[10]SUZUKI H,TAKAHASHI S,WATANABE R,et al.An isoflavone conjugate-hydrolyzing β-glucosidase from the roots of soybean(Glycine max)seedlings:Purification,gene cloning,phylogenetics,and cellular localization[J].J Biol Chem,2006,281(40):30251-30259.
[11]XUE Y M,YU J J,SONG X F.Hydrolysis of soy isoflavone glycosides by recombinant β-glucosidase from hyperthermophileThermotoga maritima[J].J Ind Microbiol Biotechnol,2009,36(11):1401-1408.
[12]XUE Y M,SONG X F,YU J J.Overexpression of β-glucosidase from Thermotoga maritimefor the production of highly purified aglycone isoflavones from soy flour[J].World J Microbiol Biotechnol,2009, 25(12):2165-2172.
[13]CHUANKHAYAN P,RIMLUMDUAN T,SVASTI J,et al.Hydrolysis ofsoybean isoflavonoid glycosides byDalbergiaβ-glucosidase[J].J Agr Food Chem,2007,55(6):2407-2412.
[14]YANG S Q,WANG L J,YAN Q J,et al.Hydrolysis of soybean isoflavone glycosides by a thermostable beta-glucosidase fromPaecilomyces thermophila[J].Food Chem,2009,115(4):1247-1252.
[15]ISMAIL B,HAYES K.β-glycosidase activity toward different glycosidic forms of isoflavones[J].J Agric Food Chem,2005,53(12):4918-4924.
[16]GABRIELA P M A,LORENA G D A L,MAIRA A,et al.Hydrolysis of soybean isoflavones byDebaryomyces hanseniiUFV-1 immobilised cells and free β-glucosidase[J].Food Chem,2014(146):429-436.
[17]张慧,邱日永,刘明杰,等.极耐热性β-葡萄糖苷酶基因克隆、超量表达及其在天然蓝色素工业化生产中的应用[J].江苏农业科学,2013,41(7):19-22.
Cloning and expression β-glucosidase A gene fromThermoanaerobacter ethanolicusfor conversion of soybean isoflavone glycosides
WANG Ruili1,SUN Wei1,XUE Yemin2
(1.College of Biological and Pharmaceutical Engineering,Xinyang College of Agriculture and Forestry,Xinyang 464000,China;2.College of Ginling,Nanjing Normal University,Nanjing 210097,China)
In order to obtain a high stability and efficiency β-glucosidase A(BglA)in the biotransformation of isoflavone glycosides,β-glucosidase gene was amplified by PCR from the genomic DNA ofThermoanaerobacter ethanolicusJW200,and produced inEscherichia coliJM109(DE3)and purified by nickel affinity chromatography for characterization of their enzymatic and kinetic properties.p-nitrophenyl-β-D-glucoside(pNPG)as substrate,optimal temperature and pH of the BglA were 80℃and 7.0,KmandKcat/Kmof BglA were(0.78±0.02)mmol/L and(6.86±0.16)×104L/(mol·s),respectively.The salicin as substrate,KmandKcat/Kmwere(5.18±0.10)mmol/L and(2.04±0.02)×104L/(mol·s),which demonstrated that the recombinant Te-BglA showed better affinity for pNPG and higher catalytic efficiency constant.And BglA was found to be greater stability which kept 70.1% activity of 1 h at 80℃and pH 4.5-8.0.High performance liquid chromatography(HPLC)results demonstrated that the effect of enzyme hydrolysis soybean isofavone glycosides to isoflavone aglycones was evident at 80℃for 3 h,the yield of soybean daidzein and genistein reached 35.9 mg/g and 59.1 mg/g.
β-glucosidase;enzymology property;soybean isoflavone glycoside;aglycone
Q93
0254-5071(2016)03-0114-06
10.11882/j.issn.0254-5071.2016.03.026
2015-12-12
河南省科技攻关资助项目(132102110047)
王锐丽(1985-),女,讲师,硕士,研究方向为微生物学及分子生物学。
