固定化重组大肠杆菌细胞催化合成靛蓝
2016-09-15程丹丹徐天虹赵玉婷肖其敏
程丹丹,徐天虹,王 舒,赵玉婷,肖其敏
(1.浙江理工大学生命科学学院,杭州 310018;2.南京市第二十九中学,南京 210036;3.东南大学医学院生物工程学系,南京 210009)
固定化重组大肠杆菌细胞催化合成靛蓝
程丹丹1,徐天虹2,王舒3,赵玉婷3,肖其敏2
(1.浙江理工大学生命科学学院,杭州 310018;2.南京市第二十九中学,南京 210036;3.东南大学医学院生物工程学系,南京 210009)
为提高表达黄素单加氧酶(FMO, E.C.1.14.13.8)的重组菌E.coliBL21(pET28a-fmo)转化吲哚的效率,采用包埋法对重组菌进行了固定化研究。采用常规的固定化方法,分别使用卡拉胶、明胶、聚乙烯醇、海藻酸钠对重组大肠杆菌进行包埋并分析各自对吲哚的转化效果,确定了海藻酸钠是较好的固定化载体。随后对海藻酸钠固定化条件进行研究,得到合适的条件是:海藻酸钠浓度为2.0%,CaCl2浓度为2.0%,固定化时间8 h,细胞包埋量50 g/L。采用该方法制备的固定化细胞靛蓝的转化率为58.6%,固定化后重组E.coli细胞的耐热性明显提高,且具有较好的操作稳定性,重复催化第8次的转化率为第1次的29.5%,说明固定化细胞转化法确实提高了重组细胞的转化吲哚合成靛蓝的效率。
重组大肠杆菌;固定化;生物合成;靛蓝
0 引 言
靛蓝是最早发现也是使用量最大的染料之一,在纺织、食品、医药等领域具有广泛的运用。微生物合成靛蓝工艺以其高效、环境友好等优点备受关注[1]。早在1929年就有微生物合成靛蓝的报道,但是野生型的菌株合成靛蓝的效率低、副产物多。1983年,Ensley等[2]首次使用表达萘双加氧酶的基因工程菌进行靛蓝生物合成,利用重组氧化酶转化合成靛蓝成为研究热点[3]。该研究表明,通过双加氧、单加氧或环氧化途径均可催化吲哚合成靛蓝。基因工程技术和分子进化技术可以获得一些转化率高、纯度高的酶,但是由于底物吲哚在水中的溶解度低、对微生物的毒性以及对催化法反应的抑制作用等原因,终产物靛蓝的浓度始终维持在较低水平,与工业化生产有一定的距离。
固定化细胞技术使得生物催化剂可以重复利用,提高了转化效率。通过包埋、交联、吸附等手段,固定化技术将游离的微生物细胞固定于载体孔径之间,有利于产物的分离,提高了生物转化的稳定性[4]。固定化细胞转化靛蓝的报道,目前有两例:陆悦飞[5]利用中空海藻酸钠微胶囊固定重组P450 BM3工程菌制备靛蓝,取得了30mg/L培养基的靛蓝产出,得率45.56%。曲媛媛等[6]将固定化技术与两相反应体系相结合,既可以使水相中的吲哚保持在一个适宜的浓度,也可以将产生的靛蓝萃取出来。这不仅降低了吲哚的毒害作用和终产物的反馈抑制,还有利于靛蓝的分离和纯化。目前靛蓝生物合成产业化最大的瓶颈之一,是底物的溶解性低,转化得到的靛蓝终浓度也不高,产量上受到很大的限制。固定化细胞进行转化反应的优点,在于完成一次催化过程后,可以及时和产物分开,再进入下一轮催化过程,这样生物催化剂得到反复利用,提高了重组细胞的催化效率,靛蓝的累积产量也得以增加。影响重组菌转化吲哚合成靛蓝效率的因素有很多,如:工程菌FMO诱导表达的条件、固定化条件、固定化颗粒的理化性质、转化过程中底物的浓度、时间、pH、温度、辅助因子的再生等。黄素单加氧酶(flavin-containing monooxygenase, FMO)是转化靛蓝的一个重要的酶种,其工艺研究仅限于游离细胞的转化。本文仅对表达黄素单加氧酶的重组工程菌E.coliBL21(pET28a-fmo)的固定化条件进行了研究。
1 实 验
1.1材料
1.1.1菌种
工程菌E.coliBL21(pET28a-fmo)菌株,携带黄素单加氧酶表达质粒,由东南大学生物工程实验室保存。
1.1.2 培养基
LB培养基(g/L):胰蛋白胨 10,酵母抽提物 5,NaCl 10。
1.1.3 试剂
无水氯化钙、氯化钾、硼酸、吲哚、正辛烷、己二胺、戊二醛、反丁烯二酸、N,N-二甲基甲酰胺等均为国产分析纯试剂。Tris-HCl(0.05 M, pH 7.0)缓冲液、磷酸盐缓冲液(0.1 M, pH 7.4)、异丙基硫代半乳糖苷(IPTG)、卡拉胶、明胶、海藻酸钠、聚乙烯醇等购自南京生兴生物技术有限公司。
吲哚显色剂:准确称取3.725g对二甲氨基苯甲醛,溶于47.4mL无水乙醇中,再加入2.6mL 98%浓硫酸,现配现用。
1.2方法
1.2.1 重组大肠杆菌细胞的培养和制备
培养方法见文献[7]。挑取工程菌E.coliBL21(pET28a-fmo)单菌落于3mL LB液体培养基(含卡那霉素50μg/mL,下同)中,于37 ℃、200 r/min震荡培养过夜,将过夜培养物1 mL转移至100 mL液体LB培养基中,于37 ℃、200 r/min下振荡培养至OD600值为0.6~0.8,加入IPTG至终浓度0.2 mmol/L,温度调节到30 ℃,继续培养4 h,离心收集菌体,并用0.1 mol/L磷酸盐缓冲液清洗,于3 000 r/min、4 ℃离心3 min,洗涤,称重,每1 g湿菌体加5 mL缓冲液重悬制备菌悬液,备用。
1.2.2重组大肠杆菌的固定化
分别采用以下四种不同包埋方法固定重组大肠杆菌细胞,并以此为生物催化剂,按照1.2.4对吲哚溶液进行转化。固定后测定靛蓝转化效率时,在底物浓度、反应浓度、pH等反应条件相同下,检测不同固定化材料制备的重组大肠杆菌对吲哚的转化效率。
固定化方法参考文献[8],略有改动,具体操作如下。
卡拉胶包埋法:用生理盐水配制5%卡拉胶溶液,取15 mL卡拉胶溶液与制备好的菌悬液5 mL(含1 g湿菌体,下同)混合,用注射针头将混合液滴入15 ℃、0.3 mol/L的KCl溶液,形成的颗粒在KCl溶液中浸泡0.5 h后,转移到85 mmol/L己二胺溶液,5 ℃下摇动10 min,加入0.3 mol/L戊二醛溶液,5 ℃下摇动30 min,再用0.3 mol/L的KCl溶液洗涤,放入1.0 mol/L的反丁烯二酸溶液,37 ℃下活化。
明胶包埋法:配制10%的明胶溶液,取15 mL冷却至室温,加入前面制备好的菌悬液5 mL,充分混合后倒入平板,凝固后切块,称重,加入0.5%戊二醛溶液交联2h,洗涤,去除多余的戊二醛。
聚乙烯醇包埋法:聚乙烯醇溶于热水制备10%PVA溶液,取15 mL与5 mL制备好的菌悬液混合均勺,将混合液倒入已灭菌的培养皿中,缓慢加入饱和硼酸溶液,浸泡6h,滤出固定化颗粒,用生理盐水洗净,备用。
海藻酸钠包埋法:海藻酸钠加热溶于水制备成2%溶液,取15 mL与制备好的5 mL菌悬液混合,用注射器针管将混合液滴入3%CaCl2溶液中,4 ℃放置10 h,滤出颗粒,用生理盐水洗净,备用。
1.2.3海藻酸钠包埋条件的的选择
按照1.2.2中“海藻酸钠包埋法”以及1.2.4中“固定化细胞对吲哚的转化”的方法,通过其它条件不变时,分别比较不同海藻酸钠浓度、CaCl2浓度、钙化时间以及包埋菌体浓度对靛蓝转化的影响。
1.2.4固定化细胞对吲哚的转化
将按上述固定化方法制备的固定化大肠杆菌细胞(均含1 g湿菌体)放入50 mL Tris-HCl (0.05M, pH7.4)缓冲液中,加入吲哚至最终浓度为50 mg/L,35 ℃、200 r/min下摇瓶培养16 h,按照1.2.6用比色法对靛蓝进行定量分析。
1.2.5固定化细胞热稳定性与操作稳定性实验
热稳定性实验:按照1.2.4中“固定化细胞对吲哚的转化”的方法,逐步升高反应温度进行吲哚转化,计算每一反应温度下的靛蓝转化率。
操作稳定性实验:按照1.2.4中“固定化细胞对吲哚的转化”的方法,进行吲哚转化。第一次反应结束后,离心收集固定化颗粒,测定反应体系中靛蓝转化率。使用Tris-HCl (0.05M, pH7.4)缓冲液洗涤颗粒3次,再加入反应液进行下一轮转化反应。如此反复,计算每一批次的靛蓝转化率。
1.2.6靛蓝和吲哚的定量分析
靛蓝和吲哚的定量分析均采用比色法[9-12]。
靛蓝分析:取转化液5mL,于12 000 r/min离心5 min,上清部分用于吲哚分析,沉淀部分用于靛蓝分析。沉淀用重蒸水洗两遍,再用2 mL N,N-二甲基甲酰胺溶解,再离心,取上清液于610 nm处测定吸光值,和标准曲线对照即得到靛蓝浓度。
吲哚分析:取上清液2.0 mL,加入吲哚显色剂2.0 mL,加水定容至5 mL,沸水浴10 min,冷却后加水定容至10 mL,于568 nm波长下测吸光值,和标准曲线对照即得到吲哚浓度。
靛蓝转化率的计算[13],靛蓝和吲哚的浓度单位均为mg/L。转化率(%)=[靛蓝浓度/(吲哚初始浓度-吲哚最终浓度)]×100.
2 结果与讨论
2.1固定化载体的选择
采用的4种固定化方法均含有1g重组大肠杆菌湿菌的细胞,以此为生物催化剂,按方法1.2.4对吲哚溶液进行生物转化。固定后测定靛蓝转化效率时,在底物浓度和反应浓度、pH等反应条件相同下,检测等量重组细胞在4种固定化载体中的转化得率,结果如表1所示。

表1 不同载体制备的固定化细胞转化吲哚的效率
聚乙烯醇有一定的细胞毒性,这也许是其转化率较低的原因。同时,聚乙烯醇凝胶、卡拉胶和明胶网格较紧密,扩散性能降低,影响了底物分子的传质过程,导致其催化活性降低。海藻酸钠具有对微生物毒性小、固定化细胞密度高等优点,从实际效果来看海藻酸钠的固定化转化率也最高。
2.2海藻酸钠固定化条件的选择
2.2.1海藻酸钠浓度的影响
海藻酸钠的浓度对靛蓝转换的影响结果如图1所示。
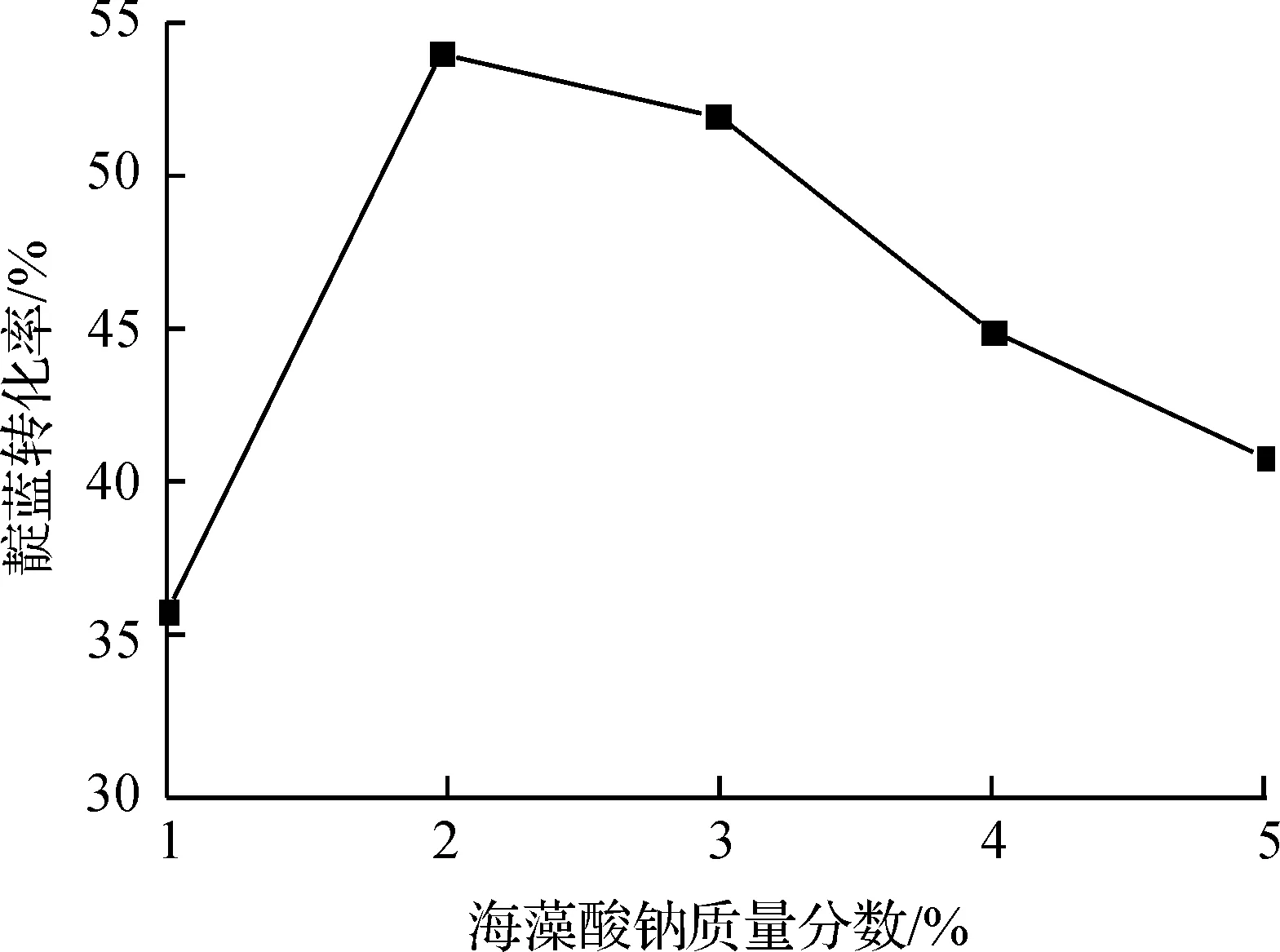
图1 海藻酸钙的浓度对靛蓝转换的影响
海藻酸钠的浓度直接影响固定化细胞的机械强度,同时也是底物扩散的影响因子。随着海藻酸钠浓度的升高,颗粒的机械强度增加,固定化颗粒的破损率减少。但海藻酸钠的浓度超过2%后,凝胶网格空隙变小,产物进入和底物扩散的阻力都增加,也会影响到微生物的转化效率。
2.2.2 CaCl2浓度的影响
CaCl2浓度对靛蓝转化率的影响,如图2所示。当CaCl2浓度为2%时,可以得到较高的转化率。

图2 CaCl2浓度对固定化效果的影响
海藻酸钠不能形成热可逆性凝胶,通常是在其溶液中加入Ca2+等二价离子,通过Ca2+取代Na+来形成凝胶网络,CaCl2浓度对固定化细胞的机械强度有直接影响。当CaCl2浓度较低时,固定化细胞颗粒的机械强度低,稳定性差,易膨胀破裂,导致其转化效果偏低;随着CaCl2浓度的增大,则会导致局部凝胶化,形成不连续的凝胶结构,降低扩散性能,导致转化效率降低。也可能由于盐的渗析作用,引起细胞脱水,致使部分微生物活性丧失。综合的结果是CaCl2浓度为2%时制备的固定化颗粒转化率较高。
2.2.3钙化时间对转化效率的影响
钙化时间对固定化细胞的转化效率的影响如图3所示。
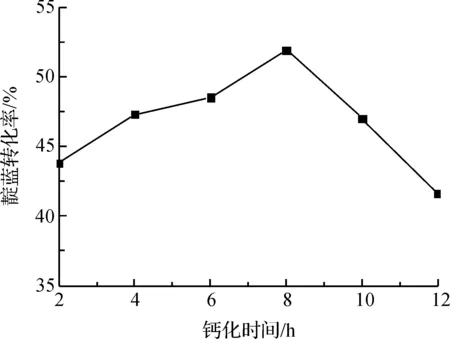
图3 钙化时间对靛蓝转化效率的影响
钙化时间较短时,外层凝胶网格过于稀疏,固定化颗粒外层钙化膜稀薄,强度低,重组细胞吸水膨胀易破裂,导致催化活力不高。随着钙化时间的延长,固定化颗粒的机械强度逐渐增强,靛蓝的转化效率也不断提高,并在8h达到最大值。但进一步延长钙化时间,固定化颗粒外层钙化膜致密,不利于重组细胞对底物的吸收,也不利于产物的扩散,导致转化率降低。因此,钙化时间8 h较为合适。
2.2.4包埋菌体浓度对转化效率的影响
包埋菌体浓度对转化效率的影响如表2所示。

表2 包埋菌体浓度对靛蓝转化效率的影响
一般而言,固定化颗粒的催化能力和包埋的微生物细胞数量成正比,但固定化颗粒的机械强度却与包埋的微生物细胞数量成反比。包埋的细胞数量增加,也会导致颗粒低破损率即菌体的损失增加,进而降低催化活力。从转化的效果看,50 g/mL为最适菌体包埋量。
2.3固定化细胞催化吲哚转化靛蓝
按以上最优条件,即海藻酸钠浓度2.0%,CaCl2浓度2.0%,固定化时间8 h,细胞包埋量50 g/L,制备的固定化细胞。将固定化的大肠杆菌细胞放入Tris-HCl(pH7.4)缓冲液中,加入吲哚至最终浓度为50 mg/L,35 ℃、200 r/min下摇瓶培养16 h,
比色法分析靛蓝浓度,计算出最后的的转化率为58.6%。
2.4固定化细胞的热稳定性
细胞经固定化后对温度稳定性的变化如图4所示。

图4 固定化细胞的热稳定性
由图4可知,在40 ℃以下,游离细胞和固定化细胞的转化效果无显著差別。温度升至45℃时,游离细胞转化效率迅速降低,温度升至55℃时,游离细胞几乎完全失活,而固定化还10%左右的转化效率,海藻酸钠固定化细胞有效提高了菌体的温度稳定性。
2.5固定化细胞的操作稳定性
固定化细胞和游离细胞重复利用过程中细胞催化活力均会逐渐下降,用该重复批次的转化率和第1次转化率的比值来衡量各自的操作稳定性,结果如表3所示。
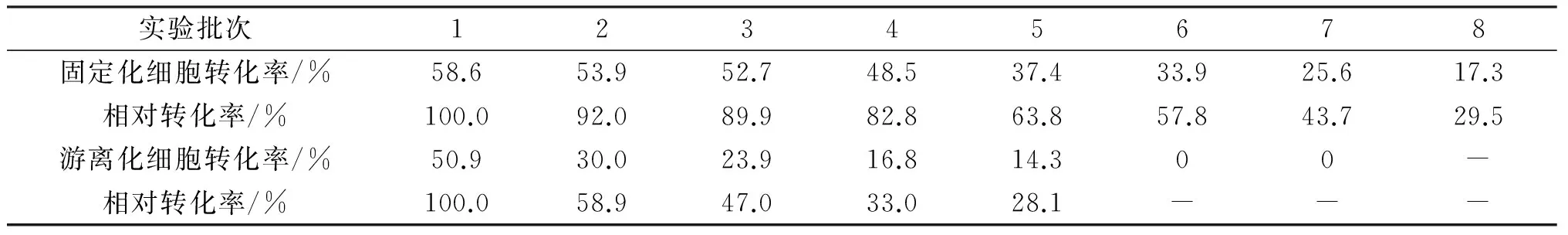
表3 固定化细胞的操作稳定性
当重复利用到第6批时,游离细胞已经基本没有检测到转化活性,而固定化细胞的转化率为初始转化率的57.8%。固定化细胞重复利用到第8批时,仍有相对初始的29.5%活力。固定化细胞颗粒容易回收,菌体损失少,钙化膜也可以降低底物的毒害,这都提高了固定化颗粒的操作稳定性。
3 结 论
本文以海藻酸钠为载体,研究其固定化细胞的最优条件为:海藻酸钠浓度2.0%,CaCl2浓度2.0%,固定化时间8 h,细胞包埋量50 g/L;且固定化后颗粒具有较好的热稳定性和操作稳定性,转化吲哚为靛蓝的转化率为58.6%,在靛蓝生物合成工业化过程中具有重要作用。
[1] 韩晓红,王伟,肖兴国.靛蓝及其同类色素的微生物生产与转化[J].生物工程学报,2008,24(6):921-926.
[2] ENSLEY B D, RATZKIN B J, OSSLUND T D, et al. Expression of naphthalene oxidation genes in Escherichia coli results in the biosynthesis of indigo[J]. Science, 1983,222(4620):167-169.
[3] 马桥,曲媛媛,张旭旺,等.靛蓝的微生物合成研究新进展[J].应用与环境生物学报,2012,18(2):344-350.
[4] 奚悦,焦姮,刘小宇.固定化细胞技术及其应用研究进展[J].生命的化学,2013,33(5):576-580.
[5] 陆悦飞.中空海藻酸钠微胶囊固定化大肠杆菌表达P450BM-3培养特征的初步研究[D].杭州:浙江大学,2006.
[6] 曲媛媛,许炳雯,丛培,等.两相体系中固定化联苯双加氧酶全细胞产靛蓝特性研究[J].大连理工大学学报,2013,53(3):340-345.
[7] 许韶威,刘冰颖,周炜,等.三叶半夏凝集素C端结构域的可溶表达及其活性研究[J].浙江理工大学学报,2014,31(7):439-444.
[8] 邹树平,颜海蔚,胡忠策,等.固定化重组大肠杆菌细胞催化合成(R)-环氧氯丙烷[J].现代化工,2013,33(7):55-59.
[9] HAN G H, SHIN H J, KIM S W. Optimization of bio-indigo production by recombinantE.coliharboring fmo gene[J]. Enzyme Microb Technol,2008,42(7):617-23.
[10] HAN G H, BANG S E, BABU B K, Bio-indigo production in two different fermentation systems using recombinant Escherichia coli cells harboring a flavin-containing monooxygenase gene[J].Process Biochemistry,2011,46:788-791.
[11] HAN G H, GIM G H, KIM S W, et al.Enhanced indirubin production in recombinant Escherichia coli harboring a flavin-containing monooxygenase gene by cysteine supplementation[J].Journal of Biotechnology,2012,164(2):179-187.
[12] CHOI H S, KIM J K, CHO E H, et al.A novel flavin-containing monooxygenase from Methylophaga sp. Strain SK1 and its indigo synthesis in Escherichia coli[J].Biochemical and Biophysical Research Communications,2003,306(4):930-936.
[13] 陆燕,梅乐和,李红,等.重组细胞色素P450BM-3突变酶在大肠杆菌中催化吲哚合成靛蓝[J].自然科学进展,2006,16(8):1047-1050.
(责任编辑: 许惠儿)
Biosynthesis of Indigo Catalyzed by Immobilized RecombinantE.coli
CHENGDandan1,XUTianhong2,WANGShu3,ZHAOYuting3,XIAOQiming2*
(1.School of Life Science, Zhejiang Sci-Tech University, Hangzhou 310018,China; 2. Nanjing No.29 High School, Nanjing 210036, China;3.School of Medical Science, Southeast University, Nanjing 210009, China)
In order to enhance the indigo conversion rate in recombinant bacteriaE.coliBL21 (pET28a-fmo) of a flavin-containing monooxygenase (FMO, E.C.1.14.13.8), the immobilization of recombinant bacteria is studied by means of embedding method. The conventional immobilization method is used and the recombinantE.coliis embedded by carrageenan, gelatin, polyvinyl alcohol and sodium alginate respectively to analyze their indigo conversion effets respectively It is determined that sodium alginate is a good carrier for immobilization. Then, the immobilized conditions of sodium alginate are studied. The results show that the optimal operating conditions are: 2.0 % of the concentration of sodium alginate, 2.0 % of CaCl2concentration, 8h of immobilization time, 50 g/L of quantity of embedded cells. The indigo conversion rate of immobilized cells prepared with this method is 58.6%; after immobilization, the heat resistance of recombinantE.coliis significantly improved and such recombinantE.colihas good operational stability. The conversion rate of the 8threpeated catalization is 29.5% of the first time. It indicates that the immobilized cell conversion method really enhances the efficiency of converting indole to synthesizing indigo by recombinant cells.
recombinantE.coli; immobilization; biosynthesis; indigo
10.3969/j.issn.1673-3851.2016.05.020
2015-11-16
国家重大新药创制项目(2012ZX09102301-009)
程丹丹(1990-),女,浙江湖州人,硕士研究生,主要从事生物制药方面的研究。
肖其敏,E-mail:xiao_qimin@126.com
Q786
A
1673- 3851 (2016) 03- 0439- 05 引用页码: 050702
