青海箭筈豌豆根瘤菌的筛选及其共生体耐盐性研究
2016-09-14王雪翠马晓彤韩梅曹卫东张宏亮白金顺曾闹华高嵩涓周国朋王艳秋
王雪翠,马晓彤,韩梅,曹卫东,张宏亮,白金顺,曾闹华,高嵩涓,2,周国朋,2,王艳秋
(1.中国农业科学院农业资源与农业区划研究所,农业部植物营养与肥料重点实验室,北京 100081;2.中国农业科学院研究生院,北京 100081;3.青海大学青海省农林科学院土壤肥料研究所,青海 西宁 8110016;4.内蒙古师范大学,内蒙古 呼和浩特 010022)
青海箭筈豌豆根瘤菌的筛选及其共生体耐盐性研究
王雪翠1,2**,马晓彤1**,韩梅3**,曹卫东1,3*,张宏亮3,白金顺1,曾闹华1,高嵩涓1,2,周国朋1,2,王艳秋4
(1.中国农业科学院农业资源与农业区划研究所,农业部植物营养与肥料重点实验室,北京 100081;2.中国农业科学院研究生院,北京 100081;3.青海大学青海省农林科学院土壤肥料研究所,青海 西宁 8110016;4.内蒙古师范大学,内蒙古 呼和浩特 010022)
箭筈豌豆是我国传统肥饲兼用的豆科绿肥作物,有关箭筈豌豆根瘤菌的研究尚属空白。为获得抗逆性强的根瘤菌菌株,在青海主产区采集样本,经分离、鉴定得到61株箭筈豌豆根瘤菌。采用水培回接法,通过主成分分析筛选出5株对宿主结瘤生长促进作用较强的根瘤菌(J1-3-2、J2-6-2、J3-12-1、J4-3-3和J5-5-3)。对该5株根瘤菌进行了离体耐盐性评价,发现菌株J5-5-3最大耐盐极限值在0.9%左右,其他4菌株最大耐盐极限值均在1.2%左右,并且5菌株的耐盐特征呈3个明显不同类型:J3-12-1和J2-6-2耐盐性最强,菌株J1-3-2和J4-3-3居中,菌株J5-5-3最差。进一步采用盆栽方法评价了其中3株(每类型1株)根瘤菌-箭筈豌豆共生体的耐盐性,结果表明,在0.15%NaCl胁迫下接种根瘤菌J5-5-3植株结瘤数最多,在0.30%NaCl胁迫下3种接种处理无显著差异;在0.15%和0.30%NaCl胁迫下,接种J3-12-1共生体株高显著大于对照(P<0.05);在0.15%和0.30%NaCl胁迫下根瘤菌J3-12-1和J5-5-3可显著提高植株干重(P<0.05);J5-5-3在0.15%和0.30%NaCl胁迫下可显著提高植株含氮量并显著提高0.15%NaCl胁迫下的植株吸氮量(P<0.05);J3-12-1显著提高了0.15%NaCl胁迫下的植株吸氮量(P<0.05)。综合来看,J3-12-1和J5-5-3可以作为在盐胁迫下提高箭筈豌豆生物量和含氮量的预选菌株。
箭筈豌豆;根瘤菌;盐胁迫
根瘤菌与豆科植物形成的固氮共生体是生物固氮中最强的体系,其固氮量约占生物固氮总量的65%以上,对农业生产有重要意义[1]。共生固氮可以为宿主植物提供氮素,从而提高作物产量[2]、改善作物品质、提高土壤氮素含量[3]。提高豆科绿肥及饲草固氮效率,是提高鲜草产量、减少化肥用量[4]、减缓能源压力、降低过量施用化学肥料造成的环境污染的有效途径[5-6]。
箭筈豌豆(Viciasativa),又名大巢菜,豆科野豌豆属,一年生或越年生豆科草本植物[7],性喜冷凉,不怕霜冻,且耐阴性好、再生力强。箭筈豌豆是北方冷凉地区春季以及南方地区冬季常用绿肥及饲草作物[8]之一,但目前有关箭筈豌豆根瘤菌的研究工作少见报道,生产中还没有与箭筈豌豆匹配的根瘤菌菌剂。箭筈豌豆根瘤菌研究的欠缺,限制了箭筈豌豆作为豆科绿肥固氮潜能的发挥。
土壤盐碱化是国内外普遍存在的问题。我国盐碱化耕地超过1.5×109hm2,在青海省等西北干旱半干旱地区分布面积大。土壤盐分胁迫对结瘤和固氮作用的影响在部分研究中有报道[9],盐分对固氮作用的不利影响通常与盐胁迫所造成的植株干重及氮含量的下降直接相关[10],在土壤盐分胁迫条件下对共生固氮而言最好的结果就是宿主、根瘤菌以及两者的交互过程均表现为对盐分的适应[11]。
青海地区是典型的大陆性高原气候,地形复杂、地貌多样、生物种类多,是一个巨大的基因库。在青海省,箭筈豌豆种植广泛,且多与小麦(Triticumaestivum)、油菜(Brassicacampestris)轮作[12-13],不但可作绿肥,还可以刈青作饲料和收籽作种子。在青海等西北地区,土壤盐渍化也是农业面临的重大问题之一。本研究在对青海地区箭筈豌豆根瘤菌分离和初筛的基础上,对初筛获得的根瘤菌进行了耐盐性研究,为豆科绿肥饲草的应用和推广提供科学支撑。
1 材料与方法
1.1根瘤菌菌株的采集、分离和鉴定
2014年在青海省海东市互助土族自治县和平安区采集根瘤样本,经过分离、纯化、镜检、16S rDNA测序分析,获得61株根瘤菌(表1),以这些菌株作为后期研究的供试菌株。

表1 分离获得的61株根瘤菌
1.2供试箭筈豌豆
758选箭豌,由绿肥种质资源平台提供,国家种质资源库编号I7A00224。
1.3根瘤菌结瘤效果评价
2014年12月进行。按照马晓彤[14]所述的水培方法,设61个接种根瘤菌处理,1个不接种对照处理,4次重复。将植株放置于光照培养箱中培养(光照16 h、光照强度8000 lx、有光温度20 ℃;无光照8 h、无光温度15 ℃),定期更换营养液,45 d后测定植株地上鲜重、植株有效瘤数(粉红色或浅粉红色)、有效瘤重等指标。
水培溶液采用松本哲良营养液[15]:KH2PO42.2 g,KCl 15.5 g,MgSO4·7H2O 25.0 g,CaCl2·2H2O 21.5 g,柠檬酸铁 3.0 g,MnSO4·H2O 100 mg,ZnSO4·7H2O 25 mg,H3BO325 mg,CuSO4·5H2O 25 mg,Na2MoO4·2H2O 5 mg;以上试剂分别溶于500 mL蒸馏水中,用时稀释200倍。
1.4根瘤菌离体耐盐性评价
2015年1月,将在1.3初筛中获得的5株固氮效果较好的菌株用于根瘤菌耐盐性评价。
设8个NaCl处理浓度:0.00,0.30%,0.60%,0.90%,1.20%,1.50%,1.80%,2.10%。配制相应NaCl浓度的YMA液体培养基,并将其分装至1.5 cm×15 cm试管中,每管5 mL,121 ℃、30 min高压蒸汽灭菌后备用。将根瘤菌转接到根瘤菌斜面培养基中,28 ℃、72 h培养;镜检以确定培养物是否被污染,然后转接到YMA液体培养基中,28 ℃、160 r/min、72 h摇瓶培养;将各菌液OD600值调一致(OD600=0.8),取100 μL菌液接种于相应YMA液体培养基中,3次重复,28 ℃、160 r/min、72 h摇床培养;使用紫外分光光度计测定不同菌液OD600值。
YMA液体培养基[16]:甘露醇 10 g,酵母膏 1 g,K2HPO40.5 g,MgSO40.2 g,NaCl 0.1 g,H2O 1 L。根瘤菌培养基:K2HPO40.5 g,MgSO4·7H2O 0.2 g,NaCl 0.1 g,甘露醇 10 g,CaCO31.5 g,1%Na2MoO42 mL,1%H3BO32 mL,酵母粉 0.8 g,0.5%刚果红 5 mL,琼脂 22 g,pH=7.0,H2O 1 L。
1.5共生体耐盐性研究
采用盆栽试验,2015年4月进行。在1.4试验基础上得到耐盐性有差异的3个菌株用于本试验。设3个盐浓度水平:0.00,0.15%和0.30%,分别接种3个根瘤菌菌株,同时设1个不接种对照,共12个处理,4次重复。
分别接种3菌株于YMA液体培养基中,摇瓶培养72 h,将各菌液OD600值调一致(OD600=0.8)。选择粒大饱满的箭筈豌豆种子,浸于10%H2O2中5 min,洗净,于培养皿中28 ℃催芽2 d。选择发芽一致的种子于相应菌液中浸泡1 h(不接种根瘤菌对照处理同时进行)后播种于装有蛭石的10 cm×10 cm×10 cm盆钵中,每盆3棵。每处理12盆。在光照培养箱中培养(光照16 h、光照强度8000 lx、有光温度20 ℃;无光照8 h、无光温度15 ℃),定期浇注Fahraeus无氮营养液。7 d后,每处理随机分为3组,分别浇灌40 mL NaCl含量为0.00,0.15%,0.30%营养液,每3 d浇灌1次;第45天测定植株株高、结瘤数、干重和含氮量(凯氏定氮法)等指标。
Fahraeus无氮植物营养液[17]:Na2HPO4·12H2O 0.15 g,MgSO4·7H2O 0.12 g,柠檬酸铁 0.005 g,CaCl2·2H2O 0.1 g,KH2PO40.1 g,Gibson微量元素液1 mL,H2O 1000 mL (Gibson微量元素液:H3BO32.68 g,MnSO4·4H2O 2.03 g,ZnSO4·7H2O 0.22 g,Na2MoO4·2H2O 1.26 g,CuSO4·5H2O 0.08 g,H2O 1000 mL)。
1.6数据处理
理相对OD600值=接种根瘤菌处理OD600值/对照OD600值。相对OD600值可以用来表征在离体培养条件下根瘤菌的耐盐性。
采用EXCEL2007和SAS8.1进行计算和统计分析。
2 结果与分析
2.1根瘤菌结瘤效果
利用水培回接法测定了62个处理的有效结瘤数、有效瘤重、植株鲜重等指标。为了更客观地进行根瘤菌结瘤效果评价,采用主成分得分法进行数据处理,根据特征值大于1且累计贡献率大于80%的原则,把测定指标转化为累计贡献率为86.26%的2个主成分(主成分1和主成分2的方差贡献率分别为65.67%和20.95%),各处理得分如表2所示。菌株J1-3-2得分最高,对促进箭筈豌豆生长结瘤效果最好;其次为菌株J2-6-2、J4-3-3、J5-5-3和J3-12-1;菌株J5-10-1和J1-2-1得分最低。选择菌株J1-3-2、J2-6-2、J4-3-3、J5-5-3和J3-12-1用于下一步根瘤菌耐盐方面研究。
注:主成分1方差贡献率为65.67%,主成分2方差贡献率为20.95%。
Note:Theproportionofprincipalcomponent1is65.67%;thepro-portionofprincipalcomponent2is20.95%.
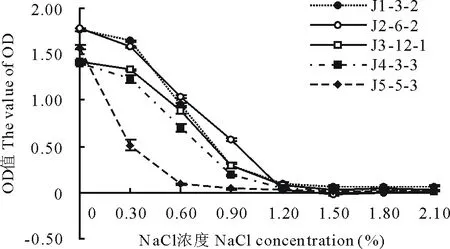
图1 NaCl浓度对根瘤菌浓度的影响Fig.1 Effects of NaCl concentration on the concentration of rhizobia
2.2根瘤菌耐盐性
OD600值是在600 nm波长下测定的菌液吸光度,在测定系统相同、培养体系相同的条件下,OD600值与菌液的浓度呈正比,可以用来衡量菌液浓度。图1表明,菌株J1-3-2、J2-6-2、J4-3-3、J5-5-3和J3-12-1均表现为随NaCl浓度的提高,菌液OD600值降低,菌浓度下降,根瘤菌的生长受到抑制,并且抑制程度随NaCl浓度增加而增加。在无盐胁迫下,5菌株的OD600值略有差异,J1-3-2、J2-6-2的OD600值最高,J5-5-3的其次,J3-12-1、J4-3-3的最低。在0.30%NaCl胁迫下,J5-5-3的OD600值急剧下降,明显低于其他4菌株,并且菌株J1-3-2、J2-6-2的OD600值依然高于J3-12-1、J4-3-3。在0.60%NaCl条件下,J5-5-3的OD600值进一步降低至0.09,J1-3-2、J2-6-2的OD600值略高于J3-12-1、J4-3-3,但4菌株间差异缩小。在0.90%NaCl条件下,各处理OD600值继续降低,J5-5-3的OD600值接近0,但总体规律与0.60%条件下的类似;NaCl浓度超过1.20%后,5菌株OD600值接近0。
细菌生长率受细菌本身特性的影响较大,不同菌种其生长曲线不同。相对菌浓度(相对OD600值表征)可以更为客观地反映菌株在盐胁迫下的相对耐盐性;在给定盐度胁迫下,相对菌浓度越大,说明耐盐性越强。
表3可以反映出随盐胁迫程度的增强,根瘤菌相对菌浓度及其生长受抑制程度的变化趋势。在低浓度0.30% NaCl胁迫下,菌株J5-5-3的相对OD600值快速下降,菌株J2-6-2、J4-3-3居中,菌株J1-3-2、J3-12-1受抑制较小,菌株J1-3-2、J3-12-1、J2-6-2、J4-3-3、J5-5-3受抑制率分别为6.7%,6.3%,11.5%,11.2%和67.4%。在中浓度0.60%NaCl胁迫下,各菌株受抑制程度进一步增大,但总体规律与低浓度较为相似,受抑制率分别为37.2%,41.7%,56.1%,49.9%和94.2%。高浓度0.9%NaCl胁迫下,受抑制率分别为67.9%,79.3%,84.7%,86.3%和97.5%。在1.20%~2.10%NaCl浓度范围内,同一种菌液OD600值没有显著性变化(P>0.05);除根瘤菌J2-6-2外,其他4菌株相对OD600值无显著性差异。
综上,供试5菌株在离体耐盐性上综合表现出明显的3个类型,即菌株J3-12-1和J2-6-2随NaCl浓度的增加,相对OD600值下降较缓,表现出较强的耐盐性,菌株J1-3-2和J4-3-3居中,菌株J5-5-3最差。
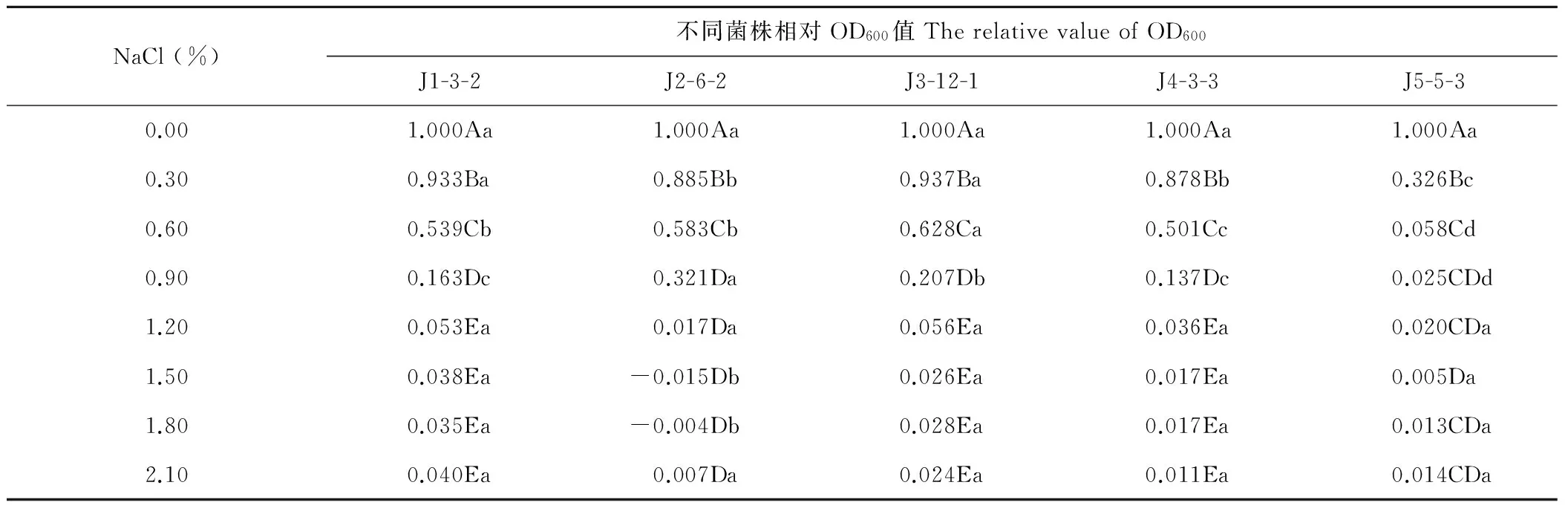
表3 NaCl浓度对根瘤菌相对浓度的影响
注:不同大写字母表示同一菌株在不同盐度下差异显著(P<0.05);不同小写字母表示在同一盐度下不同菌株差异显著(P<0.05)。
Note: Different capital letters in the same column represent significant differences (P<0.05); Different lower letters in the same row represent significant differences (P<0.05).
2.3根瘤菌-箭筈豌豆共生体耐盐性
选择上述3个类型中的各1株根瘤菌,即J1-3-2、J3-12-1和J5-5-3用于根瘤菌-箭筈豌豆共生体耐盐性盆栽试验。
2.3.1NaCl浓度对箭筈豌豆结瘤数的影响接种3株根瘤菌处理都能增加箭筈豌豆植株根部结瘤数,结瘤数随根瘤菌种类和NaCl胁迫强度的不同而不同(图2)。同时,图2表明随着盐胁迫程度的增强,3种共生体结瘤数表现出减少的趋势。在无盐胁迫和0.15%NaCl胁迫下,接种J5-5-3结瘤数最多,接种J1-3-2结瘤数最少;在0.30%NaCl胁迫下,接种J1-3-2结瘤数最多,接种J5-5-3结瘤数最少。可见,根瘤菌J5-5-3在低盐胁迫下促结瘤能力较强;J1-3-2在高盐胁迫下有促结瘤的趋势。
2.3.2NaCl浓度对箭筈豌豆株高的影响由图3可知,各根瘤菌-箭筈豌豆共生体株高随盐胁迫程度的增强而降低。在无盐胁迫下,接种J3-12-1共生体株高显著大于对照(P<0.05);接种J1-3-2和J5-5-3与对照相比没有显著性差异(P>0.05);在0.15%和0.30%NaCl胁迫下,接种J3-12-1共生体株高显著大于对照(P<0.05)。2.3.3NaCl浓度对共生体干生物量的影响如图4所示,不同共生体干重随NaCl胁迫程度的增强而降低。在无盐胁迫下,J3-12-1和J5-5-3共生体干重显著高于对照,分别比对照提高了28.02%和13.59%,其中J3-12-1达极显著水平(P<0.01);在0.15%NaCl胁迫下, J3-12-1和J5-5-3共生体干重分别比对照高66.40%和20.72%,并且差异达到极显著水平(P<0.01);在0.30%NaCl胁迫下,3种接种处理对提高植株干重都没有显著效果(P>0.05)。
2.3.4NaCl浓度对箭筈豌豆含氮量和吸氮量的影响如图5所示,箭筈豌豆含氮量随着盐胁迫程度的增强表现出降低的趋势。在无盐胁迫和0.15%NaCl胁迫下,接种J5-5-3对提高植株含氮量都有极显著效果(P<0.01),比对照分别提高了3.07%和5.43%,接种其他2菌株对提高植株含氮量没有显著效果。在0.30%NaCl胁迫下,接种J1-3-2、J3-12-1和J5-5-3能使植株含氮量提高2.35%,0.92%和4.48%。可见,在试验条件下,J5-5-3对提高盐胁迫下箭筈豌豆含氮量效果最好。
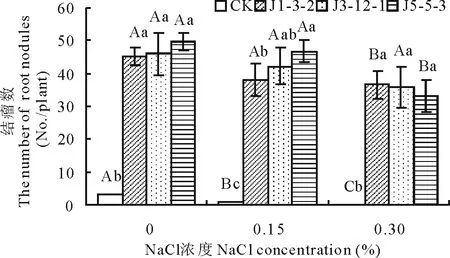
图2 NaCl浓度对共生体结瘤数的影响Fig.2 Effect of NaCl concentration on the number root nodules of the host plant
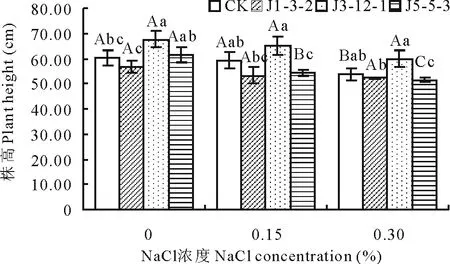
图3 NaCl浓度对植株株高的影响Fig.3 Effect of NaCl concentration on the height of the host plant
CK表示不接种处理,J1-3-2、J3-12-1、J5-5-3表示接种根瘤菌J1-3-2、J3-12-1、J5-5-3处理;不同大写字母表示同一根瘤菌处理在不同盐胁迫下差异显著(P<0.05);不同小写字母表示在同一盐胁迫下不同根瘤菌处理差异显著(P<0.05)。下同。CK represents the treatment of no inoculation; J1-3-2, J3-12-1, J5-5-3 respectively represent the treatments of inoculation; Different capital letters represent significant differences in the same rhizobia treatment (P<0.05); Different lower-case letters represent significant differences in the same NaCl concentration (P<0.05). The same below.

图4 NaCl浓度对共生体干重的影响Fig.4 Effect of NaCl concentration on the dry weight of symbionts
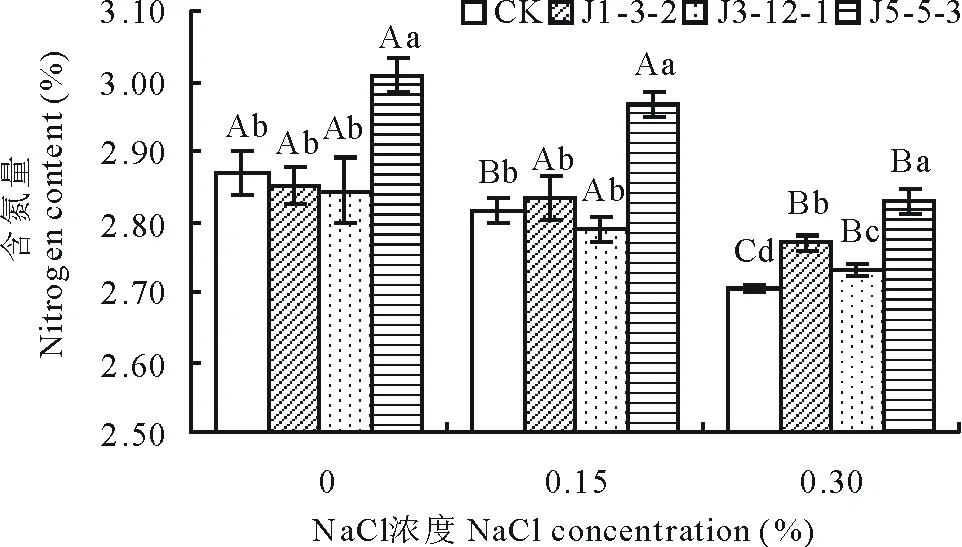
图5 NaCl浓度对植株含氮量的影响Fig.5 Effect of NaCl concentration on the nitrogen content of the host plant
在没有外源氮素供应的情况下,植株吸氮量的高低反映了根瘤菌-豆科植物共生体利用空气中游离态氮合成铵态氮并为植物体利用的能力。由图6可知,在无盐胁迫和0.15%NaCl胁迫下接种J3-12-1和J5-5-3对提高植株吸氮量都有显著效果(P<0.05),分别比对照提高26.92%,9.86%和64.93%,27.27%。在0.30%NaCl胁迫下,各接种处理与不接种相比,植株吸氮量没有显著差异(P>0.05)。

图6 NaCl浓度对植株吸氮量的影响Fig.6 Effect of NaCl concentration on the total nitrogen uptake of the host plant
3 讨论
回接结瘤试验是确定共生固氮根瘤菌比较可靠的方法。从豆科植株根瘤中分离获得的菌株只有在原寄主根部结瘤才能确定该菌为具有结瘤固氮能力的根瘤菌[18]。水培试验作为简便、直观、有效的方法被用于根瘤菌与宿主匹配性研究中。马晓彤[14]采用水培法初筛获得了几株与不同苜蓿品种匹配的根瘤菌;管凤贞等[19]采用水培法和盆栽法筛选出对紫云英有较好结瘤固氮效果的根瘤菌。本研究通过水培回接结瘤试验从61株根瘤菌中初筛出5株与箭筈豌豆共生并且结瘤效果较好的根瘤菌。
本试验结果,在不同程度盐胁迫下,根瘤菌耐盐性表现强弱不同,比如在0.30%NaCl胁迫下菌株J1-3-2和J3-12-1耐盐性最强,在0.60%NaCl胁迫下菌株J3-12-1耐盐性最强,在0.90%NaCl胁迫下菌株J2-6-2耐盐性最强。这可能与细菌在不同盐胁迫下体内积累亲和性溶质(氨基酸及衍生物等)来保持细胞内外的渗透压平衡[20]的能力不同有关,也可能与诱导菌体耐盐相关基因[21](编码氨基酸合成基因等)表达的盐浓度高低不同有关。此外,在1.20%~2.10%NaCl范围内,菌液OD值没有明显波动,这与郭丽琢等[22]研究的豌豆根瘤菌在1.00%~4.50%NaCl浓度下菌液OD值变化趋势一致,说明在超过一定程度盐胁迫下根瘤菌几乎受到完全抑制而没有明显的增殖。
分离筛选获得的耐盐根瘤菌能否与其寄主形成较好的共生关系,是科研工作者关注的问题,因此有必要在盐胁迫条件下对根瘤菌进行盆栽回接试验。本研究中,盆栽试验所用营养液为无氮营养液,接种菌株J3-12-1和J5-5-3能使共生体氮含量增加。这些氮是根瘤菌在宿主根部形成的根瘤将空气中游离态氮在固氮酶的作用下转化为铵态氮供宿主植物利用[23]的结果。
根瘤菌与植株互作能增强共生体抗逆性[24-28]。杨培志[24]研究表明,接种根瘤菌的苜蓿抗非生物胁迫的能力可能来源于三方面:根瘤菌的固氮作用、根瘤菌与苜蓿的共生免疫作用、根瘤菌固氮对植株自身组成变化或其生理应答机制的改变。王卫栋等[25]的研究表明,接种根瘤菌激活的紫花苜蓿具有较强的抗氧化和渗透调节能力,接种根瘤菌不激活的紫花苜蓿次之,不接种根瘤菌的紫花苜蓿最弱。抗氧化和渗透调节能力增强,说明苜蓿耐盐能力提高,也同样说明接种根瘤菌后形成的共生体耐盐性可能发生变化。
本研究中,菌株J5-5-3在根瘤菌耐盐性的离体鉴定中表现最差,但在共生体耐盐性鉴定中其共生体在干重、吸氮量等方面表现较好,说明在离体培养条件下测定的相关生理指标不能完全与实际应用条件下的相关指标相符,原因可能是根瘤菌需与宿主之间形成较好的匹配性。共生体的形成是一个根瘤菌与植株互作的复杂过程[29],在此过程中,菌体和植物体双方自身组成、生理特性及生理应答机制发生不同程度变化。因此,在对根瘤菌进行筛选和耐盐性研究时,需关注其在离体培养和生产应用中表现出的生理特性的差异。同时,所选出的高效共生体系在实际生产环境中的效果要通过盐渍地大田试验进一步验证[30],使根瘤菌能在与豆科绿肥联合固氮和提高植株耐盐能力方面发挥更好的潜力。
4 结论
本研究对青海高原土著箭筈豌豆根瘤菌进行了筛选及耐盐性评价。筛选出5株结瘤效果较好的根瘤菌J1-3-2、J2-6-2、J3-12-1、J4-3-3和J5-5-3。离体培养试验结果,5个菌株在不同程度盐胁迫下耐盐性强弱不同,呈三类明显的特征,即J3-12-1和J2-6-6耐盐性最强, J1-3-2和J4-3-3居中, J5-5-3最差。共生体耐盐性鉴定结果与离体培养试验结果不尽一致,表现为接种J3-12-1和J5-5-3在中、低浓度NaCl胁迫下促进共生体生长能力较强。总体来看,菌株J3-12-1和J5-5-3具有耐盐性应用前景。
References:
[1]Chen W X, Chen W F. Exertion of biological nitrogen fixation in order to reducing the consumption of chemical nitrogenous fertilizer. Review of China Agricultural Science and Technology, 2004, (6): 3-6.
[2]Guo L Z, Zhang T H, He Y H,etal. Effect ofRhizobiuminoculation on crop growth and nitrogen nutrition of a pea/maize intercropping system. Acta Prataculturae Sinica, 2012, 21(1): 43-49.
[3]Meng Q Y. Effect of rhizobia application on number of soil ammonifying bacteria, nitrifying bacteria, nitrogen fixation bacteria and soil nitrogen fertility. Heilongjiang Agricultural Sciences, 2012, (4): 55-57.
[4]Li J, Jia H Y, Xie J M,etal. Effects of partial substitution of mineral fertilizer by bio-fertilizer on yield, quality, photosynthesis and fertilizer utilization rate in broccoli. Acta Prataculturae Sinica, 2015, 24(1): 47-55.
[5]Wang P, Zhou D W, Jiang S C. Research on biological nitrogen fixation of grass-legume mixtures in a semi-arid area of China. Acta Prataculturae Sinica, 2010, 19(6): 276-280.
[6]Zhang Q L, Lin M, Ping S Z. Biological nitrogen fixation and its application in sustainable agriculture. Biotechnology Bulletin, 2008, (2): 1-4.
[7]Jiao B. China Green Manure[M]. Beijing: Agriculture Press, 1986: 396-411.
[8]Yang X, Li J H, Zhu X Q,etal. Study on the seed production on different sowing date ofViciasativain Dazi of Tibet. China Herbivores Science, 2013, 33(5): 37-39.
[9]Cordovilla M P, Ocana A, Ligero F,etal. Salinity effects on growth analysis and nutrient composition in four grain legumes-rhizobium symbiosis. Journal of Plant Nutrition, 1995, 18(8): 1595-1609.
[10]Faghire M, Bargaz A, Farissi M,etal. Effect of salinity on nodulation, nitrogen fixation and growth of common bean (Phaseolusvulgaris) inoculated with rhizobial strains isolated from the Haouz region of Morocco. Symbiosis, 2011, 55(2): 69-75.
[11]Cordovilla M P, Ligero F, Lluch C. Influence of host genotypes on growth, symbiotic performance and nitrogen assimilation in Faba bean (ViciafabaL.) under salt stress. Plant and Soil, 1995, 172: 289-297.
[12]Han M, Zhang H L, Guo S S,etal. Germplasm evaluation for yield inViciasativaL. Crops, 2013, (4): 67-69.
[13]Cao L, Qin S H, Zhang J L,etal. Effect of leguminous forage rotations on soil microbe consortiums and enzyme activity in continuously cropped potato fields. Acta Prataculturae Sinica, 2013, 22(3): 139-145.
[14]Ma X T. The Study of Screening High Symbiotic Matching Combinations of Rhizobia and Alfalfa Varieties[D]. Beijing: Master Dissertation of Chinese Academy of Agricultural Sciences, 2009.
[15]Ning G Z, Liu H Q, Ma X T. Rhizobium Leguminosarum and its Application Technology[M]. Zhengzhou: Central Plains Farmers Press, 1998: 63-64.
[16]Zhou Y Q, Deng B, Ma X T,etal. Optimization of alfalfa rhizobium medium. Acta Agrestia Sinica, 2013, 21(3): 607-611.
[17]Han M, Wang Z, Han X R. Screening and identification of a hi-efficient peanut rhizobia strain. Journal of Microbiology, 2013, 33(1): 44-47.
[18]Liu X Y, Chen W X, Zhang B. β-proteorhizobia and nonrhizobial species——a review. Acta Microbiologica Sinica, 2008, 48(10): 1408-1412.
[19]Guan F Z, Zhong S J, Qiu H D,etal. Isolating and identification of rhizobial strains of Chinese Milk Vetch. Fujian Journal of Agricultural Sciences, 2012, 27(5): 524-532.
[20]Xia Y, Min H, Lv Z B,etal. The osmoprotectant of the salt-tolerant bacteria and its regulatory mechanism. Bulletin of Biology, 2002, 37(12): 4-5.
[21]Wang W W, Tang H Z, Xu P. Salt-tolerance related genes in halophilic bacteria and Achaea. Microbiology China, 2015, 42(3): 550-558.
[22]Guo L Z, He Y H. Adaptability of pea rhizobia to NaCl and pH. Research of Soil and Water Conservation, 2009, 16(5): 270-277.
[23]Zhao Y Z, Wang H M, Wang Z Q. The role of leguminous plant rhizobium in ecological environment. Agro-Environment & Development, 2013, 30(4): 7-12.
[24]Yang P Z. Mechanism Involved in Drought/Salt Tolerance Improvement in Alfalfa Due to Symbiotic Interaction with Rhizobium[D]. Yangling: Northwest A&F University, 2012.
[25]Wang W D, Yang P Z, Zhang P,etal. The effect of symbiotic rhizobium on the antioxidative and osmoregulatory capability in alfalfa under salt stress. Acta Prataculturae Sinica, 2013, 22(5): 120-127.
[26]Chen W X, Wang E T, Chen W F. The relationship between the symbiotic promiscuity of rhizobia and legumes and their geographical environments. Scientia Agricultural Sinica, 2004, 37(1): 81-86.
[27]Shi J, Zhang L, Zhang Q,etal. The effect of calcium and acid-tolerant rhizobium on the growth of alfalfa planted in acid soil. Plant Nutrition and Fertilizer Science, 2008, 14(3): 602-607.
[28]Zhang P, Yang P Z, Wang W D,etal. Study on physiological change of alfalfa with symbiotic rhizobium under drought stress. Acta Agrestia Sinica, 2013, 21(5): 938-944.
[29]Haag A F, Arnold M F F, Myka K K,etal. Molecular insights into bacteroid development during rhizobium-legume symbiosis. FEMS Microbiology Reviews, 2013, 37: 364-383.
[30]Chen L Y, Zhang L J, Zhou Z Y. Research of salt tolerable rhizobia inoculation effects onMedicagosativa. Acta Prataculturae Sinica, 2008, 17(5): 13-47.
[1]陈文新, 陈文峰. 发挥生物固氮作用减少化学氮肥用量. 中国农业科技导报, 2004, (6): 3-6.
[2]郭丽琢, 张天虎, 何亚慧, 等. 根瘤菌接种对豌豆/玉米间作系统作物生长及氮素营养的影响. 草业学报, 2012, 21(1): 43-49.
[3]孟庆英. 施用根瘤菌对土壤微生物氮素类群数量及土壤氮素的影响. 黑龙江农业科学, 2012, (4): 55-57.
[4]李杰, 贾豪语, 颉建明, 等. 生物肥部分替代化肥对花椰菜产量、品种、光合特性及肥料利用率的影响. 草业学报, 2015, 24(1): 47-55.
[5]王平, 周道玮, 姜世成. 半干旱地区禾-豆混播草地生物固氮作用研究. 草业学报, 2010, 19(6): 276-280.
[6]张秋磊, 林敏, 平舒珍. 生物固氮及在可持续农业中的应用. 生物技术通报, 2008, (2): 1-4.
[7]焦彬. 中国绿肥[M]. 北京: 农业出版社, 1986: 396-411.
[8]杨晓, 李锦华, 朱新强, 等. 西藏达孜箭筈豌豆不同播种期种子生产性能研究. 中国草食动物科学, 2013, 33(5): 37-39.
[12]韩梅, 张洪亮, 郭石生, 等. 绿肥作物箭筈豌豆种质产量性状综合评价. 作物杂志, 2013, (4): 67-69.
[13]曹莉, 秦舒浩, 张俊连, 等. 轮作豆科牧草对连作马铃薯田土壤微生物菌群及酶活性的影响. 草业学报, 2013, 22(3): 139-145.
[14]马晓彤. 苜蓿根瘤菌与苜蓿品种共生匹配优良组合筛选的研究[D]. 北京: 中国农业科学院, 2009.
[15]宁国赞, 刘慧琴, 马晓彤. 豆科根瘤菌及其应用技术[M]. 郑州: 中原农民出版社, 1998: 63-64.
[16]周冀琼, 邓波, 马晓彤, 等. 紫花苜蓿根瘤菌培养基的优化研究. 草地学报, 2013, 21(3): 607-611.
[17]韩梅, 王卓, 韩晓日. 1株高效花生根瘤菌的筛选与鉴定. 微生物学杂志, 2013, 33(1): 44-47.
[18]刘晓云, 陈文新, 张斌. β-根瘤菌及特殊α-根瘤菌的研究概况. 微生物学报, 2008, 48(10): 1408-1412.
[19]管凤贞, 钟少杰, 邱宏端, 等. 紫云英根瘤菌的分离与鉴定. 福建农业学报, 2012, 27(5): 524-532.
[20]夏颖, 闵航, 吕正兵, 等. 耐盐细菌的渗透保护剂及其调渗机制. 生物学通报, 2002, 37(12): 4-5.
[21]王伟伟, 唐鸿志, 许平. 嗜盐菌耐盐机制相关基因的研究进展. 微生物学通报, 2015, 42(3): 550-558.
[22]郭丽琢, 何亚慧. 豌豆根瘤菌耐盐适应性鉴定. 水土保持研究, 2009, 16(5): 270-277.
[23]赵叶舟, 王浩铭, 汪自强. 豆科植物和根瘤菌在生态环境中的地位和作用. 农业环境与发展, 2013, 30(4): 7-12.
[24]杨培志. 紫花苜蓿根瘤菌共生对干旱及盐胁迫的响应机制研究[D]. 杨凌: 西北农林科技大学, 2012.
[25]王卫栋, 杨培志, 张攀, 等. 共生根瘤菌对NaCl胁迫下紫花苜蓿抗氧化和渗透调节能力的影响. 草业学报, 2013, 22(5): 120-127.
[26]陈文新, 王恩涛, 陈文峰. 根瘤菌-豆科植物共生多样性与地理环境的关系. 中国农业科学, 2004, 37(1): 81-86.
[27]石杰, 张磊, 张琴, 等. 接种耐酸根瘤菌和施钙对酸性土上紫花苜蓿生长的影响. 植物营养学报, 2008, 14(3): 602-607.
[28]张攀, 杨培志, 王卫栋, 等. 干旱胁迫下根瘤菌共生紫花苜蓿抗旱生理变化研究. 草地学报, 2013, 21(5): 938-944.
[30]陈利云, 张丽静, 周志宇. 耐盐根瘤菌对紫花苜蓿接种效果的研究. 草业学报, 2008, 17(5): 43-48.
Screening of rhizobia of common vetch (Viciasativa) in Qinghai, and assessment of symbiont salt tolerance
WANG Xue-Cui1, 2**, MA Xiao-Tong1**, HAN Mei3**, CAO Wei-Dong1,3*, ZHANG Hong-Liang3,BAI Jin-Shun1, ZENG Nao-Hua1, GAO Song-Juan1,2, ZHOU Guo-Peng1,2, WANG Yan-Qiu4
1.KeylaboratoryofPlantNutritionandFertilizer,InstituteofAgriculturalResourcesandRegionalPlanning,ChineseAcademyofAgriculturalSciences,Beijing100081,China; 2.GraduateSchoolofChineseAcademyofAgriculturalSciences,Beijing100081,China; 3.SoilandFertilizerInstitute,QinghaiAcademyofAgricultureandForestrySciences,QinghaiUniversity,Xining810016,China; 4.InnerMongoliaNormalUniversity,Hohhot010022,China
Common Vetch (Viciasativa) is a traditional legume crop in China which is widely used as a green manure and for fodder. However, there has been little study to date of the rhizobia of common vetch. This study aimed to identify rhizobial strains of common vetch with superior symbiotic properties, and also greater salt tolerance. Root nodule samples were collected from the major production areas of common vetch in Qinghai, and 61 rhizobial strains were isolated and identified. Using a hydroponics inoculation technique and principal component analysis, 5 strains with stronger ability to promote nodulation and growth of the host plants were identified, and designated J1-3-2, J2-6-2, J3-12-1, J4-3-3 and J5-5-3. The salt tolerance of these 5 strains was examined by single plant culture. Strain J5-5-3 was tolerant of NaCl concentrations up to about 0.9%, while the other 4 strains could tolerate up to 1.2% NaCl concentration. Three distinct levels of salt tolerance were evident: J3-12-1 and J2-6-2 displayed the strongest tolerance, J1-3-2 and J4-3-3 displayed medium tolerance, and J5-5-3 the weakest tolerance. One strain from each of these groups was then evaluated in a pot experiment to asses nodulation of the host under differing salinity levels of 0.15% or 0.3% NaCl. When exposed to 0.15% NaCl concentration, the largest number of root nodules was observed in plants inoculated with J5-5-3, and no significant differences among the three rhzobial strains were found when exposed to 0.30% NaCl concentration. J3-12-1 and J5-5-3 inoculation resulted in increased dry weight (P<0.05) of the host plants under NaCl concentrations of 0.15% and 0.30%. Inoculation with strain J5-5-3 increased plant nitrogen content (P<0.05) under the two levels of NaCl stress and increased nitrogen uptake (P<0.05) under the 0.15% NaCl stress, while the strain J3-12-1 significantly increased the nitrogen uptake (P<0.05) of the host plants under 0.15% NaCl stress. It was concluded that the strains J3-12-1 and J5-5-3 are suitable as inoculant rhizobial strains to increase the biomass and nitrogen content of common vetch under salt stress.
common vetch; rhizobia; salt stress
10.11686/cyxb2015497http://cyxb.lzu.edu.cn
王雪翠, 马晓彤, 韩梅, 曹卫东, 张宏亮, 白金顺, 曾闹华, 高嵩涓, 周国朋, 王艳秋. 青海箭筈豌豆根瘤菌的筛选及其共生体耐盐性研究. 草业学报, 2016, 25(8): 145-153.
WANG Xue-Cui, MA Xiao-Tong, HAN Mei, CAO Wei-Dong, ZHANG Hong-Liang, BAI Jin-Shun, ZENG Nao-Hua, GAO Song-Juan, ZHOU Guo-Peng, WANG Yan-Qiu. Screening of rhizobia of common vetch (Viciasativa) in Qinghai, and assessment of symbiont salt tolerance. Acta Prataculturae Sinica, 2016, 25(8): 145-153.
2015-11-03;改回日期:2015-12-28
公益性行业(农业)科研专项(201103005),中国农业科学院科技创新工程,国家农作物种质资源平台运行服务项目(NICGR2015-019),农作物种质资源保护与利用专项(2015NWB042)和青海省“昆仑学者”计划资助。
王雪翠(1989-),女,山东济宁人,在读硕士。E-mail: wangxuecui613@163.com。马晓彤(1967-),女,北京人,助理研究员。E-mail: maxiaotong@caas.cn。韩梅(1973-),女,青海湟中人,副研究员。E-mail: hanmei20061234@sina.com。**共同第一作者These authors contributed equally to this work.
Corresponding author. E-mail: caoweidong@caas.cn
