Ki67与核酸荧光共染在细胞周期研究中的应用
2016-09-13孙淑惠
孙淑惠
复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032
·论著·
Ki67与核酸荧光共染在细胞周期研究中的应用
孙淑惠
复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032
病原微生物与宿主细胞的相互作用是感染过程中的一个重要环节,也是研究肿瘤生物学的一项重要内容。动态研究细胞周期变化对了解病原体作用于细胞具有重要意义。本研究用Ki67/4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)和Ki67/碘化丙啶(propidium iodide,PI)共染技术分析了小鼠脾细胞的细胞周期变化,并介绍其具体应用。
细胞周期;流式细胞术;Ki67;4′,6-二脒基-2-苯基吲哚;碘化丙啶
细胞周期是指具有分裂能力的细胞从准备启动分裂到下一次分裂完成为止的过程。细胞周期研究是近年来生命科学研究的热点之一。病原体在感染过程中,可作用于宿主细胞和机体免疫系统,引起机体细胞分裂增殖,即细胞周期发生变化,因此细胞周期检测也是微生物与感染研究中的重要内容[1-3]。
细胞的生命周期可分为G0、G1、S、G2和M期5个时相。细胞在进入细胞周期后,各时相中DNA含量是变化的。在哺乳类动物中,G0期细胞是不参与增殖周期循环的一群细胞,即为静止期细胞,其细胞为恒定的二倍体DNA含量(2C)。G1期细胞已具有增殖活性,参与细胞周期循环,但DNA尚未进入复制阶段,因此其DNA含量亦为二倍体(2C)。当细胞进入S期后,DNA开始进入复制阶段,含量逐渐增加,从2C增至4C(四倍体),直至细胞DNA倍增结束,进入G2期,最终进入M期。在M期分裂为2个子细胞之前,G2和M期的DNA含量均为恒定的4C。
由于病毒缺少细胞器,其必须借助宿主细胞的结构蛋白或细胞器来辅助病毒的蛋白合成、转运及病毒包装。因此,细胞周期的改变与调控,对病毒功能有巨大影响。一些小DNA病毒,如猴病毒40 (simian virus 40)[4]、腺病毒(adenovirus)[5]、人乳头瘤病毒(human papillomavirus)[6],由于自身缺少蛋白聚合酶,需依赖宿主细胞编码某些蛋白以维持宿主细胞停留于S期,帮助病毒自身基因组合成。较大的DNA病毒(如疱疹病毒)有能力使感染的宿主细胞停留于G0/G1期,以避免与宿主细胞在自身DNA复制过程中竞争原材料[7]。同样,在反转录DNA病毒复制过程中,细胞周期受细胞核的精确调控。人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)感染细胞后,病毒Vpr蛋白可使细胞周期停留于G2/M期,从而有利于HIV-1复制[8]。尽管在RNA病毒感染过程中病毒复制主要在细胞质中进行,但也有一些研究观察到宿主的细胞周期改变对病毒功能有明显影响。例如,在冠状病毒家族中,传染性支气管炎病毒(infectious bronchitis virus,IBV)可使感染的宿主细胞发生周期变化,使其停留于G2/M期,从而有利于病毒复制[9]。而小鼠肝炎病毒(murine hepatitis virus,MHV)和严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)感染的细胞中,宿主细胞停留于G0/G1期,有助于病毒复制[10-11]。
鉴于DNA复制在细胞周期中的特点,DNA含量检测成为提供细胞周期信息的最常用指标。目前,国内外广泛使用碘化丙啶(propidium iodide,PI)染色法检测DNA含量,从而进行各类人及动物细胞的细胞周期研究[12-14]。其原理主要是利用PI与细胞内DNA的结合,DNA含量越高,PI荧光强度越强。这一方法可区分G0/G1期(2C DNA)、S期(2C~4C DNA)和G2/M期(4C DNA)细胞,但不能区分均为二倍体的G0与G1期细胞,因此并不能严格区分静止期细胞与已进入细胞周期的细胞。
Ki67是一种在细胞核内表达的蛋白。虽然其确切的生物学作用目前尚不清楚,但其表达有个特点,即只有在进入细胞周期(G1、S、G2和M)才表达,在G0期不表达或极低水平表达[15]。由于Ki67表达与细胞进入周期有严格的对应关系,其被认为是细胞进入细胞周期的一个理想标记,因此广泛应用于鉴定细胞周期[16-18]。目前,大部分研究主要使用Ki67单染来表示细胞进入细胞周期,只能区分G0 期与已进入细胞周期的细胞,并不能区分已进入细胞周期各时相(G1、S、G2和M)的细胞[19-20]。
PI单染和Ki67单染在鉴定细胞周期中均存在一定缺陷,因此有必要发展一种更有效的细胞周期染色方法。现介绍一种新的利用Ki67与4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)或PI共染来鉴定细胞周期的方法。Ki67只在进入细胞周期的细胞中表达,因此能区分G0期细胞。DAPI和PI是与DNA有较强亲和力的荧光染料,能区分DNA合成前(G0和G1,2C DNA)、合成时(S,2C~4C DNA)与合成后(G2和M,4C DNA)的细胞。因此,利用Ki67与DAPI或PI双染,能区分G0(DAPI/PI低Ki67-)、G1(DAPI/PI低Ki67+)、S(DAPI/PI中Ki67+)和G2/M(DAPI/PI高Ki67+)期细胞。与传统的PI单染相比,双染能有效区分G0与G1期细胞。现以小鼠脾脏细胞为例予以介绍。
1 材料与方法
1.1细胞准备
取小鼠脾脏B10.S细胞,经红细胞裂解后计数,将密度调至107个/mL,置于含5%小牛血清(购自美国Sigma公司)的磷酸盐缓冲液(phosphate buffered saline,PBS)中,备用。
1.2主要试剂与仪器
70%乙醇(分析纯)、RNase A、PI和DAPI购自美国Sigma公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-抗Ki67(clone:16A8)和FITC-同型(isotype)对照购自美国Biolegend公司,Fc阻断剂(纯化的抗小鼠CD16/32;clone:2.4G2)购自美国BD Biosciences公司 ,Foxp3核转录因子染色试剂盒购自美国Ebioscience公司。流式细胞仪购自美国BD LSRFortessa公司。
1.3方法
1.3.1PI单染取2×106个脾细胞,加入2 mL冰预冷的70%乙醇,混匀,-20 ℃过夜;350g离心5 min,弃上清液;加入2 mL 1×PBS洗1次,350g离心5 min,弃上清液;加入0.5 mL PI染液〔50 μL RNase、 50 μL 1 mg/mL PI、20 μL 5% Triton-100、100 μL 0.02%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)于1×PBS中,终体积为0.5 mL〕,4 ℃避光30 min。开启BD LSFortessa,启用PE频道,用于识别PI。PE频道使用线性模式。调至合适电压,读取10 000个细胞后,停止读数。
1.3.2Ki67/DAPI双染和Ki67/PI双染将2×106个脾细胞置于染色孔中(圆底96孔细胞培养板),4 ℃离心,弃上清液。将100 μL抗小鼠CD16/32(1∶200,用含5%小牛血清的PBS稀释)加入细胞培养孔,混匀,置冰上孵育20 min;4 ℃离心,弃上清液;加入100 μL Foxp3试剂盒携带的细胞固定/穿孔液,混匀,避光,室温(23 ℃)孵育1 h;加入100 μL Foxp3试剂盒携带的穿孔液,混匀后室温离心,弃上清液;加入100 μL FITC-抗Ki67(稀释液∶穿孔液为1∶100)或相同浓度的FITC-同型对照,混匀,避光,室温孵育1 h;加入100 μL穿孔液,混匀后室温离心,弃上清液;加入200 μL穿孔液,混匀后室温离心,弃上清液;将细胞重悬于200 μL含5%小牛血清的PBS中,转移至流式细胞管;将100 μL DAPI(3 μg/mL,稀释液为含5%小牛血清的PBS)或200 μL PI加入含已染色细胞的流式细胞管中,混匀,避光,冰上孵育10 min左右。开启BD LSRFortessa,启用FITC、Pacific blue和PE 3个频道,分别识别抗FITC-Ki67、DAPI和PI。其中FITC频道使用log模式,Pacific blue和PE频道使用线性模式。调至合适电压,读取20 000个细胞后,停止读数。
2 结果
PI单染结果见图1。X轴以线性PI荧光强度表示DNA含量,Y轴为相对细胞数量。结果显示,G0/G1期细胞占96.4%,S期细胞占1.8%,G2/M 期细胞占1.7%。G0期和G1期均为二倍体细胞,因此该法未能区分。
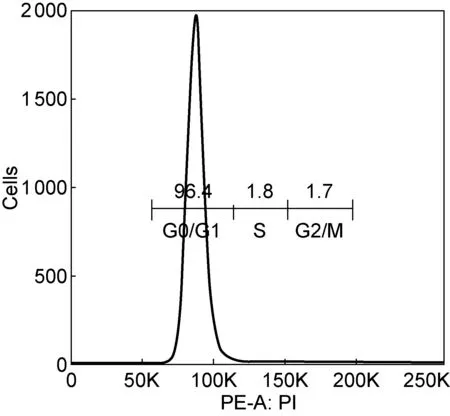
图1PI单染进行细胞周期鉴定
Fig.1Cell cycle identified by PI staining
Ki67和DAPI双染见图2。X轴以线性DAPI荧光强度表示DNA含量,Y轴以荧光强度表示Ki67表达量。以FITC同型抗体为参照[21],结果显示,G0期细胞占48.6%,G1期细胞占48.7%,S期细胞占1.4%,G2/M期细胞占1.0%。该法能有效区分G0与G1期细胞。Ki67和PI双染见图3。X轴以线性PI荧光强度表示DNA含量,Y轴以荧光强度表示Ki67表达量。结果显示,G0期细胞占45.2%,G1期细胞占49.3%,S期细胞占1.5%,G2/M期细胞占1.2%。该法也能有效区分G0与G1期细胞。
以上结果显示,利用PI单染和Ki67/DAPI或Ki67/PI双染进行细胞周期鉴定,结果具有较好的可比性。与传统的PI单染相比,Ki67/DAPI或Ki67/PI双染能有效区分G0与G1期细胞 。
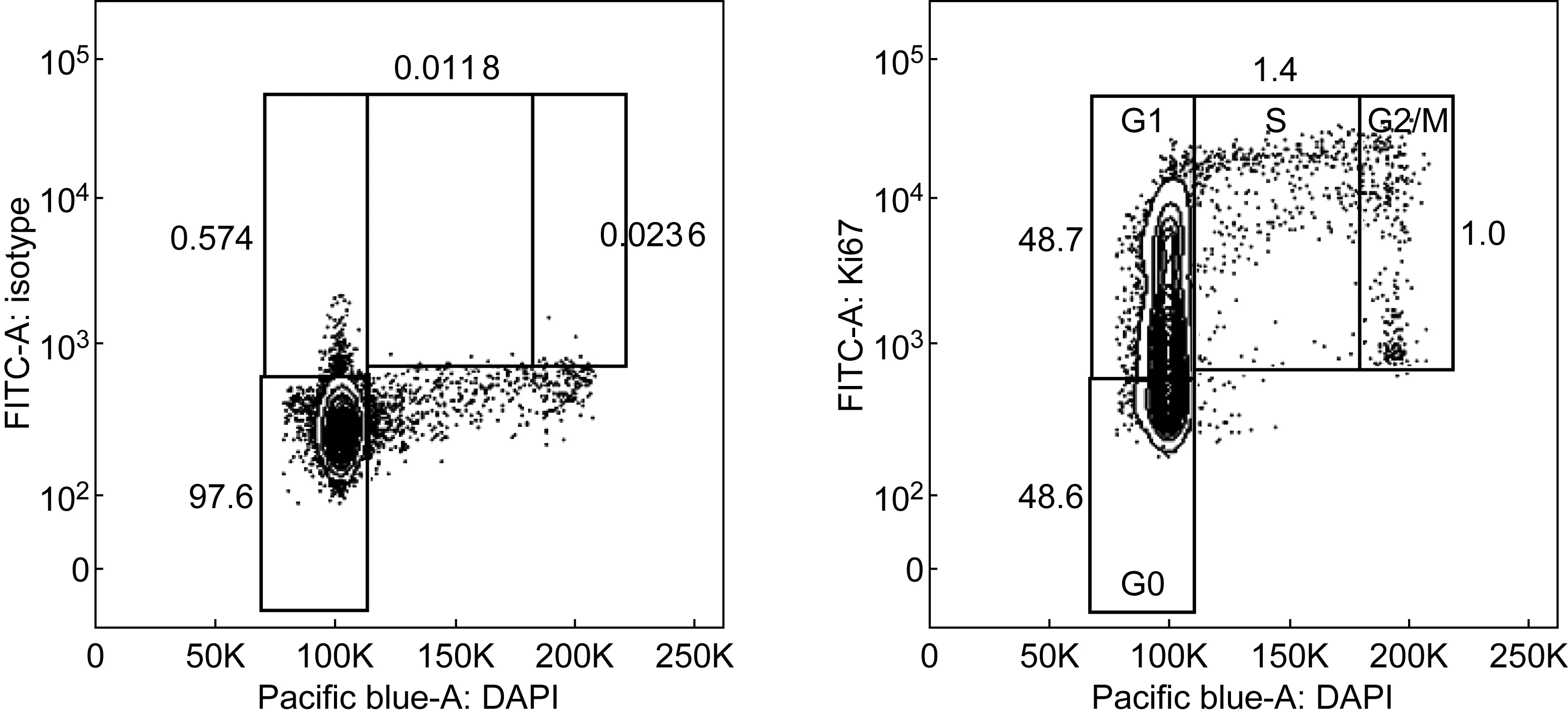
图2Ki67/DAPI双染进行细胞周期鉴定
Fig.2Cell cycle identified by Ki67 and DAPI co-staining
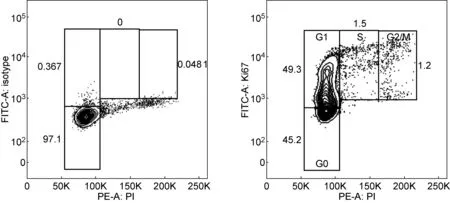
图3Ki67/PI双染进行细胞周期鉴定
Fig.3Cell cycle identified by Ki67 and PI co-staining
3 讨论
病毒的复制需从宿主细胞获得必要的资源,这一过程可能与细胞周期中的某一时相有关。因此,病毒感染细胞后常通过改变细胞周期以有利于其复制。例如病毒通过感染不分裂的细胞诱导S期,激活细胞DNA复制,从而获得病毒DNA复制所需的三磷酸脱氧核苷等。病毒还可通过破坏细胞周期蛋白及依赖细胞周期蛋白激酶复合物以影响细胞周期[22-23]。此外,病毒作用于细胞周期还与恶性肿瘤细胞转化有关。因此,细胞周期检测在研究感染性疾病与肿瘤中具有重要意义。如果宿主细胞在S期和G2/M期的存在时间相对较短或所占比例很少,仅依靠PI单染来鉴定细胞周期,可能出现阴性结果,得出错误结论。在这种情况下,如果使用Ki67/DAPI或Ki67/PI双染,可提高检测的灵敏度。
笔者在国内长期从事流式细胞检测工作,发现绝大多数的细胞周期检测仅使用PI单染,因此推荐Ki67/DAPI或Ki67/PI双染作为细胞周期鉴定的优先方法。
此外,在使用Ki67/DAPI和Ki67/PI双染技术时应注意以下几点。①Pacific blue和PE频道不要用log模式。因为如果DAPI或PI荧光强度采用log模式,会使S期区分不明显(图4)。②进行Ki67/DAPI双染时,不能同时采用V500和Amcyan等使用Amcyan通道的荧光抗体检测目标分子。Pacific blue与Amcyan的两种荧光染料发生波有较大重叠。当DAPI浓度达1 μg/mL时,会导致较多的DAPI荧光被Amcyan频道检测到,从而造成Amcyan很强的假阳性,使标记分子无法正确显示。因此,使用Ki67/DAPI双染鉴定细胞周期时,建议关闭Amcyan通道。③FITC可与嗜酸性粒细胞中的颗粒非特异性结合[24],因此FITC-抗Ki67不能用于检测嗜酸性粒细胞的周期检测。
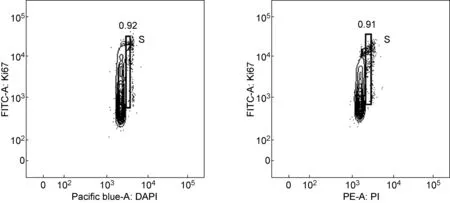
图4Log模式下显示DAPI或PI荧光强度时S期的显示图形
Fig.4The pattern of S phase with DAPI or PI fluorescence intensity displayed in log scale
虽然Ki67/DAPI和Ki67/PI双染法优点明显,但试剂价格相对较高,且需一定的技术培训,有效利用共享平台是解决这一问题的方法。
Wei F, Gan J, Wang C, Zhu C, Cai Q. Cell cycle regulatory functions of the KSHV oncoprotein LANA [J]. Front Microbiol, 2016, 7: 334. doi:10.3389/fmicb.2016.00334.
[2]Rai P, He F, Kwang J, Engelward BP, Chow VT. Pneumococcal pneumolysin induces DNA damage and cell cycle arrest [J]. Sci Rep, 2016, 6: 22972. doi: 10.1038/srep22972.
[3]Shive CL, Mudd JC, Funderburg NT, Sieg SF, Kyi B, Bazdar DA, Mangioni D, Gori A, Jacobson JM, Brooks AD, Hardacre J, Ammori J, Estes JD, Schacker TW, Rodriguez B, Lederman MM. Inflammatory cytokines drive CD4+T-cell cycling and impaired responsiveness to interleukin 7: implications for immune failure in HIV disease [J]. J Infect Dis, 2014, 210(4): 619-629.
[4]Fanning E, Knippers R. Structure and function of simian virus 40 large tumor antigen [J]. Annu Rev Biochem, 1992, 61: 55-85.
[5]Eckner R, Ewen ME, Newsome D, Gerdes M, DeCaprio JA, Lawrence JB, Livingston DM. Molecular cloning and functional analysis of the adenovirus E1A-associated 300-kD protein (p300) reveals a protein with properties of a transcriptional adaptor [J]. Genes Dev, 1994, 8(8):869-884.
[6]Werness BA, Levine AJ, Howley PM. Association of human papillomavirus types 16 and 18 E6 proteins with p53 [J]. Science, 1990, 248(4951): 76-79.
[7]Flemington EK. Herpesvirus lytic replication and the cell cycle: arresting new developments [J]. J Virol, 2001, 75(10): 4475-4481.
[8]Goh WC, Roge ME, Kinsey CM, Michael SF, Fultz PN, Nowak MA, Hahn BH, Emerman M. HIV-1 Vpr increases viral expression by manipulation of the cell cycle: a mechanism for selection of Vpr in vivo [J]. Nat Med, 1998, 4 (1): 65-71.
[9]Dove B, Brooks G, Bicknell K, Wurm T, Hiscox JA. Cell cycle perturbations induced by infection with the coronavirus infectious bronchitis virus and their effect on virus replication [J]. J Virol, 2006, 80(8): 4147-4156.
[10]Chen CJ, Makino S. Murine coronavirus replication induces cell cycle arrest in G0/G1 phase [J]. J Virol, 2004, 78(11): 5658-5669.
[11]Yuan X, Wu J, Shan Y, Yao Z, Dong B, Chen B, Zhao Z, Wang S, Chen J, Cong Y. SARS coronavirus 7a protein blocks cell cycle progression at G0/G1 phase via the cyclin D3/pRb pathway [J]. Virology, 2006, 346(1): 74-85.
[12]杨丽,张荣华,蔡宇,黄丰.去卵巢对SD大鼠MSCs生物学特性的影响 [J].中国病理生理杂志,2010,26(7):1249-1254.
[13]李倩倩,朱红,王朝莉,黎仕娟,胡为民.表皮生长因子对食管鳞癌细胞Eca109细胞周期及其调控因子的影响 [J].中国免疫学杂志,2015,31(12):1616-1620.
[14]Yaguchi T, Saito M, Yasuda Y, Kanno T, Nakano T, Nishizaki T. Higher concentrations of extracellular ATP suppress proliferation of Caco-2 human colonic cancer cells via an unknown receptor involving PKC inhibition [J]. Cell Physiol Biochem, 2010, 26(2): 125-134.
[15]Bullwinkel J, Baron-Lühr B, Lüdemann A, Wohlenberg C, Gerdes J, Scholzen T. Ki-67 protein is associated with ribosomal RNA transcription in quiescent and proliferating cells [J]. J Cell Physiol, 2006, 206(3): 624-635.
[16]Sugalski JM, Rodriguez B, Moir S, Anthony DD. Peripheral blood B cell subset skewing is associated with altered cell cycling and intrinsic resistance to apoptosis and reflects a state of immune activation in chronic hepatitis C virus infection [J]. J Immunol, 2010, 185(5): 3019-3027.
[17]Basak O, van de Born M, Korving J, Beumer J, van der Elst S, van Es JH, Clevers H. Mapping early fate determination in Lgr5+crypt stem cells using a novel Ki67-RFP allele [J]. EMBO J, 2014, 33(18): 2057-2068.
[18]Gravez B, Tarjus A, Pelloux V, Ouvrard-Pascaud A, Delcayre C, Samuel J, Clément K, Farman N, Jaisser F, Messaoudi S. Aldosterone promotes cardiac endothelial cell proliferation in vivo [J]. J Am Heart Assoc, 2015, 4(1): e001266.
[19]Gonsalvez DG, Cane KN, Landman KA, Enomoto H, Young HM, Anderson CR. Proliferation and cell cycle dynamics in the developing stellate ganglion [J]. J Neurosci, 2013, 33(14): 5969-5979.
[20]Introini A, Vanpouille C, Lisco A, Grivel JC, Margolis L. Interleukin-7 facilitates HIV-1 transmission to cervico-vaginal tissue ex vivo [J]. PLoS Pathog, 2013, 9(2): e1003148.
[21]Cai Q, Xiao B, Si H, Cervini A, Gao J, Lu J, Upadhyay SK, Verma SC, Robertson ES. Kaposi’s sarcoma herpesvirus upregulates Aurora A expression to promote p53 phosphorylation and ubiquitylation [J]. PLoS Pathog, 2012, 8(3): e1002566.
[22]Nascimento R, Costa H, Parkhouse RM. Virus manipulation of cell cycle [J]. Protoplasma, 2012, 249(3): 519-528.
[23]Kumar P, Murakami M, Kaul R, Saha A, Cai Q, Robertson ES. Deregulation of the cell cycle machinery by Epstein-Barr virus nuclear antigen 3C [J]. Future Virol, 2009, 4(1): 79-91.
[24]Bedner E, Halicka HD, Cheng W, Salomon T, Deptala A, Gorczyca W, Melamed MR, Darzynkiewicz Z. High affinity binding of fluorescein isothiocyanate to eosinophils detected by laser scanning cytometry: a potential source of error in analysis of blood samples utilizing fluorescein-conjugated reagents in flow cytometry [J]. Cytometry, 1999, 36(1): 77-82.
Application of Ki67 and nuclear acid fluorescent dye co-staining in analysis of cell cycle
SUN Shuhui
Department of Medical Microbiology and Parasitology, Key Laboratory of Medical Molecular Virology of Ministries of Education and Health, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China
The interaction between pathogenic microbes and host cells is crucial for studies on infections and tumor cell biology. The kinetic studies of cell cycle are of significance for understanding the mechanisms mediated by microbesversushost cells. In this paper, a novel method for cell cycle analysis in mouse splenic cells by Ki67 and 4′,6-diamidino-2-phenylindole (DAPI) or propidium iodide (PI) co-staining is introduced.
Cell cycle; Flow cytometry; Ki67; 4′,6-Diamidino-2-phenylindole; Propidium iodide
孙淑惠
Corresponding author. SUN Shuhui, E-mail: sunshuhui@fudan.edu.cn
2016-04-25)
