氧化燃烧法测量生物介质中有机3H和14C的活度
2016-09-09石敏
石 敏
辽宁省核与辐射监测中心,辽宁 沈阳 110161
氧化燃烧法测量生物介质中有机3H和14C的活度
石敏
辽宁省核与辐射监测中心,辽宁 沈阳110161
随着核能的快速发展,氚(3H)和14C已成为向环境排放的主要放射性核素,并愈来愈受到人们的关注。对环境生物介质中有机3H和14C的监测技术也已成为环境监测工作的重点,而如何提取生物样品中的有机3H和14C是监测分析工作中的关键。本工作采用氧化燃烧法同时提取松针生物中的3H和14C并进行测量,测量结果表明,其装置空白回收率分别可达到87.1%和96.4%,加标回收率分别为84.8%和95.7%。测得松针生物样品中有机3H、14C的比活度分别为(8.89±0.54) Bq/kg(鲜重,3.19 Bq/L,n=3)、(22.2±1.90) Bq/kg(鲜重,0.150 Bq/g(以碳计),n=3);探测下限分别为4.04 Bq/kg(鲜重,1.29 Bq/L)、14.3 Bq/kg(鲜重,0.096 Bq/g(以碳计));该分析方法的扩展不确定度分别为25.6%、39.4%(k=2)。分析结果与同类生物样品为同一水平,分析结果可靠。
生物介质;氧化燃烧法;有机3H、14C
随着国内核能的快速发展,人们对排放至环境中的放射性核素愈来愈关注,而3H和14C是排放至环境中的主要核素之一。
3H一般以气态的形式被排放到大气中,随后通过各种反应参与到大自然水的循环当中。环境中的3H可以通过人类的呼吸、饮水、饮食、皮肤接触等方式进入人体,进而对人体造成内照射伤害[1]。
3H是半衰期为12.33 a的低能β射线体,最大β射线能量Emax=18.6 keV。由于它的同位素氢是组成水和生物体的基本元素,3H能通过氧化和同位素交换反应存在于食物和一切生物体中,因而它是环境放射性监测的一个重要对象。14C的半衰期为5 730 a,最大能量Emax=156 keV。由于14C参加各种生物循环,它的半衰期长且在环境中广泛分布,因而它的放射性活度测量也受到人们的重视[2]。
生物样品作为人类饮食过程中的一个重要组成部分,其中所含的3H可以分为自由水3H(TFWT)和有机3H(OBT)。自由水3H在人体的生物半排期为10 d左右,而大部分的有机3H在人体的半排期为30 d,其在人体造成的内照射的危害相对较大[1]。14C能很容易地沉积在食物链中,生物半衰期将近40 d,相比于人体通过呼吸作用积累的14C,直接食入受污染的食物的危害更大。因此,本工作主要探讨在人类生物链中的陆地生物和海洋生物样品中有机3H和有机14C的含量测量方法。
1 测量原理
通过调查,生物介质中有机3H的收集测量方法主要有湿法氧化法[3]和氧化燃烧法[2]。湿法氧化法是利用强酸对生物介质进行氧化溶解,将有机态的3H转化成HTO,然后蒸馏反应液收集冷凝液后加氨水中和,于低本底液体闪烁测量仪中测量;氧化燃烧法是先将生物样品烘干,除去其中的自由水3H,然后放入氧化燃烧炉中,通入氮气和氧气充分燃烧样品,使有机3H全部转化成冷凝水,收集后经纯化用低本底液闪谱仪测量。
生物介质中有机14C的收集测量方法主要有苯合成法[2]、二氧化碳吸收法[2]、加速器质谱法[4]等。苯合成法和二氧化碳吸收法均是采用通氧燃烧,分别通过合成苯和碱液收集二氧化碳形成碳酸钙沉淀,然后与闪烁液混匀,用低本底液闪谱仪测定样品中14C的放射性活度;加速器质谱法则是采取索氏提取经酸碱洗涤、真空氧化、催化合成后上质谱仪测定。
可见氧化燃烧法是同时适用于生物中3H和14C收集的唯一方法,可在实际操作中同时完成生物样品中3H和14C的收集及分析。流程图示于图1。
2 实验部分
2.1主要试剂和仪器
高锰酸钾、无水碳酸钠、氢氧化钠、固体氯化铵、氯化钙、葡萄糖、无水乙醇(质量分数不低于99.7%)、Triton-X100甲苯闪烁液,市售分析纯;无水碳酸钙,市售基准纯;Hisafe Ⅲ闪烁液,光谱纯,美国GE公司;3H标准溶液、Ca14CO3标准粉末,中国计量科学研究院。
Carbolite MTT12/65/900型氚碳氧化燃烧炉,英国卡博莱特公司;1220型低本底β液体闪烁测量仪,美国PE公司;DDS-11A型电导率仪、PHS-25型pH计,上海雷磁公司;BSS224型分析天平,感量0.1 mg,量程200 g,德国赛多利斯公司;专用塑料瓶(20 mL)、低钾玻璃瓶(20 mL),美国PE公司。
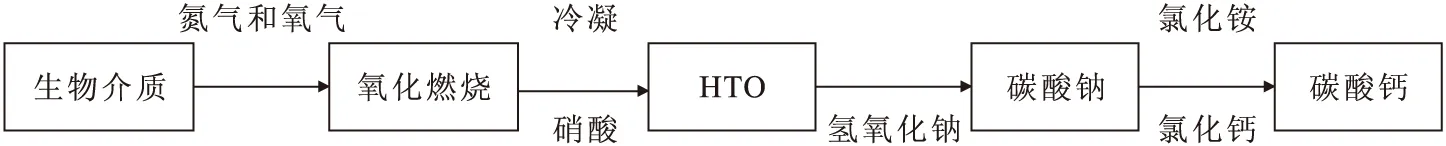
图1 氧化燃烧法收集HTO、14CFig.1 Collecting HTO and 14C by oxidation combustion
2.2样品采集及预处理
本实验分析采用的样品为松针(采集于大连瓦房店市复州城红沿河核电厂东门外),样品采集及预处理按照HJ/T61-2001《辐射环境监测技术规范》[5]进行:将松针进行除灰净化秤鲜重后进行105 ℃的烘干,并记录样品干重。样品预处理仪器及工作流程如下。
1) 仪器及工作原理
采用英国Carbolite MTT12/65/900的氚碳燃烧炉(见图2),通过加入适当的催化剂煅烧生物样品,收集主要的燃烧产物,即二氧化碳和水,然后用液闪计数器测量收集到的3H和14C活度,从而计算样品中3H和14C的含量。
2) 工作流程
(1) 称取20 g左右生物干样品于样品舟中,放入氧化燃烧区内,再将专用纯铜丝氧化剂装入氧化室,将燃烧-氧化装置连接好。
(2) 先在氧化燃烧区通氮气,控制一定流速赶尽装置内空气。待流量稳定后,调节氧化燃烧区氧气流速约50 mL/min,观察鼓泡是否正常,然后再调节燃烧区氧气流速至100 mL/min。
(3) 接通高温炉电源,使催化氧化区的温度升至700 ℃。再加热氧化燃烧室,温度设定为1~2 ℃/min升到350 ℃并保温30 min;再调节流量并升温至500 ℃,此时将氧化燃烧区气体切换成纯氧,至温度在700 ℃时保温2 h,使样品完全氧化,然后切断电源,停止加热和通气。
(4) 燃烧过程中的水蒸气通过冷凝管收集于0.1 mol/L硝酸接收瓶,供3H分析测定用;二氧化碳经盛有5 mol/L氢氧化钠溶液的吸收瓶吸收后供分析14C用。
2.3样品测量
2.3.13H的测量称量所收集的吸收液后,转入250 mL蒸馏瓶,加入少量的高锰酸钾和无水碳酸钠,氧化回流至完全褪色。然后将蒸馏瓶接入冷凝管蒸馏,再加入少量的高锰酸钾进行重蒸馏,蒸馏液密封在磨口烧瓶内。称取8 g蒸馏样品于20 mL塑料计数瓶中,与12 mL Hisfase Ⅲ闪烁液混匀,加盖密封,放入低本底β液体闪烁测量仪的样品室内避光2 h后测量100 min×10次。本底水采用电导率小于5.0 μs/cm的无氚二次蒸馏水,实验过程中用本底水与实验样品同步进行空白试验,保证化学试剂对实验结果的影响可以忽略。
2.3.214C的测量将已吸收了二氧化碳的氢氧化钠溶液通过加入固体氯化铵、在pH=10.4~10.6之间加氯化钙溶液形成碳酸钙沉淀,经蒸馏水和无水乙醇洗涤、105 ℃烘干至恒重,研成粉末保存。称取碳酸钙样品2.000 0 g,放在测量瓶中,再加入闪烁液14.0 mL,二次蒸馏水4.0 mL,加盖,振荡使碳酸钙样品与闪烁液混合均匀,将计数瓶放入低本底β液体闪烁测量仪中暗适应2 h后测量30 min×10次。本底碳酸钙采用基准CaCO3粉末,基准CaCO3不含有14C,实验过程中用基准CaCO3与实验样品同步进行空白试验,保证化学试剂对实验结果本底无贡献。
2.4测量结果的计算
生物中3H(或14C)的比活度由下式计算:
式中:a,生物样中3H(或14C)的比活度,Bq/kg(鲜重);E,仪器对3H(或14C)的计数效率,%;Nc,待测试样的计数率,min-1;Nb,本底试样的计数率,min-1;m,测量水(或碳酸钙)的质量,g;m1,生物样转化后所得到的水(或碳酸钙)总质量,g;m生物,加入前处理装置中的生物质量,g;Y,处理装置的回收率,%;Q,干鲜比,g/kg(鲜重)。
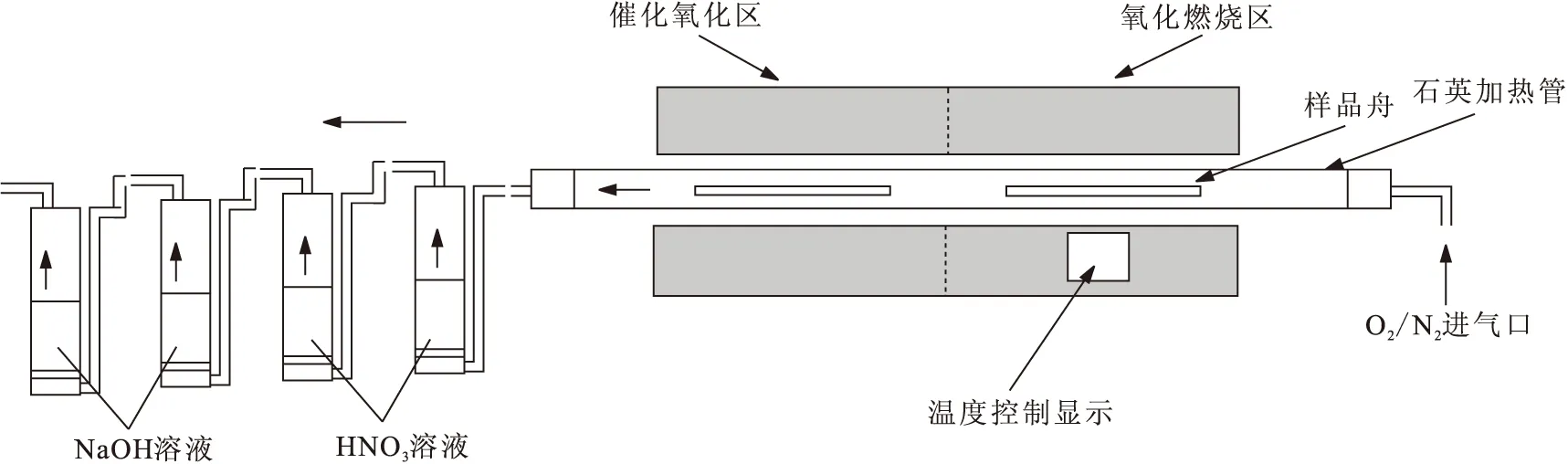
图2 氚碳氧化燃烧炉内部结构Fig.2 Internal structure of the tritium carbon oxidation burning device
仪器对3H(或14C)的计数效率计算如下:
式中:S,标准样品强度,min-1;Nc1,标准试样的计数率,min-1。
探测下限(LLD)可用下式计算:
式中,t,样品测量时间,min。
3 结果与讨论
3.1处理装置的回收率
回收率是反映待测物在样品分析过程中损失程度的指标,损失越少,回收率越高。加标回收率的测定是实验室内经常用以自控的一种质量控制技术。它分为空白加标回收率和样品加标回收率两种。
1) 空白加标回收率
在没有被测物质的空白样品基质中加入定量的标准物质,按样品的处理步骤分析,得到的结果与理论值的比值即为空白加标回收率。
实验采用葡萄糖(C6H12O6)粉末(分析纯)作为标准物质,放入燃烧炉内加热氧化,定量的葡萄糖粉末经充分氧化燃烧后,全部转化成水和二氧化碳气体。通过称量自动装置的冷凝器以及氢氧化钠碱液吸收瓶前后质量差来测定装置回收率,结果列于表1。
表1氚碳氧化燃烧炉空白回收率
Table 1Recovery results of the tritium carbon oxidation burning device
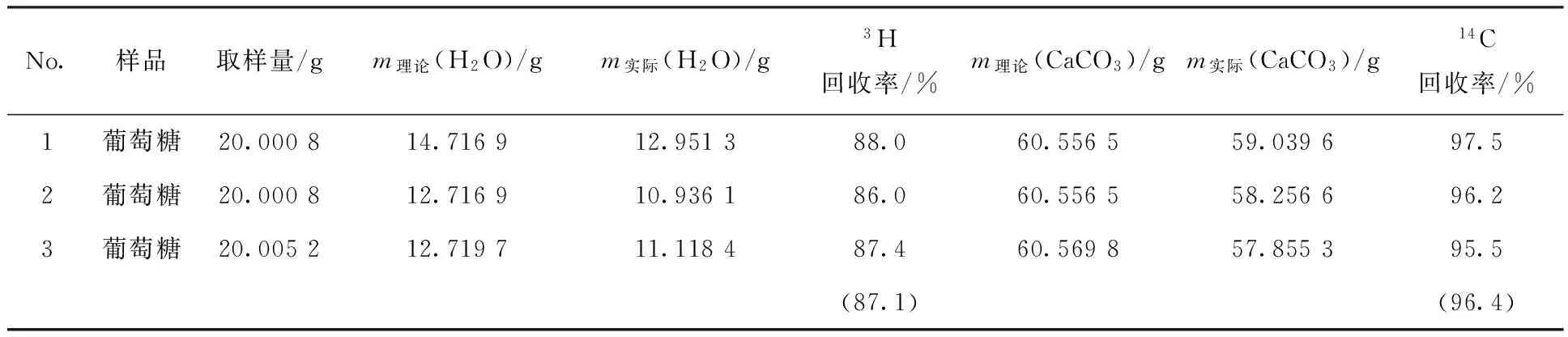
No.样品取样量/gm理论(H2O)/gm实际(H2O)/g3H回收率/%m理论(CaCO3)/gm实际(CaCO3)/g14C回收率/%1葡萄糖20.000814.716912.951388.060.556559.039697.52葡萄糖20.000812.716910.936186.060.556558.256696.23葡萄糖20.005212.719711.118487.460.569857.855395.5(87.1)(96.4)
注:氚冷凝回收采取冰水混合物方式,括号中数值为平均值
由表1可以看出,英国Carbolite MTT12/65/900型氚碳氧化燃烧炉采用冰水混合物冷凝方式回收3H 的回收率可达到87.1%,采用NaOH吸收的14C回收率达到96.4%。
2) 样品加标回收率[6]
取两份相同样品,其中一份加入定量的待测成分标准物质;同时按相同步骤分析,加标的样品所测结果减去未加标的测量结果,其差值同加入标准物质的理论值之比即为样品加标回收率。
实验采用在松针样品中加入一定活度的3H标准溶液和14C标准粉末,按照相同的前处理及分析测量步骤进行。为保证测量结果精度,平行测量3次取其平均值,其样品加标回收率结果列于表2。由表2结果可以看出,松针样品的3H加标回收率平均值为84.8%,与装置的空白回收率87.1%接近;14C加标回收率平均值为95.7%,与装置的空白回收率96.4%接近。
表23H、14C样品加标回收率
Table 2Standard addition recovery rate of3H and14C sample
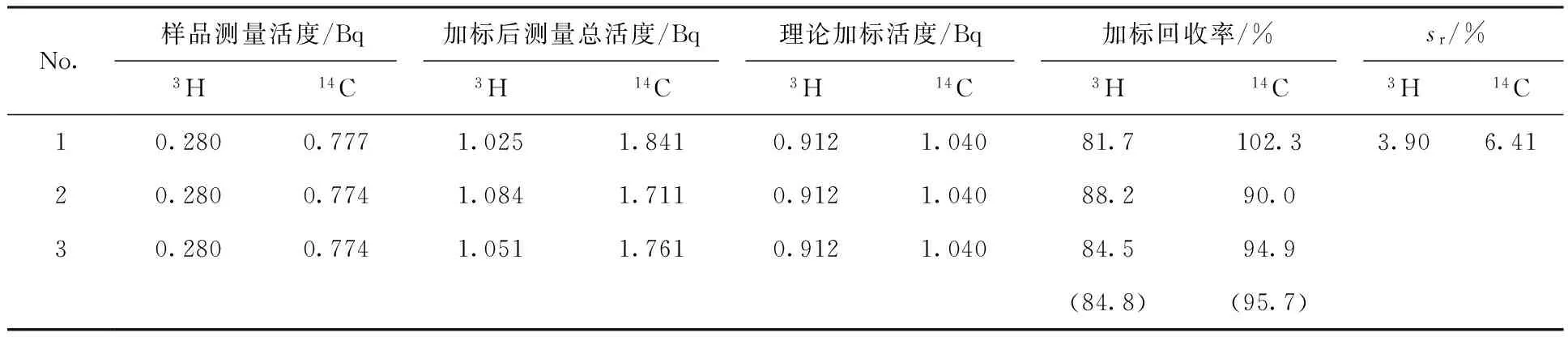
No.样品测量活度/Bq加标后测量总活度/Bq理论加标活度/Bq加标回收率/%sr/%3H14C3H14C3H14C3H14C3H14C10.2800.7771.0251.8410.9121.04081.7102.33.906.4120.2800.7741.0841.7110.9121.04088.290.030.2800.7741.0511.7610.9121.04084.594.9(84.8)(95.7)
注:括号中数值为平均值
3.2低本底液闪测量仪的计数效率
取8.00 mL标准3H溶液和12 mL闪烁液于20 mL专用塑料瓶中,摇匀后放入β低本底液体闪烁测量仪内暗适应2 h后测量100 min×10次,平行测量6次其计数效率列于表3。
取一定活度的标准Ca14CO3粉末和基准CaCO3粉末(总重约2.0 g),加入4 mL二次蒸馏水和14 mL闪烁液于20 mL低钾玻璃瓶中,摇匀后放入β低本底液体闪烁测量仪内暗适应2 h后测量30 min×10次,平行测量6次同时取约2.0 g基准CaCO3粉末,加入4 mL二次蒸馏水和14 mL闪烁液于20 mL低钾玻璃瓶中做为本底进行测量。其计数效率列于表3。
由表3可知,仪器对3H、14C的计数效率分别为20.1%、29.4%。
3.3样品分析结果及探测下限
采用松针作为生物样品,按照EJ/T 1008-96[7]中的分析方法完成生物样品中有机3H、14C的分析,测量结果列于表4。由表4可以看出,3H和14C平行3次测量结果平均值分别为(8.89±0.54) Bq/kg(鲜重,3.19 Bq/L)和(22.2±1.90) Bq/kg(鲜重,0.150 Bq/g(以碳计)),探测下限可分别达到4.04 Bq/kg(鲜重,1.29 Bq/L)和14.3 Bq/kg(鲜重,0.096 Bq/g(以碳计))。与文献[8-9]数据相比,本工作对松针的有机3H、14C的测量结果与同类生物样品为同一水平。
表33H、14C的计数效率
Table 3Counting efficiency of3H and14C sample
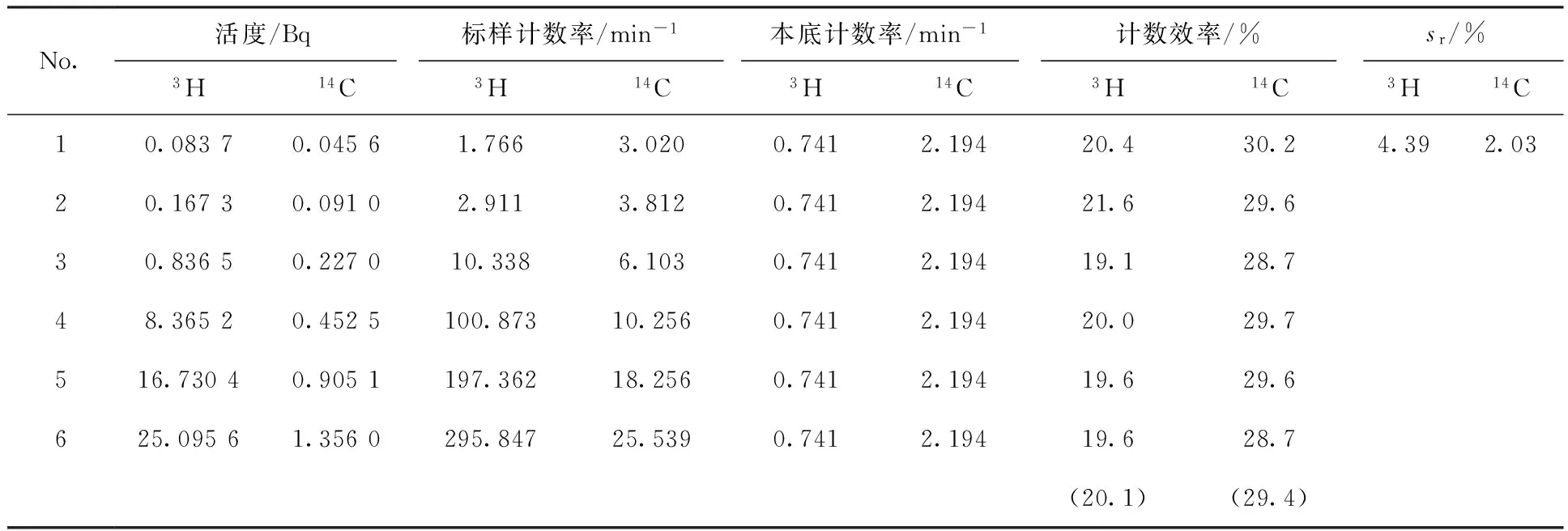
No.活度/Bq标样计数率/min-1本底计数率/min-1计数效率/%sr/%3H14C3H14C3H14C3H14C3H14C10.08370.04561.7663.0200.7412.19420.430.24.392.0320.16730.09102.9113.8120.7412.19421.629.630.83650.227010.3386.1030.7412.19419.128.748.36520.4525100.87310.2560.7412.19420.029.7516.73040.9051197.36218.2560.7412.19419.629.6625.09561.3560295.84725.5390.7412.19419.628.7(20.1)(29.4)
注:括号中数值为平均值
表4生物样品中3H、14C的测量方法精密度
Table 4Accuracy of the method about measurement of3H and14C in organism
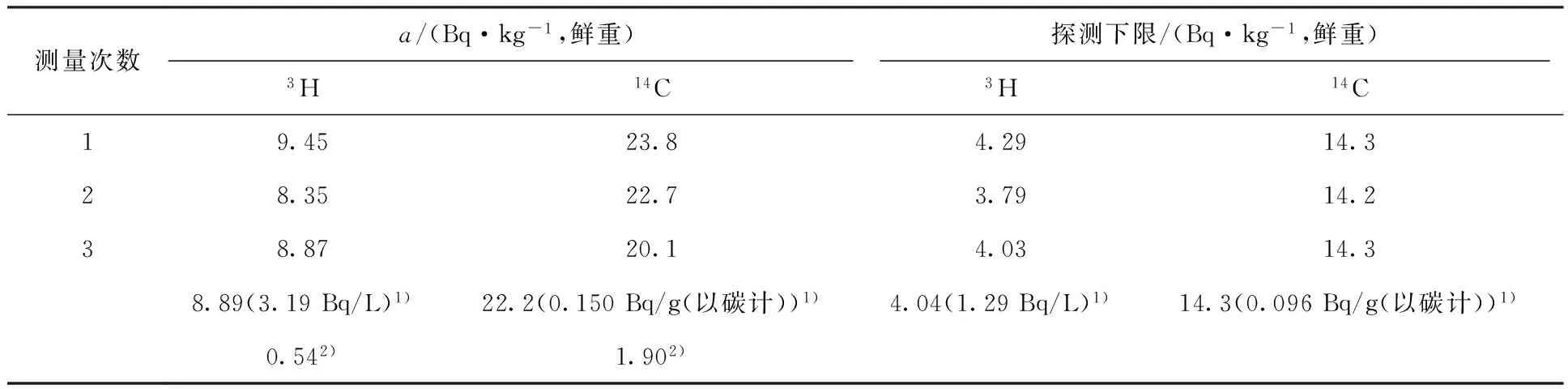
测量次数a/(Bq·kg-1,鲜重)探测下限/(Bq·kg-1,鲜重)3H14C3H14C19.4523.84.2914.328.3522.73.7914.238.8720.14.0314.38.89(3.19Bq/L)1)22.2(0.150Bq/g(以碳计))1)4.04(1.29Bq/L)1)14.3(0.096Bq/g(以碳计))1)0.542)1.902)
注:1) 平均值
2) 结果的相对偏差
3.4生物样品中3H和14C的不确定分析
本实验分析过程中的不确定度主要包括生物前处理设备回收率测定不确定度、移液管带来的不确定度、称量产生的不确定度、仪器探测效率测量的不确定度、样品测量时计数的不确定度,其分项及最终合成不确定度列于表5。由表5可以看出:本分析方法中3H和14C的扩展不确定度分别为25.6%和39.4%(k=2)。
表5生物样品中3H和14C不确定结果
Table 5Uncertainty of the method about measure3H and14C in organism
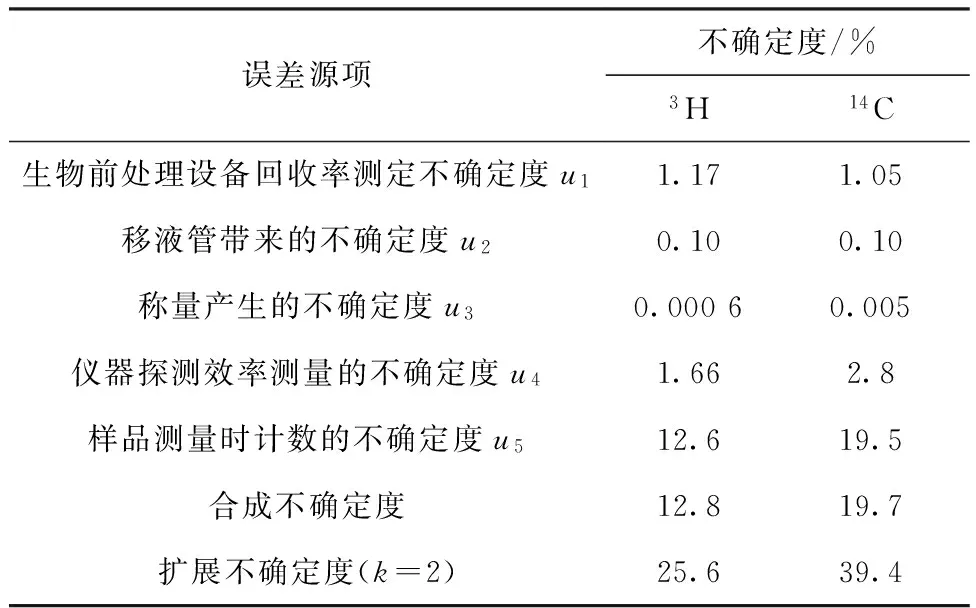
误差源项不确定度/%3H14C生物前处理设备回收率测定不确定度u11.171.05移液管带来的不确定度u20.100.10称量产生的不确定度u30.00060.005仪器探测效率测量的不确定度u41.662.8样品测量时计数的不确定度u512.619.5合成不确定度12.819.7扩展不确定度(k=2)25.639.4
4 结 论
介绍了基于3H、14C氧化燃烧法进行生物样品的预处理及通过β低本底液体闪烁谱仪测量3H、14C放出的β射线产生的计数,从而可计算出生物样品中3H、14C的放射性比活度。
(1) 采用氧化燃烧法收集松针生物中的3H,其装置的空白回收率可达到87.1%,样品加标回收率为84.8%。该方法采取冰水混合物的冷却方式,若采取温度更稳定的冷井回收3H,回收率应该会更高。
(2) 采用氧化燃烧法收集松针生物中的14C,其装置的空白回收率可达到96.4%,样品加标回收率为95.7%。
(3) 使用氧化燃烧法可同时收集生物样品中的3H、14C,平行测量3次测得松针生物样品中有机3H、14C的比活度分别为(8.89±0.54) Bq/kg(鲜重,3.19 Bq/L)、(22.2±1.90) Bq/kg(鲜重,0.150 Bq/g(以碳计));探测下限分别为4.04 Bq/kg(鲜重,1.29 Bq/L)、14.3 Bq/kg(鲜重,0.096 Bq/g(以碳计));该分析方法的扩展不确定度分别为25.6%、39.4%(k=2)。分析结果与同类生物样品为同一水平,分析结果可靠。
由于目前国内没有生物样品的有机3H和14C的分析标准,该方法可为生物样品中有机3H和14C的监测分析提供有效的方法。
[1]薛秀家.生物样品中氚的前处理装置的设计和环境样品中氚水平调查[D].苏州:苏州大学,2011.
[2]杨海兰.环境和生物样品中3H和14C的测量[J].核化学与放射化学,2004,26(3):184-188.
[3]Belcher E H. The assay of tritium in biological material by wet oxidation with perchloric acid followed by liquid scintillation counting[J]. Physics in Medicine and Biology, 1960, 5(1): 49-56.
[4]谷韶中.生物样中的14C的制样方法研究[J].辐射防护通讯,2008,28(1):37-40.
[5]国家环境保护总局.HJ/T61-2001辐射环境监测技术规范[S].北京:中国环境科学出版社,2001.
[6]宋树成,郭如侠.浅谈样品加标回收率[J].水科学与工程技术,2011(4):92-93.
[7]中国辐射防护研究院.EJ/T 1008-1996空气中14C的取样与测定方法[S].北京:中国核工业总公司,1996.
[8]董美莲,谷韶中.秦山核电基地环境生物样品中14C监测方法探讨[J].辐射防护,2016,36(2):117-121.
[9]卜扬,杨帆.海阳核电厂本底调查生物有机氚和有机碳的对比研究[C]∥3H、14C测量技术及应用学术研讨会论文集.苏州:环境保护部核与辐射安全中心,2014:40-52.
Measurement for Activity of Organic Tritium and14C in Biological Medium by Oxidation Combustion Method
SHI Min
Liaoning Provincial Nuclear and Radiation Monitoring Center, Shenyang 110161, China
With the development of nuclear energy, tritium and14C have become the main radionuclide emissions to the environment, and get more and more attention of people. Therefore, the monitoring technique about organic tritium and14C in environmental biological medium becomes the key point for the monitoring work, and how to extract organic tritium and14C in biological samples is the key for monitoring and analysis work. This article provides the method to extract and measure the organic tritium and14C by oxidation combustion, then to measure. The measured results show that the device blank recovery rate can reach 87.1% and 96.4%; the standard addition recovery rate can reach 84.8% and 95.7% respectively. The specific activity of organic tritium and14C in biological samples of pine needles are (8.89±0.54) Bq/kg (fresh weight, 3.19 Bq/L,n=3) and (22.2±1.90) Bq/kg (fresh weight, 0.150 Bq/g (carbon),n=3); and the detection lower limits of organic tritium and14C are 4.04 Bq/kg (fresh weight, 1.29 Bq/L) and 14.3 Bq/kg (fresh weight, 0.096 Bq/g (carbon)); and the expanded uncertainty of this analysis method of organic tritium and14C are 25.6% and 39.4% (k=2) respectively. Analysis results have the same level with similar biological samples, and the analysis results are reliable.
biological medium; oxidation combustion method; organic tritium and14C
2015-06-23;
2015-08-25
石敏(1964—),女,辽宁沈阳人,高级工程师,应用化学专业
X835,X837
A
0253-9950(2016)04-0207-06
10.7538/hhx.2016.38.04.0207
