黄色短杆菌ilvN基因定点突变和ilvBN、ilvC串联表达对L-缬氨酸产量的影响
2016-08-06曾邦定黄钦耿郭小雷王明兹施巧琴吴松刚
曾邦定,黄钦耿,梁 玲,郭小雷,王明兹,施巧琴,吴松刚
黄色短杆菌ilvN基因定点突变和ilvBN、ilvC串联表达对L-缬氨酸产量的影响
曾邦定1,黄钦耿1,梁玲2,郭小雷2,王明兹1,施巧琴1,吴松刚1
(1福建师范大学生命科学学院,工业微生物教育部工程研究中心,福建 福州 350117;2福建省麦丹生物集团有限公司福州研究中心,福建 福州 350008)
摘要:由ilvBN、ilvC基因编码的乙酰羟酸合成酶(AHAS)和乙酰羟酸异构还原酶(AHAIR)是L-缬氨酸合成途径的两个关键酶。本实验以黄色短杆菌Brevibacterium flavum MD515为出发菌株,通过PCR技术扩增其ilvBN 和ilvC基因,对调节亚基ilvN进行定点突变,获得抗反馈抑制突变型编码基因ilvBNrC;然后将其插入穿梭表达载体 pZ8-1中,构建串联表达质粒 pZ8-1-ilvBNrC 并转化出发菌株,筛选获得工程菌株 B.flavum MD515/pZ8-1-ilvBNrC。摇瓶发酵该工程菌株L-缬氨酸产量达29.5 g·L-1,较出发菌株提高27.7%,同时生长速度和生物量也比出发菌株有所提高,丙氨酸含量降低,L-亮氨酸及L-异亮氨酸含量提高。在30 L发酵罐连续补料发酵60 h后L-缬氨酸产量达61.7 g·L-1,糖酸转化率为39.2%。菌株MD515/pZ8-1-ilvBNrC发酵液透光率较出发菌株高且蛋白含量低,这些特性有利于发酵液后期的分离提取。
关键词:L-缬氨酸;定点突变;乙酰羟酸合成酶;乙酰羟酸异构还原酶;共表达
引 言
L-缬氨酸(valine)是一种支链氨基酸,广泛应用于医药、食品及调味剂、动物饲料和化妆品等行业[1-3]。目前,发酵法、直接提取法和化学合成法是工业生产L-缬氨酸的3种主要方法[4]。微生物发酵为首选,常用生产菌株主要由棒杆菌和短杆菌选育而来,其中以谷氨酸棒状杆菌和黄色短杆菌为代表[5]。诱变和代谢工程育种在L-缬氨酸生产菌种选育中最为常用[6]。诱变育种操作简单,技术要求低,但工作量大、周期长、突变不定向性及副产物杂酸多,提纯成本高[6-7]。而基于理性设计的代谢工程育种可避免这些问题,目的性强、育种效率高,为L-缬氨酸高产菌株选育的最有效方法[8]。
L-缬氨酸生物合成与 L-异亮氨酸和 L-亮氨酸相关[9-11],以丙酮酸为前体,经过4步酶反应而成,依次是乙酰羟酸合酶(AHAS,编码基因 ilvBN)、乙酰羟酸异构还原酶(AHAIR,编码基因 ilvC)、二羟酸脱氢酶(DHAD,编码基因ilvD)以及支链氨基酸转氨酶(TA,编码基因ilvE)[12-13](图1)。其中AHAS是四聚体,含两个ilvB基因编码的大亚基(催化亚基)和两个ilvN基因编码的小亚基(调节亚基)[14]。它是合成途径中的第一个限速酶,其调节亚基不仅受L-缬氨酸的反馈抑制,还受L-异亮氨酸和L-亮氨酸的协同阻遏[1, 11]。因此,解除3个支链氨基酸对 AHAS的多价阻遏可获得 L-缬氨酸高产菌株。
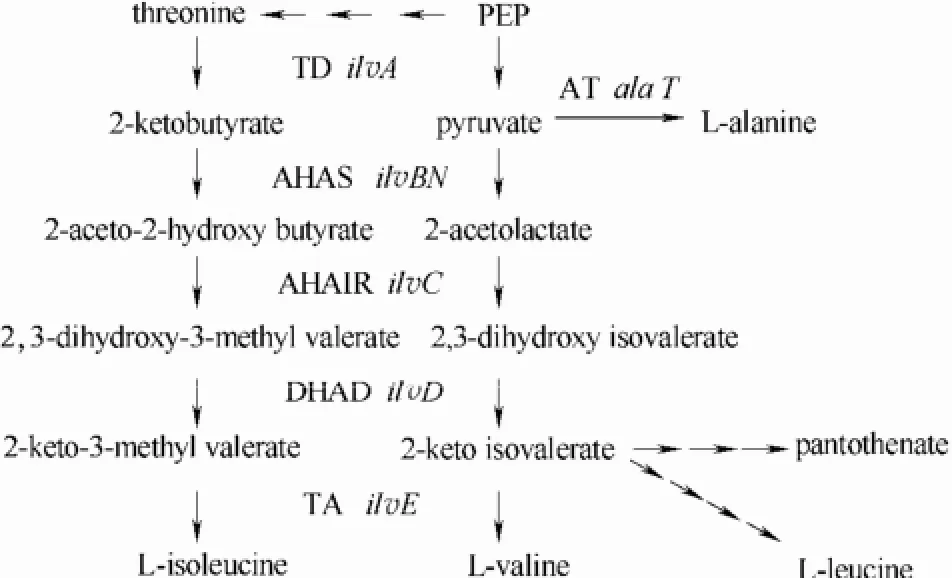
图1 L-缬氨酸的生物合成途径Fig.1 Biosynthesis pathway of L-valine
Elišáková等[15]将棒杆菌AHAS调节亚基22~24位Gly-Ile-Ile定点突变为Asp-Asp-Phe,解除了反馈抑制。Hasegawa等[16]将棒杆菌 ilvN基因156位定点突变,由Gly变成Glu,也可提高抗反馈抑制能力。此外,ilvBN与ilvC为同一操纵子(ilvBNC),同时过表达可促进 L-缬氨酸积累。Elišáková等[15]定点突变ilvN同时过表达ilvBNC,使谷氨酸棒杆菌L-缬氨酸的产量达15.2 g·L-1;Hasegawa等[16]敲除谷氨酸棒杆菌ldhA及过表达ilvBNCDE,结合工艺优化后L-缬氨酸产量可达227 g·L-1;Hou等[14]在黄色短杆菌中串联表达经定点突变的 ilvEBNrC基因,L-缬氨酸达31 g·L-1。
本文以黄色短杆菌B. flavum MD515为出发菌株,先将ilvN基因定点突变,获得抗反馈抑制突变型基因ilvBNrC,随后将其插入穿梭表达载体pZ8-1,转化出发菌株,获得过量积累 L-缬氨酸的工程菌B. flavum MD515/pZ8-1-ilvBNrC。然后摇瓶和30 L发酵罐分析其发酵性能,为工业化投产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 黄色短杆菌B. flavum MD515由福建省麦丹生物集团有限公司福州研究中心选育并保藏;穿梭表达质粒pZ8-1由福建省麦丹生物集团有限公司福州研究中心提供;质粒 pMD-18T购自TaKaRa公司。
1.1.2 主要试剂 限制性内切酶EcoRⅠ、BamHⅠ,T4连接酶、PCR试剂及所用的Taq酶、dNTP、DNA Marker等均购自TaKaRa公司;其他试剂均为国产分析纯。
1.1.3 培养基 斜面培养基(g·L-1):葡萄糖5,蛋白胨10,牛肉膏10,酵母膏3,氯化钠5,琼脂20。
种子培养基(g·L-1):葡萄糖 25,黄豆饼粉35,玉米浆5,酵母膏5,硫酸铵5,硫酸镁0.5,磷酸二氢钾1,CaCO310。
发酵培养基(g·L-1):葡萄糖125,黄豆饼粉20,玉米浆5,酵母膏3,硫酸铵35,磷酸二氢钾0.5,硫酸镁0.5,FeSO4·7H2O 0.01,MnSO4·3H2O 0.01,CaCO335,VB1100 μg·L-1,VH100 μg·L-1。以上培养基pH均为7.0。
1.2 实验方法
1.2.1 黄色短杆菌目的片段 ilvBNC的扩增 根据谷 氨 酸 棒 杆 菌Corynebacterium glutamicum ATCC13032基因序列,结合 L-缬氨酸的代谢途径分析,设计上下游引物ilvBNC-F、ilvBNC-R。
其中引物ilvBNC-F和ilvBNC-R分别带EcoRⅠ和BamHⅠ酶切位点(下划线序列)。引物由上海生工生物有限公司合成。
以黄色短杆菌基因组DNA为模板,扩增ilvBNC基因。反应体系为50 μl:ddH2O 35.5 μl,10×Ex buffer 5 μl,引物ilvBNC-F、ilvBNC-R各2.5 μl,基因组DNA模板1 μl,dNTP 2.5 μl,Ex Taq酶1 μl。反应条件为95℃预变性5 min,然后在以下条件下进行30轮循环:94℃变性40 s,57℃退火40 s,72℃延伸3 min;72℃最后延伸10 min。反应结束后,采用1%琼脂糖电泳检测,回收目的基因4℃保存。扩增产物长3700 bp。
1.2.2 pMD18-T-ilvBNC质粒载体构建及扩增 根据Takara pMD18-T Vector使用说明连接,扩增质粒,获得质粒pMD18-T-ilvBNC。
1.2.3 pMD18-T-ilvBNrC质粒载体的构建 为了将ilvN基因的第156位密码子定点突变,以提取的质粒pMD18-T-ilvBNC为模板,使用携带有突变位点的引物ilvBNrC-F和ilvBNrC-R进行PCR扩增,定点突变后的基因命名为ilvBNrC。
ilvN基因PCR介导的定点突变引物如下。
ilvBNrC-F:5′-CGAACTGATCCAATCCGAAC AGATTGCACTCAAC-3′。
ilvBNrC-R:5′-CGGATTGGATCAGTTCGCGG ATTCCGAATGGT-3′。
其中加粗的碱基为引入的第156位密码子突变碱基。PCR扩增条件为95℃预变性5 min;然后在以下条件进行12个循环:94℃变性40 s;59℃退火1.5 min;72℃延伸6 min;72℃最后延伸20 min;4℃保存。反应结束后,扩增产物用1 μl DpnI 内切酶37℃消化1 h,取20 μl消化产物转化大肠杆菌感受态细胞JM109。挑选转化子,提取质粒并进行测序验证。构建的重组载体命名为pMD18-T-ilvBNrC。
1.2.4 重组质粒 pZ8-1-ilvBNrC的构建及转化 将获得的阳性pMD18-T-ilvBNrC质粒和pZ8-1质粒分别用 EcoRⅠ和 BamHⅠ双酶切后回收质粒与基因片段,并用 T4连接酶连接以构建工程质粒pZ8-1-ilvBNrC。构建原理如图2所示。酶切体系60 μl:10×H buffer,6 μl;质粒10 μl;EcoRⅠ2 μl ;BamHⅠ2 μl;ddH2O 40 μl;37℃酶切6 h。连接体系20 μl:10×T4 ligase buffer 2 μl;ilvBNrC片段2.5 μl;pZ8-1载体片段8 μl;T4 DNA ligase 1 μl;dd H2O 6.5 μl;16℃过夜连接。
连接产物转化JM109感受态细胞,37℃复苏1 h,取200 μl复苏液涂布含50 μg·ml-1卡那霉素的LB平板,37℃倒置培养过夜。从平板上挑选卡那霉素抗性的单克隆接种至含50 μg·ml-1卡那霉素的LB培养基,37℃过夜培养,提取质粒,并对质粒进行单酶切和双酶切验证。
按照文献[17]方法制备黄色短杆菌 MD515感受态细胞,转化,筛选含有表达质粒pZ8-1-ilvBNrC的缬氨酸工程菌株,命名为 B. flavum MD515/ pZ8-1-ilvBNrC。
1.2.5 发酵产物分析 所获得的工程菌 B. flavum MD515/pZ8-1 -ilvBNrC经摇瓶发酵后分析其L-缬氨酸含量、菌体生物量以及副产物杂酸的生成情况。培养条件为 30℃,220 r·min-1发酵 48 h,以 B. flavum MD515为对照菌株。氨基酸含量测定采用纸色谱法[18]和高效液相色谱法[19]。
1.2.6 30 L罐分批补料发酵 种子液培养:挑一环新鲜斜面上的菌体接种至装有30 ml种子培养基的250 ml三角瓶中,30℃,220 r·min-1振荡培养16 h至对数生长中后期。
补料发酵:初始装液量为12 L,移种量15%,初始葡萄糖浓度约 70 g·L-1,发酵溶氧维持在15%~25%,初始搅拌转速280 r·min-1,发酵温度30℃,流加25%的氨水以控制pH在6.9~7.0,发酵期间每隔2 h取样检测菌体生物量及残糖,根据耗糖速率确定补料量;当残糖降至2.0~4.0 g·L-1时连续流加700 g·L-1的葡萄糖,维持残糖浓度在7~12 g·L-1,发酵结束前2~4 h,停止流加葡萄糖,当残糖基本耗尽时,发酵结束,整个发酵周期约60 h。
1.2.7 发酵液特性 发酵结束后,预处理、用有机膜过滤及离子交换法分离L-缬氨酸。具体操作按文献[20]方法进行,分别采用紫外可见分光光度计和考马斯亮蓝法测定透光率和蛋白浓度,比较工程菌发酵液杂蛋白等特性。

图2 重组表达质粒pZ8-1-ilvBNrC构建示意图Fig.2 Maps of plasmid pZ8-1-ilvBNrC constructed
2 结果与讨论
2.1 黄色短杆菌B. flavum MD515 ilvBNC基因的扩增
从黄色短杆菌B. flavum MD515中提取DNA为模板,以ilvBNC-F和ilvBNC-R为引物进行PCR扩增,获得一段约3700 bp的产物(图3)。将扩增产物与pMD18-T 载体连接,转化涂布于含有Amp的LBG平板。待平板长出菌落后,随机挑取10个单克隆进行菌落PCR验证,所挑取的10个单克隆均可检测到约3700 bp的目的片段。
2.2 pMD18-T-ilvBNrC的构建
采用 PCR介导的定点突变,以 pMD18-T-ilvBNC为模板对ilvN基因进行定点突变,同样采取菌落PCR验证,选取阳性克隆送交上海生工进行测序。并将序列进行Clustalx 序列分析,结果发现突变后的ilvBNrC基因与突变前ilvBNC基因的差异在于第156个密码子核苷酸由GGA突变为GAA,所编码的氨基酸由甘氨酸变为谷氨酸,与定点突变设计目标一致,表明pMD18-T-ilvBNrC构建成功。
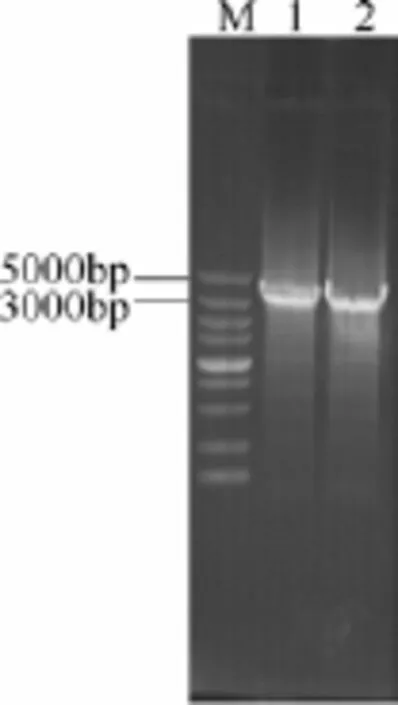
图3 黄色短杆菌B. flavum MD515 ilvBNC基因PCR克隆Fig.3 PCR of ilvBNC fragment from B. flavum MD515M—DL 5000TMDNA Marker; lane 1,2—ilvBNC fragment
2.3 点突变串联表达质粒pZ8-1-ilvBNrC的构建
pMD18-T-ilvBNrC质粒载体经EcoRⅠ和BamHⅠ双酶切后,出现长度分别为3700 bp和2700 bp的条带,回收3700 bp片段(图4)。pZ8-1质粒也经EcoRⅠ和BamHⅠ双酶切后,回收7000 bp左右的线性目标产物片段。两个酶切产物经连接后转化大肠杆菌,从卡那霉素抗性平板上获得阳性转化子,提取质粒后分别进行单酶切和双酶切验证。结果见图5,重组质粒经EcoRⅠ和BamHⅠ分别单酶切后,均产生10700 bp条带;而采用EcoRⅠ和BamHⅠ双切后,出现大小为7000 bp和3700 bp的两条带,与设计结果一致,说明重组质粒pZ8-1-ilvBNrC构建成功。
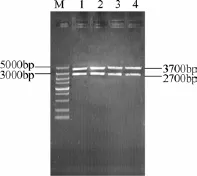
图4 pMD18-T-ilvBNrC质粒EcoRⅠ、BamHⅠ双酶切Fig.4 Restriction enzyme digestion of pMD18-T-ilvBNrC by EcoRⅠand BamHⅠM—DL 5000TMDNA Marker; lane1,2,3,4—fragments of pMD18-T-ilvBNrC plasmid by EcoRⅠand BamHⅠdouble enzymatic digestion
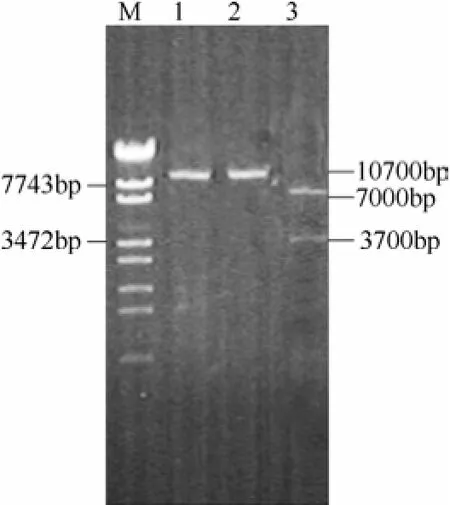
图5 重组表达质粒pZ8-1-ilvBNrC的分子验证Fig.5 Molecular verification of recombinant plasmid pZ8-1-ilvBNrC
M—λ-EcoT14 I digest DNA Marker; lane 1—fragment of pZ8-1-ilvBNrC by EcoRⅠenzymatic digestion; lane 2—fragment of pZ8-1-ilvBNrC by BamH Ⅰenzymatic digestion; lane 3—fragment of pZ8-1-ilvBNrC plasmid by EcoRⅠ, BamHⅠdouble enzymatic digestion
2.4 工程菌株获得及功能验证
将所构建的点突变串联表达质粒 pZ8-1-ilvBNrC转化黄色短杆菌MD515,分离转化子提取质粒,并以质粒为模板,ilvBNrC-F和ilvBNrC-R为引物扩增ilvBNrC,扩增产物为3700 bp,与理论值一致(图6,泳道1);用EcoRⅠ单酶切质粒,获得大小10700 bp的片段,与设计结果一致(图6,泳道2);用EcoRⅠ和BamHⅠ双酶切质粒,获得大小7000 bp和3700 bp的片段,也与设计结果一致(图6,泳道3)。表明工程菌株B. flavum MD515/pZ8-1-ilvBNrC构建成功。用同样的方法将空白质粒 pZ8-1及 pZ8-1-ilvBNC也分别转化 B. flavum MD515菌,构建对照菌株 B. flavum MD515/pZ8-1和B. flavum MD515/ pZ8-1-ilvBNC。
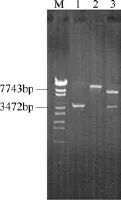
图6 重组菌株的分子验证Fig.6 Confirmation of recombinant strain by PCRM—λ-EcoT14 I digest DNA Marker; lane 1—PCR cloning of ilvBNrC fragment; lane 2—fragment of pZ8-1-ilvBNrC plasmid by EcoRⅠenzymatic digestion; lane 3—fragment of pZ8-1-ilvBNrC plasmid by EcoRⅠ, BamHⅠdouble enzymatic digestion
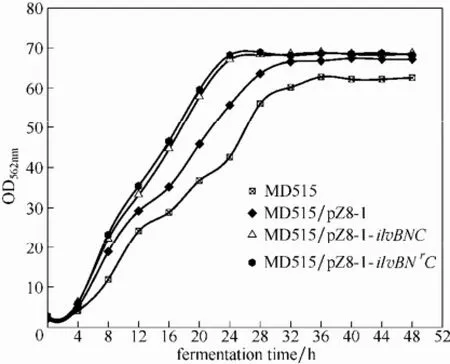
图7 不同黄色短杆菌的发酵生长曲线Fig.7 Growth curves of MD515,MD515/pZ8-1,MD515/ pZ8-1-ilvBNC and MD515/ pZ8-1-ilvBNrC
2.5 工程菌发酵产物分析
为了分析工程菌株B. flavum MD515/ pZ8-1-ilvBNrC的L-缬氨酸及主要副产物合成情况,将其与两个对照菌株B. flavum MD515/ pZ8-1和B. flavum MD515/ pZ8-1-ilvBNC相同条件培养,结果见图7和表1。
MD515/pZ8-1-ilvBNrC 菌株和 MD515/ pZ8-1-ilvBNC菌株生长速度及L-缬氨酸产量较MD515菌株有较大幅度提高;而转入空载体的 MD515/ pZ8-1菌株L-缬氨酸产量低于出发菌株MD515,但生长速度和生物量较出发菌株高;另外对于副产物,MD515/pZ8-1的丙氨酸、异亮氨酸和亮氨酸含量与出发菌株接近,而 MD515/ pZ8-1-ilvBNC 和MD515/pZ8-1-ilvBNrC发酵液中丙氨酸含量显著降低,异亮氨酸和亮氨酸的含量则有所提高,说明ilvN的定点突变及ilvBN、ilvC的串联表达不仅影响菌株的生长,对L-缬氨酸及其他氨基酸的生物合成及代谢调控也有一定影响,尤其对同一合成途径的支链氨基酸——异亮氨酸和亮氨酸。而对于提高L-缬氨酸产量,ilvBNC的串联表达较ilvN点突变具有更显著作用。

表1 MD515/ pZ8-1-ilvBNrC发酵性能比较Tabal 1 Comparison of fermentation properties of MD515/ pZ8-1-ilvBNrC
2.6 工程菌株MD515/pZ8-1-ilvBNrC在30 L发酵罐上的生产性能
在 30 L发酵罐进行连续补料发酵验证菌株MD515/pZ8-1-ilvBNrC的生产性能。发酵过程代谢曲线见图8,其L-缬氨酸发酵产量达61.7 g·L-1,糖酸转化率达39.2%,发酵稳定,较对照菌株菌体密度更大,而且可以提前产酸时间,该工程菌已实现120 t罐正常工业化生产。
工程菌株MD515/pZ8-1-ilvBNrC的发酵液陶瓷膜过滤效率优于出发菌株,发酵液透光率高于MD515,其杂蛋白含量0.85 g·L-1,远低于MD515 的1.48 g·L-1,也表明MD515/pZ8-1-ilvBNrC菌株较MD515更高效地利用培养基营养,纯化效率更高。

图8 菌株B. flavum MD515/pZ8-1-ilvBNrC 分批补料发酵代谢曲线Fig.8 Metabolism curve of strain B. flavum MD515/ pZ8-1-ilvBNrC in fed batch fermentation
3 结 论
以黄色短杆菌为出发菌株,设计构建了工程菌株MD515/pZ8-1-ilvBNrC,结果其L-缬氨酸、L-异亮氨酸和L-亮氨酸等3个支链氨基酸的含量均比出发菌株MD515提高,而丙氨酸的含量下降,表明ilvN的定点突变及ilvBN、ilvC基因的串联表达对黄色短杆菌L-缬氨酸的代谢流有明显影响。该结果可能与竞争支路丙氨酸的合成量减少有关,表达抗反馈抑制的AHAS和AHAIR可能促进丙酮酸更多地转入L-缬氨酸合成支路而减少了丙氨酸合成。结果还表明ilvBNC的串联表达较ilvN的156位碱基定点突变对提高L-缬氨酸产量影响更大。研究还发现ilvN定点突变及ilvBN、ilvC的串联表达有利于提高菌株的菌体生物量,这对于菌株提前发酵产酸时间,缩短发酵周期,达到高密度发酵具有意义。而且工程菌株发酵液透光率较出发菌株要高,杂蛋白含量更低,这对发酵液后期的分离提取非常有利。
References
[1] PARK J H, LEE K H, KIM T Y, et al. Metabolic engineering of Escherichia coli for the production of L-valine based on transcriptome analysis and in silico gene knockout simulation[J]. Proc. Natl. Acad. Sci. USA, 2007, 104(19): 7797-7802.
[2] BLOMBACH B, SCHREINER M E, HOLATKO J, et al. L-valine production with pyruvate dehydrogenase complex-deficient Corynebacterium glutamicum[J]. Appl. Environ. Microbiol., 2007, 73(7): 2079-2084.
[3] LIANG C W, HUO Y L, QI G F, et al. Enhancement of L-valine production in Bacillus licheniformis by blocking three branched pathways[J]. Biotechnology Letters, 2015, 37(1): 1243-1248.
[4] LIU H M, ZHANG W G. Preliminary study on metabolic regulation and control of L-valine fermentation in a newly screened L-valine producing Brevibacterium flavum strain[J]. Afr. J. Biotechnol., 2010, 9(22): 3308-3317.
[5] WOO H M, PARK J B. Recent progress in development of synthetic biology platforms and metabolic engineering of Corynebacterium glutamicum[J]. Journal of Biotechnology, 2014, 180: 43-51.
[6] PARK J H, LEE S Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering[J]. Appl. Microbiol.Biotechnol., 2010, 85(3): 491-506.
[7] MAHR R, GÄTGENS C, GÄTGENS J, et al. Biosensor-driven adaptive laboratory evolution of L-valine production in Corynebacterium glutamicum[J]. Metabolic Engineering, 2015, 32: 184-194.
[8] 王小元. 谷氨酸棒杆菌生产缬氨酸的代谢工程研究进展[J]. 食品与生物技术学报, 2012, 31(3): 225-231.
WANG X Y. Metabolic engineering in Corynebacterium glutamicum to increase L-valine production[J]. Journal of Food Science and Biotechnology, 2012, 31(3): 225-231.
[9] EPELBAUM S, LAROSSA R A, VANDYK T K, et al. Branched-chain amino acid biosynthesis in Salmonella typhimurium: a quantitative analysis[J]. J. Bacteriol., 1998, 180(16): 4056-4067.
[10] SINGH B K, SHANER D L. Biosynthesis of branched chain amino acids: from test tube to field[J]. Plant Cell, 1995, 7(7): 935-944.
[11] PARK J H, JANG Y S, LEE J W, et al. Escherichia coli W as a new platform strain for the enhanced production of L-valine by systems metabolic engineering[J]. Biotechnol. Bioeng., 2011, 108(5): 1140-1147.
[12] BLOMBACH B, SCHREINER M E, BARTEK T, et al. Corynebacterium glutamicum tailored for high-yield L-valine production[J]. Applied Microbiology and Biotechnology, 2008, 79(3): 471-479.
[13] PARK J H, LEE S Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering[J]. Appl. Microbiol. Biotechnol., 2010, 85(3): 491-506.
[14] HOU X H, GE X Y, WU D, et al. Improvement of L-valine production at high temperature in Brevibacterium flavum by overexpressing ilvEBNrC genes[J]. J. Ind. Microbiol. Biotechnol., 2012, 39: 63-72.
[15] ELIŠÁKOVÁ V, PÁTEK M, HOLÁTKO J, et al. Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebacterium glutamicum[J]. Appl. Environ. Microb., 2005, 71(1): 207-213.
[16] HASEGAWA S, UEMATSU K, NATSUMA Y, et al. Improvement of the redox balance increases L-valine production by Corynebacterium glutamicum under oxygen deprivation conditions[J]. Appl. Environ. Microbiol., 2012, 78(3): 865-875.
[17] SAMBROOK J, RUSSELL D W. 分子克隆实验指南[M]. 北京: 科学出版社, 2002: 96-98.
SAMBROOK J, RUSSELL D W. Molecular Cloning Lab Manual[M]. Beijing: Science Press, 2002: 96-98.
[18] 莫少文, 姚城镇, 张云开, 等. 纸层析法测定缬氨酸含量的改良[J].食品工业科技, 2012, 33(6): 111-112.
MO S W, YAO C Z, ZHANG Y K, et al. Determination of L-valine by improved quantitative paper chromatography[J]. Science and Technology of Food Industry, 2012, 33(6): 111-112.
[19] CHEN Q, WANG Q, WEI G, et al. Production in Escherichia coli of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) with differing monomer compositions from unrelated carbon sources[J]. Appl. Environ. Microb., 2011, 77(14): 4886-4893.
[20] 李新涛, 徐庆阳, 冯宁, 等. 从发酵液中高效提取 L-缬氨酸的工艺研究[J]. 生物技术通讯, 2011, 22(2): 229-233.
LI X T, XU Q Y, FENG N, et al.Study on L-valine efficient extraction technology from the fermentation broth[J]. Letters in Biotechnology, 2011, 22(2): 229-233.
2015-12-21收到初稿,2016-04-17收到修改稿。
联系人:王明兹。第一作者:曾邦定(1990—),男,硕士研究生。
Received date: 2015-12-21.
中图分类号:Q 815
文献标志码:A
文章编号:0438—1157(2016)07—2956—07
DOI:10.11949/j.issn.0438-1157.20151935
Corresponding author:WANG Mingzi, mingziw@fjnu.edu.cn
Effects of Brevibacterium flavum with directed mutagenesis of ilvN and co-expression of ilvBNC cluster on L-valine production
ZENG Bangding1, HUANG Qingeng1, LIANG Ling2, GUO Xiaolei2, WANG Mingzi1, SHI Qiaoqin1, WU Songgang1
(1College of Life Sciences, Engineering Research Center of Industrial Microbiology of Ministry of Education, Fujian Normal University, Fuzhou 350117, Fujian, China;2Fuzhou Research Center of Fujian Maidan Biology Group Co., Ltd., Fuzhou 350008, Fujian, China)
Abstract:Acetohydroxy acid synthase (AHAS) and acetohydroxy acid isomeroreductase (AHAIR) encoded by ilvBN and ilvC are two key enzymes which play important roles in the biosynthetic pathway of L-valine. Brevibacterium flavum MD515 was used as the origin strain and site-specific mutagenesis was performed in its ilvN gene which coded for the regulatory subunit of AHAS, resulting in the obtainment of an anti-feedback inhibition gene, named ilvBN'C. Then, the ilvBNrC gene was ligased to plasmid pZ8-1 for construction of the recombinant plasmid pZ8-1-ilvBNrC, which was subsequently transfored into B. flavum MD515. With this method, the targeted transformant B. flavum MD515/pZ8-1-ilvBNrC showed better L-valine producing capacity of 29.5 g·L-1, 27.7% increase than that of original strain when it was cultured in 250 ml shake flasks. Meanwhile, the yield of leucine and isoleucine also increased while the alanine decreased. The biomass and growth rate were also increased. Moreover, fermentation experiments was performed in a 30 L fermentor and the results indicated thatthe L-valine productivity of B. flavum MD515/pZ8-1-ilvBNrC reached to 61.7 g·L-1while the conversion rate of glucose/valine was up to 39.2%. The work finally made some simple investigations about the purification of L-valine in B. flavum MD515/ pZ8-1-ilvBNrC and B. flavum MD515. The results showed that the light transmittance of strain B. flavum MD515/pZ8-1-ilvBNrC was higher while the protein content was lower than that of B. flavum MD515, which was beneficial for subsequent separation process.
Key words:L-valine; site-specific mutagenesis; acetohydroxy acid synthase; acetohydroxy acid isomeroreductase; co-expression
