利用90K基因芯片进行小麦旗叶相关性状的QTL定位
2016-07-29连俊方张德强武炳瑾宋晓朋马文洁周丽敏孙道杰
连俊方,张德强,武炳瑾,宋晓朋,马文洁,周丽敏,冯 毅,孙道杰
(西北农林科技大学农学院,陕西杨凌 712100)
利用90K基因芯片进行小麦旗叶相关性状的QTL定位
连俊方,张德强,武炳瑾,宋晓朋,马文洁,周丽敏,冯 毅,孙道杰
(西北农林科技大学农学院,陕西杨凌 712100)
摘要:为了发掘影响小麦旗叶相关性状的QTL,以小麦骨干亲本周8425B与优良品种小偃81构建的包含102个家系的重组自交系(Recombinant inbred line,RIL)为材料,采用小麦90K SNP基因芯片技术和SSR标记对其进行分子标记检测,构建含有全基因组SNP和SSR 标记的高密度遗传图谱,并在4个环境下对小麦旗叶相关性状QTL进行检测。结果表明,所构建图谱含有6 949对多态性标记,其中,SNP标记6 910对,SSR标记39对,覆盖染色体总长度4 839.9 cM,标记间平均距离0.7 cM;A、B和D染色体组分别有2 085、4 677和187对标记,分别占总标记数的30.0%、67.5%和2.7%,标记间平均距离分别为1.0、0.6和0.8 cM。采用完备复合区间作图法共检测到22个旗叶性状加性效应 QTL,10个旗叶长 QTL 分布于 2A、3B、4B、5A、6B和7B染色体上,解释表型变异 7.900%~24.098%,除 Qfll2A-1能在2个环境中检测到外,其余均为单环境QTL;4个旗叶宽 QTL分布于2A、3A和5B染色体上,解释表型变异9.080%~16.540%,其中, Qflw2A-1在3个环境中均能检测到,解释表型变异12.483%~16.540%,为1个稳定的主效QTL;8个旗叶面积 QTL 分布于2A、3B、4B、5A、6B和7A染色体上,解释表型变异9.310%~30.498%,其中,3个QTL位于5A染色体上。此外,鉴定出3个分布于2A、5A和6B染色体上的 QTL富集区段。
关键词:小麦;重组自交系;旗叶性状;SNP;QTL
小麦旗叶对小麦的产量具有重要的影响[1],在抽穗开花后对粒重的贡献率超过30%,而在发育后期,旗叶的净光合物质几乎全部运输到籽粒中去[2]。小麦旗叶的长、宽及叶面积等相关性状与其产量具有显著的正相关关系[3-7]。因此,对小麦旗叶相关性状的研究将会对小麦产量育种提供理论指导。
目前,国内外有关旗叶性状的QTL研究已有诸多报道。常 鑫等[8]和赵 朋等[9]分别利用小偃81/西农1376和春小麦宁春4号/宁春27构建的重组自交系(Recombinant inbred line,RIL)群体,在多环境中检测出位于不同染色体的多个控制旗叶长、宽和面积的QTL;闫 雪等[10]利用旱选10号和鲁麦14构建的包含150个家系的DH群体,分别在干旱胁迫与正常灌溉条件下检测到多个控制旗叶长、宽和面积的QTL;Jia等[11]在5A染色体上发现一个控制旗叶宽的QTL;Xue等[12]利用以绵阳99-323 和 PH691为遗传背景的近等基因系(NIL)衍生的次级F2群体将Jia等[11]发现的 Qflw.naw-5A精细定位并发现其与5A染色体上的 Fhb5紧密连锁。然而,这些研究都是利用传统的SSR等标记构建的低密度遗传图谱,标记间距离大,检测方法费时、繁琐,人工成本高,很难应用于育种实践。基因芯片技术已经广泛应用于医学领域[13-15]以及水稻[16-17]、大麦[18]等谷类作物的研究中。Zhang等[19]利用SNP基因芯片定位到控制水稻旗叶宽的主效QTL, Bertholdsson等[20]利用SNP基因芯片在大麦中发现5个影响光量子产量的QTL。近年来,基于Illumina 技术平台开发了小麦9K和90K SNP基因芯片[21]。Wu等[22]利用9K SNP芯片和SSR标记在燕大1817与北农6号组成的RIL群体中定位出与旗叶性状有关的QTL。然而目前利用90K芯片对旗叶相关性状的QTL检测还鲜见报道。
本研究以利用周8425B和小偃81构建的包含102个家系的RIL群体为研究材料,采用小麦90K SNP基因芯片技术和SSR标记对其进行分子标记检测,构建含有全基因组SNP和SSR 标记的高密度遗传图谱,并在4个环境下对小麦旗叶相关性状QTL进行检测,以期为小麦旗叶长、宽和面积等数量性状的基因定位、分子标记开发、功能基因的精细定位以及株型育种提供理论依据。
1材料与方法
1.1试验材料
供试材料为周8425B(母本,是由周口市农科院育成的高产、抗病新种质)与小偃81(父本,为李振声院士育成的高产、优质、抗病、半冬性、多穗型中熟品种)杂交后经单粒传法得到的含 102个家系的 F8~F9代RIL群体,由西北农林科技大学农学院王 辉教授课题组创制并保存。
1.2田间种植和性状调查
2013-2014年度和2014-2015年度将RIL群体及其亲本种植于陕西杨凌和河南安阳两地。两年均采用完全随机区组设计,每个株系种植2行,2次重复,行长2 m,行距0.25 m,株距3 cm。田间管理按照当地大田生产管理标准进行。于小麦开花后20 d(灌浆期)测定其旗叶长、宽,每个株系随机抽取6株进行测量,数据读取至小数点后两位,然后取其均值作为该品系旗叶长、宽值,旗叶面积采用宋荷仙等[23]的方法,旗叶面积=叶长×叶宽×0.83。
1.3DNA 的提取和分子标记检测
采用CTAB法[24]提取102个RIL家系及其亲本DNA,将其保存在TE中,用分光光度计定量,并将样品用TE调到标准浓度50 ng·μL-1,然后用0.8%的琼脂糖凝胶进行电泳。样品电泳主带清晰,大小在10 kb以上,没有明显降解,总量 1 μg 以上,A260/A280=1.7~2.1,为合格样品。
SNP标记由北京博奥晶典生物技术有限公司利用 Illumina SNP Genotyping技术测试平台,使用微珠芯片技术(BeadArray)进行检测,其多态性使用 Genomestudio v1.0 软件进行分析。
SSR引物由上海生工生物工程有限公司合成,引物序列信息从GrainGene 2.0(http://wheat.pw.usda.gov/GG2/index.shtml)获得,利用两亲本进行多态性标记筛选,用多态性引物在RIL群体中进行检测。
1.4遗传连锁图的构建和QTL定位
利用软件QTL IciMapping 4.0和QTL Mapchart 2.1构建分子标记的连锁图。利用IBM SPSS statistics 对表型数据进行偏峰度及相关性分析。在此基础上,结合表型数据,使用QTL IciMapping 4.0软件,采用完备区间作图法(ICIM-ADD)[25]进行QTL检测,其中,LOD阈值为2.5,扫描步长为1 cM,逐步回归进入的概率(PIN)为0.001,缺失表型不用于QTL作图(表型缺失的基因型数据仍会使用)。QTL 的命名参考 McIntosh等[26]的方法,按照性状及染色体位置进行命名,旗叶长命名为Qfll,旗叶宽命名为Qflw,旗叶面积命名为Qfla,如 Qfll3A-1表示位于3A染色体上控制旗叶长且位于第一个标记区间的QTL。
2结果与分析
2.1遗传图谱构建
在亲本周8425B和小偃81中进行标记检测,共筛选出8 650对多态性标记,其中包含187对SSR标记和8 463对SNP标记。经过连锁分析,共有6 949对标记构建到图谱中,其中包含6 910对SNP标记和39对SSR标记,覆盖染色体总长度4 839.9 cM,标记间平均距离0.7 cM。构建的遗传图谱中,A 染色体组有2 085对标记,占总标记数的30.0%,全长2 074.1 cM,标记间平均距离为1.0 cM;B染色体组多态性标记最多,共4 677对,占标记总数的67.3%,全长2 624.6 cM,标记间平均距离仅为0.6 cM;D染色体组标记数目最少,共187对,占标记总数的2.7%,染色体覆盖长度最短,全长仅有141.2 cM,标记间平均距离0.8 cM。
2.2表型性状变异分析
将2013-2014年度种植在陕西杨凌(E1)、河南安阳(E2)和2014-2015年度种植在陕西杨凌(E3)、河南安阳(E4)的各亲本及RIL家系的表型性状进行统计分析,结果(表1)表明,亲本周8425B的旗叶长、宽和面积在多环境中表现均大于亲本小偃81,且差异具有统计学意义。RIL群体各环境下表现出明显的超亲遗传,各家系3个性状表型变异丰富,且呈现连续变异,偏、峰度绝对值基本都小于1,符合正态分布,表现为多基因控制的数量性状遗传的特点,适合做QTL分析。虽然2014-2015年度种植于安阳的旗叶面积的峰度稍大于1,但根据李慧慧等[27]数量性状作图的要求,表型性状的非正态性分布并不影响QTL作图。
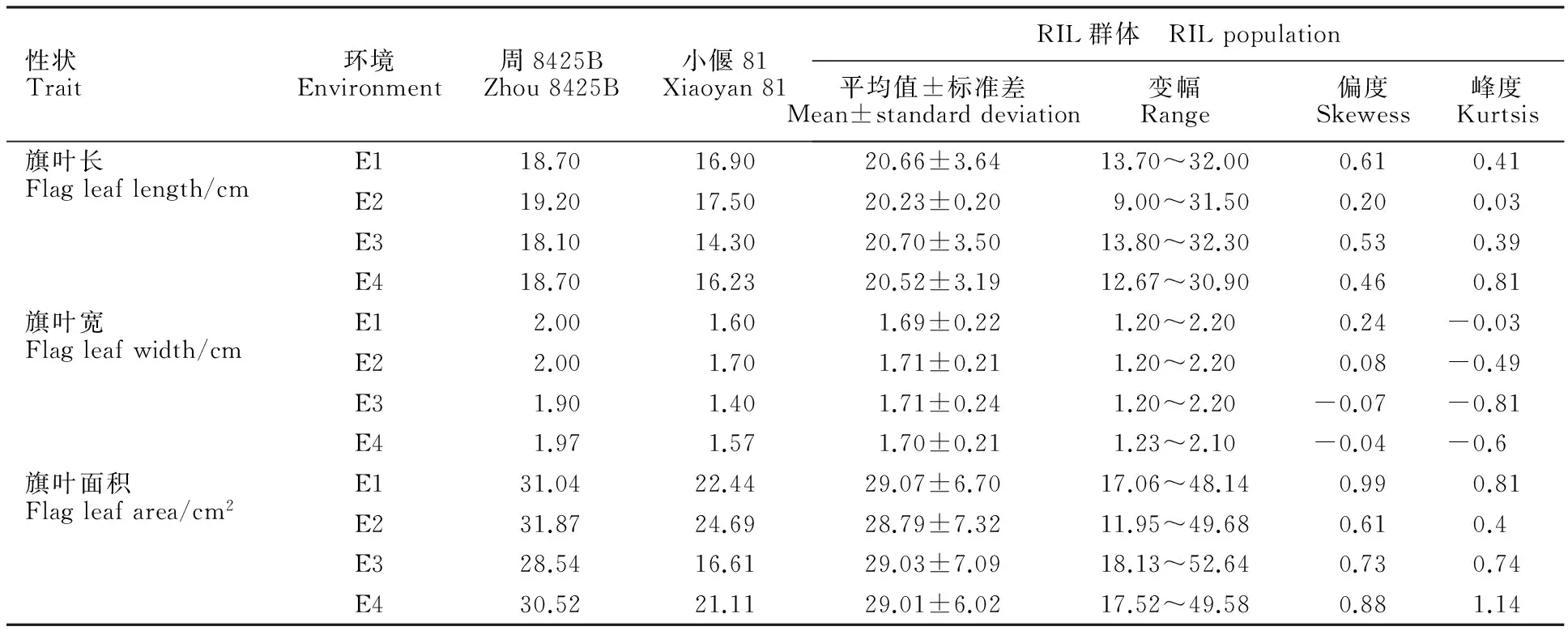
表1 不同环境下RIL群体及其亲本的旗叶长、宽和面积
2.3旗叶长、宽和面积的QTL分析
在4个环境中共检测到22个旗叶长、宽和面积相关的QTL,分别位于2A、3A、3B、4B、5A、5B、6B、7A和7B染色体上,其中3个QTL在多个环境中均检测到。A、B、D基因组分别含有10、12和0个QTL;第1至7同源群上分别检测到0、3、4、2、6、5和2个QTL(表3,图1)。
2.3.1旗叶长QTL
4个环境中共检测到10个控制旗叶长的QTL,分别位于2A、3B、4B、5A、6B和7B染色体上,解释表型变异7.900%~24.080%。除 Qfll2A-1外,其他QTL只能在1个环境中检测到,说明旗叶长的遗传基础复杂且受环境的影响很大。 Qfll2A-1在E3和E4两个环境中检测到,位于标记Tdurum_contig64391_231和RAC875_c58503_182之间,标记间距离仅为0.5 cM。
2.3.2旗叶宽QTL
4个环境中共检测到4个控制旗叶宽的QTL,分别位于2A、3A和5B染色体上,解释表型变异9.080%~16.540%。其中, Qflw2A-2在E2、E3、E4多个环境中均检测到,位于标记RAC875_c58006_352和BS00094574_51之间,标记间距离为1.0 cM。
2.3.3旗叶面积QTL
4个环境中共检测到8个控制旗叶面积的QTL,分别位于2A、3B、4B、5A、6B和7A染色体上,解释表型变异9.310%~30.498%。其中, Qfla4B-1在E3、E4中均检测到,位于标记RAC875_c18200_929和Excalibur_c47209_87之间,标记间距离为0.5 cM。此外,在E2和E4中检测到 Qfla5A-1、 Qfla5A-2和 Qfla5A-3均位于5A染色体200.0 cM附近。
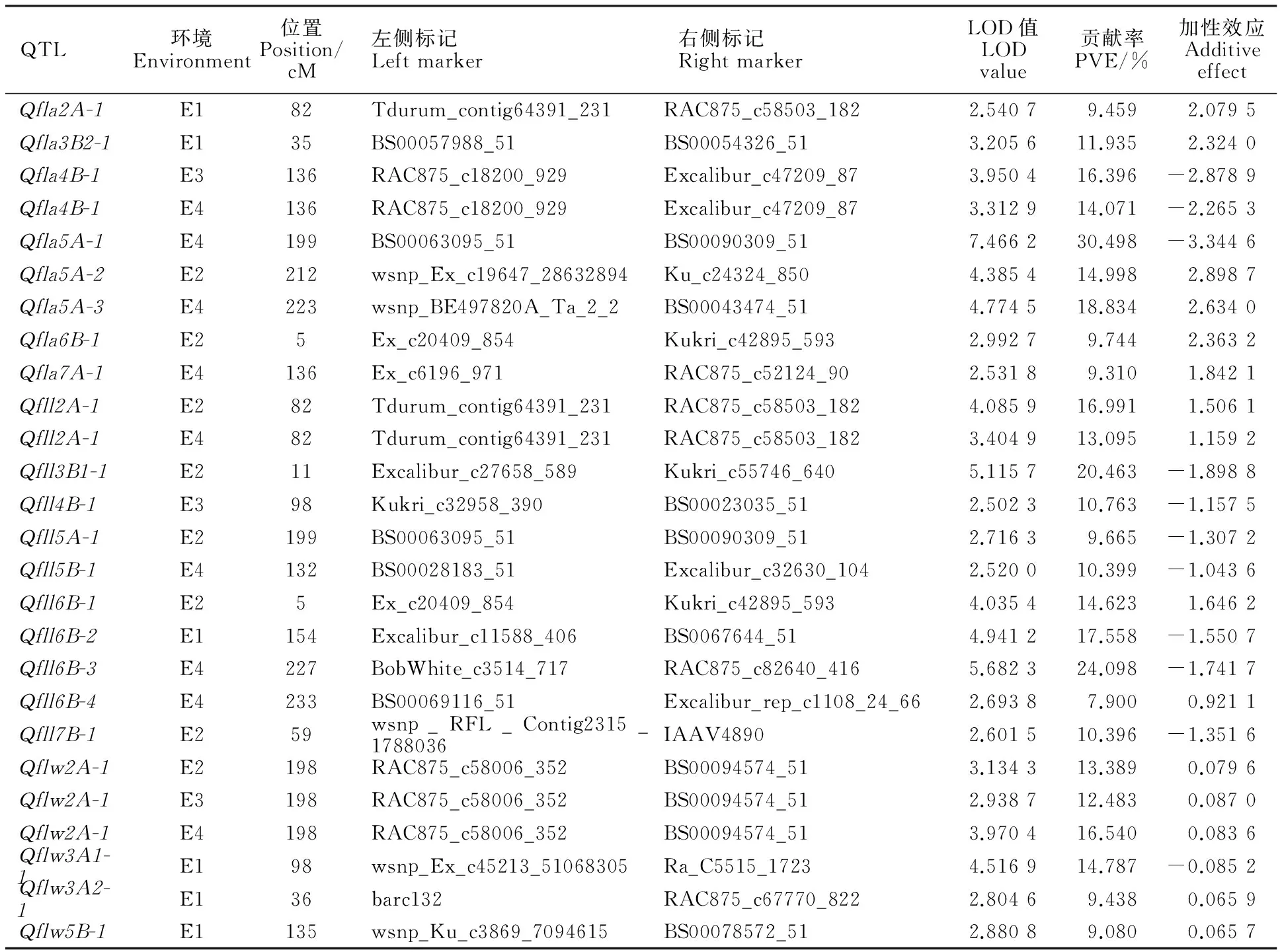
表2 不同环境中旗叶长、宽和面积的QTL定位结果



3讨 论
3.1QTL定位结果一致性
数量性状受多基因控制,且受环境影响较大,即使相同群体不同年份检测出的QTL也存在较大差异。目前已有利用SSR标记和9K芯片对旗叶性状的QTL定位的研究,但由于遗传图谱密度小,定位出的QTL标记间距离大,存在的假阳性QTL多,很难应用于育种实践。然而,利用90K基因芯片对小麦旗叶性状进行QTL的发掘却很少有学者进行研究。本研究利用90K SNP芯片构建遗传图谱,所用标记和前人研究所用标记不同,很难用于比较是否为同一QTL,但仍具有一定的参考价值。
Qfla3B2-1是位于小麦3B染色体上控制旗叶面积的QTL,Wu等[22]和常 鑫等[8]也在该染色体上检测出控制旗叶长的QTL,但位置相距较远,应该不是同一QTL。在4B染色体上检测到控制旗叶长的 Qfll4B-1,Fan等[28]在4B染色体上发现3个旗叶长QTL,但由于所用标记不同,不能确定是否存在相同QTL。位于5B染色体上的 Qfll5B-1与Fan等[28]在5B染色体上发现旗叶长相关QTL的表型贡献率都较低,不是主效QTL。在3个环境中均检测到位于6B染色体上的旗叶长QTL,其中3个QTL都在200.0 cM附近的位置,该区段应该为1个控制旗叶长的染色体簇,赵 朋等[9]也在该染色体上发现旗叶长QTL。在2A染色体的RAC875_c58006_352和BS00094574_51标记之间检测到1个旗叶宽QTL,在3个环境中均稳定表达,解释表型变异13.389%~16.540%,是1个主效QTL。 Qflw5B-1为在5B上控制旗叶宽的QTL,Fan等[28]和Jia等[11]也在同一染色体上发现旗叶宽QTL。 Qfla4B-1为在4B染色体上136.0 cM位置控制旗叶面积的QTL,在2个环境中均稳定表达,表型贡献率为14.071%~16.396%,说明这是1个稳定的主效QTL,Fan等[28]也在4B染色体上检测出旗叶面积QTL,但临近的标记不同,不能确定是否为同一位点。在5A染色体200.0 cM附近存在3个控制旗叶面积的QTL,Wu等[22]在5A上200.0 cM处也检测出1个旗叶面积QTL,且在多环境中均能检测到,预测该位点存在稳定表达的QTL,但是否为同一位点还很难判断。本研究发现的旗叶面积 Qfla6B-1与Fan等[28]在6B染色体上发现旗叶面积QTL均为微效QTL。位于7A染色体上的 Qfla7A-1与常 鑫等[8]发现旗叶面积QTL在7A上的位置相近,预测该位置附近存在影响旗叶面积的基因。 Qfll2A-1为在2A染色体上Tdurum_contig64391_231与RAC875_c58503_182标记之间存在的1个控制旗叶长的QTL,该位点在E2和E4两个环境中均能检测出来,是一个新发现的位点,标记间距离仅为0.5 cM,但目前只在一个群体检测出来,需要在多个群体中进一步验证,以期能够早日应用于育种实践。
3.2QTL聚集区及一因多效QTL
本研究在2A、5A和6B染色体上检测出3个QTL聚集区及一因多效QTL。高度相关的性状之间表现出区域化分布现象或存在一些共同的QTL[29]。位于2A染色体标记Tdurum_contig64391_231与RAC875_c58503_182之间的QTL为同时控制旗叶长和旗叶面积的一因多效QTL,且该QTL在多个环境中均能检测到,为1个稳定的QTL;在5A染色体上3个相近的区间BS00063095_51-BS00090309_51、wsnp_Ex_c19647_28632894-Ku_c24324_850和wsnp_BE497820A_Ta_2_2-BS00043474_51包含1个旗叶长和3个旗叶面积的QTL,其中,BS00063095_51-BS00090309_51之间的QTL为同时控制旗叶长和旗叶面积的一因多效QTL;在6B染色体上Ex_c20409_854-Kukri_c42895_593区间的QTL同时影响旗叶长和旗叶面积,为一因多效QTL。在5A染色体上检测到3个旗叶面积QTL,且3个QTL距离在24.0 cM内,推测这一区段为控制旗叶面积的基因簇。此外,6B染色体上检测出4个旗叶长相关QTL。
本研究发现控制旗叶相关性状的QTL存在QTL聚集区和一因多效现象,这说明旗叶不同性状之间具有一定的相关性。控制相关性状的基因更倾向于形成基因聚合区域,而非零散分布,这也许是物种进化带来的结果,同时也对聚合育种提供了很大的便利。
参考文献:
[1]Saha C S,郑康乐.小麦旗叶节以上不同结构的光合面积与籽粒产量的关系 [J].麦类作物学报,1982(5):28-31.
Saha C S,Zheng K L.The relationship between photosynthetic area and grain yield of wheat with different structure of flag leaf [J].JournalofTriticeaeCrops,1982(5): 28-31.
[2]Simón M R.Inheritance of flag-leaf angle,flag-leaf area and flag-leaf area duration in four wheat crosses [J].TheoreticalandAppliedGenetics,1999,98(2):310-314.
[3]Stahli D,Perrissin-Fabert D,Blouet A,etal.Contribution of the wheat(TriticumaestivumL.) flag leaf to grain yield in response to plant growth regulators [J].PlantGrowthRegulation,1995,16(3):293-297.
[4]Mcneal F H,Berg M A.Flag leaf area in five spring wheat crosses and the relationship to grain yield [J].Euphytica,1977,26(3):739-744.
[5]成东梅,彭 涛,高 燕,等.高产小麦旗叶与穗粒重关系的研究 [J].安徽农业科学,2007,35(36): 11798-11799.
Cheng D M,Peng T,Gao Y,etal.Study on the relationship between the flag leaves and ear grain weight of high-yield wheat [J].JournalofAnhuiAgriculturalSciences,2007,35(36):11798-11799.
[6]傅兆麟,马宝珍,王光杰,等.小麦旗叶与穗粒重关系的研究 [J].麦类作物学报,2001,21(1):92-94.
Fu Z L,Ma B Z,Wang G J,etal.Relationship between the flag leaf and the grain weight per spike in wheat [J].JournalofTriticeaeCrops,2001,21(1):92-94.
[7]郭翠花,高志强,苗果园.花后遮阴对小麦旗叶光合特性及籽粒产量和品质的影响 [J].作物学报,2010,36(4): 673-679.
Guo C H,Gao Z Q,Miao G Y.Effect of shading at post flowering on photosynthetic characteristics of flag leaf and response of grain yield and quality to shading in wheat [J].ActaAgronmicaSinica,2010,36(4):673-679.
[8]常 鑫,李法计,张兆萍,等.小麦旗叶长、宽及面积的QTL分析 [J].西北植物学报,2014,34(5):896-901.
Chang X,Li F J,Zhang Z P,etal.Mapping QTLs for flag leaf length,width and area in wheat [J].ActaBotanicaBoreali-OccidentaliaSinica,2014,34(5):896-901.
[9]赵 朋,徐 凤,蒋文慧,等.春小麦旗叶长度、宽度及叶绿素含量QTL分析 [J].麦类作物学报,2015,35(5):603-608.
Zhao P,Xu F,Jiang W H,etal.Quantitative trait loci analysis of flag leaf length width and chlorophyll content of spring wheat [J].JournalofTriticeaeCrops,2015,35(5):603-608.
[10]闫 雪,史雨刚,梁增浩,等.小麦旗叶形态相关性状的QTL定位 [J].核农学报,2015,29(7):1253-1259.
Yan X,Shi Y G,Liang Z H,etal.QTL mapping for morphological traits of flag leaf in wheat [J].JournalofNuclearAgriculturalSciences,2015,29(7):1253-1259.
[11]Jia H,Wan H,Yang S,etal.Genetic dissection of yield-related traits in a recombinant inbred line population created using a key breeding parent in China’s wheat breeding [J].TheoreticalandAppliedGenetics,2013,126(8):2123-2139.
[12]Xue S,Xu F,Li G,etal.Fine mapping TaFLW1,a major QTL controlling flag leaf width in bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2013,126(8):1941-1949.
[13]Arnold M,Hartsperger M L,Baurecht H,etal.Network-based SNP meta-analysis identifies joint and disjoint genetic features across common human diseases [J].BioMedCentralGenomics,2012,13:490.
[14]Wang Y,Sung P,Lin P,etal.A multi-SNP association test for complex diseases incorporating an optimal P-value threshold algorithm in nuclear families [J].BioMedCentralGenomics,2015,16(1):381-481.
[15]Chen X,Gong X,Yan N,etal.RNASET2 tag SNP but not CCR6 polymorphisms is associated with autoimmune thyroid diseases in the Chinese Han population [J].BioMedCentralMedicalGenetics,2015,16(1):11.
[16]Shen B,Yu W,Zhu Y,etal.Fine mapping of a major quantitative trait locus, qFLL6.2,controlling flag leaf length and yield traits in rice(OryzasativaL.) [J].Euphytica,2012,184(1):57-64.
[17]Duan D,Zhang H.A single SNP in NRT1.1B has a major impact on nitrogen use efficiency in rice [J].ScienceChinaLifeSciences,2015,58(8):827-828.
[18]Xue D W,Chen M C,Zhou M X,etal.QTL analysis of flag leaf in barley(HordeumvulgareL.) for morphological traits and chlorophyll content [J].JournalofZhejiangUniversity,2008,9(12):938-943.
[19]Zhang B,Ye W,Ren D,etal.Genetic analysis of flag leaf size and candidate genes determination of a major QTL for flag leaf width in rice [J].Rice,2015,8(1):2-12.
[20]Bertholdsson N,Holefors A,Macaulay M,etal.QTL for chlorophyll fluorescence of barley plants grown at low oxygen concentration in hydroponics to simulate waterlogging [J].Euphytica,2015,201(3):357-365.
[21]Wang S,Wong D,Forrest K,etal.Characterization of polyploid wheat genomic diversity using a high-density 90,000 single nucleotide polymorphism array [J].PlantBiotechnologyJournal,2014,12(6):787-796.
[22]Wu Q,Chen Y,Fu L,etal.QTL mapping of flag leaf traits in common wheat using an integrated high-density SSR and SNP genetic linkage map [J].Euphytica,2016,208(2):337-351.
[23]宋荷仙,李跃建,冯君成,等.小麦收获指数和源、库性状的遗传研究 [J].中国农业科学,1993,26(3):21-26.
Song H X,Li Y J,Feng J C,etal.A study on gengtics of harvest index and source-sinnk of wheat [J].ScientiaAgriculturaSinica,1993,26(3):21-26.
[24]Porebski S,Bailey L G,Baum B R.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components [J].PlantMolecularBiologyReporter,1997,15(1):8-15.
[25]王建康.数量性状基因的完备区间作图方法 [J].作物学报,2009,35(2):239-245.
Wang J K.Inclusive composite interval mapping of quantitative trait genes [J].ActaAgronmicaSinica,2009,35(2):239-245.
[26]Mccouch S R,Cho Y G,Yano M,etal.Report on QTL nomenclature [J].RiceGeneticsNewsletters,1997,11(14):11-13.
[27]李慧慧,张鲁燕,王建康.数量性状基因定位研究中若干常见问题的分析与解答 [J].作物学报,2010,36(6):918-931.
Li H H,Zhang L Y,Wang J K.Analysis and answers to frequently asked questions in quantitative trait locus mapping [J].ActaAgronmicaSinica,2010,36(6):918-931.
[28]Fan X,Cui F,Zhao C,etal.QTLs for flag leaf size and their influence on yield-related traits in wheat(TriticumaestivumL.) [J].MolecularBreeding,2015,35(1):24.
[29]陈建省,陈广凤,李青芳,等.利用基因芯片技术进行小麦遗传图谱构建及粒重QTL分析 [J].中国农业科学,2014,47(24):4769-4779.
Chen J S,Chen G F,Li Q F,etal.Construction of genetic map using genotyping chips and QTL analysis of grain weight [J].ScientiaAgriculturaSinica,2014,47(24):4769-4779.
收稿日期:2016-01-17修回日期:2016-03-07
基金项目:国家重点基础研究计划项目(2014CB138100);陕西省自然科学基金项目(2015JM3094);陕西省重点科技创新团队项目(2014KCT-25)
通讯作者:冯 毅(E-mail:fengyi1455@126.com);孙道杰(E-mail:chinawheat@163.com)
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)06-0689-10
QTL Mapping of Flag Leaf Traits Using an Integrated High-density 90K Genotyping Chip
LIAN Junfang,ZHANG Deqiang,WU Bingjin,SONG Xiaopeng,MA Wenjie,ZHOU Limin,Feng Yi,SUN Daojie
(College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China)
Abstract:In order to carry out the quantitative trait loci(QTLs) of wheat flag leaf traits,in this study,QTLs for flag leaf traits were mapped using an available high-density 90K wheat SNP and SSR genetic linkage map developed from a recombinant inbred line(RIL) population of Zhou 8425B × Xiaoyan 81.A genetic map covering 21 wheat chromosomes was constructed,which contains 6 949 polymorphism markers(6 910 SNP and 36 SSR),with a total genetic distance of 4 839.9 cM and an average interval distance of 0.7 cM.A,B and D chromosomes posseed 2 085,4 677 and 187 polymorphism markers,accounting for the proportion of 30.0%,67.3% and 2.7%,respectively.And the average interval distance of the markers were 1.0,0.6 and 0.8 cM,respectively.Using phenotypic data at two locations(Yangling and Anyang) in two years(2013-2014 and 2014-2013 growing seasons),22 QTLs for flag leaf length(FLL),flag leaf width(FLW) and flag leaf area(FLA) were detected by inclusive composite interval mapping(ICIM)(LOD ≥ 2.5). Among those QTLs,ten QTLs for FLL were mapped on chromosome 2A,3B,4B,5A,6B and 7B with phenotypic variations ranging from 7.900% to 24.098%.A stable and major QTL associated with FLL, Qfll2A-1,was detected in two environments,while the other nine QTLs can be detected in only one environment.Four QTLs for FLW were found on chromosome 2A,3A and 5B with phenotypic variations from 9.080% to 16.540%. A stable and major QTL associated with FLW, Qflw2A-1,was detected in three environments with phenotypic variations ranging from 12.483% to 16.540%.Eight QTLs for FLA were mapped on chromosome 2A,3B,4B,5A,6B and 7A with phenotypic variations ranging from 9.310% to 30.498% and three of them were anchored on 5A chromosome.Three QTL enrichment sections of 2A,5A and 6B chromosomes were identified.
Key words:Wheat; RILs; Flag leaf traits; SNP; QTL
网络出版时间:2016-05-30
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160530.1535.004.html
第一作者E-mail:18829785748@163.com
