中国实验动物中鼠管状线虫的分子鉴定和感染调查
2016-07-27高正琴李晓波冯育芳王淑菁李冠民贺争鸣岳秉飞
高正琴,李晓波,冯育芳,王 吉,付 瑞,邢 进,王淑菁,魏 杰,王 洪,巩 薇,李冠民,贺争鸣,岳秉飞
(中国食品药品检定研究院,北京 100050)
技术方法
中国实验动物中鼠管状线虫的分子鉴定和感染调查
高正琴,李晓波,冯育芳,王 吉,付 瑞,邢 进,王淑菁,魏 杰,王 洪,巩 薇,李冠民,贺争鸣,岳秉飞
(中国食品药品检定研究院,北京 100050)
【摘要】目的 对鼠管状线虫进行分子鉴定和感染调查,为国家标准的修订提供参考依据。方法 923批5199只SPF动物(包括:1批5只猴,3批25只小型猪,28批55只兔,13批248只地鼠,37批198只豚鼠,93批459只大鼠,742批4179只小鼠,5批25只鸡和1批5只鸭)和145批1389只清洁动物(包括:1批3只兔,4批31只地鼠,16批157只豚鼠,32批268只大鼠和92批930只小鼠)来自全国50个不同的厂家。应用直接镜检实时动态显微视屏摄录技术结合形态学鉴定方法,进行鼠管状线虫感染筛查。应用多重PCR和测序技术,鉴定分离的鼠管状线虫ITS(内转录间隔区)、28S rRNA(28S核糖体RNA)、nad1(NADH脱氢酶亚单位1)和cox1(细胞色素C过氧化物酶亚基1)基因,从分子水平上确证鼠管状线虫感染。结果 应用直接镜检实时动态显微视屏摄录技术,从动物中检出鼠管状线虫的虫卵、幼虫和成虫。根据鼠管状线虫的卵细胞、幼虫、雌雄成虫的大小和形态来鉴定虫种。应用多重PCR测序技术,能从分离的单个鼠管状线虫的虫卵、幼虫和成虫中鉴定出ITS、28S rRNA、nad1和cox1基因,与其他不同种属的寄生虫无交叉反应。应用直接镜检实时动态显微视屏摄录技术,从5199份SPF和1389份清洁动物样本中分别检出鼠管状线虫阳性样本285份和135份。应用多重PCR和测序技术,鉴定证明这些阳性样本中确实含有鼠管状线虫特异性的DNA。测序结果显示,不同动物分离的鼠管状线虫的ITS、28S rRNA、nad1和cox1部分基因序列核苷酸相似性达100%。SPF和清洁动物的鼠管状线虫感染率分别为5.5%(285/5199)和9.7%(135/ 1389)。结论 应用直接镜检实时动态显微视屏摄录技术联合多重PCR测序技术能够快速精准检测鉴定出鼠管状线虫。鼠管状线虫的人兽共患本质可以视作为公共卫生的一个预警。良好的动物质量控制对保护人类身体健康和保障人民用药安全具有重要作用。本研究对中国SPF和清洁动物的鼠管状线虫进行了分子鉴定和感染调查。
【关键词】实验动物;鼠管状线虫;分子鉴定;感染调查
鼠管状线虫隶属于线虫纲(Nematoda)、尖尾目(Oxyurida)、管 状 科 (Syphaciidae)、管 状 属(SyPhacia),也称蛲虫(Pinworm),寄居于肠道,轻度感染时无明显临床症状,重度感染时引起神经精神症状、生长发育障碍、腹痛腹泻、肠炎等[1,2]。鼠管状线虫感染一方面损坏宿主的神经系统、血液循环系统、呼吸系统、消化系统、泌尿生殖系统、皮肤黏膜功能,另一方面影响宿主的肠道生理学、血液学指标,干扰免疫学、营养学、传染病学、自生免疫性疾病等的研究,感染还可传播扩散,增加宿主感染其他病原体的机会[3-6]。国家标准规定了清洁及以上动物中不得检出全部蠕虫[7,8],但未见鼠管状线虫(SyPhacia muris)检测方法,至今尚无精准快速检测鉴定方法,更缺乏全面监测感染数据。本研究应用直接镜检实时动态显微视屏摄录技术检测和形态学鉴定方法联合多重 PCR(multiple polymerase chain reaction,multiple-PCR)和测序技术,对我国无特定病原体(specific pathogen-free,SPF)和清洁动物的鼠管状线虫进行快速检测和分子鉴定并开展感染调查,对丰富完善国家标准、防控实验动物疫病暴发、维护社会公共安全具有重要意义。
1 材料和方法
1.1 仪器设备
生物安全柜(Thermo Fisher Scientific,美国);LEICA DM2500生物显微镜(Leica Microsystems,德国);倒置显微镜及成像系统(Nikon,日本);二氧化碳培养箱(北京五洲东方科技发展有限公司);基因扩增仪(Applied Biosystyem,美国);凝胶成像分析系统(东乐自然基因生命科学公司)。
1.2 样品来源
923批5199只SPF动物(包括:1批5只猴,3 批25只小型猪,28批55只兔,13批248只地鼠,37 批198只豚鼠,93批459只大鼠,742批4179只小鼠,5批25只鸡和1批5只鸭)和145批1389只清洁动物(包括:1批3只兔,4批31只地鼠,16批157只豚鼠,32批268只大鼠和92批930只小鼠)来自全国50个不同的厂家。对于猴、小型猪、兔等活体采集其直肠内容物或新鲜粪便样本,对于地鼠、豚鼠、大鼠、小鼠等则安乐死后采集其回盲部内容物样本。
1.3 直接镜检实时动态显微视屏摄录技术检测和形态学鉴定鼠管状线虫
在负压生物安全柜内,分别将采集的直肠内容物、回盲部内容物和新鲜粪便样本,置洁净离心管中,加生理盐水充分混匀,弃上清液,沉淀置于新的洁净离心管中,洗涤数次后重新悬浮,迅速连续滴片,应用直接镜检实时动态显微视频摄录技术和形态学鉴定方法进行蠕虫检定。根据蠕虫的虫卵、幼虫、成虫的形态和大小等进行虫种鉴定。
1.4 鼠管状线虫离体生存能力试验
在负压生物安全柜内,无菌移取新分离的鼠管状线虫,置培养瓶中,加入新鲜配制的含10%胎牛血清和1%青/链霉素的DMEM培养液,置37℃5% CO2实验条件下培养,倒置显微镜观察,实时拍摄记录结果。
1.5 多重PCR和测序技术鉴定鼠管状线虫
为了后续鼠管状线虫DNA条形码分子鉴定体系的建立,本研究选定的靶标基因是鼠管状线虫内转录间隔区(internal transcribed spacer,ITS)、28S核糖体RNA(28 S ribosomal RNA,28 S rRNA)、NADH脱氢酶亚单位1(NADH dehydrogenase subunits 1,nad1)和细胞色素C过氧化物酶亚基1(cytochrome c oxidase subunit 1,cox1)基因,设计合成四对引物(表1)。建立优化多重PCR检测体系和反应条件,进行特异性、灵敏性、稳定性试验和方法评价验证,应用于SPF和清洁动物鼠管状线虫检测。将直接镜检实时动态显微视屏摄录技术检出,经形态学鉴定为鼠管状线虫的单个虫卵、幼虫、雌性成虫和雄性成虫,提取DNA。分别以抽提的虫卵、幼虫和成虫DNA为模板,同时用已知鼠管状线虫、四翼无翅线虫(AsPiculuris tetraPtera)、隐匿管状线虫(SyPhacia obvelata)基因组DNA作阳性和阴性对照。鼠管状线虫PCR检测总反应体系为50 μL,包括5.0 μL 10 ×buffer(Mg2+Plus)、4.0 μL dNTP mixture、各0.5 μL正反向引物、0.25 μL EX Taq、2.0 μL模板DNA、37.75 μL nuclease-free water。循环参数:95℃1 min 1 cycle;95℃ 30 s,60℃ 30 s,72℃ 1 min,40 cycles;72℃ 10 min 1 cycle。琼脂糖凝胶电泳检测多重PCR扩增产物。提取SPF和清洁动物样本DNA,作为模板DNA同上进行多重PCR检测。阳性样本进一步作多基因测序鉴定。

表1 鼠管状线虫多重PCR引物Tab.1 Multiplex-PCR primers of SyPhacia muris
2 结果
2.1 直接镜检实时动态显微视屏摄录技术检测和形态学鉴定鼠管状线虫结果
镜下可见:许多细小、乳白色虫体游走蠕动,雌虫较活泼且个体比雄虫大,同时可见处于不同发育阶段的幼虫和虫卵。雌虫长2.8~4.0 mm,口孔在虫体头部顶端,有3片唇瓣环绕,头端的角皮向周围膨起形成头翼,食管下部膨大成球状(图1A),阴门开口于虫体前1/4处的腹侧,阴门上方为一较长的阴道,阴道与前后排列的2根子宫相接,交配后有雄虫射精管腺体分泌的棕黄色物质栓塞雌虫阴门,子宫与输卵管、卵巢相接,内部充满卵(图1B),虫体中部膨大,尾端直而尖细,肛门开口于虫体后1/6处(图1C)。雄虫长1.2~1.3 mm,射精管与直肠末端共同构成泄殖腔,经肛门通向外界,尾端明显向腹侧弯曲,尾端有引带、交合刺,尾端角皮上有乳突(图1D)。虫卵大小为(72~82)μm×(25~36)μm,无色透明,壳薄,两侧稍不对称,一侧扁平,一侧隆起,呈肾形,内含物为发育中的幼虫,在卵一端的凹面有一粗糙小区,是幼虫孵化出口或称卵盖(图1E)。依据雌雄成虫、幼虫的形态、大小、构造和虫卵的大小、形状、颜色、卵壳、内含物特征,鉴定为鼠管状线虫。应用实时动态显微视屏摄录直接镜检技术检测和形态学鉴定鼠管状线虫,结果从5199份SPF动物样本中分离鉴定获得285份鼠管状线虫活体阳性样本,阳性率5.5%(285/5199);从1389份清洁动物样本中分离鉴定获得135份鼠管状线虫活体阳性样本,阳性率9.7%(135/1389)。自SPF和清洁动物中分离获得,经形态学鉴定为鼠管状线虫的活体阳性样本中,精心挑选出形态完整、特征典型的新鲜的鼠管状线虫单个虫卵、幼虫、雌性成虫和雄性成虫,特殊方法固定,保存备用。在研究中,笔者发现了一些动物个体同时自然感染鼠管状线虫与其他种属寄生虫(如:隐匿管状线虫、四翼无刺线虫、鞭毛虫、纤毛虫、体外寄生虫)的现象(另文报道)。形态学鉴定经验不足者极易将鼠管状线虫误判为隐匿管状线虫,笔者鉴别二虫要点有五:第一,虫卵:两者均呈肾形,但前者较小且两端钝圆,后者较大且两端尖锐;第二,成虫:前者雌雄成虫个体均小于后者,前者雌虫阴门在虫体前1/4处,交配后阴门有栓塞,而后者在虫体前1/6处,阴门前后缘均有唇状隆起;第三,虫体头端:前者角皮向周围膨起形成头翼,后者颈翼膜窄小而平缓;第四:食道:两者食道前部皆为棒状,但前者食管下部膨大如容量瓶样球形,而后者恰似烧瓶样球状;第五,虫体:前者中部膨大而尾部直且尖细,后者中部匀称而尾部长且细尖。
2.2 鼠管状线虫离体生存能力试验结果
对鼠管状线虫培养观察发现:37℃5%CO2实验条件下,鼠管状线虫离体至少能存活10 d。第2天时,鼠管状线虫的幼虫可见包络鞘,说明蜕皮发生。第3天,雌雄特征已清晰可辨。第4天,雌性成虫阴门有深色阴道栓塞封闭,表明已发生交配。第5天,雄性成虫行动迟缓出现死亡,雌性成虫子宫中可见少量虫卵。第6天,雌性成虫子宫中可见大量虫卵。第7天,雌性成虫子宫中充满成熟的卵。第8天,妊娠的雌性成虫在暴露的空气中产卵。第9天,产卵后的雌虫形体萎缩死亡,虫卵中含有发育完全的、活动的、有感染性的幼虫。
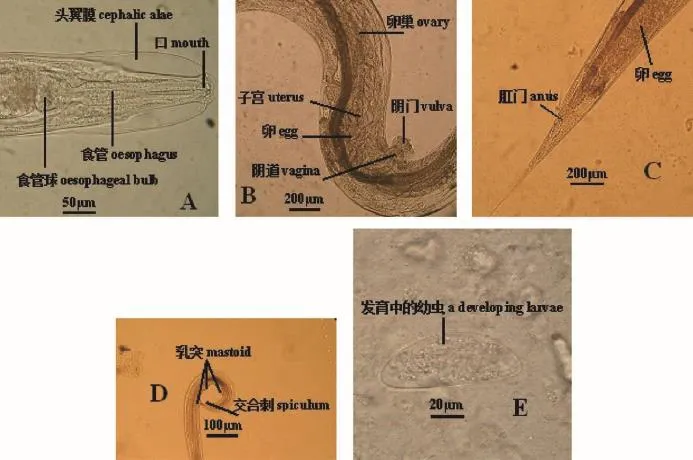
图1 中国SPF和清洁动物鼠管状线虫镜检形态(A:雌性成虫前部;B:雌性成虫腹部;C:雌性成虫尾部;D:雄性成虫尾部;E:虫卵)Fig.1 Microscopic morphology of SyPhacia muris isolated from SPF and clean animals in China. A,Anterior portion of a female adult;B,Ventral side of a female adult;C,Posterior portion of a female adult;D,Posterior portion of a male adult;E,egg)
2.3 多重PCR和测序技术鉴定鼠管状线虫结果
对鼠管状线虫虫卵、幼虫、成虫DNA分别进行多重PCR检测,结果在单个虫卵、幼虫、雌性成虫和雄性成虫DNA样本中,均可检出鼠管状线虫靶标基因ITS(702 bp)、28S rRNA(507 bp)、nad1(396 bp)和cox1(296 bp)特异性目的片段,而作为阴性对照的四翼无翅线虫、隐匿管状线虫却未见特异性片段。将目的条带回收纯化后进行测序鉴定。将所获得的鼠管状线虫多基因测序数据,在线提交NCBI,通过BLAST(http://blast.ncbi.nlm.nih.gov)进行比对分析,结果显示本研究分离获得的鼠管状线虫靶标基因ITS、28 S rRNA、nad1和cox1序列,与国际上已公布的不同国家不同来源的鼠管状线虫ITS、28 S rRNA、nad1和cox1基因核苷酸同源性达99% ~100%(GenBank登录号为 EU263106.2、AB500174.1、HM204802.1和HM204808.1)。多重PCR和测序技术从基因角度证明了实验动物鼠管状线虫感染。多重PCR和测序技术检测鼠管状线虫结果与直接镜检实时动态显微视屏摄录技术检测鼠管状线虫结果相一致。研究结果说明应用直接镜检实时动态显微视屏摄录技术联合多重PCR和测序技术,能够快速检测精准鉴定鼠管状线虫。
本研究应用该技术对我国SPF和清洁动物的鼠管状线虫自然感染进行了监测,检测5199只SPF动物(包括:5只猴,25只小型猪,55只兔,248只地鼠,198只豚鼠,459只大鼠,4139只小鼠,25只鸡,5只鸭),检测结果显示,SPF动物的鼠管状线虫阳性检出率为5.5%(285/5199),其中:SPF豚鼠、大鼠和小鼠的鼠管状线虫感染率分别为2%(4/198)、12.4%(57/459)和5.4%(224/4179),而SPF猴、小型猪、兔、地鼠、鸡和鸭未检出鼠管状线虫;检测1389只清洁级动物(包括:3只兔,31只地鼠,157只豚鼠,268只大鼠,930只小鼠),检测结果显示,清洁动物鼠管状线虫阳性检出率为9.7%(135/ 1389),其中:清洁豚鼠、大鼠和小鼠的鼠管状线虫感染率分别为5.1%(8/157)、10.8%(29/268)和10.5%(98/930),而清洁兔、地鼠未检出鼠管状线虫(表2)。
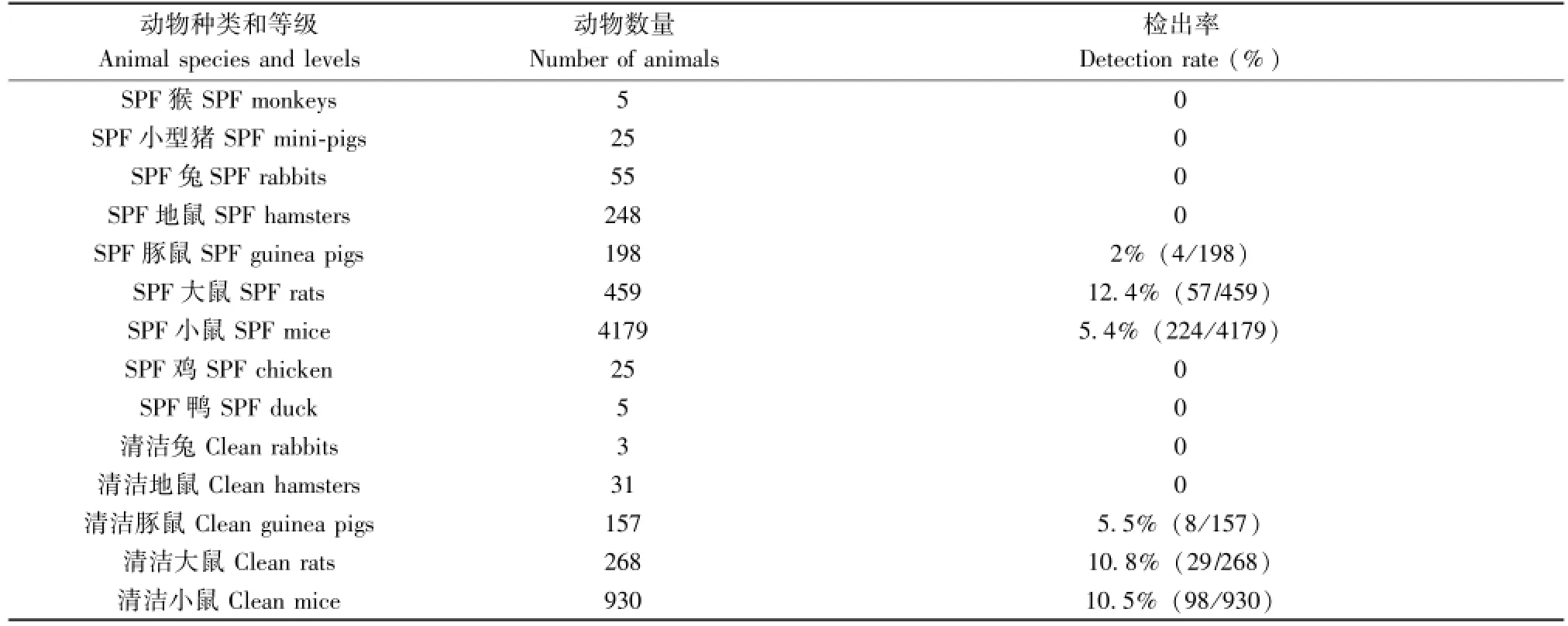
表2 中国SPF和清洁动物鼠管状线虫感染监测结果Tab.2 Prevelance of SyPhacia muris infestation in SPF and clean animals in China
3 讨论
鼠管状线虫生活史属直接型,感染期虫卵被宿主摄食后,在十二指肠内经消化液的作用,幼虫孵出,沿小肠下行,经几次蜕皮发育为成虫。成虫寄生在盲肠、结肠及回肠下部,重度感染时可达胃和食管等处。雌、雄虫交配后,雄虫很快死亡并排出体外,故宿主肠道内雌虫数比雄虫多。雌虫在肠道内低氧、温度及pH等影响下不排卵或仅排少量卵。而在宿主睡眠时肛门括约肌处于松弛状态下,妊娠雌虫便乘机移行至肛门外,受肛周温湿度及氧气的刺激,虫体头尾交替收缩蠕动,子宫发生强有力的收缩,瞬间排出大量虫卵。粘附在肛周的虫卵6 h后发育成熟,蜕皮1次后成为感染期虫卵,卵细胞内是发育完全的、活动的、有感染性的幼虫。排卵后的雌虫或孵化出的幼虫可经肛门逆行进入肠内或钻入阴道、尿道内引起新的感染[9-12]。虫卵轻得可以漂浮在空气中,造成大面积的环境污染[13]。虫卵可经空气中的粉尘、污染的设备、动物和人进行传播。Stone[14]报道美国研究人员在儿童和猴子的粪便中检出鼠管状线虫卵。Lytvynets[15]报道捷克实验动物繁育设施中的灰尘、空调、饲养笼和技术人员手的鼠管状线虫卵检出率分别为7.6%、28.7%、50.8%和37.9%。鼠管状线虫卵高度耐受各种环境因素如低温、干燥和消毒剂[16],一旦污染不易去除。Meade[17]报道鼠管状线虫卵在外界环境中暴露7个月依然具有活力。本文作者在37℃5%CO2实验条件下研究发现,鼠管状线虫可在体外存活近十天。本研究获得的鼠管状线虫可作为模式生物,用于抗寄生虫药物筛选研究,也可作为人类寄生虫病动物模型制备材料,进一步开展该虫的致病机理研究。
鼠管状线虫的自然感染在世界各地流行。Tung等[18]报道台湾野生大鼠的鼠管状线虫感染率为28.6%。Paramasvaran等[19]报道马拉西亚野生大鼠的鼠管状线虫感染率为17.6%。Kataranovski等[20]报道南斯拉夫野生大鼠的鼠管状线虫感染率为7.4%。Sharma等[21]报道印度野生大鼠和小鼠的鼠管状线虫感染率分别为 6.97% 和 8.57%。Kamranrashani等[22]报道伊朗野生小鼠的鼠管状线虫感染率为2.89%。Hayashimoto等[23,24]报道日本实验小鼠和宠物小鼠鼠管状线虫感染率分别为6.2%和46.4%。Hussey等[25]报道美国实验鼠鼠管状线虫感染率为100%。Beyhan等[26]报道土耳其实验大鼠和小鼠的鼠管状线虫感染率均为100%。我们的研究调查结果显示:我国SPF和清洁动物鼠管状线虫感染率分别为5.5%和9.7%,其中:SPF豚鼠、大鼠和小鼠的鼠管状线虫感染率分别为2%、12.4%和5.4%;清洁豚鼠、大鼠和小鼠的鼠管状线虫感染率分别为5.1%、10.8%和10.5%。实验动物寄生虫感染对人类寄生虫感染起一定的储存和传播作用,在流行病学上具有重要意义。即使当下进行的胚胎干细胞移植也并不能消除所有的感染性的病原体[27]。人兽共患病名录中人兽共患寄生虫病69种,我国存在60种[28-30]。最近我国时有SPF或清洁动物因人兽共患寄生虫感染致病或致死的报道[31-33]。当前,我国实验动物感染人兽共患寄生虫的现状不容乐观。实验动物携带的人兽共患寄生虫,不仅会污染环境、饮水、食品、空气,同时也会对人类健康造成危害,已污染的实验动物用于食品药品生物制品医疗器械检定或动物种质资源收集保存分发后果不堪设想。因此,各实验动物种子中心承担单位和动物繁育生产单位一定要高度重视人兽共患寄生虫病原体的生物安全性问题,切实落实自查抽查工作,及时发现并处理被污染的动物、粪便、垫料、饲料、饮水、笼器具、通风排气系统,彻底杀灭病原体并作无害化处理,避免污染公共水源和周边环境,要认真查找、严格控制并切断污染源,强化公共卫生安全防控意识,保证动物质量,保障人员安全,保护生态环境。
目前,直接检查肠道内容物仍是蠕虫检测的“金标准”,其局限性是安乐死动物[34]。肛周胶带法可检测宿主肛周粘附的蛲虫卵,但漏检率较高[35]。粪便漂浮法常用于检测产粪量较大的动物粪便中虫卵,不太适合实验动物[36]。Parel等[37]曾用ITS2区PCR-RFLP鉴定鼠管状线虫,PCR扩增后再进行酶切和电泳,操作繁琐且易污染。Leblanc等[38]曾在蛲虫通用引物PCR中得到了假阳性结果。Dole等[39]曾认为PCR检虫卵比粪检法灵敏,但后来在PCR检测阴性样本中竟然发现了活的虫体,提示单纯PCR方法不适合感染性的寄生虫病原体检测。本研究中,我们将直接镜检实时动态显微视屏摄录技术和形态学鉴定方法联合多重PCR和测序技术应用于鼠管状线虫的快速检测和分子鉴定,进行了方法学研究和验证,并对动物鼠管状线虫感染情况进行了监测,对鼠管状线虫筛查和确认的有效性进行了评价。应用多重PCR能够检测出单个鼠管状线虫卵、幼虫、雌性成虫和雄性成虫DNA,经多基因测序技术鉴定出鼠管状线虫靶标基因ITS、28S rRNA、nad1和cox1,与其他不同种属的寄生虫无交叉反应,尤其是形态学鉴定上与鼠管状线虫容易混淆的隐匿管状线虫和四翼无刺线虫,表明:多重PCR结合测序技术检测鉴定鼠管状线虫具有较高的灵敏度和特异性。对直接镜检实时动态显微视屏摄录技术检出,经形态学鉴定为活体鼠管状线虫的285份SPF和135份清洁动物阳性样本,分别提取DNA后,用多重PCR检测,均能获得预期目的条带,阳性样本测序证实获得的是鼠管状线虫靶标基因ITS、28S rRNA、nad1和cox1。测序结果显示,不同SPF和清洁动物分离获得的鼠管状线虫的ITS、28S rRNA、nad1和cox1基因核苷酸相似性达100%。应用多重PCR和测序技术检测SPF和清洁动物样本中的鼠管状线虫,结果分别检出285份和135份阳性,SPF和清洁动物鼠管状线虫阳性率分别为5.5%(285/5199)和9.7%(135/1389)。诊断灵敏度二者无差异。直接镜检实时动态显微视屏摄录技术通过形态学鉴定鼠管状线虫联合多重PCR和测序技术通过基因分析方法鉴定鼠管状线虫的分子验证结果相吻合,显示多重PCR和测序技术检测鉴定鼠管状线虫的特异性,提示今后可将ITS、28 S rRNA、nad1和cox1基因作为鼠管状线虫快速检测精准识别的分子靶标,有效扩展目前检疫检测方法和常规健康监测途径,为国家标准修订提供技参考依据和技术支撑,获得的多基因位点数据可用于鼠管状线虫遗传多样性研究,为进一步开展分子流行病学调查奠定基础。
欧洲实验动物学会联合会制定了统一的欧洲标准,规定肠道蠕虫是实验动物要求检测的病原体[40]。日本中央实验动物研究所实验动物质量控制标准规定必检蛲虫。随着中国社会经济的发展和国内外交流合作的增加,实验动物在诸多领域中的作用日益重要,因此,适应全球经济一体化,研究国外标准,以我国实验动物寄生虫监测调研基础数据作为科学依据,修订完善国家标准显得非常必要,这需要我们今后继续开展更多确定的研究予以支持。
综上所述,直接镜检实时动态显微视屏摄录技术和形态学鉴定联合多重PCR及测序技术可有效应用于鼠管状线虫感染的快速检定和感染监测中。本研究首次对中国SPF和清洁动物的鼠管状线虫进行了分子鉴定和感染调查,整体而言调查的面还不够宽广,还需要扩大样本的容量和丰度,以获得更全面的监测数据。鼠管状线虫作为一种重要的人兽共患病病原,其对动物质量和人类健康造成的危害不容忽视,今后一定要加强人兽共患病的防控工作,联合使用多种技术精准科学做好监测工作,切实保护人民生命健康,保障人民用药安全。
参考文献:
[1] Sotillo J,Trelis M,Cortés A,et al.Proteomic analysis of the pinworm SyPhacia muris(Nematoda:Oxyuridae),a parasite of laboratory rats[J].Parasitol Int,2012,61(4):561-564.
[2] Roman E,Kientruong T.Behavior of the rat in relation to oxyurid SyPhacia muris infestations at different stages of life[J].Bull Soc Pathol Exot Filiales,1973,66(1):178-183.
[3] Wagner M.The effect of infection with the pinworm(SyPhacia muris)on rat growth[J].Lab Anim Sci,1988,38(4):476 -478.
[4] Gonçalves L,Noronha D,Gomes DC.Worm burdens in outbred and inbred laboratory rats with morphometric data on SyPhacia muris(Yamaguti,1935)Yamaguti,1941(Nematoda,Oxyuroidea)[J].Mem Inst Oswaldo Cruz,2001,96(1):133 -136.
[5] Trelis M,Cortés A,Fried B,et al.Protective immunity against Echinostoma caProni in rats is induced by SyPhacia muris infection[J].Int J Parasitol,2013,43(6):453-463.
[6] Plachy'V,Litvinec A,Langrová I,et al.The effect of SyPhacia muris on nutrient digestibility in laboratory rats[J].Lab Anim,2015,16.pii:0023677215577038.
[7] 中华人民共和国国家标准[S].GB/T 14922.1-2001.2001,1-2.
[8] 中华人民共和国国家标准[S].GB/T 18448.10-2001.2001,17-19.
[9] Ross CR,Wagner JE,Wightman SR,et al.Experimental transmission of SyPhacia muris among rats,mice,hamsters and gerbils[J].Lab Anim Sci,1980,30(1):35-37.
[10] Lübcke R,Hutcheson FA,Barbezat GO.Impaired intestinal electrolyte transport in rats infested with the common parasite SyPhacia muris[J].Dig Dis Sci,1992,37(1):60-64.
[11] Stahl W.Studies on the life cycle of SyPhacia muris,the rat pinworm[J].Keio J Med,1963,12:55-60.
[12] Lewis JW,D'Silva J.The life-cycle of SyPhacia muris Yamaguti (Nematoda:Oxyuroidea)inthelaboratoryrat[J].J Helminthol,1986,60(1):39-46.
[13] Baker DG.Natural pathogens of laboratory mice,rats,and rabbits and their effects on research[J].Clin Microbiol Rev,1998,11(2):231-266.
[14] Stone WB,Manwell RD.Potential helminth infections in humans from pet or laboratory mice and hamsters[J].Public Health Rep,1966,81(7):647-653.
[15] Lytvynets A,Langrova I,Lachout J,et al.Detection of pinworm eggs in the dust of laboratory animals breeding facility,in the cages and on the hands of the technicians[J].Lab Anim,2013,47(1):71-73.
[16] Dix J,Astill J,Whelan G.Assessment of methods of destruction of SyPhacia muris eggs[J].Lab Anim,2004,38(1):11-16.
[17] Meade TM,Watson J.Characterization of rat pinworm(SyPhacia muris)epidemiology as a means to increase detection and elimination[J].J Am Assoc Lab Anim Sci,2014,53(6):661 -667.
[18] Tung KC,HsiaoFC,YangCH,etal.Surveillanceof endoparasitic infections and the first report of Physaloptera sp. and Sarcocystis spp.in farm rodents and shrews in central Taiwan [J].J Vet Med Sci,2009,71(1):43-47.
[19] Paramasvaran S,Sani RA,Hassan L,et al.Endo-parasite fauna of rodents caught in five wet markets in Kuala Lumpur and its potential zoonotic implications[J].Trop Biomed,2009,26 (1):67-72.
[20] Kataranovski M,Mirkov I,Belij S,et al.Intestinal helminths infection of rats(Ratus norvegicus)in the Belgrade area (Serbia):the effect of sex,age and habitat[J].Parasite,2011,18(2):189-196.
[21] SharmaD,JoshiS,VatsyaS,etal.Prevalenceof gastrointestinal helminth infections in rodents of Tarai region of Uttarakhand[J].J Parasit Dis,2013,37(2):181-184
[22] Kamranrashani B,Kia E,Mobedi I,et al.Helminth parasites of Rhombomys opimus from Golestan Province,Northeast Iran[J]. Iran J Parasitol,2013,8(1):78-84.
[23] HayashimotoN,MoritaH,IshidaT,etal.Current microbiological status of laboratory mice and rats in experimental facilities in Japan[J].Exp Anim,2013,62(1):41-48.
[24] Hayashimoto N,Morita H,Ishida T,et al.Microbiological survey of mice(Mus musculus)purchased from commercial pet shops in Kanagawa and Tokyo,Japacommercial pet shops in Kanagawa and Tokyo,Japan[J].Exp Anim,2015,64(2):155-160.
[25] Hussey KL.SyPhaia muris vs.S.obvelata in laboratory rats and mice[J].J Parasit,1957,43(5):555-559.
[26] Beyhan YE,Gürler AT,Bölükbaş CS,et al.Helminths of some laboratory animals detected by necropsy and fecal examination [J].Turkiye Parazitol Derg,2010,34(2):98-101.
[27] Mook D,Taylor DK,Huerkamp MJ.The rodent quarantine quagmire[J].J Am Assoc Lab Anim Sci,2009,48(5):472-474.
[28] Taylor LH,Latham SM,Woolhouse ME.Risk factors for human disease emergence[J].Philos Trans R Soc Lond B Biol Sci,2001,356(1411):983-989.
[29] Woolhouse ME,Gowtage-Sequeria S.Host range and emerging and reemerging pathogens[J].Emerg Infect Dis,2005,11 (12):1842-1847.
[30] 于恩庶,黄丰,潘亮,等.当今人兽共患病病原体分类[J].中国人兽共患病学报,2006,22(6):485-491.
[31] 高正琴,贺争鸣,关伟鸿.肿瘤移植裸鼠粪类圆线虫感染病原和分子诊断[J].中国比较医学杂志,2014,24(7):51-53.
[32] 高正琴,贺争鸣,岳秉飞.蓝氏贾第鞭毛虫诊断[J].中国比较医学杂志,2015,25(1):76-79.
[33] 高正琴,岳秉飞.四翼无刺线虫形态和分子鉴定[J].中国人兽共患病学报,2015,31(7):635-639.
[34] Sousa JE,Carvalho EF,Levenhagen MA,et al.Diagnosis of the pinworm SyPhacia muris in the Wistar rat Rattus norvegicus[J]. J Helminthol,2014,90(1):117-120.
[35] Hill WA,Randolph MM,Mandrell TD.Sensitivity of perianal tape impressions to diagnose pinworm(Syphacia spp.)infections in rats(Rattus norvegicus)and mice(Mus musculus)[J].J Am Assoc Lab Anim Sci,2009,48(4):378-380.
[36] Beyhan YE,Gürler AT,Bölükbaş CS,et al.Helminths of some laboratory animals detected by necropsy and fecal examination [J].Turkiye Parazitol Derg,2010,34(2):98-101.
[37] Parel JD,Galula JU,Ooi HK.Characterization of rDNA sequences from SyPhacia muris,SyPhacia muris,and AsPiculuris tetraPteraanddevelopmentofaPCR-basedmethodfor identification[J].Vet Parasitol,2008,153(3-4):379 -383.
[38] Leblanc M,Berry K,Graciano S,et al.False-positiveresults after environmental pinworm PCR testing due to Rhabditid nematodes in Corncob bedding[J].J Am Assoc Lab Anim Sci,2014,53(6):717-724.
[39] Dole VS,Zaias J,Kyricopoulos-Cleasby DM,et al.Comparison of traditionalandPCRmethods duringscreeningforand confirmation of AsPiculuris tetraPtera in a mouse facility[J].J Am Assoc Lab Anim Sci,2011,50(6):904-909.
[40] Mähler Convenor M,Berard M,Feinstein R,et al.FELASA recommendations for the health monitoring of mouse,rat,hamster,guineapigandrabbitcoloniesinbreedingand experimental units[J].Lab Anim.2014,48(3):178-192.
〔修回日期〕2016-02-19
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)06-0067-08
doi:10.3969.j.issn.1671-7856.2016.06.013
[基金项目]国家科技支撑计划(No.2013BAK11B03)。
[作者简介]高正琴,副研究员,研究方向:病原生物学和快检新技术研究。
[通讯作者]岳秉飞,研究员,研究方向:实验动物学。monkeys,3 batches of 25 mini-pigs,28 batches of 55 rabbits,13 batches of 248 hamsters,37 batches of 198 guinea pigs,93 batches of 459 rats,742 batches of 4179 mice,5 batches of 25 chickens and one batch of 5 ducks)and 145 batches of 1389 clean animals(including one batch of 3 rabbits,4 batches of 31 hamsters,16 batches of 157 guinea pigs,32 batches of 268 rats and 92 batches of 930 mice)came from 50 different manufactures in China.Direct microscopy real-time dynamic video recording techniques in combination with morphological identification method were applied to screen the SyPhacia muris infestation.A multiple polymerase chain reaction(multiple-PCR)testing of the isolate based on amplification of the conserved portions of the SyPhacia muris internal transcribed spacer(ITS),28S ribosomal RNA(28S rRNA),NADH dehydrogenase subunits 1(nad1)and cytochrome c oxidase subunit 1(cox1)genes,and the molecular sequencing of the multiple-PCR amplicons was used to confirm the SyPhacia muris infection.Results SyPhacia muris eggs,larvae and adults were detected by using direct microscopy real-time dynamic video recording technique.SyPhacia muris were detected based on the morphology and size of ovum,larvae,and female and male adult worms.Multiple-PCR and sequencing were performed to identify ITS,28S rRNA,nad1 and cox1 genes of DNA extracted from the single egg,larva and adult parasite SyPhacia muris.This approach allowed the specific identification with no amplicon being amplified from heterogeneous DNA samples,and sequencing confirmed the identity of the amplified sequences.Molecular characterization by multiple-PCR amplification and sequencing of the ITS,28S rRNA,nad1 and cox1 genes demonstrated the presence of SyPhacia muris.Multiple-PCR followed by sequencing confirmed 285 of 5199 SPF and 135 of 1389 clean animal samples classified as positive by using direct microscopy real-time dynamic video recording technique in the study as containing SyPhacia muris-sPecific DNA.Comparison of the partial sequences of the ITS,28S rRNA,nad1 and cox1 genes revealed 100%similarity amongst SyPhacia muris from different animals.The prevalence of SyPhacia muris infection in SPF and clean animals were 5.5% (285/5199)and 9.7% (135/1389),respectively.Conclusions Direct microscopy realtime dynamic video recording technique,multiple-PCR and sequencing can be used to rapidly detect and accurately identify SyPhacia muris.The zoonotic nature of SyPhacia muris can be regard as a public health alter,hence the good quality control of animal has an important role in protecting human health and safeguarding people safety.This is the first molecular identification and infection investigation of SyPhacia muris in SPF and clean animals in China.
Prevalence and molecular identification of Syphacia muris in laboratory animals in China
GAO Zheng-qin,LI Xiao-bo,FENG Yu-fang,WANG Ji,FU Rui,XING Jin,WANG Shu-jing,WEI Jie,WANG Hong,GONG Wei,LI Guan-min,HE Zheng-ming,YUE Bing-fei
(National Institutes for Food and Drug Control,Beijing 100050,China)
【Abstract】Objective To acquire the prevalence and molecular identification data on SyPhacia muris and provide reference for the revision of national standard.Methods 923 batches of 5199 SPF animals(including one batch of 5
【Key words】laboratory animal,SyPhacia muris,Molecular identification,Infection investigation
