“大马士革”玫瑰嫩茎组培快繁技术研究
2016-07-25李敏张晨光路喆王自健王朴
李敏+张晨光++路喆++王自健+王朴++蒋新明
摘要:以“大马士革”玫瑰当年生枝条为外植体,研究了不同枝条部位、取材时期、无机盐浓度、激素浓度组合对腋芽萌发、不定芽增殖及生根的影响。结果表明:“大马士革”玫瑰当年生枝条的中部茎段腋芽萌发率较高,且以11月份采集的腋芽萌芽率较好;MS培养基适于玫瑰枝条腋芽的萌发;外源激素NAA和6-BA在促进腋芽萌发中起重要作用,最佳组合为MS+0.1 mg/L NAA+1.0 mg/L 6-BA,诱导率达97.5%;继代培养中,最佳增殖培养基为MS+005 mg/L NAA+1.0 mg/L 6-BA,增殖系数为4.2;最佳生根培养基为MS+0.05 mg/L NAA,生根率为43.3%。
关键词:玫瑰;组织培养;增殖;腋芽
中图分类号: S685.120.4+3文献标志码: A文章编号:1002-1302(2016)06-0081-03
收稿日期:2016-01-15
基金项目:新疆生产建设兵团科技支疆项目(编号:2014AB010、2011AB007);新疆生产建设兵团科技攻关项目(编号:2011BA005)。
作者简介:李敏(1971—),女,四川仁寿人,高级农艺师,从事特色作物育种及栽培技术研究工作。E-mail:lm6389@126.com。
通信作者:张晨光,副研究员,从事特色作物育种及栽培技术研究。玫瑰(Rose rugosa Thunb.)是蔷薇科(Rosaceae)蔷薇属直立落叶丛生灌木[1],其花色艳丽、花形优美、香气浓郁、含油量高,是一种重要的特产经济植物,具有很高的经济和观赏应用价值。此外,玫瑰花蕾香嫩、润泽,具有理气解郁之功效,也是一种重要的茶饮及中药材[2-3]。随着社会的进步及生活水平的提高,玫瑰的市场需求日益增加,高产成为玫瑰生产者追逐的主要目标之一。常规玫瑰繁殖方法主要有:扦插、压条、分株等[4-5],然而这些方法的繁殖率较低,已不能满足消费需求。组织培养技术不仅克服了常规繁殖方法繁殖系数低的缺点,还可以在短期内获得大量生长发育一致的苗木,具有生产周期短、生产成本低、种苗产量高、经济效益显著等优势[6,7]。目前,组织培养技术在玫瑰快繁中的应用已经有研究报道[8-11],但仍存在诱导率低、生根率差、成活率低等问题。为此,本研究以“大马士革”玫瑰为试材,从外植体取材、激素配比等方面探讨玫瑰当年生枝条快速繁殖问题,以期为玫瑰的组培快繁提供理论依据和技术支持。
1材料与方法
1.1试验材料
“大马士革”玫瑰品种由新疆生产建设兵团第四师农业科学研究所芳香植物种质资源圃提供。选择生长健壮、无病虫害的二年生健康植株作试材,取当年生枝条顶端的嫩茎作为本试验外植体材料。
1.2试验方法
1.2.1外植体的准备与培养选取生长健壮的二年生玫瑰植株,剪取当年生带有腋芽的嫩茎,置于自来水下冲洗 30 min,按照上(未木质化)、中(半木质化)、下(完全木质化)将嫩茎剪成多个小段,且每一段均含有至少1个腋芽,做好标记。外植体灭菌参照张振超等的方法[12]。所有茎段先用75%乙醇消毒30 s,无菌水冲洗1~2次,后用0.1%氯化汞消毒20 min,之后再用无菌水冲洗3~5次。在超净工作台内,将无菌茎段倾斜插入培养基上,保持腋芽朝上,置于培养室培养,光照度为2 000 lx,温度(25±1) ℃,光照时间12 h/d,观察统计腋芽出芽情况。
1.2.2不同无机盐浓度对腋芽萌发的影响在超净工作台内,将无菌茎段倾斜插入添加了0.1 mg/L NAA和1.0 mg/L 6-BA的MS、1/2MS、1/4MS培养基(均添加0.7%琼脂、3%蔗糖,pH值5.8~6.0)上,培养20 d后统计茎段上的腋芽萌芽率。
1.2.3不同取材时期对腋芽萌芽的影响分别于7、9、11月的中旬,于晴天的上午采集当年生枝条,剪取中部带有腋芽的半木质化茎段,经消毒处理后接种于筛选出的优良培养基上(MS+0.1 mg/L NAA+1.0 mg/L 6-BA,含0.7%琼脂、3%蔗糖,pH值5.8~6.0)进行诱导培养,每个处理每个组培瓶接种10个无菌外植体,每个培养基接种7瓶,培养20 d后统计腋芽萌发率,其计算公式如下:萌发率=(腋芽萌发的带芽茎段数/接种的带芽茎段总数)×100%。
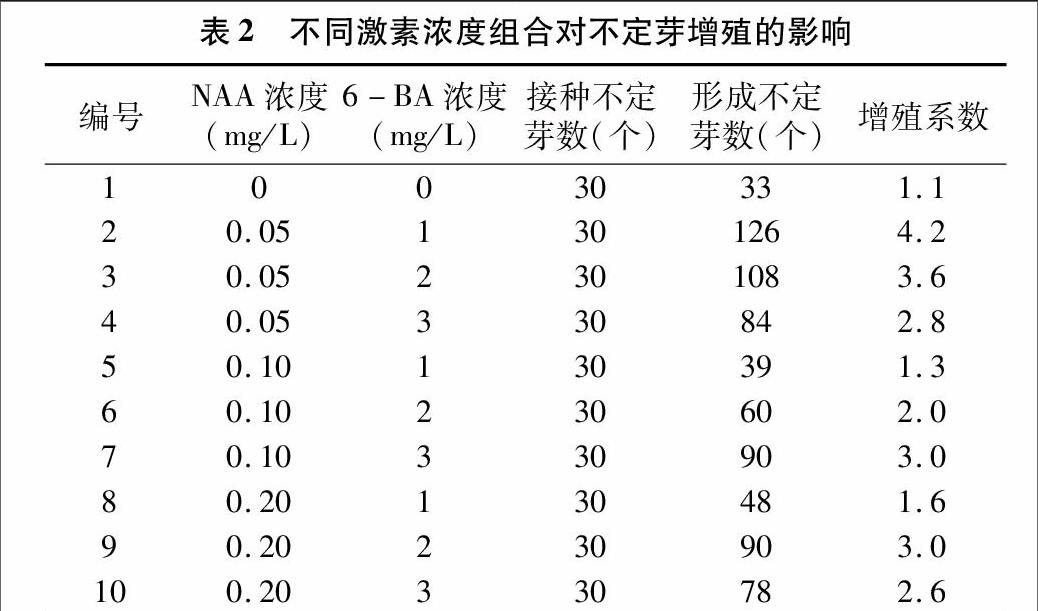
1.2.4不同激素配比对玫瑰腋芽萌发的影响将消毒处理的茎段接种于含有不同浓度NAA 和6-BA组合的MS培养基上。每瓶接种4个外植体,每个处理每次接种27瓶(108个芽),重复3次,20 d后统计腋芽萌发率。待初代培养分化产生的不定芽长到2 cm左右时,将其分开切成单个芽,之后接种于添加不同浓度NAA和6-BA组合的MS增殖培养基上(表1)。每瓶接种5个,每个处理每次接种6瓶(30个芽)。培养30 d后,统计每个处理的新生芽数,计算增殖系数:增殖系数=新生芽数/原来接种芽数。
1.2.5激素配比对壮苗生根培养的影响当幼苗长到3 cm左右时,切取单个幼苗,然后接种在添加了不同浓度(0~0.2 mg/L)NAA的MS培养基上诱导幼苗生根,长成完整植株。每个处理接种30株幼苗,重复3次,30 d后统计生根率和根系生长情况。生根率=(已生根的苗数/接种的组培苗数)×100%。
1.3数据分析
利用Excel对试验数据进行分析及相关图表制作。
2结果与分析
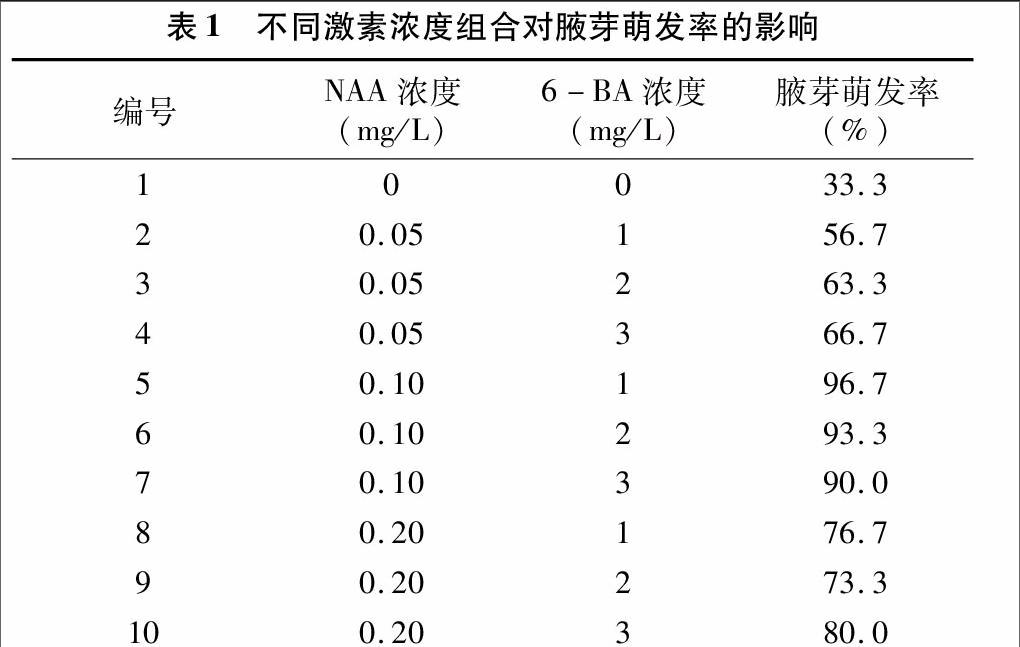
2.1取材时期对腋芽萌发的影响
从图1可见,分别在7月、9月和11月不同时间采集的接种材料萌发率存在差异,以11月份采集的枝条的腋芽萌发率最高,达到了84.2%,其原因可能是在11月份,枝条生长时间较长,积累养分丰富,腋芽饱满;而7月和9月采集的枝条腋芽萌发率相对较低,分别为61.9%和74.0%,其原因可能是枝条较幼嫩,营养不足,腋芽发育不全所致。综上比较可得,11月是进行“大马士革”玫瑰组织快繁取材的最佳时期,并且11月取材的腋芽在培养过程中最先开始萌发,萌发所需时间最短,而且萌发的腋芽生长旺盛。
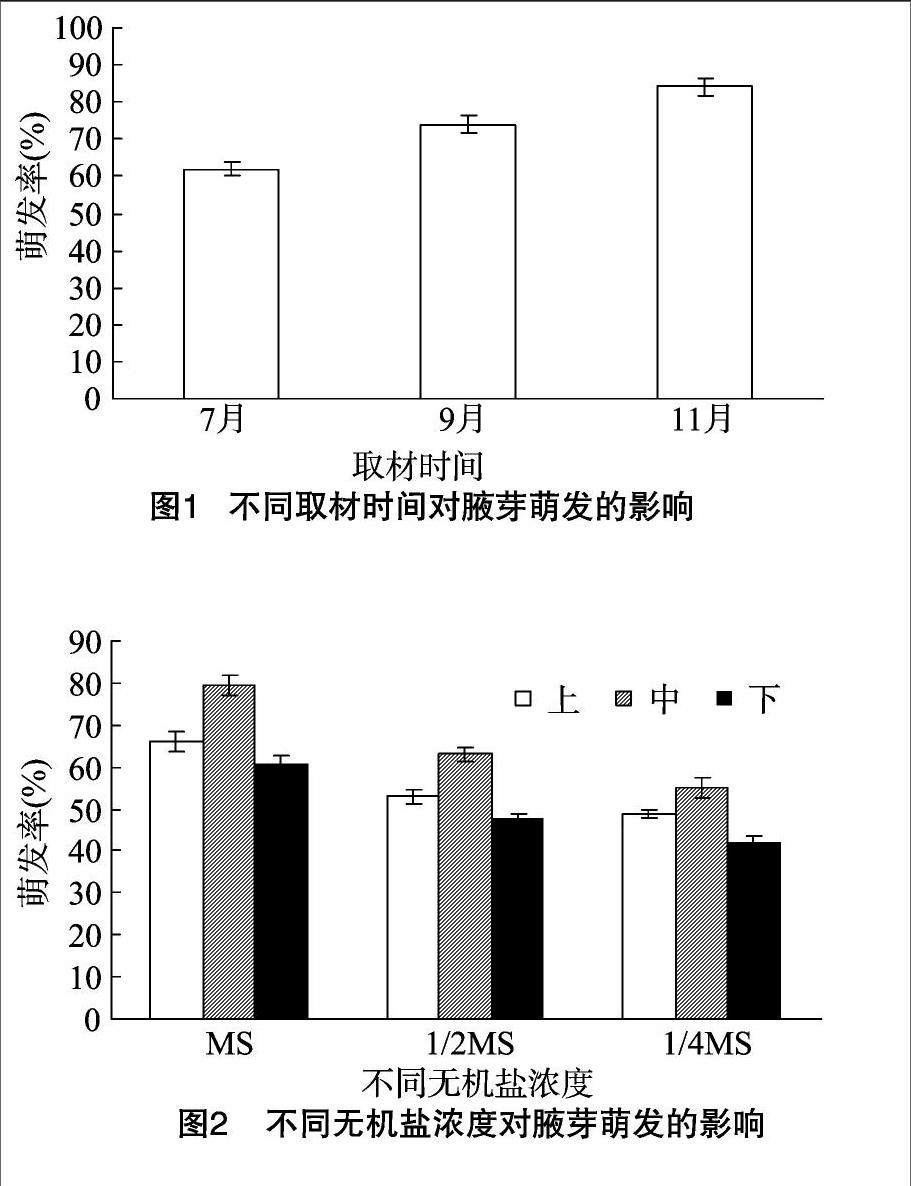
2.2不同无机盐离子浓度对腋芽萌发的影响
由图2可以看出,无机盐浓度显著影响“大马士革”玫瑰腋芽的萌发。基本培养基为MS时,上、中、下3种腋芽的萌发率都较高。同一培养基对不同腋芽部位萌发效果存在差异,其中以中部腋芽,即半木质化枝条的腋芽萌发效果最好,在MS培养基上萌芽率为79.6%;而未木质化茎段腋芽萌芽率最低,为65.7%。半木质化枝条的腋芽萌发率高,可能是由于半木质化茎段上腋芽的分生能力强,腋芽内部营养成分丰富,以及内源激素水平利于腋芽萌发。
2.3不同激素浓度及配比对腋芽萌发及丛生苗诱导的影响
由表1可以看出,在MS培养基中添加不同激素浓度显著影响腋芽的萌发,NAA浓度为0.1 mg/L时,腋芽萌发率较高,其中以MS+0.1 mg/L NAA+1.0 mg/L 6-BA的组合最好,萌芽率达到97.5%。虽然MS+0.1 mg/L NAA+2.0 mg/L 6-BA和MS+0.1 mg/L NAA+3.0 mg/L 6-BA的组合,其腋芽萌发率也较高,但其腋芽在萌发后易出现玻璃化现象,健壮苗的数量略少。NAA浓度为0.2 mg/L时,腋芽萌发率为75%左右,萌发率不如NAA浓度为0.1 mg/L组合高,而且少数幼苗长势较弱。
与对照相比,添加了不同浓度激素的培养基有利于“大马士革”玫瑰腋芽的增殖。接种培养30 d后,腋芽萌发成苗后,在诱导培养基上能够诱导生成多个芽,即芽增殖。9种不同激素配比的培养基,其增殖系数也不同。当MS培养基添加0.05 mg/L NAA+1.0 mg/L 6-BA时,新芽的增值能力强,芽增殖数量最多,即增殖系数最大,为4.2,说明此时激素浓度及配比最适于芽的增殖。而在其他激素配比下,新芽的增殖能力较弱,芽增殖数量少,增殖系数低(表2)。
2.4不同浓度NAA对幼苗生根的影响
将增殖的芽接种于含有不同NAA浓度的MS培养基中,培养15 d后,便能观察到幼苗茎基部长出白色的幼根,而无NAA的MS培养基中,没有观测到幼根,说明NAA能促进玫瑰幼苗生根。由图3可以看出,NAA浓度对其幼苗的诱导生根率有显著影响。当NAA浓度为0.05 mg/L时,“大马士革”玫瑰幼苗生根率显著高于其他浓度,达到43.3%;当NAA浓度增大时,其生根率却降低,说明适当浓度的NAA能够促进“大马士革”玫瑰幼苗的生根。
3讨论
外植体再生能力强弱是影响组培快繁的一个重要因素。外植体的取材时间对外植体的再生能力存在一定的影响。本试验中,“大马士革”玫瑰11月份时取材的腋芽萌发率较高,这与桑树外植体最佳取材时期[13]基本一致。其原因可能在于,11月份时玫瑰枝条处于休眠期,其腋芽饱满,积累了丰富的营养和激素,此时将含有腋芽的茎段进行离体培养,其形态发生能力强,萌发率高。而其他时期采集的腋芽营养和激素含量较低,故其萌芽率也较低。
一些研究者认为最佳的外植体采集部位是枝条的上部和中部[14]。而不同部位的腋芽其萌芽率也存在差异。本研究发现“大马士革”玫瑰中部枝条上的腋芽萌芽率较高,即半木质化茎段的萌芽率最高。其原因可能是中部茎段木质化程度低,再分化能力较强,营养充足,促使腋芽较早萌芽,且保持较强的长势。
玫瑰启动和增殖培养中常用 MS培养基和1/2MS培养基。在培养基中添加激素对于玫瑰的分生组织的再生能力有明显促进作用[15]。在本研究中,不同培养基成分及激素种类和浓度对“大马士革”玫瑰成苗及生根有显著影响。不同培养基成分中,MS培养基比较适合“大马士革”玫瑰的组织培养。植物激素NAA和6-BA均可促进“大马士革”玫瑰分化出不定芽,其中MS+0.1 mg/L NAA+1.0 mg/L 6-BA能显著促进腋芽的萌发,而增殖培养基以MS+0.05 mg/L NAA+1.0 mg/L 6-BA效果较佳,生根培养基以MS+0.05 mg/L NAA效果最佳。
采用“大马士革”玫瑰腋芽诱导完整植株的方法,可以在短时间内培育出大量玫瑰幼苗,明显缩短了繁育周期,既节省了时间,又可获得大量健壮的优良幼苗。本试验以“大马士革”玫瑰茎段腋芽为外植体材料,进行快繁研究,具有其他繁殖方法不可取代的优势,为玫瑰的繁殖及种苗的生产提供了方法依据和技术支持。
参考文献:
[1]卢绪娟,丰震,赵兰勇,等. 平阴玫瑰组培苗多酚含量及多酚氧化酶活性与其生根的关系[J]. 园艺学报,2007,34(3):695-698.
[2]杨博,韩振海,张永,等. 不同光照强度对玫瑰组织培养中初代培养物褐化的影响[J]. 中国农学通报,2003,19(6):194-196.
[3]邓燕红,余春香. 玫瑰组织培养研究[J]. 凯里学院学报,2008,26(6):104-105.
[4]林鑫,潘玉兴,刘洪珠. 食用玫瑰栽培技术[J]. 北京农业,2008(8):18-19.
[5]王贵淼. 花卉栽培实用技术[M]. 福州:福建科学技术出版社,1998:9.
[6]杨新征,杨德,张跃华. 玫瑰的价值及开发前景[J]. 新疆农业科学,2004(2):110-112.
[7]郭志刚,张伟. 玫瑰[M]. 北京:清华大学出版社,1998:1-4.
[8]黄钦才,董茂山,林静芳. 重瓣玫瑰营养芽离体培养[J]. 植物生理学通讯,1984(3):44.
[9]韩德复,王彦轩. 红玫瑰嫩茎组织培养的研究[J]. 长春师范学院学报:自然科学版,2013,32(6):81-82.
[10]黄颖,胡磊,谷晴,等. “大马士革”玫瑰茎尖组培快繁技术研究[J]. 北方园艺,2014(3):104-106.
[11]任玉芬. 玫瑰组织培养繁殖初报[J]. 宁夏农林科技,1986,(5):36
[12]张振超,戴忠良,毛忠良,等.青花菜雄性不育系组培快繁技术研究[J]. 江苏农业学报,2011,27(3):680-681
[13]Pattnaik S K,Shaoo Y,Chand P K. Mieropropagation of a fruit tree,Morus australis Poir. syn. M. acidosa Griff [J]. Plant Cell Reports,1996,15:841-845.
[14]闫晓红,李红梅,舒永宏. 玫瑰组织培养与快繁技术试验研究[J]. 中国园艺文摘,2011(9):32-33.
[15]王勇刚. ‘紫芙蓉玫瑰组培快繁技术研究[D]. 泰安:山东农业大学,2012.
