棉布支架固定化米根霉联产果胶酶及用于处理烟梗
2016-07-14何源郑羽西潘君王远亮生物流变科学与技术教育部重点实验室生物材料与仿生工程中心重庆大学生物工程学院重庆400044
何源,郑羽西,潘君,王远亮(生物流变科学与技术教育部重点实验室;生物材料与仿生工程中心;重庆大学生物工程学院,重庆 400044)
研究开发
棉布支架固定化米根霉联产果胶酶及用于处理烟梗
何源,郑羽西,潘君,王远亮
(生物流变科学与技术教育部重点实验室;生物材料与仿生工程中心;重庆大学生物工程学院,重庆 400044)
摘要:利用果胶酶处理烟梗纤维生产乳酸等对环境友好,而应用新的发酵组合方式和优化发酵条件是提高产酶量,降低成本的有效途径。本文采用实验室研发的棉布支架固定化米根霉细胞的技术,优化了底物为果胶或烟梗的发酵产果胶酶的培养条件,还优化了处理烟梗果胶的条件。底物为果胶的最佳产酶条件为:转速190r/min,装液量50mL/250mL,发酵温度30℃,初始pH值5,初始孢子浓度0.75×106个/mL。底物为烟梗的最佳产酶条件为:初始pH值4.6、初始孢子浓度0.5×106个/mL等。在优化处理烟梗果胶的条件下,固定化米根霉产果胶酶连续法比游离的果胶酶法降解烟梗果胶的效果好,果胶降解率提高18.5%,达到74.1%。棉布支架固定化米根霉利用果胶发酵产果胶酶量较高,利用烟梗发酵脱胶效果较好。
关键词:米根霉;果胶酶;固定化;生物脱胶;烟梗
第一作者:何源(1990—),男,硕士研究生。联系人:王远亮,教授,博士生导师,从事组织工程与生物材料。E-mail wyl@cqu.edu.cn。
四川、云南、贵州等是烟草资源较为丰富的省份,每年经过打叶复烤会有大量的烟梗产生,绝大部分烟梗被废弃,造成了资源的极大浪费,还给当地带来了环境污染的问题[1-2]。对烟梗进行综合开发、利用,是实现烟梗经济价值的重要途径[3]。烟梗作为一种可再生天然纤维素资源,是生产乳酸等的有效碳源。天然纤维素的预处理方法中非酸的物理化学方法对原料中果胶等的处理不够[4]。果胶是一种无定形的植物多糖,是胞间层的主要组成,在初生壁中与木质纤维的微纤维以及某些伸展蛋白相互交联作用[5]。果胶的去除可以改变纤维原料表面的物化性质,增大其孔隙率和酶的接触面积,从而提高纤维素的酶解率,此外还可减少黏性物质对糖化过程高底物浓度导致的混合和传热的影响[6-8]。处理木质纤维素中果胶的方法有物理化学法、微生物法和生物酶法[9]。物理化学法产生的废酸液会严重污染环境,还可能产生高浓度的糠醛毒害发酵微生物[10]。生物酶法和微生物法因不存在上述缺点,所以受到人们的关注[7,11-12]。生物酶法和微生物法是直接利用果胶酶等或产果胶酶的微生物处理纤维素原料,从而获得纤维素。
果胶酶是一类果胶分解酶的总称,在食品、纺织、医药、造纸、环境、生物技术等领域有广泛应用,市场需求量越来越大[13]。米根霉是一种高商业价值的安全菌种,产生的果胶酶主要是聚半乳糖醛酸酶(polygalacturonases,PG),该酶作用于部分D-半乳糖醛酸的α-1,4-糖苷键,有内切酶和外切酶之分[14-15]。目前国内外对黑曲霉、芽孢杆菌等生产果胶酶研究较多。对米根霉生产果胶酶的研究主要是利用橘子浆或橘皮的固态发酵[16-18],由于发酵形式传统,缺乏对培养基和条件的优化,果胶酶产量不高。纤维类材料适合固定化细胞,能提高产酶量,有半连续和连续发酵的潜力[19-20]。棉布支架固定化效果好,适合发酵工艺的扩大化,便于工业上应用[21]。本研究在已优化的两种培养基条件下,分别对棉布支架固定化米根霉的产果胶酶条件进行初步优化,对游离的果胶酶直接处理烟梗的条件进行初步优化,并与产酶优化条件下的固定化米根霉连续化处理烟梗的效果进行比较。固定化米根霉产果胶酶连续化处理烟梗的方法有利于解决乳酸等生产过程中果胶带来的系列问题,为天然纤维素资源生产乳酸等提供了一种新的微生物预处理方法。
1 材料与方法
1.1 原料
烟梗由重庆某公司提供,经分拣、小型粉碎机粉碎过筛得50目粉末,放入干燥器待用。棉布支架由不锈钢细网和棉布组成,几何尺寸为长3.00cm× 高0.75cm的六角形支架,各分支成60°夹角,如图1所示。
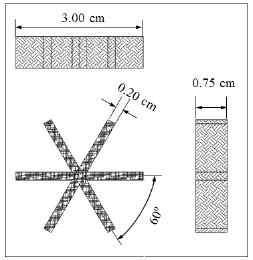
图1 棉布支架的三视图
1.2 菌种
米根霉(Rhizopus oryzae)As3.3158:产乳酸优良型,中国科学院微生物研究所生产。
1.3 试剂
果胶(半乳糖醛酸≥74%,甲氧基≥6.7%,Sigma);D-半乳糖醛酸(Sigma);其余试剂均为国产试剂,分析纯。
1.4 培养基
斜面培养基:PDA46g/L。灭菌后,倒入试管,倾斜摆放。
种子培养基:葡萄糖 30g/L,酵母提取物 2.5 g/L,自然pH值。
果胶发酵培养基:果胶25g/L,(NH4)2SO415g/L,K2HPO44g/L,KH2PO44g/L,ZnSO40.168g/L,Tween80 1.5 g/L,pH值5.8。
烟梗发酵培养基:烟梗20g/L,葡萄糖6g/L,硫酸铵3g/L,K2HPO42.0g/L,KH2PO42.0g/L,ZnSO40.168 g/L,Tween80 1g/L,自然pH值4.6。
以上培养基均采用 1×105Pa条件下,灭菌 20 min,pH值用 2mol/L NaOH和 1mol/L HCl溶液调节。
1.5 固定化种子培养及发酵[21]
种子培养:用无菌生理盐水洗脱PDA斜面培养基上的孢子。按接种后种子培养液中孢子浓度0.25×106个/mL,将孢子悬液加入 250mL三角瓶中,种子培养液50mL,加入1×105Pa灭菌30min的棉布支架一个,摇床转速 170 r/min,30℃培养24h。
发酵培养:弃去原种子液,将固定化的菌体用无菌水冲洗3次,然后将其装入含有50mL发酵培养基的250mL三角瓶中,摇床转速170r/min,30℃培养24h。
1.6 测定方法
果胶酶(pectinases,PEC)活力测定[22]:底物pH值调至4。酶活力单位定义:在45℃下,30min催化产生 1mg还原糖所需的酶量为一个酶活力单位(U)。聚半乳糖醛酸内切酶(endopolygalacturonase,Endo-PG)活力测定[23]:底物pH值调至4。酶活力单位定义:在45℃下,30min使黏度下降50%所需要的酶量为一个酶活力单位(U)。
CMC酶活力定义:在50℃下,1h水解CMC-Na生成相当于 1mg葡萄糖的还原糖的量为一个酶活力单位(U)。FPA酶活力定义:在50℃下,1h水解滤纸生成相当于 1mg葡萄糖的还原糖的量为一个酶活力单位(U)。纤维素酶活力测定依据QB2583—2003。还原糖的测定采用DNS法[24]。
发酵粗酶液的制备:将发酵液在 4℃、8000 r/min离心5min后取上清液作为粗酶液,冰箱中4℃保存。粗酶液稀释倍数的确定[25]:在不同稀释倍数下,作稀释倍数与酶活力的曲线选取偏差小,稳定范围较大的稀释倍数。
生物量的测定:取出棉布支架,剥离菌体,三蒸水洗涤(当发酵培养基为果胶时,先用 6mol/L的盐酸洗涤),过滤,于70℃烘至恒重。
果胶含量测定采用柠檬酸-乙醇沉淀法[26]。烟梗中纤维素、半纤维素、木质素及灰分含量的测定参照文献[27]。
1.7 产酶条件的优化及数据分析
发酵底物为果胶时,研究摇床转速、装液量、发酵温度、初始pH值和初始孢子浓度对固定化米根霉产果胶酶的影响。转速梯度为 150r/min、170r/min、190r/min、210r/min;装液量梯度为50mL、 60mL、70mL;发酵温度梯度为28℃、30℃、32℃;初始pH值梯度为3、4、5、6、7、8;初始孢子浓度梯度为 0.25×106个/mL、0.50×106个/mL、0.75×106个/mL、1×106个/mL。每个因素的同一个水平重复3次。
发酵底物为烟梗时,主要研究初始pH值和初始孢子浓度对产酶的影响,梯度设置与上述相同。每个因素的同一个水平重复三次。
1.8 游离的果胶酶和固定化米根霉连续降解烟梗实验
游离的果胶酶降解烟梗:研究了果胶酶量和液料比对烟梗果胶降解率的影响。果胶酶量梯度为400U/mL、600U/mL、800U/mL、1000U/mL;液料比梯度为10、15、20、25。酶解条件:初始pH值3.5,温度45℃,摇速150r/min,反应时间12h。以烟梗果胶的绝对降解率为指标,还测定了处理后烟梗果胶、纤维素、半纤维素及木质素的相对百分含量。
固定化米根霉连续降解烟梗:在优化后的产酶培养条件下进行发酵。测定了烟梗果胶的绝对降解率,还测定纤维素、半纤维素和木质素的绝对百分含量。发酵结束后取游离烟梗粉末测定果胶、纤维素、半纤维素及木质素的相对百分含量。
2 结果与讨论
2.1 底物为果胶的发酵条件优化
2.1.1 最佳转速的确定
转速影响培养液中溶解氧,较高转速和较少装液量下溶氧量较多,产酶量较大。固定化米根霉在190r/min时PEC产量达到最大,而在150r/min时Endo-PG产量最大,如图 2所示。最低转速下Endo-PG产量最大,可能是菌体对溶氧不足的响应,通过合成更多Endo-PG减少培养基黏度,提高氧传递速率。过高转速会带来高剪切力,影响菌体形态,直接影响碳源分流,进而影响产酶量。以PEC产量为准,选择转速为190 r/min。
2.1.2 最佳装液量的确定
装液量也对培养液中的溶解氧有影响,装液量越少,摇瓶中溶氧越多,产酶量越大。经过不同的装液量培养,在装液量为50mL(满足菌体被浸没)时,PEC和Endo-PG产量较大,如图3所示。
2.1.3 最佳发酵温度的确定
温度对微生物生长和代谢产物合成的影响是许多因素综合作用的体现。发酵温度升高,酶反应速率增加,菌体生长代谢加快,产物提前产生。但温度升高,酶失活加快,菌体易衰老,合成产物受影响。温度还对发酵液中溶解氧含量有直接的影响。如图4所示,在30℃时PEC、Endo-PG产量均达到最大。
2.1.4 最佳初始pH值的确定
不同初始pH值会改变底物带电性,会抑制或激活酶的活性使菌体代谢途径发生改变,会改变细胞原生质膜的电荷使膜的渗透性改变,从而影响米根霉对营养物质的吸收。如图5所示,在pH值为4~5时,PEC和Endo-PG产量均较高。在pH值分别为5~7和5~6时,产酶量急剧减少,在pH值为7~8时,产酶趋于平稳。这可能与酶最适pH值有关,米根霉产生的Endo-PG的最适pH值为4.5[28],果胶裂解酶最适pH值为7.5且在酸性条件下酶活力和稳定性极低[29],真菌产生果胶酯酶最适pH值一般偏酸性。本研究初始pH值选为5。
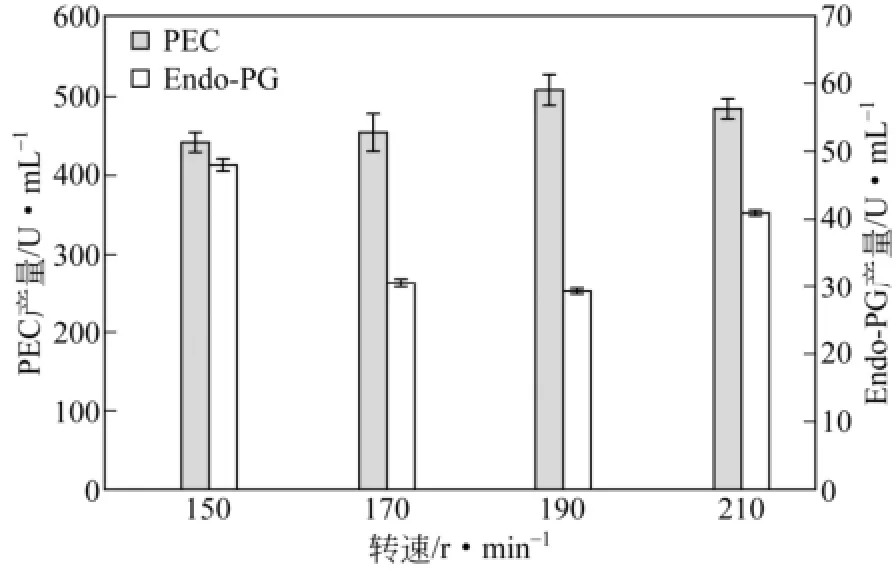
图2 不同转速下底物为果胶的果胶酶产酶
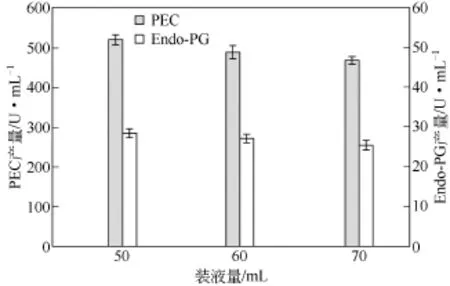
图3 不同装液量下底物为果胶的果胶酶产量
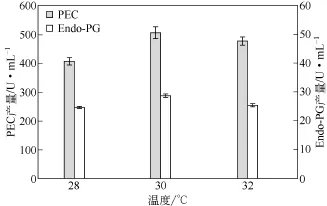
图4 不同发酵温度下底物为果胶的果胶酶产量
2.1.5 最佳初始孢子浓度的确定
孢子浓度与生物量关系密切,合适的生物量避免细胞之间对营养物质激烈的竞争,对生长和产酶有利。如图6所示,PEC和Endo-PG产量的变化趋势相近,在浓度为0.75×106个/mL时产酶达到最高。
2.2 底物为果胶的固定化米根霉产果胶酶动力学行为

图5 不同初始pH值下底物为果胶的果胶酶产量
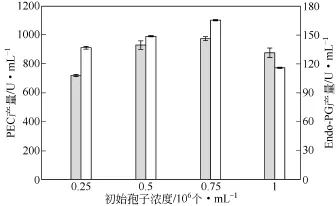
图6 不同初始孢子浓度下底物为果胶的果胶酶产量
如图7所示,PEC和Endo-PG的最高产量分别在30h和72h达到,发酵前24h产酶量急剧增加,48h后PEC产量下降较快而Endo-PG产量平稳;pH值变化呈V形,pH值由5到3再到6.4;生物量持续增加,在96h时达到最大。PEC和Endo-PG产量变化显著不同,可能是由于产物的抑制作用,也可能是由于发酵条件的变化,如pH值等[30];pH值的V形变化与寡聚半乳糖醛酸、半乳糖醛酸等酸性物质的产生和消耗或碱性化合物的产生有关[31]。因此造成了PEC产量变化与pH值变化表现出较强的负相关性。
由于PEC的大小受底物、稀释倍数等影响,因此PEC产量估计在3.34×102~1.00×103U/mL。有研究报道固定化黑曲霉的果胶酶产量为0.64×102U/mL[20]和固定化芽孢杆菌的果胶酶产量为 8.55×102U/mL[32]。因此固定化米根霉利用果胶产果胶酶能达到或高于已有产酶水平,具有可开发前景。
2.3 底物为烟梗的发酵条件优化
底物为果胶的产酶研究发现,初始pH值和初始孢子浓度对产酶有较大影响,因此主要对这两个因素进行优化。在转速190r/min、装液量50mL/250 mL、发酵温度30℃下,研究这两个因素对产酶的影响。如图8和图9所示,初始pH值、初始孢子浓度对产酶的影响与底物为果胶产酶时相似,初始pH值在自然pH值4.6时产酶最佳,初始孢子浓度在0.5×106个/mL时产酶量最高。
2.4 底物为烟梗的固定化米根霉产果胶酶动力学行为
如图10所示,发酵过程中PEC和Endo-PG产量分别在24h和96h较高,发酵前24 h产酶量急剧增加,48h后PEC产量下降较快而Endo-PG产量继续增加;pH值由4.6持续增加至6.8;总量浓度呈V形变化且在24h最低。底物为烟梗的发酵产酶变化、菌体量变化与底物为果胶的发酵类似,这可能是葡萄糖被米根霉利用合成大量果胶酶等,加剧了烟梗多糖被降解利用的程度,同时菌体量得以增加。pH值变化与底物为果胶的pH值变化不同,这可能是由于烟梗果胶含量相对较少,产生的酸性物质很快被消耗。
2.5 游离的果胶酶法和固定化米根霉连续法处理烟梗
2.5.1 游离的果胶酶法处理烟梗
最佳果胶酶量的确定,如图11所示,随果胶酶量的增加,果胶降解率增加,酶量大于600U/mL时,增加不明显;随酶量的增加,烟梗质量损失增加;综合考虑降解效果和经济成本,选择为600U/mL。最佳液料比的确定,如图12所示,随液料比的增大,果胶的降解率和烟梗质量损失的变化呈倒V形,在液料比为20时,果胶降解率较大为55.6%,高于文献报道的42%[33]。
2.5.2 固定化米根霉连续法处理烟梗
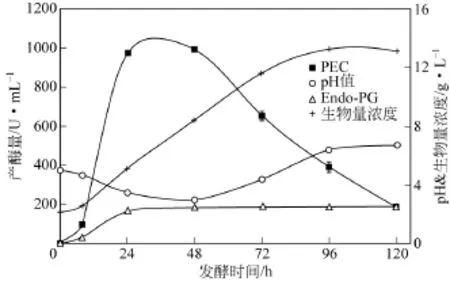
图7 底物为果胶的固定化米根霉产果胶酶动力学行为
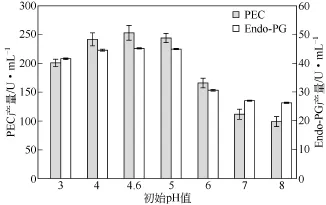
图8 不同初始pH值下底物为烟梗的果胶酶产量

图9 不同初始孢子浓度下底物为烟梗的果胶酶产量

图10 底物为烟梗的固定化米根霉产果胶酶动力学行为
如图13所示,烟梗果胶降解率在前期急剧增加,然后变慢,96h后降解率为74.1%。纤维素酶产量峰值出现在24h,48h后产酶较低平,如图14所示。烟梗经过米根霉发酵,植物性多糖如果胶、半纤维素和纤维素等被不同程度利用。如图15所示,发酵 96h后烟梗各物质的绝对含量为果胶25.9%、半纤维素 45.5%、纤维素 86.7%和木质素98%,烟梗中果胶与半纤维素降解较多且变化相似,纤维素降解较少,木质素基本不变。这是由于米根霉缺乏降解木质素的酶类,因此木质素含量变化不大。纤维素由于结晶性对酶的高度抵制及有限的酶结合位点数又可能受到果胶和半纤维等的屏蔽作用使之难以被微生物利用。由于无定性的半纤维素和果胶易与微生物产生的酶作用,因此它们的损失较大,烟梗果胶降解率为74.1%,高于文献报道45%[34]。
2.5.3 游离果胶酶法和固定化米根霉连续法处理烟梗效果的比较
烟梗经不同方法处理后各组分相对含量如表 1所示。烟梗经固定化米根霉连续法处理后,纤维素和木质素的含量增加明显,果胶含量变化不大。经米根霉处理的烟梗与未经过处理烟梗相比,果胶含量增加2.2%,纤维素含量提高2.9倍,半纤维素含量持平,木质素提高3.4倍。而游离果胶酶法(酶量为 1000U/mL)处理的烟梗与未处理烟梗相比,果胶含量增加4.4%,纤维素含量提高1.4倍,半纤维含量提高1.2倍,木质素提高1.4倍。
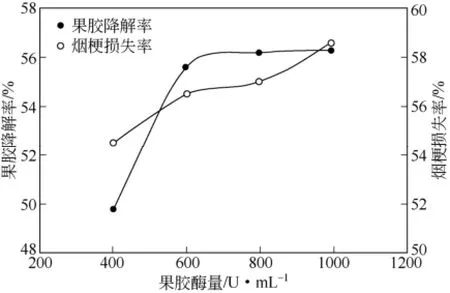
图11 不同果胶酶量下果胶降解率和烟梗损失率

图12 不同液料比下果胶降解率和烟梗损失率

图13 发酵过程中果胶降解率与果胶酶产量变化
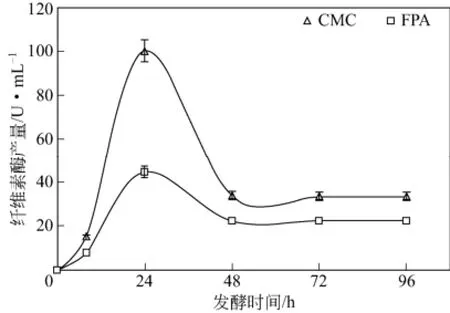
图14 发酵过程中纤维素酶产量变化
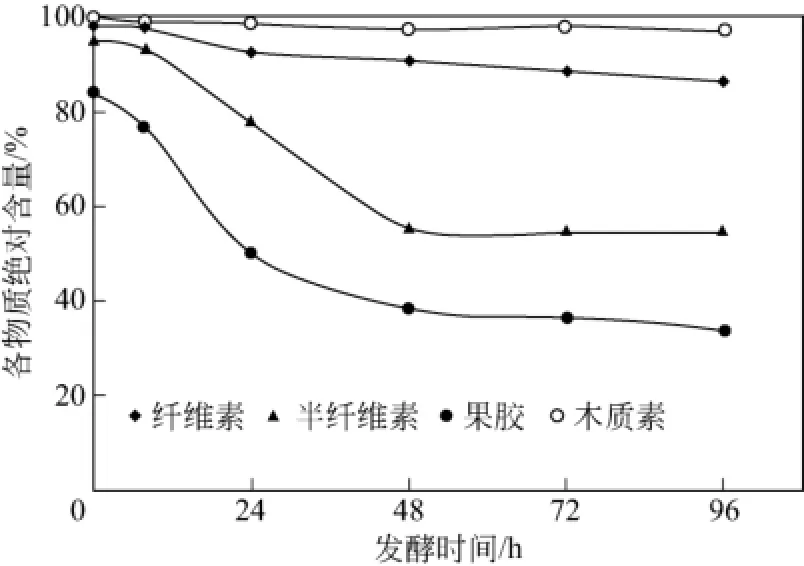
图15 发酵过程中果胶和木质纤维素绝对含量变化
固定化米根霉连续法与游离果胶酶法处理烟梗相比,烟梗果胶降解率提高18.5%。这是由于一方面菌体合成较为丰富的酶系利用烟梗,另一方面菌体消耗了酶解产物避免了底物对酶的抑制作用。通过对烟梗果胶和半纤维素(主要为木糖)的去除,使烟梗的结构变得疏松,纤维素的相对含量增加,纤维表面与酶接触的可及度增大,有利于提高酶解烟梗产糖率和缓解木糖对米根霉产乳酸的抑制作用[7,35-36]。

表1 烟梗经不同方法处理后各组分相对含量
3 结 论
(1)通过单因素试验对固定化米根霉利用果胶产果胶酶条件进行优化,得到的优化条件如下:最佳转速190r/min,最佳装液量50mL/250mL,最佳发酵温度30℃,最佳初始pH值5,最佳初始孢子浓度0.75×106个/mL,PEC和Endo-PG产量最高能达到1.00×103U/mL和1.91×102U/mL。
(2)通过单因素法优化影响固定化米根霉利用烟梗产果胶酶的两个关键因素,得到优化条件如下:最佳初始 pH值 4.6,最佳初始孢子浓度 0.5×106个/mL,其他条件不变,PEC和Endo-PG产量最高能达到3.42×102U/mL和5.27×10 U/mL。
(3)棉布支架固定化米根霉在利用果胶发酵产果胶酶的产量约 3.34×102~1.00×103U/mL,在利用烟梗发酵产果胶酶的产量约 1.14×102~3.42×102U/mL,达到或高于已有产酶水平。
(4)通过优化处理烟梗的条件,得到结果如下:游离的果胶酶法在酶量600U/mL、液料比20等条件下,烟梗果胶降解率达到55.6%;固定化米根霉连续法在优化产酶的条件下,烟梗果胶降解率达到为74.1%,半纤维素降解率达到54.5%。
(5)棉布支架固定米根霉产果胶酶连续化处理烟梗的研究表明,这不仅能获得一定量果胶酶,还能大量降解烟梗中果胶和半纤维素等,为天然纤维素资源生产乳酸等提供了一种新的微生物预处理方法。
参 考 文 献
[1] 任民,王志德,牟建民,等. 我国烟草种质资源的种类与分布概况[J]. 中国烟草科学,2009,30(s1):8-14.
[2] 董占能,白聚川,张皓东. 烟草废弃物资源化[J]. 中国烟草科学,2008,29(1):39-42.
[3] 鲁蕾,付敏,郭宝星. 烟梗成分提取及其应用研究[J]. 四川化工,2004,7(1):9-11.
[4] MOSIER N,WYMAN C,DALE B,et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology,2005,96(6):673-686.
[5] CAFFALL K H,MOHNEN D. The structure,function,and biosynthesis of plant cell wall pectic polysaccharides[J]. Carbohydrate Research,2009,344(14):1879-1900.
[6] 陈洪章. 纤维素生物技术[M]. 北京:化学工业出版社,2015.
[7] BERLIN A,MAXIMENKO V,GILKES N,et al. Optimization of enzyme complexes for lignocellulose hydrolysis[J]. Biotechnology and Bioengineering,2007,97(2):287-296.
[8] RUDOLF A,ALKASRAWI M,ZACCHI G,et al. A comparison between batch and fed-batch simultaneous saccharification and fermentation of steam pretreated spruce[J]. Enzyme Microb. Technol.,2005,37(2):195-204.
[9] 冯洪建,黄国林. 果胶提取的研究进展[J]. 广东化工,2013,40 (21):84-85.
[10] GRAY K A,Zhao L S,EMPTAGE M. Bioethanol[J]. Current Opinion in Chemical Biology,2006,10(2):141-146.
[11] PARIDAH M T,BASHER A B,SAIFULAZRY S,et al. Retting process of some bast plant fibers and its effect on fiber quality:a review[J]. Bioresources,2011,6(4):5260-5281.
[12] ZHANG J,HENRIKSSON H,SZABO I J,et al. The active component in the flax-retting system of the zygomycete Rhizopus oryzae sb is a family 28 polygalacturonase[J]. J. Ind. Microbiol. Biotechnol.,2005,32(10):431-438.
[13] 李祖明,张洪勋,白志辉,等. 微生物果胶酶研究进展[J]. 生物技术通报,2010,80(3):42-49.
[14] GHOSH B,RAY R R. Current commercial perspective of Rhizopus oryzae:a review[J]. Journal of Applied Science,2011,11(14): 2470-2486.
[15] JAYANI R S,SAXENA S,GUPTA R. Microbial pectinolytic enzymes:a review[J]. Process Biochemistry,2005,40(9): 2931-2944.
[16] HART H E,PARISH M E,BUMS J K,et al. Orange finisher pulp as substrate for polygalacturonase production by Rhizopus oryzae [J]. J. Food Sci.,1991,56(2):480-483.
[17] HAMDY H S. Purification and characterization of the pectin lyase secreted within the macerating fluid of Rhizopus oryzae(Went,Prinsen Geerlings)grown on orange peel[J]. Indian J. Biotechnol.,2006,5(3):284-291.
[18] KAREEM S O,ADEBOWALE A A. Clarification of orange juice by crud fungal pectinase from citrus peel[J]. Nig. Food J.,2007,25(1): 130-137.
[19] LAN T Q,WEI D,YANG S T,et al. Enhanced cellulase production by Trichoderma viride in a rotating fibrous bed bioreactor[J]. Bioresource Technology,2013,133:175-182.
[20] IBRAHIM D,WELOOSAMY H,SHEH-HONG L. Potential use of nylon scouring pad cubes attachment method for pectinase productionby Aspergillus niger HFD5A-1[J]. Process Biochemistry,2014,49 (4):660-667.
[21] 王润光,王远亮,王珍,等. 一种新型支架在乳酸发酵中的应用[J].化工进展,2010,29(4):733-738.
[22] MARCIA M C N S,ROBERTO S,Eleni Gomes. Screening of bacterial strains for pectinolytic activity:characterization of the polygalacturonase produced by Bacillus sp.[J]. Revista de Microbiologia,1999,30:299-303.
[23] TUTTOBELLO R,MILL P J. The pectic enzymes of Aspergillus niger:the production of active mixtures of pectic enzymes[J]. Biochemical Journal,1961,79(1):51-57.
[24] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugars[J]. Analytical Chemistry,1959,31(3):426-428.
[25] 王小敏,吴文龙,闾连飞,等. 分光光度计法测定果胶酶活力的方法研究[J]. 食品工业科技,2007,28(5):227-229.
[26] 张凤仙,刘梅芳. 15种植物果胶含量及甲氧基的测定[J]. 植物学通报,1995(12):69-70.
[27] 杨胜. 饲料分析及饲料质量检测技术[M]. 北京:中国农业大学出版社,1993.
[28] SAITO K,TAKAKUWA N,ODA Y. Purification of the extracellular pectinolytic enzyme from the fungus Rhizopus oryzae NBRC 4707[J]. Microbiological Research,2004,159(1):83-86.
[29] HAMDY H S. Purification and characterization of the pectin lyase produced by Rhizopus oryzae grown on orange peels[J]. Ann. Microbiol.,2005,55(3):205-211.
[30] ZENI J,CENCE K,GRANDO C E,et al. Screening of pectinase-producing microorganisms with polygalacturonase activity[J]. Applied Biochemistry and Biotechnology,2011,163 (3):383-392.
[31] CORDEIRO C A M, MARTINS M L L. Produção de poligalacturonase,pelo termofílico Bacillus sp. e algumas de suas propriedades[J]. Ciência e Tecnologia de Alimentos,2009,29(1): 135-141.
[32] KAPOOR M,BEG Q K,BHUSHAN B,et al. Production and partial purification and characterization of a thermo-alkalistable polygalacturonase from Bacillus sp. MG-cp-2[J]. Process Biochemistry,2000,36(5):467-473.
[33] 刘耀飞,常纪恒,于川. 烟梗中果胶的酶法降解[J]. 烟草科技,2013 (8):40-44.
[34] 杨慧芳. 降解烟梗果胶质微生物筛选及产果胶酶的研究[D]. 无锡:江南大学,2012.
[35] 阮昕,李彪,候读成,等. 超声波耦合酶反应去除烟梗中果胶和纤维素的工艺优化[J]. 贵州农业科学,2015,43(2):145-149.
[36] 王珍. 一种新型棉布载体在固定化米根霉发酵生产 L-乳酸的研究[D]. 重庆:重庆大学,2010.
Pectinase production with Rhizopus oryzae mycelium immobilized on cotton matrix and treatment of tobacco stem
HE Yuan,ZHENG Yuxi,PAN Jun,WANG Yuanliang
(Key Laboratory of Biorheological Science and Technology,Ministry of Education;Center of Bioinspired Material Science and Engineering;Bioengineering College,Chongqing University,Chongqing 400044,China)
Abstract:The use of pectinases causes less environmental pollution in tobacco stem fiber processing for the production of lactic acid,etc. The effective way to improve pectinase production and reduce cost is to use a new combined fermentation mode and optimize its conditions. Mycelia of Rhizopus oryzae were immobilized on the cotton matrix by immobilized cells technology developed in our laboratory. Conditions of pectinase production were optimized in culture medium of pectin or tobacco stem and the treatments of tobacco stem pectin were also optimized. The optimal fermentation conditions in pectin medium were rotary speed of 190r/min,liquid volume of 50mL/250mL,temperature of 30℃,pH value of 5,and spore concentration of 0.75×106/mL. The optimal fermentation conditions in tobacco stem medium were,pH value of 4.6,spore concentration of 0.5×106/mL,etc. Under the optimal treatment conditions of tobacco stem pectin,immobilized Rhizopus oryzae continuous processing method showed a better pectin degradation performance than the free pectinases processing method with the pectin degradation rate increased by 18.5%,up to 74.1%. Pectinase production with Rhizopus oryzae mycelium immobilized on the cotton matrix showed a higher pectinase production in pectin medium and better tobacco stem fiber degumming in tobacco stemfermentation.
Key words:Rhizopus oryzae;pectinase;immobilization;bio-degumming; tobacco stem
中图分类号:TQ 920.6
文献标志码:A
文章编号:1000-6613(2016)05-1494-08
DOI:10.16085/j.issn.1000-6613.2016.05.34
收稿日期:2015-11-10;修改稿日期:2015-12-24。
基金项目:国家自然科学基金(30870609)及重庆市自然科学基金重点项目(CSTC2012JJB90009)。
