实时电导率法测定乙酸乙酯皂化反应速率常数
2016-07-05柳明洙王一杉郑赖建豪高尔雅李丹彤朱肖淇鄢尤奇冯雪芝
张 毅 张 喆 柳明洙 李 锦 秦 燃 王一杉郑 炯 郑 申 赖建豪 陈 然 高尔雅 李丹彤朱肖淇 李 击 鄢尤奇 冯雪芝 赵 明,* 胡 新,*
(1北京中科泛华测控技术有限公司,北京100083;2北京大学基础医学院2011级,北京100191;3北京大学药学院,北京100191)
实时电导率法测定乙酸乙酯皂化反应速率常数
张毅1,§张喆1,§柳明洙1李锦1秦燃1王一杉1郑炯1郑申2赖建豪2陈然2高尔雅2李丹彤2朱肖淇2李击3鄢尤奇3冯雪芝3赵明3,*胡新3,*
(1北京中科泛华测控技术有限公司,北京100083;2北京大学基础医学院2011级,北京100191;3北京大学药学院,北京100191)
摘要:采用由电导率传感器、数据采集卡和个人计算机构成的模块化设计,以及基于LabVIEW 2013的虚拟仪器编程技术,建立了一套多通道的、并行的、实时的和自动化的电导率数据采集实验系统,使用该系统对经典的电导率法测定乙酸乙酯皂化二级反应速率常数实验进行了改革,提高了这一实验的教学效率。此项改革可以为今后其他经典化学实验改革提供参考。
关键词:化学反应速率常数;电导率;实时测定;并行测试;多通道测试
www.dxhx.pku.edu.cn
§共同第一作者
乙酸乙酯皂化二级反应速率常数测定是一个使用超过30年的经典大学物理化学教学实验,该实验自上世纪70年代以来被国内物理化学实验教科书广泛采用,此实验可见于北京大学化学系(现为化学及分子工程学院)上世纪80年代的《物理化学实验》和本世纪初的北京大学药学院《现代实验化学》教科书中[1-5]。该实验旨在通过测定乙酸乙酯在氢氧化钠作用下皂化过程的二级化学反应的速率常数,进而使得学生了解化学反应速率常数测定的原理和方法,以及温度对于化学反应速率的影响。以往的实验教学为两个学生一组,一位学生将乙酸乙酯溶液加入到某一恒定温度下放有氢氧化钠溶液的反应容器中,另外一位同学将电导率仪的电导电极放入反应容器中测定电导率并按下计时器开始记录反应时间,然后手写记录某一反应时刻和该时刻相对应的电导率数值,电导率数值用以标志皂化反应的进程。由于读取秒表时刻与该时刻相应的电导率值至少要有1秒钟的时间间隔,同时每次记录数据与下一次电导率数据读取要有一个较长的时间间隔,因此,这些时间间隔中的化学反应的数据会丢失,对于化学反应过程的细节观察是不全面的。
尽管如此,乙酸乙酯皂化二级反应速率常数测定仍然是一个成熟的物理化学实验,具有实验体系简单和稳定、实验结果易于重复、试剂和仪器成本较低的特点,特别是这个实验经过长时间的教学实践证实是一个有助于学生理解化学反应动力学基本概念的经典实验。因此,有必要对其通过自动化改革克服以上所述及的缺点,将其继续保留在物理化学实验教科书中。近半个世纪以来,大量的中外文献报道了对于乙酸乙酯皂化反应的反应器设计、测试技术和数据处理方法的改进。特别值得一提的是,自1997年以来,国内多所大学的不同学科的实验室自己设计和研发了电导率法测定乙酸乙酯皂化反应速率常数实验自动测控系统[6-9],其中2004年武汉大学化学及分子科学学院报道了他们使用由微机控制的电导率仪多通道采集数据系统改进此实验的工作。但是,这部分系统是专用系统,当时成本较高,并没有普遍应用于基础物理化学实验。
为此,北京大学药学院的教师与北京中科泛华测控技术有限公司的技术人员合作研发了一个多通道的、并行的、实时的和自动化的电导率数据采集实验系统,重新编写了实验讲义,并将该实验更名为“实时电导率测量法测定乙酸乙酯皂化二级反应速率常数”,然后由6位北京大学基础医学院在校学生组成的小组对改革后的实验进行教学实施前的测试,测试包括使用新的自动化数据采集系统测定不同温度下乙酸乙酯皂化二级反应速率常数,同时将改革后所得结果与以往的方法所得结果进行对比,最后填写实验改革效果的调查问卷,得到了比较令人满意的效果。
1 实验原理和方法
1.1电导率法测定乙酸乙酯皂化反应速率常数的原理
乙酯乙酯被氢氧化钠皂化(水解)的化学反应方程式为:

乙酸乙酯皂化反应速率是与两种反应物乙酸乙酯( cA)和氢氧化钠( cB)浓度相关的二级化学反应,k为反应速率常数,单位为L∙mol-1∙min-1,其反应速率表达为:

如果两个反应物乙酸乙酯(A)、氢氧化钠(B)的初始浓度分别为cA0和cB0,t时间后有ct量的反应物参与反应,t时刻的反应速率以产物的形式表示为:

如果将A、B两物质的起始浓度设计成相等,即cA0= cB0,则

对式(3)进行积分变换后表示为:

以1/ ct对1/t作图可拟合成一直线,从拟合所得直线的斜率即可求出皂化反应速率常数k。
氢氧根离子和乙酸乙酯为反应物质,随着皂化反应的进行,氢氧根离子浓度逐渐降低,形成部分电离的弱电解质醋酸和乙醇,总的离子浓度逐渐降低,导致溶液的总电导率不断下降。因此,可以通过溶液的电导率数值的变化跟踪皂化反应的进程。
在稀溶液中,强电解质的电导率κ与该电解质的浓度成正比,溶液的总电导率等于组成溶液的各电解质的电导率之和。乙酸乙酯在氢氧化钠溶液中的皂化涉及的氢氧化钠和醋酸钠都是强电解质,若乙酸乙酯和氢氧化钠初始浓度很小且相等,反应的初始浓度设为a,κ0和κ∞分别为反应开始和结束时溶液的电导率,κt为t时刻溶液的总电导率,则:

其中A1、A2是与温度、溶剂、电解质的性质有关的比例常数。
将式(4)、式(5)两式处理后可以得出:

实验中只要实时测定出一系列不同时刻t的电导率κt,以κt对作图,从斜率和初始浓度cA0即可求出反应速率常数k。
1.2虚拟实时电导率测定原理
传统的台式仪器可分为测试资源、数据处理单元和供电单元,测试资源又可以根据功能不同分为传感器、信号调理电路和模数转换电路等。虚拟仪器技术以测试数据为核心,将传统的台式仪器测试资源中的一部分信号调理电路、模数转换电路单独分离出来组成板卡模块,通过高速总线结合计算机技术强大的数据处理能力,并配以更为坚固稳定的机械结构和供电单元,使得仪器仪表获得前所未有的灵活性(图1)。

图1 虚拟仪器的通用架构
模块化软硬件的仪器设计思想有3方面优势:其一,测试资源不变,通过选择不同的传感器,并设计不同的控制软件,可以用较低的费用实现多种仪器功能;其二,所有模块均为商用货架产品,通用性强,在损坏时易于更换,因此维护费用低;其三,相比传统定制化仪器,虚拟仪器具有随时可更改的控制软件,使得仪器功能更为丰富,基于测试数据的分析处理更为灵活,添加、删减功能易如反掌。
在教学实践中,需要根据不同课程的需求搭建不同的实验平台,实验数据的获得离不开测量仪器,以往的测试方案是专用的和固化的,这导致了核心测试资源的高度重复,造成了资金浪费。虚拟电导率实验系统基于虚拟仪器这一概念研制开发,传感器由基于交流电桥法测试电导率的CM-230工业在线电导监视仪(北京艾凡鹏仪表有限公司)改装而成;核心器件采用中科泛华测控技术有限公司研发的nextkit nano便携式USB数据采集卡,其主要作用是将前端传感器感应到的模拟电压信号转化为数字信号供计算机存储及分析;在计算机中,利用LabVIEW编写程序实现对nextkit nano的灵活控制(图2)。
基于本实验系统,当测试需求改变时,比如需要增加多路温度的测试,只需增加相应的传感器,再根据测试需求简单修改软件,毋须再购置计算机及数据采集设备,即可变换功能形成一套新的实验系统[10-13]。
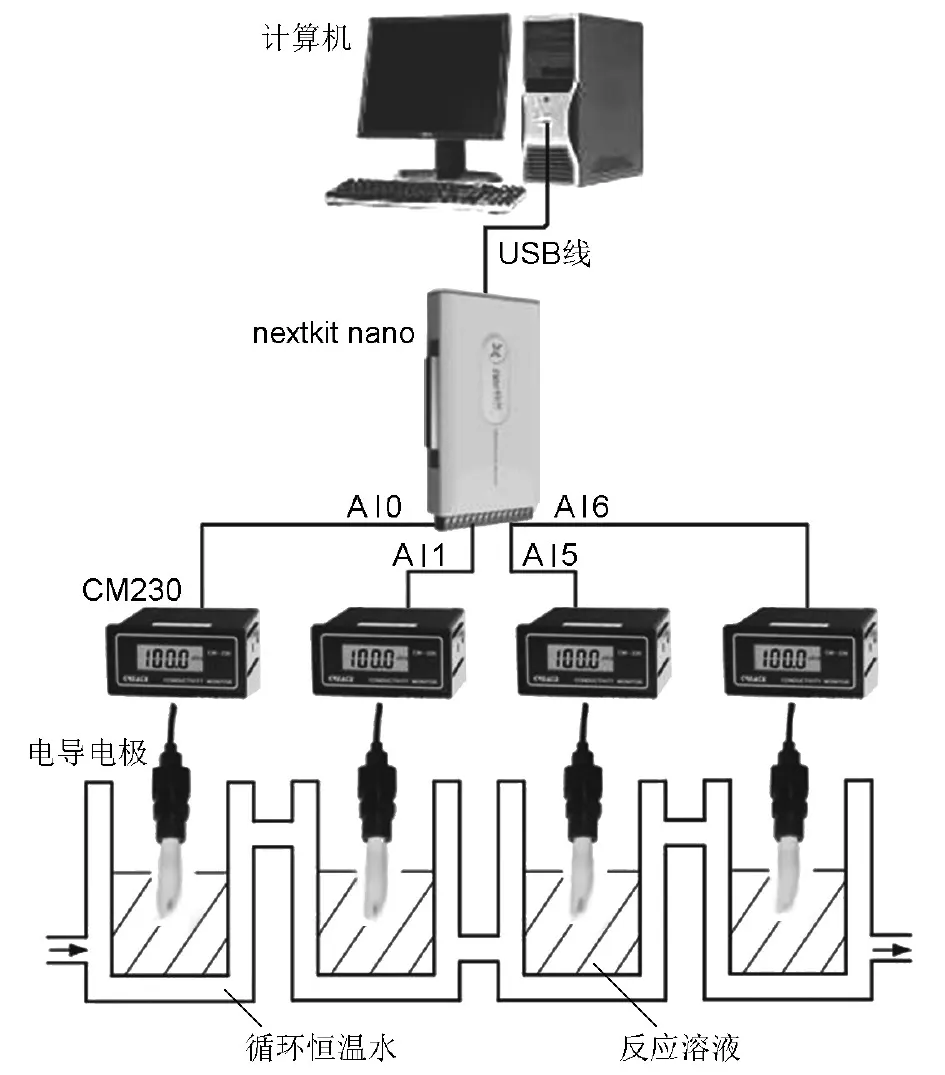
图2 模块化实时虚拟电导率测定实验系统nextkit nano-nextmed-01示意图
2 结果与讨论
2.1实验系统的设计
自行设计的模块化实时虚拟电导率实验系统nextkit nano-nextmed-01示意图见图2。该系统可以同时4路(也可以更多通道)并行实时测试电导率数据,nextkit nano数据采集卡的4个数据采集通道AI0、AI1、AI5、AI6接口分别连接4个电导率测试传感器(CM-230温度补偿型电导率测试仪,测量误差在±2%),使用LabVIEW 2013(美国国家仪器公司)编程的实时电导率数据采集软件安装于个人计算机(Windows7操作系统,美国微软公司),采集的实时电导率数据储存在EXCEL文件里。恒温系统为串联式恒温槽(SC-15数控超级恒温槽,宁波新芝生物科技股份有限公司)。测试时只需点击界面上“开始测试”即可。可以选择数据采集的时间间隔以及数据采集通道,测试结束后还可以通过回放数据导出电导率数据。
2.2测定系统的校准
本项研究分别使用自行设计的nextkit nano-nextmed-01实时电导率虚拟测试系统的两个不同传感器及通道AI0、AI5和以往使用的DDSJ-308型电导率仪(雷磁仪器厂,上海精密科学仪器有限公司,测量误差±0.5%)测定乙酸乙酯在氢氧化钠作用下皂化过程的电导率数据,因此,本文以后的叙述中,涉及以往的电导率测定方法简称为“传统法”,虚拟仪器方法简称为“虚拟仪器法”。
在测定之前,使用去除二氧化碳的去离子水配制了浓度为0.00100、0.00500、0.0100、0.0200 mol∙L-1KCl基准溶液,对两个测试系统进行电导率数值的校准。由于不同的电导率数据测试范围的电导池常数并不一样,因此,参考IUPAC和国外其他实验室提供的不同温度(25.0、30.0、35.0°C)下的纯水(0.055、0.071、0.090 μS∙cm-1)、0.0100 mol∙L-1KCl水溶液(1413、1552、1688 μS∙cm-1)和0.0200 mol∙L-1KCl水溶液(2765、3036、3312 μS∙cm-1),0.00100、0.00500 mol∙L-1KCl水溶液(146.88、717.4 μS∙cm-1,25.0°C)电导率数据[14-17]得到图3及图4的电导率校准线和表1所示的电导率校准拟合公式。从结果可以看出,校准线并非一条通过原点的直线,校正参数的不同可能源于电导率传感器、数据采集系统与标准数值测定系统的差别。即使使用同一虚拟电导率数据采集系统的两个并行测试的通道也存在差异。
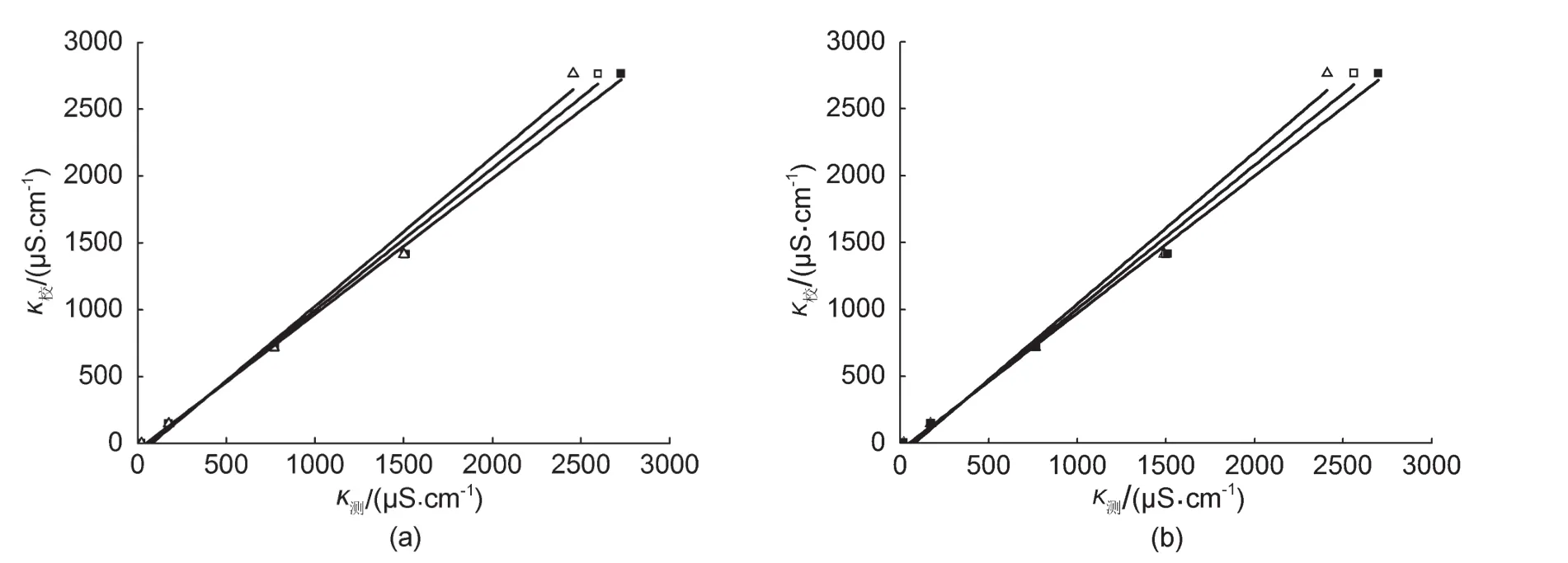
图3 nextkit nano-nextmed-01 AI0通道(a)与AI5通道(b)的电导率测定校准线■25.0°C,□30.0°C,Δ 35.0°C
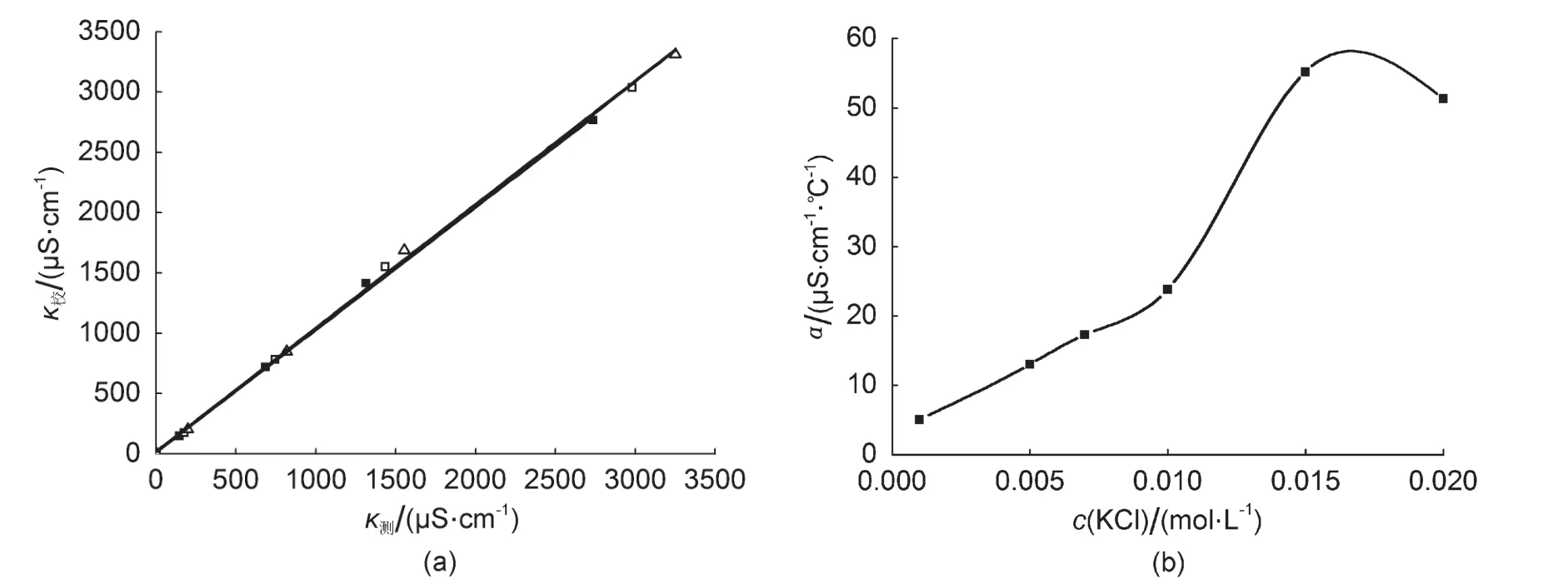
图4 (a) DDSJ-308型电导率仪测定校准线(■25.0°C,□30.0°C,Δ 35.0°C);(b) 25.0-35.0°C之间,使用DDSJ-308型电导率仪测得不同浓度的KCl水溶液的电导率温度系数
由于虚拟仪器系统采用了CM-230温度补偿型电导率传感器,在不同温度下虚拟仪器法的电导率值以25.0°C时的标准值为参考值进行校准。实验发现,DDSJ-308型电导率仪在不同浓度的KCl溶液中具有不同的温度系数(图4(b)),对于不同范围的电导率数值采用不同的电导率温度系数计算其在25.0°C时的电导率,计算公式为:
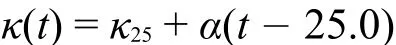
其中κ(t)为温度为t°C时的电导率;κ25为25.0°C时的电导率;t为温度(°C);α为电导率温度系数(μS∙cm-1∙°C-1)。
使用传统法测定电导率时采用非温度补偿方式,除了需要做出不同温度下相对于标准值校正外,还要做出温度补偿的校正,即从κ(t)、α、t计算出κ25。

表1 两种不同的测定方法在不同温度下的电导率校正公式
2.3虚拟仪器法测定乙酸乙酯皂化反应速率常数
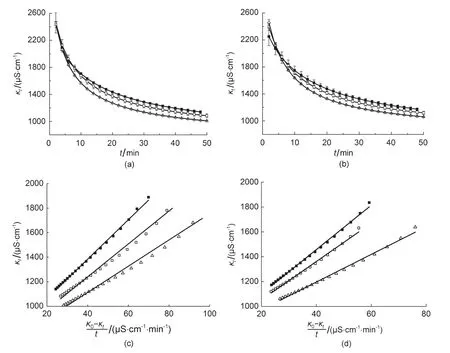
图5 虚拟仪器法AI0通道(a)与AI5通道(b)的实时电导率曲线(数据点为同样温度下3次平行实验(n = 3)测定的相同时刻电导率的平均值±平均标准偏差)及AI0通道(c)与AI5通道(d)测得的κt-(κ0-κt)/t图及拟合直线
分别在25.0、30.0、35.0±0.1°C恒温条件下使用虚拟仪器测试系统的两个通道AI0、AI5并行测定了乙酸乙酯皂化反应的实时电导率曲线(图5(a)、图5(b))。恒温条件下分别使用两支移液管将20.00 mL浓度为0.0183 mol∙L-1的乙酸乙酯水溶液加入到已在相同温度下恒温的两份20.00 mL等浓度(0.0183 mol∙L-1)的NaOH水溶液中,待反应液初步混合后开始使用两个传感器及测试通道(AI0、AI5)并行测定两份反应液的实时电导率κt,数据采集的时间间隔为2 min。从图5(a)和图5(b)的结果可以看出,同样温度下电导率随时间下降,较高温度电导率值低于较低温度的值,说明温度升高反应速率加快。从图5(c)与图5(d)以及表2与表3可以看出,κt与(κ0-κt)/t呈现出直线相关的关系,从拟合直线斜率计算出的乙酸乙酯皂化反应速率常数随着温度的升高而增大,两个不同通道的测定结果接近。κ0为0时刻反应溶液的电导率,其数值为稀释一倍后的NaOH溶液(0.00915 mol∙L-1)的电导率。图中所有数值均使用基准KCl水溶液校正。CM-230电导率传感器是温度补偿型的电导率测定传感器,结果主要显示了温度升高对于乙酸乙酯皂化反应速率的影响所导致的电导率的变化。

表2 两种不同方法在不同温度下的拟合直线方程
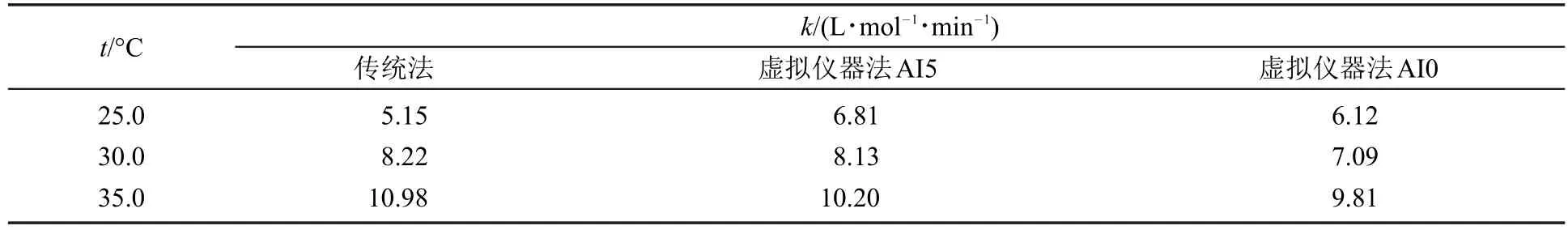
表3 两种不同方法测得的乙酸乙酯皂化反应速率常数k
2.4传统法测定乙酸乙酯皂化反应速率常数
为了比较实时电导率虚拟测定系统与以往方法测定乙酸乙酯皂化反应速率常数结果的差别,分别在25.0、30.0、35.0±0.1°C恒温条件下使用移液管将20.00 mL浓度为0.0183 mol∙L-1的乙酸乙酯水溶液加入到已在相同温度下恒温的20.00 mL等浓度NaOH(0.0183 mol∙L-1)水溶液中,待两溶液初步搅拌混合后即打开秒表计时,然后分别在不同时刻使用DDSJ-308型电导率仪测试并记录电导率值(图6 (a))。由图6(a)可以看出,电导率随时间延长呈现下降趋势,温度升高时化学反应速率增大,电导率也随之降低,图中所示为经过温度补偿校正后的电导率。由于电导率测定在非温度补偿型的条件下进行,观察到的电导率数值是由于温度上升皂化反应速率加快所导致的电导率下降和由于温度上升所导致的电导率值上升两者叠加的结果,经过温度补偿的校正后,可以看出仅仅由于温度上升时化学反应速率增加导致的电导率的变化值。
从图6(b)和表2与表3的结果可以看出,κt-(κ0-κt)/t为线性关系,从拟合直线斜率计算出的乙酸乙酯皂化反应速率常数随着温度的升高而增大。
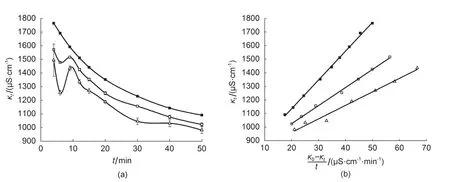
图6 (a)使用传统方法得到的电导率-时间图线,数据点为同样温度下三次平行实验(n = 3)测定的同样时刻电导率的平均值±平均标准偏差;(b)κt-(κ0-κt)/t图及拟合直线
2.5空气中二氧化碳气体对电导率测定的影响
图7为没有乙酸乙酯时NaOH水溶液的电导率κ0。实验发现,κ0有一个逐步下降最后达到稳定数值的过程,即使是使用温度补偿法测定或作过温度补偿校正的电导率数值也会随着温度升高而上升,可能是因为在乙酸乙酯皂化反应过程中,二氧化碳被NaOH水溶液吸收,进而影响到电导率的测定值。
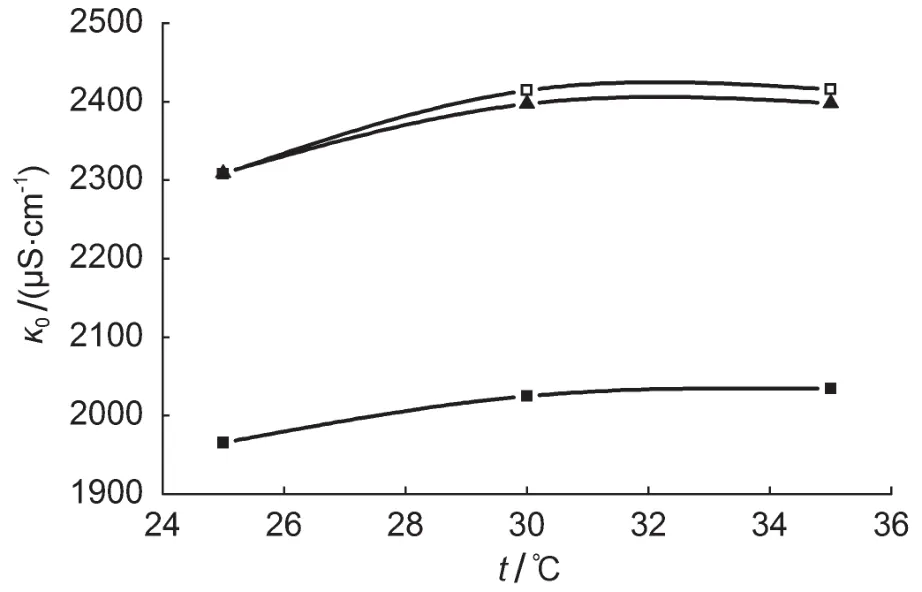
图7 不同温度下未加入乙酸乙酯的NaOH水溶液(0.00915 mol∙L-1)的电导率κ0
2.6虚拟仪器法与传统方法结果的比较
据文献报道[9,18,19],25.0°C时,k = 6.42 L∙mol-1∙min-1;30.0°C时,k =8.68 L∙mol-1∙min-1;35.0°C时,k =10.5 L∙mol-1∙min-1,可以看出,大部分虚拟仪器法测得速率常数与文献值接近。
本实验计算出的活化能为:传统法(57.9 kJ∙mol-1),虚拟仪器法(AI0:30.8 kJ∙mol-1,AI5:35.9 kJ∙mol-1),虚拟仪器法的活化能值更接近文献值(33.24 kJ∙mol-1)[20]。
3 实验改革效果的调查
本实验由北京大学基础医学院2011级6位在校学生使用两种不同方法测定了乙酸乙酯皂化反应速率常数,最后对6人各发放一份教学改革效果调查表,其中提出了9个调查问题,大部分学生认为:使用虚拟仪器法实验改革后实验效率提高,虽然使用不同方法测定所使用实验时间几乎一样(9±1小时),虚拟仪器法在自动测试数据的50分钟时间内,毋须不停地看计时器和手写记录电导率数据,实验改革后所得速率反应常数与传统法的结果比较接近。同时也指出,由于加入乙酸乙酯溶液的步骤没有完全自动化,不同的组别必须手动同步加入,这可能是导致不同通道测定结果差别的原因。此外,由于虚拟仪器法更为灵敏,所测定的电导率数值会出现由于电极极化和温度对测定影响导致的实时变化,看起来似乎传统法数据更易于重复。
4 结论
使用自行设计和安装的自动化的虚拟仪器电导率数据采集系统对经典的电导率法测定乙酸乙酯皂化二级反应速率常数教学实验进行了改革。此项改革可以得到更多的实时的电导率数据,还可以将电导率数据直接保存在EXCEL文件中使得数据处理更为容易。改进后的方法所得化学反应速率常数与经典法结果相近,其差别源于两种不同测试系统的差异。因此,虚拟仪器电导率测试法可以提高实验教学效率,有望替代传统的教学实验方法。本项教学改革研究还在跨学科合作和产学研结合的教学改革模式上做出了一些尝试,可以为以后其他经典化学实验教学改革提供借鉴和帮助[21]。
今后将通过加入溶液加样和混合的自动化模块实现此经典实验的全面自动化,以克服目前存在的实验初始阶段溶液混合不均匀以及不同通道测试不容易同步的缺陷。
参考文献
[1]复旦大学主编.物理化学实验(上册).北京:北京人民教育出版社, 1979.
[2]曾慧慧,刘俊义.现代实验化学(上册).北京:北京大学医学出版社, 2004.
[3]崔广华,崔文权.物理化学实验.北京:中国计量出版社, 2008.
[4]北京大学化学院物理化学实验教学组.物理化学实验.第4版.北京:北京大学出版社, 2008.
[5]南京大学化学化工学院.物理化学实验.北京:高等教育出版社, 2010.
[6]王锐,吕祖舜,张云奎.大学化学, 1997, 12 (1), 40.
[7]赵文龙,陆秉娟,颜流水,王承宜,湛建生.实验技术与管理, 1998, 15 (2), 37.
[8]汪永涛,张文清,侯若冰,义祥辉,方芳.广西师范大学学报(自然科学版), 2001, 19 (3), 50.
[9]况黎,吴玲.大学化学, 2004, 19 (4), 39.
[10]裴峰,杨万生.计算机与应用化学, 2004, 21 (4), 619.
[11]刘赵荣,王玉春,薛海霞,习艳妮.山西大同大学学报(自然科学版), 2009, 25 (6), 41.
[12]李将渊,刘赵荣,王玉春,蔡铎昌.计算机与应用化学, 2005, 22 (10), 918.
[13]张喆,郑宾.伺服控制, 2013, No. 1, 53.
[14] ASTM Standard D 1125-95,ASTM International, West Conshohocken, PA, USA, 2009.
[15] Pratt, K. W.; Coch, W. F.; Wu, Y. C.; Berezensky, P.A. Pure Appl. Chem. 2001, 73 (11), 1783.
[16] Conductivity Theory and Practice. Radiometer Analytical SAS, France 2004-05B.
[17] David, R. L. CRC Handbook of Chemistry and Physics, 73rd ed.; CRC Press: Boca Raton, Florida, 1992-1993; pp5-110.
[18]傅献彩,陈瑞华.物理化学.第3版.北京:人民教育出版社, 1982.
[19]朱长缨.华中师范大学学报, 1985, No. 3, 125.
[20]БapoH, H. M.物理化学简明手册.周振华,译.上海:上海科学技术出版社, 1964.
[21]赵明.大学化学, 2011, 26 (1), 7.
∙化学实验∙
Determination of the Second-Order Rate Constant for the Saponification of Ethyl Acetate by Real-Time Conductivity Measurements
ZHANGYi1,§ZHANG Zhe1,§LIUMing-Zhu1LI Jin1QINRan1WANGYi-Shan1ZHENG Jiong1ZHENG Shen2LAI Jian-Hao2CHEN Ran2GAOEr-Ya2LI Dan-Tong2ZHU Xiao-Qi2LI Ji3YANYou-Qi3FENG Xue-Zhi3ZHAO Ming3,*HU Xin3,*
(1Beijing Zhong Ke Fan Hua Measurement & Control Technology Co., Ltd, Beijing 100083, P. R. China;2School of Basic Medicine, Peking University, Beijing 100191, P. R. China;3School of Pharmaceutical Sciences, Peking University, Beijing 100191, P. R. China)
Abstract:Determination of the second-order rate constant for the saponification of ethyl acetate has been a classical experiment in the physicochemical laboratory course for more than thirty years. In this paper, a new measurement system composed of the conductivity sensor and the computer equipped with the Nextkit Nano data acquisition card programmed with LabVIEW 2013, has been designed and constructed for multi-channel, parallel, real-time, and automatic acquisition of conductivity data. This setup has improved the teaching efficiency, and sets up an example for the future reforms of other classical experiments in chemical laboratory courses.
Key Words:Rate constant of chemical reactions; Conductivity; Real-time measurement; Parallel measurement; Multi-tunnel measurement
中图分类号:O6-3;G64
doi:10.3866/PKU.DXHX20160355
*通讯作者,Email: sunmoonzhao@bjmu.edu.cn; huxinbjmu@bjmu.edu.cn
基金资助:北京大学药学院教学改革项目
