产直链脂肽类抗菌物质枯草芽孢杆菌HS-A38的生物学特性
2016-06-22马树瑞,丛丽娜,孙蕾,李成,王岩,张欢,张齐
马 树 瑞, 丛 丽 娜, 孙 蕾, 李 成, 王 岩, 张 欢, 张 齐
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
产直链脂肽类抗菌物质枯草芽孢杆菌HS-A38的生物学特性
马 树 瑞,丛 丽 娜,孙 蕾,李 成,王 岩,张 欢,张 齐
( 大连工业大学 生物工程学院, 辽宁 大连116034 )
摘要:以从海参肠道中筛选的枯草芽孢杆菌HS-A38为目的菌株,分析了其生长特性、产酶特性、抑菌活性及其产生抗菌活性物质的能力。结果表明,培养时间为36~38 h时芽孢出芽率最高,该菌株具有较强的抑菌作用,并具有产生蛋白酶、脂肪酶、淀粉酶和果胶酶的能力。从该菌株的发酵后上清液中提取得到2种具有抗菌活性的化合物,初步推断这2种物质为直链脂肽类抗菌物质。
关键词:枯草芽孢杆菌;抗菌活性;脂肽类抗菌物质
0引言
枯草芽孢杆菌广泛分布于自然界中,如土壤,湖泊,海洋,植物组织,动物类诸如猪肠道、鸡肠道、对虾胃肠道中。枯草芽孢杆菌无致病性,可分泌多种酶和抗生素。枯草芽孢杆菌具有良好的发酵基础[1],在水质处理、医药、食品、饲料工业等众多领域都具有广泛的应用[2]。枯草芽孢杆菌是农业部公布的12种饲料级微生物添加剂之一,可直接饲喂动物[3],不仅能够促进动物健康生长,又可降低抗生素的用量[4]。刘雪等[5-6]报道了枯草芽孢杆菌由核糖体合成途径产生的抗菌物质,如细菌素、酶类、活性蛋白质类以及非核糖体合成途径产生的抗菌物质,如脂肽类、多肽类等。近年来,多种枯草芽孢杆菌的抗菌活性物质已经从其代谢产物中分离纯化出来[7-8],研究人员对其结构组成、作用机理进行了详细介绍,为枯草芽孢杆菌在植物病虫害生物防治中的应用提供了参考。课题组从大连海域海参肠道中筛选得到了一株枯草芽孢杆菌HS-A38,本实验对该菌株的生长特性、酶学性质以及产活性物质进行了初步研究。
1材料和方法
1.1材料
1.1.1菌株
枯草芽孢杆菌HS-A38,实验室分离,16SrDNA序列在GenBank数据库检索号为GQ466597。
指示菌:金黄色葡萄球菌(Staphylococcus aureus)、溶壁微球菌(Micrococcus lysodeikticus)、副溶血性弧菌(Vibrio parahaemolyticus)、铜绿假单胞菌(Pseudomonas aeruginosa),实验室分离保存。
1.1.2培养基
种子液培养基:酵母膏1g/L,蛋白胨5g/L,磷酸铁0.1g/L,pH7.2。
菌株HS-A38发酵培养基:牛肉膏15g/L,葡萄糖10g/L,K2HPO45g/L,pH7.2。
HS-A38固体培养基:在发酵培养基中加入1.5%的琼脂粉。
指示菌液体培养基:牛肉膏3g/L,蛋白胨10g/L,氯化钠5g/L,pH7.2~7.4。
指示菌固体培养基:在发酵培养基中加入1.5% 的琼脂粉。
1.2方法
1.2.1菌株HS-A38生长特性测定
菌株形态:将保存的HS-A38菌株在固体培养基上30 ℃ 培养24h,观察菌落形态。挑取培养基上的单菌落进行革兰氏染色,在显微镜下进行菌株形态观察。
生长曲线:将保存在斜面上的菌种挑取少许接入10mL的种子液培养基中,在30 ℃、转速160r/min条件下培养16h即为种子液。将活化后的HS-A38菌株的种子液按5%的体积分数接入50mL发酵培养基中,在30 ℃、160r/min的条件下摇床培养,每隔4h取样,用分光光度计测吸光值OD600。横坐标为培养时间,纵坐标为OD600测量值绘制菌株HS-A38的生长曲线。
出芽孢时间:将菌株HS-A38在发酵培养基中培养,每隔4h取样,用电子显微镜观察其出芽孢情况。
1.2.2菌株HS-A38发酵液抑菌谱测定
采用管碟法[9]测定菌株HS-A38发酵液对指示菌的抗菌活性。取100μL指示菌培养液,均匀涂布在指示菌固体平皿培养基上,抑菌平板上放置灭过菌的牛津杯,分别取200μL菌株HS-A38的发酵上清液加入牛津杯中,于37 ℃过夜培养,观察测量抑菌圈。
1.2.3菌株HS-A38产酶特性测定
蛋白酶活力:采用福林法[10]测定。1mL上清液在pH8.0、40 ℃,每分钟水解酪蛋白产生1mol酪氨酸的酶量为1个酶活力单位(U)。
脂肪酶活力:采用p-NPP法[11]测定。1mL上清液在pH7.0、37 ℃,每分钟水解p-NPP并释放1molpNP的酶量为1个酶活力单位(U)。
淀粉酶活力:采用碘指示法[12]测定。1mL上清液在pH6.0、40 ℃,每分钟水解1mg淀粉所需的酶量为1个酶活力单位(U)。
纤维素酶活力:测定采用DNS法[13]测定。1mL上清液在pH5.4、37 ℃,每分钟从4mg/mL的羧甲基纤维素钠溶液中产生1μmol还原糖的酶量为1个酶活力单位(U)。
果胶酶活力:采用DNS法[14]测定。1mL上清液在pH4.8、40 ℃,每分钟水解果胶产生1μg半乳糖醛酸的酶量为1个酶活力单位(U)。
1.2.4菌株HS-A38产活性物质的初步检测
抗菌粗品制备:发酵液1 000mL经8 000r/min离心20min得到上清液,用6mol/L的HCl调节上清液pH至2.0,4 ℃静置过夜;将上清液离心后保留沉淀,再用甲醇充分溶解沉淀,过滤得到棕色液体提取物;蒸干提取物,丙酮溶解得到黄色液体产物,再向其中加入饱和正丁醇萃取,萃取3次,取出正丁醇层,将正丁醇层在旋转蒸发仪中蒸干得到浅棕色固体粗提物。
取蒸干得到的粗提物0.1g溶于2mL甲醇中混匀;取5μL样品在薄层层析(TLC)分析板上点样,在层析缸中展开。展开剂为氯仿-甲醇-水(V(氯仿)∶V(甲醇)∶V(水)=65∶25∶4),0.5%茚三酮水溶液染色。
活性化合物的分离及检测:采用制备型层析板制取技术分离TLC板上的2种化合物(P1和P2)。取甲醇溶解粗品液100μL,在板上每点10μL点样;在层析缸中展开,展开剂为氯仿-甲醇-水(V(氯仿)∶V(甲醇)∶V(水)=65∶25∶4),干燥;选定茚三酮显色区域,在TLC板上确定2种化合物的位置,刮取与此显色位置对应的制备板区域的硅胶,用甲醇充分溶解,通过离心去除硅胶粉,得到待检测的物质P1和P2。以原粗提物甲醇溶解液为对照,与刮取后分离的提取物一起在TLC板点样分析。
将分离得到的2种化合物甲醇溶解液用微孔过滤膜过滤除菌,在常温下使甲醇挥发,得到的化合物P1和P2。取适量无菌水将化合物P1和P2溶解,并用无菌水作为空白对照,采用滤纸片法检测其对副溶血弧菌的抑菌活性[15]。参照文献[16]对化合物P1和P2进行双缩脲反应检测。
2结果与分析
2.1菌株HS-A38生长特性
2.1.1菌株形态特征
菌落形态特征(图1(a)):单菌落圆形,表面光滑,隆起,不透明,乳白色,边缘整齐,有一定黏度。在显微镜下观察经革兰氏染色后的菌株(图1(b)),发现HS-A38为革兰氏阳性菌,菌体呈杆状,芽孢位于菌体中央或微偏一侧。

图1 HS-A38的菌落形态和细胞形态
2.1.2生长曲线
在一定条件下液体培养菌株HS-A38,根据相应发酵时间取样测得菌体吸光值,绘制菌株的生长曲线。生长拟合曲线为y=-2.836x4+0.003x3-0.088x2+1.243x+0.043。由图1可知菌株HS-A38发酵基本无延迟期,迅速进入对数期,6h后进入稳定期,36h后进入衰亡期。
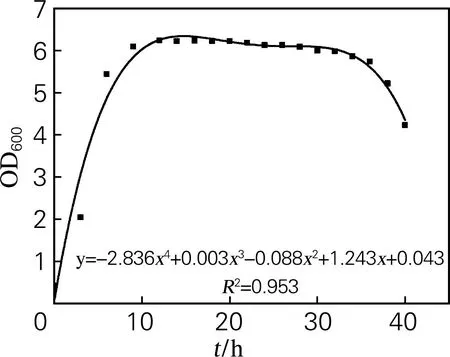
图2 菌株HS-A38的生长曲线
2.1.3芽孢形成时间
每4h对菌株HS-A38培养液进行取样,在显微镜下观察其出芽孢情况。培养到36~40h时,每个细胞几乎都产生了芽孢。由菌株HS-A38生长曲线可知,培养36h时生长状态处于稳定末期,尚未处于衰亡期。因此可以确定,若将HS-A38菌株开发成益生菌微生态制剂,选择培养时间36~38h较为适宜;在此条件下制成的微生态制剂其芽孢比率高,能够保持枯草芽孢杆菌的活性和稳定性,利于运输保藏。
2.2菌株HS-A38发酵液抑菌谱
采用管碟法对菌株HS-A38的发酵液进行抑菌活性检验。抗菌活性结果(表1)表明,该发酵液分泌的代谢物质不仅对以金黄色葡萄球菌和溶壁微球菌为代表的革兰氏阳性菌有很强的抑制作用,而且对以铜绿假单胞菌和副溶血性弧菌为代表的革兰阴性菌也具有较好的抑菌作用。


表1 菌株HS-A38发酵上清液的抑菌活性
2.3菌株HS-A38产酶特性
由表2可以看出,枯草芽孢杆菌HS-A38具有分泌脂肪酶、蛋白酶和淀粉酶的能力,不具备分泌纤维素酶的能力。该菌株分泌的这些消化酶,对降解动植物性饲料中复杂有机物、促进消化吸收、提高饲料利用率非常有利。


表2 枯草芽孢杆菌HS-A38酶活力
2.4菌株HS-A38产直链脂肽活性物质
该菌株发酵后的上清液经盐酸沉淀、有机溶剂提取后,在TLC板上经展层剂展开、再经茚三酮染色后,可以观察到几个分离的化合物点。再用制备型的层析板将其中2个化合物点分离并纯化,命名为化合物P1和P2(图3A)。将纯化的P1和P2液体样品点样至含有副溶血弧菌为指示菌平板的小滤纸片,该平板经培养后发现,作为对照组的无菌水的周围并没有抑菌圈的出现而化合物P1和P2的周围出现了抑菌圈(图3B),从而证明化合物P1和化合物P2具有抗菌活性。
经检测化合物P1和P2对蛋白酶K不敏感。这2个化合物的茚三酮反应均呈阳性,说明它们含有自由N-端。在用酸水解后,茚三酮反应和双缩脲反应呈阳性,所以推测它们可能为直链的肽类化合物[17-18]。

A:TLC图谱(a—抗菌粗品)
3结论
菌株HS-A38分离来自海参肠道,属于枯草芽孢杆菌(B. subtilis)。通过测定菌株HS-A38的生长曲线和在电子显微镜下观察其出芽孢的情况发现,发酵培养36h时发酵液的菌体浓度最高,且此时的细胞几乎全部出现了芽孢,因此确定以发酵时间36~38h为该菌株的最适培养时间。通过抑菌试验检测,枯草芽孢杆菌对以金黄色葡萄球菌和溶壁微球菌为代表的革兰氏阳性菌以及对以铜绿假单胞菌和副溶血性弧菌为代表的革兰阴性菌均具有较好的抑菌作用。通过检测枯草芽孢杆菌发酵液的酶活,发现其具有分泌蛋白酶、脂肪酶、淀粉酶、果胶酶活性的能力,尤其是脂肪酶活力较高,不分泌纤维素酶。另外,从该菌株发酵液提取的粗品中分离得到2种物质P1和P2,通过印三酮显影技术及双缩脲反应结果,初步推断这2种物质为一类直链脂肽类化合物,并且发现它们对副溶血弧菌具有明显的抑制作用。
参考文献:
[1] 张欢,丛丽娜,侯英敏,等.响应面法优化海洋枯草芽孢杆菌HS-A38增殖发酵培养基[J].大连工业大学学报,2012,31(1):19-23.
[2]ZHANGY,MUJ,GUX,etal.Amarinesulfate-reducingbacteriumproducingmultipleantibiotics:biologicalandchemicalinvestigation[J].MarineDrugs, 2009, 7(3): 341-354.
[3] 胡东新,潘康成.微生态制剂及其作用机理[J].中国饲料,2001(3):14-16.
[4]ISOLAURIE,SALMINENS,OUWEHANDAC.Microbial-gutinteractionsinhealthanddisease.probiotics[J].BestPractice&ResearchinClinicalGastroenterology, 2004, 18(2): 299-313.
[5] 刘雪,穆长青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006,22(增刊):179-184.
[6]TAMEHIRON,OKAMOTO-HOSOYAY,OKAMOTOS,etal.Bacilysocin,anovelphospholipidantibioticproducedbyBacillus subtilis 168[J].AntimicrobialAgentsandChemotherapy, 2002, 46(2): 315-320.
[7] 杨永青,谢远红,张红星,等.枯草芽孢杆菌C3抗菌物质发酵条件优化[J].中国酿造,2014,33(3):28-31.
[8] 别小妹,吕凤霞,陆兆新,等.枯草芽孢杆菌fmbR抗菌物质稳定性研究[J].食品科学,2006,27(6):104-108.
[9] 孟立花,李社增,郭庆港,等.枯草芽孢杆菌NCD-2菌株抗菌蛋白初步分析[J].华北农学报,2008,23(1):189-193.
[10] 王福荣,庞玉珍.福林-酚试剂法测定蛋白酶活力的条件试验[J].中国调味品,1981,12(1):21-24.
[11]SUZNKIT,NAKAYAMAT,KURIHARAT,etal.Acold-activeesterasewithasubstratepreferenceforvinylestersfromapsychrotroph, Acinetobactersp.strainno. 6:genecloning,purification,andcharacterization[J].JournalofMolecularCatalysisB:Enzymatic, 2002, 16(5/6): 255-263.
[12] 荣俊,杨待建,伍晓雄.加酶饲料中淀粉酶总活力的测定——碘淀粉比色法[J].饲料业,1994,15(3):40-42.
[13] 杨涛,马美湖.生物质降解酶酶活的测定方法[J].中国酿造,2006(11):67-69.
[14] 宋志军,纪重光.现代分析仪器与测试方法[M].杨陵:西北农业大学出版社,1994.
[15]HOLMQUISTM.Alpha/beta-hydrolasefoldenzymes:structures,functionsandmechanisms[J].CurrentProtein&PeptideScience, 2000, 1(2): 209-235.
[16] 北京大学生物系生物化学教研室.生物化学实验指导[M].北京:人民教育出版社,1982.
[17]STEINT. Bacillus subtilisantibiotics:structures,synthesesandspecificfunctions[J].MolecularMicrobiology, 2005, 56(4): 845-857.
[18] 邓建良,刘红彦,王鹏涛,等.生防芽孢杆菌脂肽抗生素研究进展[J].植物保护,2010,36(3):20-25.
BiologicalcharacteristicsofBacillus subtilisHS-A38producinglinearlipopeptideantibacterialsubstance
MAShurui,CONGLina,SUNLei,LICheng,WANGYan,ZHANGHuan,ZHANGQi
(SchoolofBiologicalEngineering,DalianPolytechnicUniversity,Dalian116034,China)
Abstract:Bacillus subtilis HS-A38 was isolated from the sea cucumber intestine and its growth characteristic, produced enzyme, antibacterial activity and the ability of producing antimicrobial substances were analyzed. The results showed that the maximum budding rate was present at 36-38 h. It was shown that the strain had excellent antimicrobial effect and could produce protease, lipase, amylase and pectinase. Two antimicrobial compounds were isolated from the supernatant after fermentation, and were preliminarily deduced to be straight-chain lipopeptide.
Key words:Bacillus subtilis; antibacterial activity; lipopeptide antibacterial substances
收稿日期:2015-03-01.
基金项目:国家海洋食品工程技术研究中心资助项目(2012FU125X03);海洋公益性行业科研专项(201405003-3);辽宁省教育厅重点实验室项目(LZ2014029).
作者简介:马树瑞(1990-),男,硕士研究生;通信作者:丛丽娜(1962-),女,教授,E-mail:congln@dlpu.edu.cn.
中图分类号:S917.1
文献标志码:A
文章编号:1674-1404(2016)03-0181-04
