细胞外信号调节激酶1/2信号转导通路调控牙周膜细胞成骨分化的研究
2016-06-20伍栋鲍光辉湖南省常德市第一人民医院口腔科常德415000
伍栋 鲍光辉湖南省常德市第一人民医院口腔科 常德 415000
细胞外信号调节激酶1/2信号转导通路调控牙周膜细胞成骨分化的研究
伍栋 鲍光辉
湖南省常德市第一人民医院口腔科 常德 415000
[摘要]目的探索细胞外信号调节激酶(ERK)1/2信号转导通路是否参与调控牙周膜细胞的成骨分化。方法取体外培养的第3代牙周膜细胞进行研究。实验分为空白对照组、成骨诱导组和实验组(在成骨诱导培养基中加入10 nmol·L¯1ERK1/2磷酸化的抑制剂PD98059)。培养1周和3周后通过定量聚合酶链反应(qPCR)、碱性磷酸酶(ALP)染色和茜素红染色检测其成骨能力。结果成骨诱导可促进牙周膜细胞中ERK1/2的磷酸化。培养1周后,抑制ERK1/2的磷酸化可上调成骨标志物Runx2、ALP和骨钙蛋白(OCN)的表达,与成骨诱导组相比较,OCN的表达差异具有统计学意义(P<0.05),Runx2、ALP的表达差异也具有统计学意义(P<0.01)。培养3周后,实验组牙周膜细胞成骨标志物Runx2、ALP和OCN的表达仍较成骨诱导组高,ALP染色和钙结节形成较成骨诱导组强,其中Runx2、ALP的表达差异具有统计学意义(P<0.05),OCN的表达差异也具有统计学意义(P<0.01)。结论ERK 1/2信号转导通路参与了调控体外培养的牙周膜细胞的成骨分化。
[关键词]ERK1/2;牙周膜细胞;成骨
细胞外信号调节激酶(extracellular signalregulated kinase,ERK)1/2是丝裂原激活蛋白激酶(mito-gen-activated protein kinase,MAPK)家族的一个成员,是一种重要的细胞信号转导因子[1]。与细胞增殖、分化和凋亡密切相关[1-2]。在间充质细胞的成骨分化过程中,已有研究[3]报道: ERK1/ 2对骨髓间充质干细胞、牙髓干细胞等细胞的成骨分化具有重要的调控作用。牙周膜细胞包含有牙周膜间充质干细胞,是牙周组织及骨组织工程重要的细胞来源[4]。有研究显示: ERK1/2参与了牙周膜细胞的增殖调控,但其在牙周膜细胞成骨分化中的作用尚未见报道。本研究拟探讨 ERK1/2信号通路是否对牙周膜细胞的成骨分化具有调控作用,以期为牙周组织和骨组织工程提供新的靶点和思路。
1 材料和方法
1.1材料
PD98059(Merck公司,德国),胎牛血清(fetal bovine serum,FBS)(Hyclone公司,加拿大),磷酸化ERK1/2一抗(CST公司,美国),达尔贝科改进的Eagle培养液(Dulbecco’s modified eagle medium,DMEM)(Gibco公司,美国),磷酸盐缓冲液(phosphate buffered saline,PBS)(Gibco公司,美国)、胰蛋白酶(Sigma公司,美国)、Trizol试剂(Invitrogen公司,美国),聚合酶链反应(polymerase chain reaction,PCR)引物(上海生工生物工程公司),反转录试剂盒、定量PCR试剂盒(TaKaRa公司,日本),茜素红(Sigma公司,美国),碱性磷酸酶(alka-line pho-sphatase,ALP)染色试剂盒(江苏海门市碧云天生物技术研究所),显微镜(Nikon公司,日本)。
1.2方法
1.2.1牙周膜细胞的培养选择至湖南省常德市第一人民医院口腔科因正畸需要拔除的健康人的前磨牙为研究对象,年龄15~24岁(平均年龄18.1岁)。牙齿拔除后立即用含有双抗的PBS清洗。无菌条件下用锐利刀片刮取牙根中1/3牙周膜组织,剪成约1 mm3大小的碎块,然后把组织块均匀地放置在10 cm培养皿的DMEM液滴里,每个液滴放8~10块组织,再加盖四角涂有凡士林的盖玻片,最后加入含质量分数为15%的FBS的DMEM培养基中,于体积分数为5%的CO2、37 ℃条件下培养,每4~5 d换液1次。待细胞生长达80%融合时,胰酶消化细胞,传代后继续培养。本研究中用3代细胞进行相应的实验。
1.2.2免疫组织化学染色用成骨诱导培养基或含10 nmol·L¯1PD98059的成骨诱导培养基培养15 min后,牙周膜细胞用质量分数4%的多聚甲醛室温固定20 min,PBS洗涤后用0.25%的triton-100透膜。接下来用3%的FBS室温封闭60 min,然后加入磷酸化ERK1/2(phosphorylated ERK1/2,pERK1/2)一抗,4 ℃过夜。PBS洗涤后滴加辣根过氧化物酶标志的二抗,室温孵育1 h后二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精染核,常规脱水透明,中性树胶封片,显微镜观察。
1.2.3 牙周膜细胞的成骨诱导 取第3代牙周膜细胞按照每毫升为5×104个的密度接种于6孔板,用成骨诱导培养液(含有15%的FBS、0.8 mol·L-1地塞米松、0.01 mol·L-1β-甘油磷酸钠、50 mg·L-1抗坏血酸的DMEM高糖培养基)进行成骨诱导培养3周。
实验分组如下。1)成骨诱导组:牙周膜细胞用成骨诱导培养基进行成骨诱导培养3周。2)实验组:牙周膜细胞在成骨诱导培养过程中加入10 nmol·L¯1的PD98059(ERK1/2磷酸化抑制剂)。PD98059的加入方法如下:在进行成骨诱导培养以前加入常规DMEM培养基,按10 nmol·L¯1的浓度加入PD98059后培养2 h,然后去除常规培养基,换含有10 nmol·L¯1PD98059的成骨诱导培养基,此后用含有10 nmol·L¯1PD98059的成骨诱导培养基持续换液培养3周。3)空白对照组:用常规DMEM培养的牙周膜细胞。
1.2.4定量PCR培养1周和3周的牙周膜细胞分别用PBS漂洗后加入1 mL Trizol试剂,吹打细胞至溶解后加入三氯甲烷(氯仿)400 μL,冰上放置10 min。12 000 ×g离心15 min后吸取上层液,加入1 mL异丙醇,室温放置10 min。12 000 ×g离心15 min,离心后弃上清,加入用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水配置的75%的乙醇1 mL洗涤沉淀。12 000 ×g离心5 min后弃上清,沉淀用适量DEPC水溶解。用紫外分光光度计测定RNA总浓度和纯度,A260/280>1.8可用于实验。然后用PrimeScript RT reagent kit按照说明书将RNA逆转录成cDNA,反应条件为37 ℃ 15 min,85 ℃ 10 s,-80 ℃保存。
将cDNA模板加入Eppendorf实时荧光定量PCR(fluorescent quantitive polymerase chain reaction,qPCR)反应系统,检测培养的牙周膜细胞成骨标志物Runx2(runt-related transcription factor 2)、ALP和骨钙蛋白(osteocalcin,OCN)的mRNA表达情况。实验过程简述如下:在96孔PCR板中,每孔加入20 μL反应体系,每个样本设3个平行孔,不同批次之间数据以内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehy-drogenase,GAPDH)为基准调整基线。Runx2、ALP、OCN和GAPDH的引物序列和反应条件参照文献[5-6]中所用序列,反应条件为95 ℃(20 s)-60 °C(15 s)-72 °C(20 s),共进行30个循环。数据处理方法按Eppendorf公司说明书进行。
1.2.5ALP染色培养3周的牙周膜细胞用PBS洗涤3次,4%多聚甲醛固定20 min,PBS洗涤。按照说明书配制5-溴-4-氯-3-吲哚基磷酸盐(5-bromo-4-chloro-3-indolyl phosphate,BICP)和四唑硝基蓝(tetranitroblue tetrazolium chloride,NBT)混合染色工作液,加入适量BCIP/NBT染色工作液,室温避光孵育30 min。除BCIP/NBT染色工作液,用蒸馏水洗涤,终止显色反应,扫描仪扫描。
1.2.6 茜素红染色 培养3周的牙周膜细胞用PBS清洗,然后用95%乙醇固定30 min,去除乙醇,加入0.1%的茜素红染色液,室温下染色30 min。用PBS清洗,扫描仪扫描。
1.3统计学处理
应用SPSS 18.0软件对数据进行成组t检验,数据以均数±标准差表示,P<0.05认为差异有统计学意义。
2 结果
2.1成骨诱导对牙周膜细胞中ERK1/2磷酸化的影响

图1 原代牙周膜细胞 显微镜 × 400Fig1 Primary human periodontal ligament cells microscope × 400

图2 pERK1/2免疫组织化学染色 显微镜 × 400Fig2 Immunohistochemical staining of pERK1/2 microscope × 400
本研究应用组织块法成功培养了人牙周膜细胞,牙周膜细胞呈梭形、多角形(图1)。免疫组织化学染色结果显示:牙周膜细胞经成骨诱导后pERK1/2染色较对照组增强(图2A)。这提示其可能参与牙周膜细胞在体外的成骨分化。而加入10 nmol·L¯1PD98059(ERK1/2磷酸化抑制剂)后,pERK1/2染色较成骨诱导组的牙周膜细胞减弱(图2B),说明该抑制剂能抑制牙周膜细胞中ERK1/2的磷酸化。
2.2ERK1/2信号通路对牙周膜细胞成骨分化的影响
牙周膜细胞在体外经成骨诱导培养1周和3周后分别进行成骨标志物的qPCR检测,结果显示:成骨诱导培养1周后牙周膜细胞的ALP和Runx2的表达较对照组明显增加,OCN的mRNA表达较对照组有增高,但增加的量不如ALP和Runx2。加入PD98059后,ALP和Runx2的表达较成骨诱导组明显升高(P<0.01),骨桥蛋白(osteopontin,OPN)的表达也高于成骨诱导组(P<0.05)(图3)。成骨诱导培养3周后,牙周膜细胞的ALP和Runx2的表达较对照组仍然要高,但较培养1周时有降低,而OCN的mRNA表达较对照组明显增加。加入PD98059后,ALP和Runx2的表达较成骨诱导组增高(P<0.05),而OPN的表达较成骨诱导组明显增高(P<0.01)(图3)。 ALP染色结果也显示成骨诱导可增强牙周膜细胞的ALP活性,而抑制ERK1/2信号通路会进一步增强牙周膜细胞中ALP的活性。茜素红染色结果和ALP染色的结果相似,也显示抑制ERK1/2信号通路会促进牙周膜细胞形成钙结节(图4)。这些结果提示:ERK1/2信号通路参与了牙周膜细胞的成骨分化。
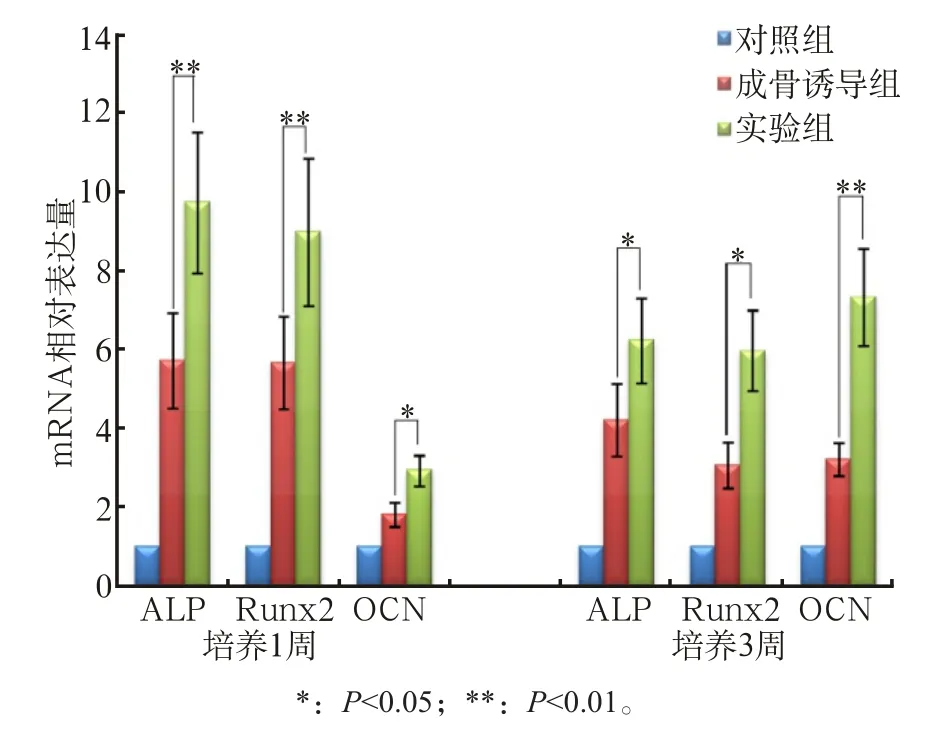
图3 成骨标志物的定量PCR检测Fig3 qPCR results for osteogenic markers

图4 各组ALP染色和茜素红染色的结果Fig4 ALP staining and alizarin red staining results in different groups
3 讨论
ERK1/2是MAPK家族的一员,是一个重要的细胞信号转导分子,参与了许多细胞生物学活动如成骨、成软骨分化等[1]。在间充质细胞的成骨分化方面,现有研究表明ERK1/2信号通路对间充质细胞成骨分化的调控作用十分复杂且存在一些争议,部分研究发现ERK1/2信号通路对间充质干细胞成骨分化起正向调控作用,而另外一些研究则认为ERK1/2信号通路对充质干细胞的成骨分化呈负向调控作用[7-10]。这些研究结果存在争议可能是与相关基因的表达量、表达时序存在差异,或与细胞的类型相关,也或者是缘于上游的调控因子存在差异;因此,虽然ERK1/2的小分子抑制剂十分丰富,具有潜在的临床应用价值,但如何在牙周组织或骨组织工程中发挥作用尚无定论。本研究中笔者发现:成骨诱导可促进牙周膜细胞中ERK1/2的磷酸化,而抑制ERK1/2磷酸化会促进成骨分化。这提示ERK1/2信号通路对牙周膜细胞的成骨分化具有重要的调控作用。以往也有研究[11]表明一些基因突变可使ERK1/2过度磷酸化进而引起颅颌面发育异常如颅缝早闭等,这也进一步说明ERK1/2信号通路对颅颌面组织尤其是骨组织的发育具有十分重要的调控作用,其也提示研究者通过对ERK1/2信号通路的操作有可能是防治临床上相关疾病或促进颅颌面骨组织/牙周组织再生的有效办法。
牙周膜细胞包含部分间充质干细胞,其具有多向分化潜能,近年来受到广泛关注[4]。体内、外研究[4]表明:牙周膜干细胞能分化为成脂肪细胞、软骨细胞及成骨细胞等,是牙周组织和骨组织再生的重要细胞来源。牙周膜干细胞的成骨分化是一个复杂的过程,许多分子如骨形态发生蛋白7、雌激素、表皮生长因子等参与了这一调控过程[12-14]。本研究中,笔者发现:ERK1/2在体外是负向调控牙周膜细胞的成骨分化。ALP和Runx2是生物矿化和成骨细胞分化成熟的重要早期标志物。OCN 是由分化成熟的成骨细胞合成,是细胞骨向分化的晚期标志物[15]。本研究显示:抑制ERK1/2可促进ALP、Runx2和OCN的表达,提示ERK1/2对牙周膜细胞的早期和晚期分化可能都有影响。由于笔者在实验中是从成骨诱导培养开始持续加入ERK1/2的抑制剂,因此在不同时间点加入抑制剂,以及持续时间的长短等可能会对牙周膜细胞的成骨分化具有不同的效果,需要设计更为复杂的实验进一步的研究,并在体内进行验证,从而为临床上牙周组织再生或骨组织工程提供更为合理的应用方案。
总之,牙周膜细胞成骨分化是一个十分复杂的过程,受到许多分子的调控和体内外环境的影响。ERK1/2是调节牙周膜细胞成骨分化的重要因子,但ERK1/2抑制剂的选择、持续时间、体内外差异以及调控的具体机制仍需要进行深入的研究,其将有望为临床应用提供新的靶点、思路和重要的参考依据。
4 参考文献
[1]Roskoski R Jr.ERK1/2 MAP kinases: structure,function,and regulation[J].Pharmacol Res,2012,66 (2):105-143.
[2]Mebratu Y,Tesfaigzi Y.How ERK1/2 activation controls cell proliferation and cell death: Is subcellular localization the answer[J].Cell Cycle,2009,8(8):1168-1175.
[3]Xu DJ,Zhao YZ,Wang J,et al.Smads,p38 and ERK1/2 are involved in BMP9-induced osteogenic differentiation of C3H10T1/2 mesenchymal stem cells[J].BMB Rep,2012,45(4):247-252.
[4]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-155.
[5]Wang L,Dormer NH,Bonewald LF,et al.Osteogenic differentiation of human umbilical cord mesenchymal stromal cells in polyglycolic acid scaffolds[J].Tissue Eng Part A,2010,16(6):1937-1948.
[6]Dai J,Wang J,Lu J,et al.The effect of co-culturing costal chondrocytes and dental pulp stem cells combined with exogenous FGF9 protein on chondrogenesis and ossification in engineered cartilage[J].Biomaterials,2012,33(31):7699-7711.
[7]Twigg SR,Vorgia E,McGowan SJ,et al.Reduced dosage of ERF causes complex craniosynostosis in humans and mice and links ERK1/2 signaling to regulation of osteogenesis[J].Nat Genet,2013,45(3):308-313.
[8]Bai B,He J,Li YS,et al.Activation of the ERK1/2 signaling pathway during the osteogenic differentiation of mesenchymal stem cells cultured on substrates modified with various chemical groups[J].Biomed Res Int,2013,2013:361906.
[9]Xu L,Meng F,Ni M,et al.N-cadherin regulates osteogenesis and migration of bone marrow-derived mesenchymal stem cells[J].Mol Biol Rep,2013,40 (3):2533-2539.
[10]Miraoui H,Oudina K,Petite H,et al.Fibroblast growth factor receptor 2 promotes osteogenic differentiation in mesenchymal cells via ERK1/2 and protein kinase C signaling[J].J Biol Chem,2009,284(8):4897-4904.
[11]De Rocca Serra-Nédélec A,Edouard T,Tréguer K,et al.Noonan syndrome-causing SHP2 mutants inhibit insulin-like growth factor 1 release via growth hormone-induced ERK hyperactivation,which contributes to short stature[J].Proc Natl Acad Sci USA,2012,109(11):4257-4262.
[12]Rajshankar D,McCulloch CA,Tenenbaum HC,et al.Osteogenic inhibition by rat periodontal ligament cells: modulation of bone morphogenic protein-7 activity in vivo[J].Cell Tissue Res,1998,294(3):475-483.
[13]Matsuda N,Kumar NM,Ramakrishnan PR,et al.Evidence for up-regulation of epidermal growthfactor receptors on rat periodontal ligament fibroblastic cells associated with stabilization of phenotype in vivo[J].Arch Oral Biol,1993,38(7):559-569.
[14]Tang X,Meng H,Han J,et al.Up-regulation of estrogen receptor-beta expression during osteogenic differentiation of human periodontal ligament cells[J].J Periodont Res,2008,43(3):311-321.
[15]James AW.Review of Signaling pathways governing MSC osteogenic and adipogenic differentiation[J].Scientifica: Cairo,2013,2013:684736.
(本文编辑王姝)
Extracellular signal-regulated kinase 1/2 signal pathway regulates the osteogenic differentiation of periodontal ligament cells
Wu Dong,Bao Guanghui.(Dept.of Stomotology,Changde First People’s Hospital in Hunan Province,Changde 415000,China)
[Abstract]ObjectiveThis study aims to explore whether the extracellular signal-regulated kinase(ERK) 1/2 signaling pathway could regulate the osteogenic differentiation of periodontal ligament cells.MethodsThe human periodontal ligament cells from the third passage were divided into three groups,namely,black control group,osteogenic induction group,and experimental group(10 nmol·L-1PD98059,an inhibitor of ERK1/2 phosphorylation,was added in the osteogenic medium).One or three weeks after culture,the osteogenic capability of the periodontal ligament cells was evaluated using quantitative polymerase chain reaction(qPCR),alkaline phosphatase(ALP) staining,and alizarin red staining.Results Osteogenic induction promoted ERK1/2 phosphorylation.One week after culture,inhibition of ERK1/2 phosphorylation up regulated the expression of Runx2,ALP,and osteocalcin(OCN) in periodontal ligament cells.Statistically significant differences were found in OCN and the osteogenic induction group(P<0.05),and statistically significant differences were found in ALP and Runx2(P<0.01).Three weeks after culture,the expression of Runx2,ALP,and OCN remained higher in the experimental group than in the osteogenic induction group.In addition,strong ALP staining and more calcium nodule formation were observed in the periodontal ligament cells of the experimental group.Statistically significant differences were found in ALP and Runx2(P<0.05),and statistically differences were found in OCN(P<0.01) .Conclusion The ERK1/2 signal pathway could regulate the osteogenic differentiation of periodontal ligament cells in vitro.
[Key words]ERK1/2;periodontal ligament cell;osteogenesis
[收稿日期]2015-05-14;[修回日期]2015-11-05
[作者简介]伍栋,主治医师,硕士,Email:dong_wu1983@163.com
[通信作者]伍栋,主治医师,硕士,Email:dong_wu1983@163.com
[中图分类号]Q 55
[文献标志码]A[doi] 10.7518/gjkq.2016.03.004
