勃起功能障碍大鼠阴茎海绵体周细胞数量和微血管密度变化的研究
2016-06-20周明宽张亚东吕坤龙庄锦涛邓春华涂响安
周明宽 张亚东 吕坤龙 庄锦涛 邓春华 涂响安
510080 广州,中山大学附属第一医院泌尿外科
勃起功能障碍大鼠阴茎海绵体周细胞数量和微血管密度变化的研究
周明宽张亚东吕坤龙庄锦涛邓春华涂响安
510080 广州,中山大学附属第一医院泌尿外科
【摘要】目的检测勃起功能障碍(ED)大鼠模型阴茎海绵体周细胞数量(PN)和微血管密度(MVD)变化。方法构建高脂血症ED大鼠模型(ED组),检测勃起状态下海绵体内压(ICP)变化,免疫组织化学染色法检测阴茎海绵体PN和MVD,并比较其与正常大鼠(正常对照组)的差异。结果大鼠阴茎海绵体周细胞主要分布在阴茎海绵体靠近白膜的微血管部分。勃起状态下ED组大鼠ICP为(21.0±1.5)mm Hg,低于正常对照组大鼠的(36.3±5.7)mm Hg(P<0.01)。ED组大鼠阴茎海绵体的PN为(7.13±1.82)个,少于正常对照组的(8.89±2.24)个(P<0.01),2组大鼠的MVD比较差异无统计学意义(P>0.05)。结论阴茎海绵体周细胞可能与阴茎海绵体勃起的血流调控过程有关。
【关键词】勃起功能障碍;海绵体;周细胞;数量
勃起功能障碍(ED)是指阴茎不能达到或维持足够的勃起硬度以完成满意的性生活,是男科的常见病和多发病。阴茎海绵体是主要的勃起器官,有丰富的动、静脉血管分布。近年研究发现,糖尿病、高血压病、高脂血症等与ED的发生密切相关,血管内皮功能障碍是其发病的中心环节[1]。另有报道,对于微血管血流量的调控,除内皮细胞外,包括微血管周细胞在内的血管周围细胞在微血管系统的动态调节中发挥关键作用[2]。周细胞是位于微血管(微动脉、毛细血管、微静脉)内皮细胞外的壁细胞[3]。研究认为,周细胞参与血脑屏障功能、血流调控、内皮细胞调节、纤维化和血管再生等多种病理生理过程的调节,在泌尿生殖系统病理生理过程如肾脏纤维化、肾血流调节、肾小球滤过等也有一定的调节作用[4-5]。本研究应用免疫组织化学(免疫组化)法检测阴茎海绵体中周细胞数量(PN)和微血管密度(MVD),并比较不同疾病状态下PN和海绵体内压(ICP)的变化,探讨周细胞对阴茎海绵体勃起过程中血流调控的影响。
材料与方法
一、实验动物
无特定病原体级成年雄性SD大鼠10只,购自中山大学实验动物中心,实验动物处理符合中山大学附属第一医院实验动物伦理委员会规定。
二、主要试剂
实验用抗体:兔源多克隆抗大鼠CD31(Abcam,美国),兔源多克隆抗大鼠血小板衍生生长因子受体-β(PDGFR-β,Santa,美国),小鼠源单克隆抗大鼠α-平滑肌激动蛋白(α-SMA,武汉博士德),二抗为超敏型二步法检测试剂盒(北京中杉金桥)。所有抗体均采用含5%山羊血清和0.05% Tween 20的磷酸盐缓冲液(PBS)稀释。
三、方法
1. 高脂血症ED大鼠模型的建立及鉴定
大鼠适应性喂饲1周后,随机分成ED组和正常对照组进行实验,每组各5只。ED组喂饲高脂饲料(普通饲料+15%食用油+6%胆固醇+2%胆酸钠+10%蔗糖+0.2%丙基硫氧嘧啶)制作高脂血症动物模型,正常对照组喂饲普通饲料;2组大鼠均正常自由饮水。每日观察大鼠活动情况,每周称量体质量和测量体长,记录进食量和饮水量。饲养周期30 d。30 d后,禁食12 h,再次称量体质量和测量体长;腹腔注射水合氯醛麻醉,眼底静脉丛采血,采用酶法分别检测血清总胆固醇和甘油三酯。
2. 大鼠阴茎ICP测定
ICP的测定方法参照文献[6],即大鼠经4%水合氯醛(400 mg/kg)腹腔注射麻醉后,仰卧位固定于手术台上,取下腹部正中切口,充分暴露阴茎及球海绵体肌,并解剖暴露阴茎背神经。将充满肝素盐水的25 G针头插入一侧阴茎海绵体,针的另一端连接压力传感器,固定针头和阴茎。记录大鼠的基础ICP,电刺激阴茎背神经诱发勃起,测定勃起后的ICP并记录。
3. 阴茎组织的免疫组化染色检查
大鼠麻醉固定后,剪开阴茎皮肤,完整切取阴茎海绵体,PBS漂洗去除血迹并取中段制作阴茎海绵体冠状位连续石蜡切片。免疫组化染色采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP)法。免疫学染色时,石蜡切片烤片,常规脱蜡、水化后分别对内皮细胞标志物CD31和周细胞标志物PDGFR-β及α-SMA进行免疫组化染色。染色过程中抗原修复方法为高压修复法。二氨联苯胺(DAB)显色,苏木素复染,脱水封片后观察,检测海绵体组织中CD31、PDGFR-β和α-SMA的表达并比较。
4. 海绵体PN和MVD的定量检测
PN:阴茎海绵体免疫组化切片首先在100倍视野下选择计数部位,然后在400倍视野下计数。每组计数5例,每例分别选取9个不重复视野计数并拍照(两侧阴茎海绵体各4个,中间连接部1个),然后计算单位视野(400倍)平均PN,即PN。
MVD:阴茎海绵体免疫组化切片首先在100倍视野下选择计数部位,然后在400倍视野下计数,单个内皮细胞作为1个计数单位,残存血管或管腔直径>8个红细胞者不计数。每组计数5例,每例分别选取9个不重复视野计数并拍照(两侧阴茎海绵体各4个,中间连接部1个),然后计算单位视野(400倍)平均微血管数量,即MVD。
四、统计学处理
结果
一、大鼠阴茎ICP测定
大鼠喂饲30 d后,ED组大鼠体质量、血清总胆固醇和甘油三酯水平均高于正常对照组(P<0.05),见表1。大鼠麻醉后测量ICP,ED组与正常对照组ICP基线水平相似;电刺激阴茎背神经诱发勃起后测量ICP,ED组平均ICP高于正常对照组(P<0.05),表明ED组制模成功,具体数据见表1。
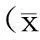
表1 ED组和正常对照组大鼠各指标水平比较±s)

图1 ED组和正常对照组大鼠ICP比较
A:ED组;B:正常对照组;绿色条带为电刺激持续时间
二、阴茎海绵体周细胞和微血管免疫组化结果
大鼠阴茎海绵体冠状位石蜡切片分别对内皮细胞抗体CD31、周细胞抗体PDGFR-β和α-SMA进行免疫组化染色,抗体抗原阳性反应呈棕色,3种抗体均有表达,且主要分布在阴茎海绵体靠近白膜的部分,见图2、3。
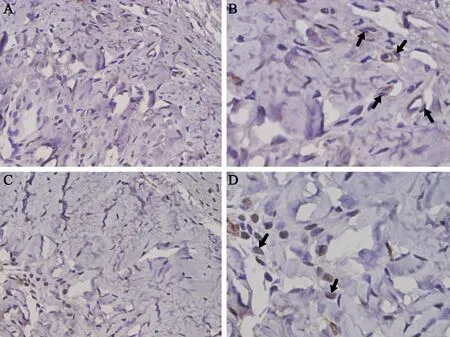
图2 大鼠阴茎海绵体周细胞免疫组化染色结果(SP法,A、C×200,B、D×400)
A、 B:正常对照组;C、D:ED组;黑色箭头所示为周细胞
图3 阴茎海绵体微血管免疫组化(SP法,A、C×200,B、D×400)
A、 B:正常对照组;C、D:ED组;黑色箭头所示为微血管
三、阴茎海绵体PN和MVD比较
ED组大鼠阴茎海绵体PN少于正常对照组(P<0.01),2组MVD比较差异无统计学意义(P>0.05),见表2。
表2 ED组和正常对照组大鼠阴茎海绵体
讨论
ED是男性常见的性功能障碍之一,严重影响患者的生活质量。流行病学研究发现,ED与男性的年龄、身体状况、吸烟、血糖和血脂等状态密切相关[7]。阴茎主要由阴茎海绵体和尿道海绵体构成,阴茎海绵体是主要的勃起器官,由小梁和血窦组成。阴茎勃起是神经内分泌调节下阴茎海绵体动脉复杂血流动力学变化的血管调节过程:动脉扩张、动脉血流量明显增加。研究发现,在内皮细胞分泌的内皮素、血管紧张素Ⅱ、一氧化氮、内皮源性超极化因子和神经末梢释放的去甲肾上腺素、一氧化氮及局部其他细胞释放的多种血管活性物质的作用下,阴茎海绵体平滑肌细胞内钙离子浓度和对钙离子的敏感性发生变化,引起平滑肌细胞的收缩、舒张以及海绵体血流量的变化,阴茎勃起状态改变[8]。
对于微血管血流量的调控,除内皮细胞外,包括微血管周细胞在内的血管周围细胞在微血管系统的动态调节中也发挥着关键作用。周细胞位于微血管内皮细胞和基膜之间并部分包绕内皮细胞,它通过多种途径参与血管功能的维持和调节。国外研究发现,周细胞能合成细胞外基质,当周细胞缺乏时,微血管发育异常、管径不规则,通透性增加[9]。周细胞通过多种信号通路,包括转化生长因子-β及其受体系统、血管生成素及其受体、血小板生长因子-β及其受体和1-磷酸-鞘氨醇及其受体等,与微血管内皮细胞相互联系,共同调节和维持血管的稳定性[10]。周细胞内还含有SMA,体外试验可直接观察到周细胞的收缩,因此推测周细胞可能直接参与调控微血管直径,调节局部血流量等[11-12]。
PN因组织器官类别、生长阶段和疾病状态的不同而有较大差异,其与内皮细胞的数量比例范围为1∶100至1∶1,大约覆盖10%~50%的血管内皮层。在啮齿动物模型中,糖尿病发生后2个月PN开始减少,这一现象比无细胞毛细血管的出现早数月;并且无论是自然发生的糖尿病模型还是药物诱导的动物模型,视网膜PN均从2~3个月时开始减少,实验6个月时,PN减少了15%~50%,其机制仍不清楚,推测可能与局部活性氧簇物质、糖基化产物过多等导致周细胞的凋亡有关[13]。PN的减少会引起部分内皮细胞超微结构的改变:正常血管内壁是平整光滑的,周细胞缺如的血管内壁会出现较多的膜折叠,影响内皮细胞的外形,进而影响血管的直径和功能[12]。
本研究发现,周细胞在大鼠阴茎海绵体中主要分布在较靠近白膜的海绵体微血管部分, ED大鼠阴茎海绵体MVD与正常对照组相近,PN较正常对照组明显减少,而ICP测定显示,ED大鼠阴茎ICP较正常对照组明显降低,提示阴茎海绵体周细胞可能与阴茎海绵体勃起的血流调控过程有关,但周细胞在勃起过程中对海绵体血流调控的具体作用机制仍不清楚,需要进一步研究阐明。
参考文献
[1]Kovanecz I, Nolazco G, Ferrini MG, Toblli JE, Heydarkhan S, Vernet D, Rajfer J, Gonzalez-Cadavid NF. Early onset of fibrosis within the arterial media in a rat model of type 2 diabetes mellitus with erectile dysfunction.BJU Int,2009,103(10):1396-1404.
[2]Birbrair A, Zhang T, Wang ZM, Messi ML, Mintz A, Delbono O. Pericytes at the intersection between tissue regeneration and pathology.Clin Sci (Lond),2015,128(2):81-93.
[3]Richards OC, Raines SM, Attie AD. The role of blood vessels, endothelial cells, and vascular pericytes in insulin secretion and peripheral insulinaction.Endocr Rev,2010,31(3):343-363.
[4]Dalkara T, Gursoy-Ozdemir Y, Yemisci M. Brain microvascular pericytes in health and disease.Acta Neuropathol,2011,122(1):1-9.
[5]周明宽, 张亚东, 涂响安. 周细胞在泌尿生殖系统中的作用. 中华男科学杂志, 2014,20(12):1126-1130.
[6]Chen X, Yang Q, Zheng T, Bian J, Sun X, Shi Y, Liang X, Gao G, Liu G, Deng C. Neurotrophic effect of adipose tissue-derived stem cells on erectile function recovery by pigment epithelium-derived factor secretion in a rat model of cavernous nerve injury. Stem Cells Int,2016,2016:5161248.
[7]齐涛, 张滨. 勃起功能障碍流行病学研究. 新医学, 2011,42(2):117-118.
[8]Molodysky E, Liu SP, Huang SJ, Hsu GL. Penile vascular surgery for treating erectile dysfunction: current role and future direction.Arab J Urol,2013,11(3):254-266.
[9]Trost A, Lange S, Schroedl F, Bruckner D, Motloch KA, Bogner B, Kaser-Eichberger A, Strohmaier C, Runge C, Aigner L, Rivera FJ, Reitsamer HA.Brain and retinal pericytes: origin, function and role. Front Cell Neurosci,2016,10:20.
[10]von Tell D, Armulik A, Betsholtz C.Pericytes and vascular stability. Exp Cell Res,2006,312(5):623-629.
[11]Joyce NC, Haire MF, Palade GE.Contractile proteins in pericytes. I. Immunoperoxidase localization of tropomyosin.J Cell Biol,1985,100(5):1379-1386.
[12]Betsholtz C. Insight into the physiological functions of PDGF through genetic studies in mice.Cytokine Growth Factor Rev,2004,15(4):215-228.
[13]Pfister F, Przybyt E, Harmsen MC, Hammes HP. Pericytes in the eye.Pflugers Arch,2013,465(6):789-796.
Changes in pericyte number and microvascular density in corpus cavernosum of rat models with erectile dysfunction
ZhouMingkuan,ZhangYadong,LyuKunlong,ZhuangJintao,DengChunhua,TuXiang’an.
DepartmentofUrology,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080,ChinaCorrespondingauthor,TuXiang’an,E-mail:txabs9988@163.com
【Abstract】ObjectiveTo investigate the changes in the pericyte number (PN) and microvascular density (MVD) in the penile corpus cavernosum of rat models with erectile dysfunction (ED). MethodsED rat models with hyperlipidemia were established. The changes in the intracavernosal pressure (ICP) were measured under erectile status. PN and MVD of the corpus cavernosum were analyzed by immunohistochemistry and statistically compared with the normal rats (control group). ResultsThe pericytes were mainly distributed in the microvesssels adjacent to the tunica albuginea of the corpus cavernosum. Under erectile status, the mean ICP in the ED group was (21.0±1.5) mmHg, significantly lower compared with (36.3±5.7) mmHg in the control group (P<0.01). The PN in the ED group was 7.13±1.82, considerably less than 8.89±2.24 in the control group (P<0.01). The MVD did not significantly differ between the ED and control groups (P>0.05). ConclusionThe pericyte of the corpus cavernosum might be associated with the regulation of blood flow in the penile corpus cavernosum.
【Key words】Erectile dysfunction; Corpus cavernosum; Pericyte; Number
DOI:10.3969/j.issn.0253-9802.2016.05.006
基金项目:国家自然科学基金(81172432,81302223,81471449);广东省科技计划对外合作项目(2013B51000021);广州市科技计划项目(2013J4500010);广东省自然科学基金博士启动项目(S2013040012294);广东省医学科学技术研究基金(A2014822, C2013022)
(收稿日期:2016-01-25)(本文编辑:林燕薇)
·基础研究论著·
通讯作者,涂响安,E-mail:txabs9988@163.com
