自体内皮祖细胞促进组织工程骨血管化的体内外实验研究
2016-06-14柯腾飞陈泽谷魏韩笑张承磊
吴 莉,赵 娴,柯腾飞,陈泽谷,陆 林,魏韩笑,张承磊,刘 流△
(1.昆明医科大学第一附属医院医学影像科 650032;2.昆明医科大学第一附属医院整形外科 650032;3.中南大学湘雅医学院附属海口医院放射科,海口 570208;4.昆明医科大学第一附属医院血管外科 650032)
自体内皮祖细胞促进组织工程骨血管化的体内外实验研究
吴莉1,赵娴2,柯腾飞1,陈泽谷3,陆林1,魏韩笑2,张承磊4,刘流2△
(1.昆明医科大学第一附属医院医学影像科 650032;2.昆明医科大学第一附属医院整形外科 650032;3.中南大学湘雅医学院附属海口医院放射科,海口 570208;4.昆明医科大学第一附属医院血管外科 650032)
[摘要]目的探讨自体内皮祖细胞(EPCs)在体内、外促进组织工程骨血管化的能力。方法将兔自体外周血EPCs及骨髓间充质干细胞(BMSCs)按联合培养时细胞增殖率最大时配比(EPCs∶BMSCs=1∶2)体外培养(联合培养组),在体外采用实时定量PCR方法检测成骨相关细胞因子Osteonectin、Osteopotin、Col-1及成血管相关细胞因子血管内皮生长因子(VEGF)表达,于培养3、7、14 d观察表达量的变化并与单纯EPCs及BMSCs组比较;将单纯EPCs、BMSCs及联合培养组的组织工程骨移植到兔四肢肌袋内,于移植后2、4、8周观察组织工程骨生长情况,同时制成组织切片行CD34、CD105、ZO-1免疫组织化学染色,采用Image-Pro plus 6.0图像分析软件,测量光密度值,比较3组工程骨表达量变化。结果3、7、14 d Osteonectin、Osteopotin、Col-1、VEGF各组表达均逐渐增高,其中联合培养组增高最明显,且各时间点表达量最高(P<0.01);2、4、8周兔四肢肌袋内的组织工程骨中联合培养组细胞复合的工程骨随时间延长成骨增加最明显,新生血管长入最多,免疫组织化学显示CD34、CD105、ZO-1表达最明显(P<0.01)。 结论自体EPCs与BMSCs相互作用,在体内、体外均可促进组织工程骨血管化。
[关键词]干细胞;内皮, 血管;间充质干细胞;新生血管化, 生理性;组织工程骨
近些年来组织工程技术研究在骨缺损修复中显示出巨大的潜力,组织工程骨移植入体内,骨的血管化、成骨破骨细胞再生、骨端融合是移植骨成活的3个重要环节,其中血管化是前提,是组织工程骨内复合的干细胞存活、增殖、转化为成骨组织替代支架的决定因素。目前组织工程骨的血管化不足、缺乏功能性血管已成为其发展进入临床应用的最大障碍[1]。国内外学者采用多种方法加快组织工程骨内部血管网的形成使新生血管或血管网与宿主血管沟通,如改善或改造支架结构、成分,干细胞移植时加入血管生成因子及将内皮细胞与成骨细胞共同培养等方法[2],但均不能生成保证细胞存活的足够密度的微血管网。
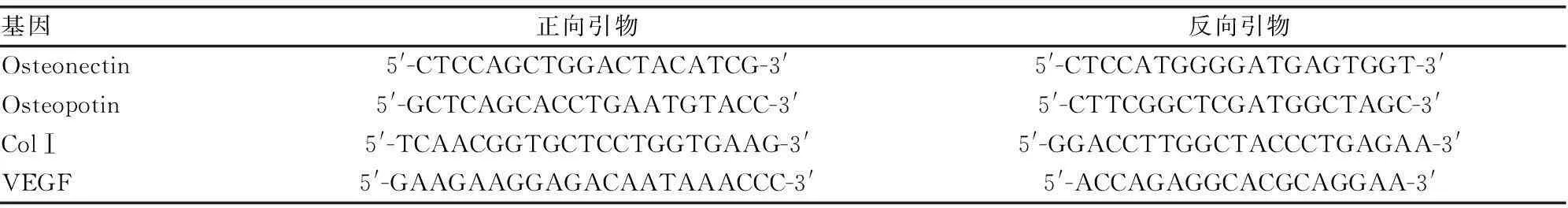
表1 引物序列
研究报道,内皮祖细胞(endothelial progenitor cells,EPCs)不仅可以促进新生血管生成,还可促进间充质干细胞(mesenchymal stem cells,MSCs)成骨[3]。因此本研究将自体来源的EPCs与骨髓MSCs(BMSCs)直接共培养形成共培养体系,体外与单纯培养的EPCs与BMSCs两组细胞比较成血管相关细胞因子血管内皮生长因子(vacular endothelial growth factor,VEGF)及成骨细胞因子(Osteonectin、Osteopotin、Col-1)的表达差异;将上述3组细胞复合到包被纤维粘连蛋白的部分脱蛋白生物骨(partially deproteinised bone,PDPB)上于兔四肢肌袋内培养,不同时间大体观察及免疫组织化学检测成骨及微血管化能力的差异,了解EPCs在BMSCs成骨中的促进作用。
1材料与方法
1.1实验仪器5% CO237 ℃培养箱购自Thermo Scientific公司,低温离心机购自北京医用离心机厂,RT-PCR仪购自Bio-Rad公司,倒置相差显微镜购自Olympus公司;L-DMEM培养基、胎牛血清(FBS)购自Hyclone公司,胰蛋白酶、Trizol购自Takara公司,PDPB由本实验组自制[4],自体外周血EPCs及BMSCs由本实验组自行分离培养鉴定后冻存,本次实验为采用复苏后第三代细胞,兔CD34、CD105、ZO-1一抗购自北京博奥森公司,逆转录试剂盒购自Thermo Fisher Scientific公司,荧光定量PCR试剂盒购自宝生物工程有限公司,引物设计由宝生物工程有限公司完成,Loading Buffer、DNA分子标记物购自 Fermantas公司。
1.2方法
1.2.1外周血EPCs促进BMSCs成骨细胞因子及成血管能力的体外检测取本实验组分离培养鉴定后[5]冻存的自体第3代EPCs及BMSCs复苏后培养3 d,将单纯EPCs(EPCs组)、BMSCs(BMSCs组)及共培养细胞(EPCs∶BMSCs=1∶2,联合培养组)[5]3组细胞种植于9块6孔板,每孔加1.5 mL含15% FBS的L-DMEM培养基,置培养箱培养,每3天换1次液。第3、7、14天分别取3块板,Trizol法进行总RNA的提取,将总RNA反转录为cDNA,以cDNA为模板进行实时定量PCR反应,引物见表1,以上步骤按试剂盒说明书进行操作。用2-△△Ct计算Osteonectin、Osteopotin、Col-1、VEGF的相对表达量,以实验组与对照组表达量差异倍数=实验组2-△△Ct/对照组2-△△Ct表示。
1.2.2复合3组种子细胞的组织工程骨体内实验取本实验组冻存的自体第3代EPCs及BMSCs复苏,将3组细胞复合在4 ℃冰箱储存的包被纤维粘连蛋白大小为0.5 cm×0.5 cm×0.3 cm的PDPB上:将PDPB置于装有DMEM的培养皿中预湿后加入3组细胞,细胞浓度均为0.5×106/mL,总量为20 μL,培养箱内培养4 h后置96孔板中,加完全培养基至总量为100 μL后培养箱中培养,隔天换液,第4天将复合3组细胞的组织工程骨异位移植到兔四肢肌袋内(移植兔即为复苏的第3代EPCs及BMSCs的宿主,从而确保了自体移植),分别于2、4、8周观察工程骨与周围软组织的变化。各时间点每组取3块工程骨制作成切片,每块组织取中心部分连续切片3张,免疫组织化学染色CD34、CD105、ZO-1,每张切片随机拍3个视野,用Image-Pro plus 6.0图像分析软件,得到阳性细胞平均光密度值,比较各组工程骨内随时间变化CD34、CD105、ZO-1表达量变化。
2结果
2.1体外3、7、14 d Osteonectin、Osteopotin、Col-1、VEGF表达变化采用实时荧光半定量分析,计算Osteopotin、Oteonectin、Col-1的表达量,此时以EPCs组为对照组,联合培养组及BMSCs组为实验组,结果显示随着时间延长Osteopotin、Osteonectin、Col-1 3个指标相对表达量逐渐增加,各时间点以联合培养组增加最明显,14 d为最高;计算VEGF时以BMSCs组为对照组,EPCs组及联合培养组为实验组,结果显示VEGF随时间延长,各时间点相对表达量值明显增大,以联合培养组最明显,14 d为最高。见图1。
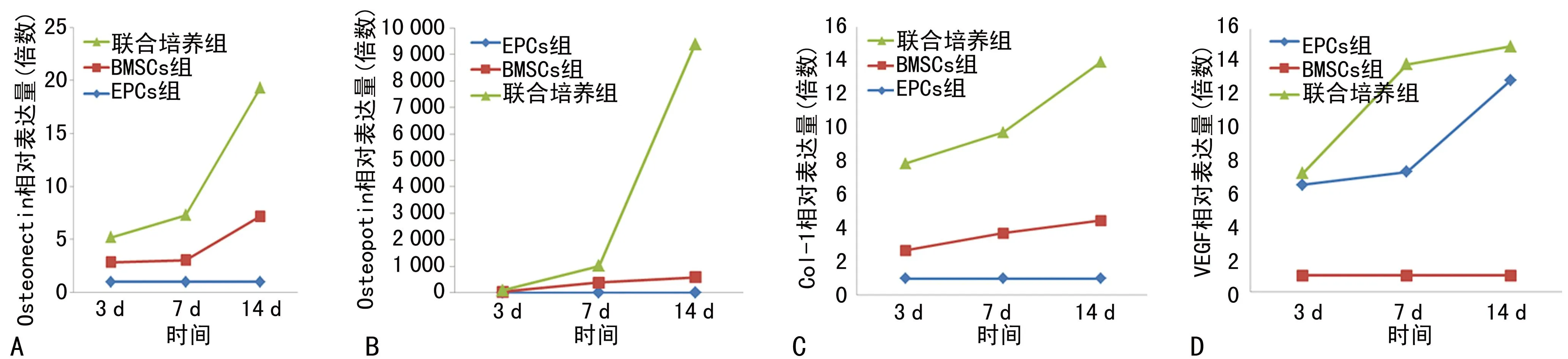
A:Osteonectin ;B:Osteopotin ;C:Col-1 ;D:VEGF;用2-△△Ct计算相对表达量,以实验组/对照组相对比值为计算倍数。
2.2第2、4、8周组织工程骨异位移植大体观察及免疫组织化学染色检测CD34、CD105、ZO-1表达情况
2.2.1第2、4、8周异位移植骨大体观察情况第2周见肌袋边缘软组织包裹组织工程骨,与工程骨局部相连,但组织工程骨边缘锐利,切面可见明显工程骨孔隙;第4周包绕工程骨软组织增多,工程骨表面变红软组织增厚,边缘变钝,部分切面孔隙内见鲜红软组织填充;第8周软组织进一步包裹工程骨,与其分界不清,工程骨边缘圆润,切面大部分孔隙由鲜红软组织填充,以上现象联合培养细胞组最明显(图2A~C),其次为BMSCs组。
2.2.2第2、4、8周CD34、CD105、ZO-1表达情况随着时间延长,组织内表达CD34、CD105、ZO-1的阳性细胞均增多,第2周EPCs及联合培养细胞组见少量阳性细胞,BMSCs组未见阳性细胞;第4周逐渐围成管腔形成新生血管,少量管腔内其内可见红细胞;第8周,见明显新生血管管腔且部分与宿主血管沟通。见图2D~L。采用Image-Pro plus 6.0图像分析软件测量阳性细胞光密度值,第2、4、8周3组间用单因素方差分析进行比较:F2周=5.537,P2周=0.008,F4周=24.167,P4周=0.000,F8周=6.541,P8周=0.004,均P<0.01,第2、4、8周各组间差异均有统计学意义,其中联合培养组阳性细胞光密度值在各时间点最高,进一步两两比较见图2M~O。
A~C:联合培养细胞组生长大体观察;D~F:联合培养细胞组CD34(×200);G~I:联合培养细胞组CD105(×200);J~L:联合培养细胞组ZO-1(×200);M~O:联合培养细胞组第CD34、CD105、ZO-1表达分析图;a:P<0.05,与EPCs组比较;b:P<0.05,与联合培养组比较;c:P<0.05,与BMSCs组比较。
图22、4、8周组织工程骨异位移植联合培养细胞组大体观察及免疫组织化学CD34、CD105、ZO-1表达情况
3讨论
组织工程骨重建是个复杂的过程,不仅涉及骨生成,还涉及血管生成。组织工程骨技术中种子细胞复合到可降解的生物载体上及时形成功能性血管才能保证种子细胞的存活[1]。在细胞和分子水平了解骨和血管生成机制及其相互关系和作用,有助于组织工程骨的存活及与宿主骨的整合,从而修复骨缺损[6]。BMSCs有高度自我更新及多向分化潜能,在体内、体外不同的微环境下均可诱导分化为成骨细胞、成软骨细胞和破骨细胞,又由于其独特的免疫调节作用,取材容易,不涉及伦理道德等特点,是组织工程应用最多的种子细胞[7]。但只使用一种细胞作为种子细胞诱导成骨有一定的局限性,很多时候复合在组织工程支架内的细胞即使同时移植了成骨所需因子,由于未形成与宿主的有效血液循环,没有营养物质供应,在植入后很短时间就会死亡[2],组织工程支架上的种子细胞只有在有氧代谢、细胞灌注充足,保证合理的营养物质供应和代谢产物的排出才能存活[8-9]。研究显示移植复合一种种子细胞的支架结构后,周围宿主血管内营养物质的扩散深度仅约150 μm/h[10],尤其对于体积较大的工程骨,营养物质无法很快进入支架内部,从而使中心复合的干细胞坏死,无法成骨。研究者曾采用人脐静脉内皮细胞、内皮细胞与间充质细胞联合移植促进组织工程骨的血管化,但由于上述两种细胞分化能力较差,会出现明显的移植后凋亡,因此并未被广泛应用。EPCs是内皮细胞的前体细胞,与造血干细胞表达相同表面标志物,存在于脐带血、骨髓及外周血中,骨髓是其最主要的来源,在前炎症因子等的刺激下,可迁移到外周血及组织中,分泌VEGF,其与EPCs上的VEGF受体特异性结合,活化受体细胞内段偶联的络氨酸激酶,催化下游的信号蛋白从而促使EPCs增殖并定向向内皮细胞分化[11],促进新生血管管腔形成,在新生血管生成中起重要作用[12]。有研究将VEGF165基因通过腺病毒载体转染至内皮祖细胞,不仅提高了内皮祖细胞分泌VEGF效率,同时也提高了EPCs自身增殖能力[13],从而表明VEGF是EPCs促进血管生成中最重要的因子。有研究证明[14]粒细胞集落刺激因子(G-CSF)可动员外周血EPCs细胞,提高VEGF和基质细胞衍生因子1(SDF-1)的表达,增强EPCs增殖能力和归巢能力。
BMSCs通过旁分泌分泌多种可溶性细胞因子如VEGF、G-CSF、骨形成蛋白-2(bone morphogeneticp roteins-2,BMP-2)等参与EPCs促进新生血管管腔形成过程,VEGF及G-CSF可被EPCs利用,进一步促进EPCs新生血管及形成血管管腔[15]。有研究报道显示[16]BMSCs与EPCs通过直接接触和旁分泌信号表达相互作用,促进血管和骨的形成:直接接触改变共培养环境,上调黏附蛋白、生长因子等细胞因子的分泌,其中BMP-2与VEGF间的相互作用起着很重要的作用[17]。本实验将自体EPCs及BMSCs按照最佳比例(1∶2)共同培养形成联合培养体系并复合在组织工程支架上,体外培养3、7、14 d检测显示,联合培养细胞组成骨相关因子Osteopotin、Osteonectin、Col-1表达量较BMSCs组及EPCs组明显增加(P<0.01),14 d最高,可见将两种细胞联合培养促进了骨及新生血管的生成。另有报道显示BMSCs可在低氧环境中释放多种血管生成因子及抑制BMSCs细胞向脂肪细胞及成骨、破骨细胞转化,在这里起主要作用的调节因子是作为转录因子的低氧诱导因子(hypoxia-inducing factor 1,HIF-1),它可以通过活化内皮生长因子调节血管形成。在低氧条件下,HIF-1的α亚型呈指数上调,刺激了多种血管形成蛋白如VEGF等级联式地增加,从而促进组织工程骨内新生血管的形成[18-19]。BMP-2既可由BMSCs分泌,其亦是EPCs分泌的重要生长因子[20],在移植后15 min内即可促进BMSCs成骨分化[21-23],将EPCs与BMSCs采用Transwell小室间接共培养,可明显提高BMSCs的干性功能、增殖和分化能力及成骨能力,温丽[24]认为是EPCs旁分泌的细胞因子所起的作用,即在EPCs旁分泌因子的作用下,BMSCs增加了VEGF及BMP-2等的分泌,从而促进了新生血管的形成及成骨。
本实验将联合3组种子细胞的组织工程骨移植至兔四肢肌袋内使其生长分化,观察其变化,培养2个月后,联合培养细胞体系复合的组织工程支架未出现排异反应,且逐步降解,由胶原、骨小梁及新生骨替代,且其内见大量表达CD34、CD105、ZO-1的血管内皮细胞、部分形成血管腔结构且与周围软组织内血管沟通,代表组织工程骨移植成功且血管化良好,认为EPCs可加快组织工程骨内新生血管及血管网的形成,增加BMSCs的存活数量,提高其增殖和成骨转化能力。CD34是特异性的血管内皮细胞标记物,能突出显示较小的不成熟的微血管和单个内皮细胞,然而成熟的血管内皮细胞CD34也可表现为阳性;本研究还采用新生血管特异性标记CD105,其是研究肿瘤、组织工程移植物及血管病变治疗后探讨新生血管生长能力的重要指标。ZO-1是紧密连接蛋白,其表达代表血管为功能性血管,可见流动血流通过,ZO-1与CD105阳性说明新生血管为功能性血管,具有携带营养物质带走代谢产物的功能[25]。
本实验将两种细胞共同培养形成联合培养体系,无论在体内、体外均增加了成骨和成血管因子的表达水平,说明EPCs不仅促进组织工程骨血管化的形成,还促进BMSCs成骨,认为这是在两种细胞直接或间接相互作用基础上形成的,尽管本研究显示了这一结果,但两细胞相互作用的确切分子机制还没有完全明确,有待于进一步研究。本次实验结果为自体细胞复合的组织工程骨应用于临床提供了理论基础。
参考文献
[1]Amini AR,Laurencin CT,Nukavarapu SP.Differential analysis of peripheral blood- and bone marrow-derived endothelial progenitor cells for enhanced vascularization in bone tissue engineering[J].J Orthop Res,2012,30(9):1507-1515.
[2]Kampmann A,Lindhorst D,Schumann P,et al.Additive effect of mesenchymal stem cells and VEGF to vascularization of PLGA scaffolds[J].Microvasc Res,2013,90(1):71-79.
[3]Berendsen AD,Olsen BR.Regulation of adipogenesis and osteogenesis in mesenchymal stem cells by vascular endothelial growth factor A[J].J Intern Med,2015,277(6):674-680.
[4]王福科,刘流,李彦林,等.骨髓基质干细胞与PDPB体外构建组织工程骨的适宜条件[J].中国组织工程研究与临床康复,2008,12(33):6401-6405.
[5]韩雪松.自体种子干细胞体内成骨研究[D].昆明:昆明医科大学,2013.
[6]Song X,Liu S,Qu X,et al.BMP2 and VEGF promote angiogenesis but retard terminal differentiation of osteoblasts in bone regeneration by up-regulating Id1[J].Acta Biochim Biophys Sin (Shanghai),2011,43(10):796-804.
[7]Li M,Ikehara S.Bone-marrow-derived mesenchymal stem cells for organ repair[J].Stem Cells Int,2013,2013:132642.
[8]Schumann P,Tavassol F,Lindhorst D,et al.Consequences of seeded cell type on vascularization of tissue engineering constructs in vivo[J].Microvasc Res,2009,78(2):180-190.
[9]Laschke MW,Strohe A,Scheuer C,et al.In vivo biocompatibility and vascularization of biodegradable porous polyurethane scaffolds for tissue engineering[J].Acta Biomater,2009,5(6):1991-2001.
[10]Ebrahim NA,Leach L.Temporal studies into attachment,VE-cadherin perturbation,and paracellular migration of human umbilical mesenchymal stem cells across umbilical vein endothelial monolayers[J].Stem Cells Dev,2015,24(4):426-436.
[11]Everaert BR,Van Craenenbroeck EM,Hoymans VY,et al.Current perspective of pathophysiological and interventional effects on endothelial progenitor cell biology:focus on PI3K/AKT/eNOS pathway[J].Int J Cardiol,2010,144(3):350-366.
[12]Pedersen TO,Blois AL,Xing Z,et al.Endothelial microvascular networks affect gene-expression profiles and osteogenic potential of tissue-engineered constructs[J].Stem Cell Res Ther,2013,4(3):52.
[13]王伟,刘德红,李卓成,等,转染VEGF基因对内皮祖细胞生长的影响研究[J].中国实验诊断学,2015,19(3):355- 358.
[14]白丽萍,赵志红,陈冲,等.正常成人粒细胞集落刺激因子动员外周血内皮祖细胞的生物学特性[J].中国组织工程研究,2014,18(32):5190-5196.
[15]Wang QR,Wang F,Zhu WB,et al.GM-CSF accelerates proliferation of endothelial progenitor cells from murine bone marrow mononuclear cells in vitro[J].Cytokine,2009,45(3):174-178.
[16]Aguirre A,Planell JA,Engel E.Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis[J].Biochem Biophys Res Commun,2010,400(2):284-291.
[17]Iwasaki H,Kawamoto A,Tjwa M,et al.PlGF repairs myocardial ischemia through mechanisms of angiogenesis,cardioprotection and recruitment of myo-angiogenic competent marrow progenitors[J].PLoS One,2011,6(9):e24872.
[18]Melchiorri AJ,Nguyen BN,Fisher JP.Mesenchymal stem cells:roles and relationships in vascularization[J].Tissue Eng Part B Rev,2014,20(3):218-228.
[19]Wang JA,Chen TL,Jiang J,et al.Hypoxic preconditioning attenuates hypoxia/reoxygenation-induced apoptosis in mesenchymal stem cells[J].Acta Pharmacol Sin,2008,29(1):74-82.
[20]Chen J,Xavier S,Moskowitz-Kassai E,et al.Cathepsin cleavage of sirtuin 1 in endothelial progenitor cells mediates stress-induced premature senescence[J].Am J Pathol,2012,180(3):973-983.
[21]Overman JR,Farré-Guasch E,Helder MN,et al.Short (15 minutes) bone morphogenetic protein-2 treatment stimulates osteogenic differentiation of human adipose stem cells seeded on Calcium phosphate scaffolds in vitro[J].Tissue Eng Part A,2013,19(3/4):571-581.
[22] Chou YF,Zuk PA,Chang TL,et al.Adipose-derived Stem cells and BMP2:Part1.BMP2-treated adipose-derived stem cells do not improve repair of segmental femoral defects[J].Connect Tissue Res 2011,52(2):109-118.
[23] Zuk P,Chou YF,Mussano F,et al.Adipose-derived stem cells and BMP2:Part2.BMP2 maynot influence the osteogenic fate of human adipose-deriveds tem cells[J].Connect Tissue Res,2011,52(2):119-132.
[24]温丽.血管内皮祖细胞对大鼠骨髓间充质干细胞生物学特性调控作用的研究[D].西安:第四军医大学,2013.
[25]Pusztaszeri MP,Seelentag W,Bosman FT.Immunohistochemical expression of endothelial markers CD31,CD34,von Willebrand factor,and Fli-1 in normal human tissues[J].J Histochem Cytochem,2006,54(4):385-395.
Autologous endothelial progenitor cells promote the neovascularization of tissue engineering bone in vitro and vivo*
WuLi1,ZhaoXian2,KeTengfei1,ChenZegu3,LuLin1,WeiHanxiao2,ZhangChenglei4,LiuLiu2△
(1.DepartmentofMedicalImaging,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China;2.DepartmentofPlasticSurgery,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China;3.DepartmentofRadiology,theAffiliatedHaikouHospitalofXiangyaSchoolofMedicine,CentralSouthUniversity,Haikou570208,China;4.DepartmentofVascularSurgery,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China)
[Abstract]ObjectiveInvestigate the ability of autologous endothelial progenitor cells (EPCs) in promoting the neovascularization of tissue engineering bone in vitro and vivo.MethodsCo-culture EPCs drived from autologous peripheral blood and mesenchymal stem cells drived from bone marrow (BMSCs) at the best proportion of 1∶2 which was the largest cell proliferation rate in vitro,osteogenesis related cytokines Osteonectin,Osteopotin,Collagen Type 1(Col-1) and angiogenesis related cytokine VEGF in vitro by using real-time quantitative polymerase chain reaction(PCR),and compared with pure EPCs and BMSCs groups at 3rd,7th and 14th day;the tissue engineering bone seeded with EPCs,BMSCs and co-culture cells (EPCs∶BMSCs=1∶2) were transplanted into rabbit limbs muscle,the growing states of tissue engineering bone were observed at 2,4 and 8 weeks after transplantation,at the same time the expression of CD34,CD105 and ZO-1 were detected with immunohistochemistry staining.ResultsThe mRNA expression of Osteonectin,Osteopotin,Col-1 and VEGF were gradually increased when detected at 3rd,7th and 14th day with real-time PCR,and the co-culture cells group increased most obviously in the three groups in vitro at the same period time(P<0.01);The microvascularization of the engineering biological bone were observed in vivo with immunohistochemistry,and neovascularization of co-culture cells group was also the most obvious group in three groups,immunohistochemical showed that CD34,CD105 and ZO-1 was also higher than the other two groups(P<0.01).ConclusionAutologous EPCs interact with BMSCs could promote vascularization of tissue engineering bone both in vivo and in vitro.
[Key words]stem cells;endothelium,vascular;bone marrow mesenchymal stem cells;neovascularization, physiologic;tissue engineered bone
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.02.005
基金项目:国家自然科学基金资助项目(81460298);云南省科技厅-昆明医科大学应用基础研究联合专项(2015 FB 038)。
作者简介:吴莉(1976-),主治医师,在读博士,主要从事组织工程与分子影像学方面研究。 △通讯作者:E-mail:liuliu3939@126.com。
[中图分类号]R318.08
[文献标识码]A
[文章编号]1671-8348(2016)02-0159-05
(收稿日期:2015-09-10修回日期:2015-10-10)
