GPV感染扰动雏鹅系统互作网络的研究
2016-06-03朱新产王倩文朱峰伟杨丽金
朱新产,王倩文,朱峰伟,杨丽金
(1.青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109;2.青岛即墨畜牧兽医局,山东 即墨 266200)
GPV感染扰动雏鹅系统互作网络的研究
朱新产1,王倩文1,朱峰伟2,杨丽金1
(1.青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛266109;2.青岛即墨畜牧兽医局,山东 即墨266200)
摘要:为了解GPV(Goose parvovirus)侵染的病理学致病机理,探究GPV感染扰动雏鹅动态代谢网络平衡系统,对GPV感染雏鹅血液中的蛋白质、代谢酶活性及其同工酶结构和功能等进行生化分析。结果显示,GPV感染雏鹅的血液中,蛋白酶、Est、POD、SOD、ALP、ADH、Amy、CAT、GPT、LDH活性分别提高约41%/63%,30%/53%,50%/14%,36%/73%,156%/142%,1005%/22%,36%/26%,13%/51%,60%/244%,289%/139%;IgG、IgM含量分别降低约50%,40%;蛋白质含量增长约50%,GPV感染雏鹅的血浆Est、SOD、ADH、Amy同工酶分别新增2,2,1,3条酶谱带,Est同工酶消减2条慢区谱带;血细胞Est、POD、SOD、Amy同工酶分别新增1,2,1,2条酶谱带;血液中CAT、LDH、GPT、ALP同工酶分别出现7,1,3,3条酶带变异,血细胞CAT、ADH同工酶分别缺少快区和慢、快区酶带,ALP同工酶在血浆与血细胞方面分别缺少慢区和快区酶带。同时显示重链59 kDa蛋白带是CK组IgM/G的共同特征,感染组IgG还缺失258,36 kDa蛋白带;血浆与血细胞分别新增加131,86,43,33 kDa和144,104,58,53 kDa蛋白。血浆消减1条慢区酶蛋白,血细胞增加2条慢区酶蛋白。提示GPV感染应激与寄主蛋白质、蛋白酶及同工酶基因表达的协同作用,通过独特的扰动宿主动态平衡代谢网络直接或间接调控细胞易感性能。
关键词:雏鹅;鹅细小病毒;蛋白/酶;同工酶;代谢网络
小鹅瘟(Derzsy′s病)是由鹅细小病毒(Gooseparvovirus,GPV)引起的一种高度接触性、败血性传染病,感染致病具有选择性,主要侵害雏鹅和雏番鸭,病程短,致病性强,病死率高,其流行形式随环境发生新的转变,呈现无规律的散发性流行[1]。虽然宿主在进化中逐步演化、形成了高效的天然免疫系统和获得性免疫系统,分别识别病原体模式分子和抗原分子,二者相互协同,依靠动态平衡调控来抵御病原体干扰,从而实现自我防御功能[2-3]。然而由于病毒基因组大小的限制,病毒已形成了利用宿主细胞机制的能力来推动自身生命周期的有效途径,建立了针对宿主免疫反应的逃逸机制以拮抗宿主的免疫攻击,从而逃避免疫清除,导致病毒性的传染病[4-5]。因此,病毒的免疫调节可能会通过常规或独特的扰动宿主分子防御网络来调控细胞先天免疫反应。基因组测序已确定了诸多与病毒易感性相关联的胚系突变及大量的体细胞基因组变异,但从这些引起或驱动突变的数据集仍然难以区分突变的背景或致病突变[6]。故此研究GPV感染雏鹅的蛋白质、酶与同工酶的变异性,试图探究GPV病毒在侵染过程中与宿主细胞的相互作用,了解病毒入侵细胞扰动代谢网络由稳定的平衡状态到紊乱状态的转换,旨为研究病毒侵入机制和有效预防和控制病毒传播与感染提供科学的理论依据。
1材料和方法
1.1试验动物
随机挑选生长一致、健康的3日龄雏鹅60只(莱阳五龙鹅实验基地提供)。处理组(RD):将种毒GPV YZ(由扬州大学王永坤老师提供)用无菌生理盐水(内含青、链霉素各1 000 U/mL)适当稀释,经口腔接种6日龄的雏鹅,每只接种0.2 mL;对照组(CK)接种等量的生理盐水,连续观察发病症状,分别采集血液,肝素抗凝。
1.2试验方法
1.2.1血浆与血细胞的分离将血样在0~4 ℃,3 000 r/min离心15 min,分别收集上部血浆和下部血细胞。
1.2.2酶/蛋白液的制备取血浆或血细胞0.5 mL,在4 ℃下,用0.5 mol/L PBS (pH值6.8)提取,10 000 r/min离心10 min,收集上清液。
1.2.3蛋白酶和淀粉酶(Amy)活性测定参照文献[7]的方法,分别以酪氨酸和葡萄糖建立标准曲线,蛋白酶用福林酚法,680 nm波长测定光吸收值;淀粉酶用3,5-二硝基水杨酸(DNS)显色,540 nm波长测定光吸收值,按公式:U=A·K·D/10 计算酶活力,U(μg/(mL·min)),A表示吸光值,K为换算系数,D是稀释倍数。
1.2.4乳酸脱氢酶(LDH)和乙醇脱氢酶(ADH)活力测定参照文献[8]的方法,采用丙酮酸钠/乙醇-辅酶Ⅰ法,取80 μL各组织制备酶液,NADH显色,测定340 nm波长吸光度值。以每分钟内吸光度值变化0.001为1个LDH或ADH酶活性单位(U)。计算公式:酶活性单位(U)= ΔA340×Vt/W×Vs×0.001×t,式中,ΔA340为ΔA酶样/min-ΔA空白/min;Vt为酶液总体积;Vs为酶液用量;t为反应时间;W为样品重量。
1.2.5过氧化物酶(POD)和过氧化氢酶(CAT)活力的测定参照文献[9]的方法,分别用愈创木酚法和乙醇-钼酸铵法,取50 μL各组织制备酶液,愈创木酚和钼酸铵显色,在470或405 nm波长测定吸光度值。以每分钟内吸光度值变化 0.01为1个POD或CAT酶活性单位(U)。计算公式:酶活性(U)=ΔA470×Vt/W×Vs×0.01×t,式中,ΔA470(ΔA405)为ΔA酶样-ΔA空白;Vt为酶液总体积(mL),Vs为酶液用量(mL),t为反应时间(min),W为样品重量(g)。

1.2.8碱性磷酸酶(ALP)活力测定参照文献[12]的方法,用磷酸苯二钠法,在510 nm测吸光度值。每100 mL血清在 37 ℃与底物作用 15 min,产生1 mg 酚为1 个金氏单位(Kinggs)。按公式:ALP活力(金氏单位)=(A测定-A对照)×0.05×100/(A标准-A空白)计算。式中:A为吸光度,0.05为酚标准液(0.05 mg/mL),100为所加酶液体积 (mL)。
1.2.9谷丙转氨酶 (GPT) 活性的测定参照文献[13]的方法,以丙酮酸钠-谷氨酸为反应液,2,4-二硝基苯肼显色,520 nm波长测定光吸收值。按公式:转氨酶活性(U)=4×ΔA520×酶液总体积/样品总体积,式中:ΔA520= (A测定-A对照)/(A标准-A空白),4为丙氨酸转氨酶换算单位。1.2.10蛋白质含量检测参照文献[14]的方法,用牛血浆蛋白为标准,紫外法检测,蛋白质(mg/mL)=1.55×A280-0.76×A260,F1=1.115,F2=0.76。1.2.11同工酶PAGE参照文献[15]的方法,分离胶7.0%,浓缩胶2.5%,4 ℃恒流20 mA,电泳6~7 h。蛋白酶用0.12%考马斯亮蓝R250 (CBB) 染色显带;EST 同工酶采用α/β醋酸-偶联剂固兰RR系统染色;POD同工酶和SOD同工酶分别选用联苯胺-Vc-H2O2乙酸缓冲液系统及NBT-核黄素磷酸盐缓冲系统(负染法)染色;ALP 同工酶采用α-萘酚磷酸钠-固兰RR硼酸缓冲液染色系统;LDH同工酶采用辅酶Ⅰ-NBT-乳酸钠-Tris-HCl系统染色;ADH同工酶采用辅酶Ⅰ-NBT-乙醇-Tris-HCl系统染色;GPT同工酶用L-天冬氨酸、α-酮戊二酸Tris-HCl 缓冲系统,吡哆醛-5-磷酸-固蓝BB显色条带;Amy同工酶用淀粉-乙酸缓冲体系预孵,碘显色,冰乙酸/甲醇液固定;CAT同工酶用KMnO4-H2O2中性染色系统(负染法)染色;用无离子水漂洗脱色至背景清晰,pH值4.7乙酸缓冲液固定保存,透射光下照相记录。
1.2.12血液蛋白SDS-PAGE参照文献[16]的方法,分离胶10.0%,浓缩胶2.5%,恒流25 mA,电泳6~7 h,标准蛋白:BM523(M1)、MBI SM0431(M2)。0.12%考马斯亮蓝染色,透射光成像记录。
1.2.13数据分析用BandScan 5.0扫描PAGE凝胶,标记分析。
2结果与分析
2.1血液中蛋白质含量与酶活性的变化
由图1可知,受GPV感染雏鹅的血液,与对照组相比,血浆中RD组的蛋白酶、Est、POD、SOD、ALP、ADH、Amy、CAT、GPT、LDH活性分别增高0.41,0.30,0.50,0.36,1.56,10.05,0.36,0.13,0.64,2.89倍,血细胞中分别增高0.63,0.53,0.14,0.73,1.42,0.22,0.26,0.51,2.44,1.39倍;并且血细胞的POD与GPT活性分别是血浆的202~265,8~17倍,表明POD和GPT主要存在于血细胞内。血浆与血细胞的蛋白质含量也分别升高0.51,0.49倍增长约50%;而免疫球蛋白IgG、IgM含量在血浆与血细胞中分别降低了0.541,0.567和0.475,0.247倍,降低约50%和40%。

指标的系数:Est/LDH/ADH×103;POD(1)×105、(2)×104;ALP/Protein×10;SOD/CAT×102;Amy×10-1;GPT×10-2;
2.2血液中蛋白质结构组成的变化
2.2.1血液中的酶蛋白由图2显示,雏鹅的血液出现了5~9条不同酶蛋白谱带,与对照组相比,受GPV感染雏鹅的血浆中减少1条慢区酶蛋白带,而血细胞增加了2条慢区酶蛋白带,并且酶蛋白带灰度值变化与蛋白酶活性变化相一致。
2.2.2血液中的蛋白质由图3可看出,雏鹅的血液出现了12~18条差别蛋白质谱带,与对照组相比较,GPV感染雏鹅的血浆中新增加131,86,43,33 kDa蛋白条带,血细胞中新增加144,104,58,53 kDa蛋白条带。并且血浆及血细胞蛋白带灰度值变化与其含量变化相一致。

M.迁移距离;G.灰度值;S.信号;CK1.血浆对照组;CK2.血细胞对照组;RD1.血浆GPV感染组;RD2.血细胞GPV感染组。图3-13同。

M1.标准蛋白BM523;M2.标准蛋白MBI SM0431;W.分子质量(kDa)。
2.2.3血清中的免疫球蛋白由图4显示,雏鹅血清IgG的特征蛋白带是58~70 kDa,CK组IgM/G的共同特征蛋白带为59 kDa。CKIgM与RDIgM相比较,大于116 kDa的为6∶4,116~40 kDa的为4∶3,小于45 kDa的为3∶5,RDIgM明显缺失59 kDa特征蛋白带,低分子量蛋白明显占优势,而CKIgM的高分子量蛋白居多。CKIgG与RDIgG相比较,大于116 kDa的为5∶3,116~45 kDa的为5∶5,小于40 kDa的为6∶5,RDIgG明显缺失258,36,59 kDa蛋白带。

M.标准蛋白BM523;CKIgM.对照组IgM;CKIgG.对照组IgG;RDIgM.感染IgM;RDIgG.感染组IgG。
2.3保护酶同工酶的变化
2.3.1酯酶(Est)同工酶由图5显示,雏鹅血液的Est同工酶出现4条差异明显变化谱带,与对照组相比,GPV感染鹅的血浆减少了2条慢区谱带,增加了2条快区谱带。而血细胞新出现1条快区同工酶带,并且Est同工酶谱带灰度值变化与Est的活性变化相一致。

图5 GPV感染雏鹅血液的Est同工酶谱与扫描参数分析
2.3.2过氧化物酶(POD)同工酶由图6可知,GPV感染雏鹅的血细胞POD同工酶出现5条酶带(中区),与对照组比较,新出现2条酶带,而血浆的POD同工酶未显出酶带。血细胞POD同工酶谱带灰度值变化与POD活性的变化相一致。

图6 GPV感染雏鹅血液的POD同工酶谱与扫描参数分析
2.3.3超氧化物歧化酶(SOD)同工酶由图7显示,GPV感染雏鹅血液中的SOD同工酶存在慢、中、快区酶带变异,与对照组比较,GPV感染的血浆与血细胞的SOD同工酶分别增加2,1条中区酶谱带,并且SOD同工酶带灰度值变化与SOD的活性变化相一致。2.3.4过氧化氢酶(CAT)同工酶由图8可知,GPV感染雏鹅血浆中的CAT同工酶存在慢、中、快区7条酶带变异,而血细胞中出现慢、中区3条酶带,缺少快区酶带。与对照组比较,RD组的血浆与血细胞的CAT同工酶谱带灰度值与其酶活性变化相一致。

图7 GPV感染雏鹅血液的SOD同工酶谱与扫描参数分析
2.4脱氢酶同工酶的变化
2.4.1乳酸脱氢酶(LDH)同工酶由图9可看出,GPV感染雏鹅血液中的LDH同工酶出现1个慢区同工酶谱带,与对照组相比,RD组的血浆与血细胞的LDH同工酶谱带灰度值与其酶活性变化相一致。

图9 GPV感染雏鹅血液的LDH同工酶谱与扫描参数分析
2.4.2乙醇脱氢酶(ADH) 同工酶由图10显示,GPV感染雏鹅血液中的ADH同工酶存在慢、中、快区酶带变异,与对照相比,GPV感染的血浆ADH同工酶增加1条快区酶谱带,血细胞缺少慢、快区酶带。并且ADH同工酶带灰度值变化与其活性的变化相一致。

图10 GPV感染雏鹅血液的ADH同工酶谱与扫描参数分析
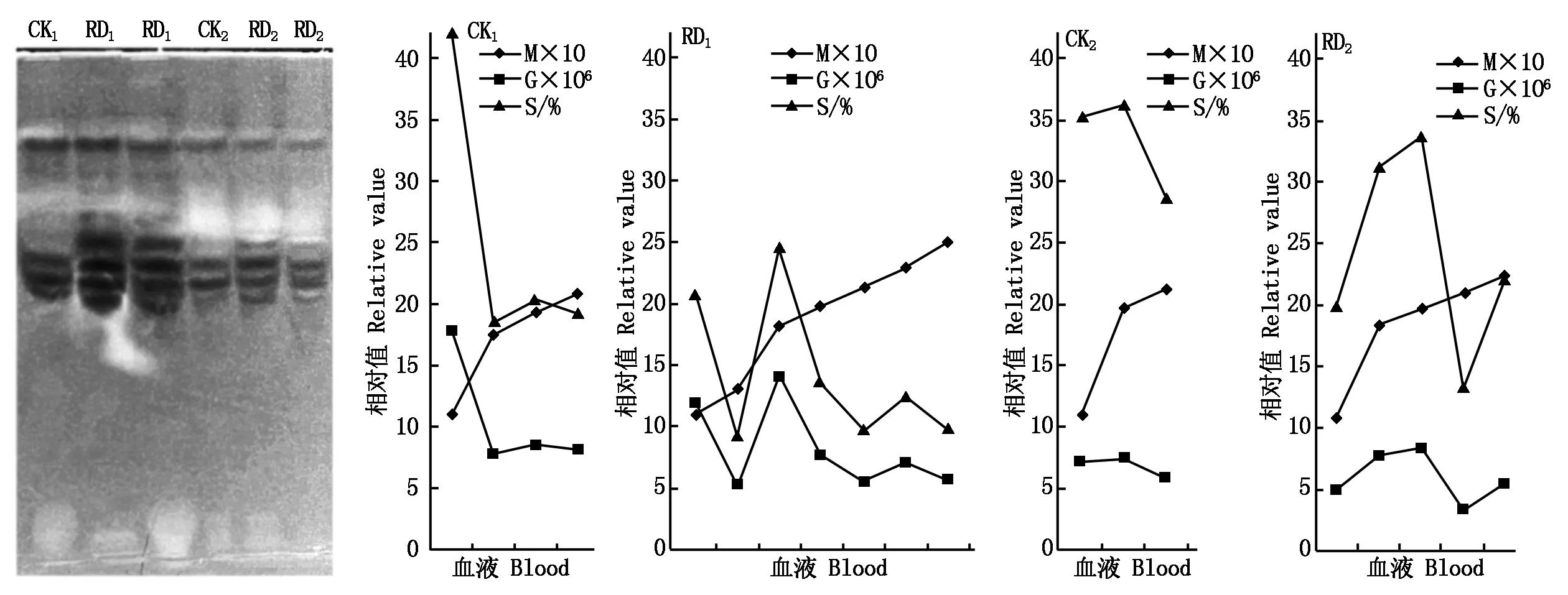
图11 GPV感染雏鹅血液的Amy同工酶谱与扫描参数分析
2.5代谢酶同工酶的变化
2.5.1淀粉酶(Amy)同工酶由图11可知,GPV感染雏鹅血液中出现了3~7个淀粉酶同工酶谱带变化,与对照组相比,GPV感染的血浆与血细胞Amy同工酶分别增加了3,2条中区同工酶带,并且Amy同工酶谱带灰度值变化与Est的活性变化趋势相一致。
2.5.2谷丙转氨酶(GPT)同工酶由图12显示,GPV感染雏鹅的血细胞GPT同工酶出现3条中区酶带,而血浆的GPT同工酶未显出酶带,并且血细胞GPT同工酶谱带灰度值变化与其活性的变化相一致。

图12 GPV感染雏鹅血液的GPT同工酶谱与扫描参数分析
2.5.3碱性磷酸酶(ALP)同工酶由图13可看出,GPV感染雏鹅的血浆与血细胞ALP同工酶存在2,3条酶带变异,分别缺少慢区和快区酶带。ALP同工酶带灰度值变化与其活性的变化相一致。

图13 GPV感染雏鹅血液的ALP同工酶谱与扫描参数分析
2.6GPV感染对动态代谢平衡网络的调控
受GPV感染雏鹅的血液中,蛋白质含量增长,IgG、IgM含量降低,蛋白酶、Est、POD、SOD、ALP、ADH、Amy、CAT、GPT、LDH活性分别不同程度的增高,及其他同工酶谱带的消长差异变化。反映蛋白、酶与同工酶基因表达谱型出现变异体,直接参与了体内代谢网络,GPV感染扰动代谢网络平衡,宿主通过酶蛋白/酶与GPV相互作用调节多种代谢活动,应激理化病状如图14所示。
3讨论
GPV的侵入感染是利用宿主细胞机制的能力来推动自身生命周期,易感性的蛋白/酶是必需的,每一种都会绑定到人类细胞表面的一种特殊受体,并刺激宿主细胞接受病原体。通常情况下,这些受体分子能够执行不同的功能,如调控细胞生长和修复创伤等[17]。酶蛋白/酶多肽缔合分子间互相作用的类型和频率及构型、大小、数目,随细胞的应激环境及功能状态发生特异性变化,密切关联着个体发育的病理理化特征和基因调控机制[18]。因此,GPV病毒在侵染过程中与宿主细胞协同作用,通过常规或独特的扰动宿主分子防御网络,由稳定的代谢平衡状态转换为紊乱状态,从而调控细胞先天免疫反应。本试验结果显示,在受GPV感染雏鹅的血液中,IgG、IgM含量分别降低约50%和40%;蛋白质含量增长约50%,蛋白酶、Est、POD、SOD、ALP、ADH、Amy、CAT、GPT、LDH酶活性分别提高约41%/63%,30%/53%,50%/14%,36%/73%,156%/142%,1005%/22%,36%/26%,13%/51%,60%/244%,289%/139%,蛋白酶和其他酶的同工酶谱带灰度值也呈现类似的增强趋势。Ig具有抗体活性,调节免疫系统[19],蛋白酶调节基质动态平衡,SOD、POD和CAT是演化过程中建立的关键生物防御系统酶,形成解毒系统[20]。Est维持免疫耐受[21],Amy参与生理活动的能量供给和抵御病毒的侵害作用[22];LDH、ADH调节机体的NAD+/NADH的比率与生理机能,GPT调节各种生理活动,增强抗逆性,ALP直接参与磷代谢,与DNA、RNA和蛋白质脂质代谢关联,辅助标记组织损伤程度病理状态。提示GPV感染扰动代谢网络平衡,宿主通过酶蛋白/酶的特征变化与GPV相互作用调节多种代谢活动,协调体内代谢平衡网络。

图14 GPV感染扰动动态代谢平衡调控网络
同工酶的变异型等位基因频率及基因型,随应激环境和遗传基础的不同导致其结构或活性差异变化,反映基因表达差异或特殊功能[23]。本试验结果表明,GPV感染雏鹅的血浆Est、SOD、ADH、Amy同工酶分别新增2,2,1,3条酶谱带,Est同工酶消减2条慢区谱带,POD/GPT同工酶未显出酶带;血细胞Est、POD、SOD、Amy同工酶分别新增1,2,1,2条酶谱带;血液中CAT、LDH、GPT、ALP同工酶分别出现7,1,3,3条酶带变异,血细胞CAT、ADH同工酶分别缺少快区和慢、快区酶带,ALP同工酶在血浆与血细胞分别缺少慢区和快区酶带。提示GPV感染应激同工酶基因与寄主的互作,诱发同工酶基因表达谱型出现变异体,出现显性等位新基因,直接或间接调控酶促反应防御体系,是雏鹅应激GPV感染的敏感酶。
Ig不同组分间共同协作,强化功能,应答多种变化,抵御外源病原微生物的侵袭,而对机体无任何副作用[24]。本试验研究显示,鹅血清IgG的特征蛋白带是重链(58~70 kDa),重链59 kDa蛋白带是CK组IgM/G的共同特征,而RD组明显缺失这个特征蛋白带,RDIgG还缺失258,36 kDa蛋白带。提示GPV的感染影响了雏鹅血清Ig基因的表达,使雏鹅血清IgM/G基因表达的蛋白图谱发生了改变,59 kDa重链Ig是GPV的敏感蛋白,Ig基因是鹅细小病毒的易感基因。同时GPV感染雏鹅的血浆消减了1条慢区酶蛋白,新增加131,86,43,33 kDa蛋白。而血细胞增加2条慢区酶蛋白和144,104,58,53 kDa蛋白。提示GPV感染应激基因表达的变异,改变酶/蛋白构成的亚基结构,直接或间接地调控代谢途径与生理机能,因此,蛋白质、酶及同工酶发生变异的基础是GPV感染与宿主基因表达的协同互作,通过扰动平衡代谢网络直接或间接调节病理性能,是雏鹅应激病症的有效标记。
参考文献:
[1]Shao H,Lü Y,Ye J,et al.Isolation of a goose parvovirus from swan and its molecular characteristics[J].Acta Virologica,2014,58(2):194-198.
[2]Boergeling Y,Rozhdestvensky T S,Schmolke M,et al.Evidence for a novel mechanism of influenza Virus-induced type I interferon expression by a defective RNA-encoded protein[J].PLoS Pathogens,2015,11(5):e1004924.
[3]Li B,Wang Q,Pan X,et al.Bunyamweraviruspossesses a distinct nucleocapsid protein to facilitate genome encapsidation[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(22):9048-9053.
[4]Gulbahce N,Yan H,Dricot A,et al.Viral perturbations of host networks reflect disease etiology[J].PLoS Computational Biology,2012,8(6):e1002531.
[5]Wibawa H,Bingham J,Nuradji H,et al.Experimentally infected domestic ducks show efficient transmission of Indonesian H5N1 highly pathogenic avian influenza virus,but lack persistent viral shedding[J].PLoS One,2014,9(1):e83417.
[6]Rozenblatt-Rosen O,Deo R C,Padi M,et al.Interpreting cancer genomes using systematic host network perturbations by tumour virus proteins[J].Nature,2012,487(748):491-495.
[7]赵峰,张宏福,侯水生,等.鸭空肠液中淀粉酶、胰蛋白酶、糜蛋白酶活性变异的研究[J].畜牧兽医学报,2008,39(5):601-607.
[8]邓艳美.水牛血液与乳中LDH活力的对比研究[J].中国畜牧兽医,2008,35(4):134-135.
[9]Allison S D,Schultz J C.Differential activity of peroxidase isozymes in response to wounding,gypsy moth,and plant hormones in northern red oak (QuercusrubraL.)[J].Journal of Chemical Ecology,2004,30(7):1363-1379.
[10]江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
[11]张宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报:自然科学版,2002,33(6):677-681.
[12]刘维全.动物生物化学实验指导[M].北京:中国农业出版社,2008:90-92.
[13]叶晓健,田纪伟,高岱峰,等.脊髓半切伤大鼠血清谷丙转氨酶和谷草转氨酶活性变化的研究[J].中国临床康复,2004,8(17):3282-3283.
[14]Shim S M,Kim J H,Jung S E,et al.Multilaboratory assessment of variations in spectrophotometry-based DNA quantity and purity indexes[J].Biopreservation and Biobanking,2010,8(4):187-192.
[15]赵永芳.生物化学技术原理及其应用[M].武汉:武汉大学出版社,1994:287-295.
[16]朱新产,邵艳红,朱峰伟,等.鹅细小病毒感染雏鹅的免疫球蛋白IgG/IgM变异性研究[J].华北农学报,2015,30(1):42-53.
[17]Kajihara M,Sakoda Y,Soda K,et al.ThePA2,PA,HA,NP,andNSgenes of a highly pathogenic avian influenza virus A/whooper swan/Mongolia/3/2005 (H5N1) are responsible for pathogenicity in ducks[J].Virol J,2013,10:45.
[18]Danchenko O O,Kalytka V V.Formation of antioxidant defence system of geese in embryogenesis and early postnatal ontogenesis[J].Ukrains′kyi Biokhimichnyi Zhurnal,2004,74(4):120-124.
[19]Li F.Receptor recognition mechanisms of coronaviruses:a decade of structural studies[J].Journal of Virology,2015,89(4):1954-1964.
[20]Shah K,Nahakpam S.Heat exposure alters the expression of SOD,POD,APX and CAT isozymes and mitigates low cadmium toxicity in seedlings of sensitive and tolerant rice cultivars[J].Plant Physiol Biochem,2012,57:106-113.
[21]Surolia I,Pirnie S P,Chellappa V,et al.Functionally defective germline variants of sialic acid acetylesterase in autoimmunity[J].Nature,2010,466(733):243-247.
[22]Kumagai Y,Satoh T,Inoue A,et al.Enzymatic properties and primary structures of two α-amylase isozymes from the Pacific abalone haliotis discus hannai[J].Comparative Biochemistry and Physiology,2013,164(2):80-88.
[23]Niyomploy P,Srisomsap C,Chokchaichamnankit D,et al.Superoxide dismutase isozyme detection using two-dimensional gel electrophoresis zymograms[J].J Pharm Biomed Anal,2014,90:72-77.
[24]Guo Y,Gao M,Wang J.A novel gene encoding goose immunoglobulin λ light chain[J].Acta Biochimica et Biophysica Sinica,2012,44(9):805-806.
Study on Perturbing Systematic Interaction Network of GPV-gosling in an Infectious Context
ZHU Xinchan1,WANG Qianwen1,ZHU Fengwei2,YANG Lijin1
(1.College of Life Science,Qingdao Agricultural University,Key Laboratory of Plant Biotechnology in University of Shandong Province,Qingdao266109,China;2.Jimo Bureau of Animal Husbandry and Veterinary,Jimo266200,China)
Abstract:Perturbing systematic host network for Goose parvovirus (GPV) in natural infection were still unknown.Understanding pathogenic mechanism required that protein,enzymes and isozyme from goslings infected as manifestations of network properties,rather than simply as the result of individual variations.Here blood of experimentally GPV infected goslings were examined by biochemical analysis.The results indicated that the activity of protease,Est,POD,SOD,ALP,ADH,Amy,CAT,GPT and LDH from goslings infected GPV were higher 41%/63%,30%/53%,50%/14%,36%/73%,156%/142%,1005%/22%,36%/26%,13%/51%,60%/244%,289%/139% than that of control group respectively.The content of IgG and IgM from goslings infected GPV were lower 50%,40% than that of control group respectively,but protein was higher 50%.The isozyme of Est,SOD,ADH and Amy appeared 2,2,1,3 new enzyme band respectively,but deleted 2 slow-zone Est isozyme band in the serum of goslings infected Goose parvovirus.The isozyme of Est,POD,SOD and Amy appeared 1,2,1,2 new enzyme band in the blood corpuscle of goslings infected Goose parvovirus respectively.The isozyme of CAT,LDH,GPT and ALP appeared 7,1,3,3 variation band in the blood of goslings infected GPV respectively.The isozyme of CAT and ADH defected fast-zone and slow-zone,fast-zone band in the blood corpuscle of goslings infected Goose parvovirus respectively.The isozyme of ALP defected slow-zone and fast-zone band in the serum and blood corpuscle of goslings infected GPV respectively.At the same time,it also showed that the 59 kDa protein band was a common feature of IgM/G in gosling,and IgG deleted still 258,36 kDa protein in the blood of goslings infected Goose parvovirus.The protein were increased by 131,86,43,33 kDa and 144,104,58,53 kDa band in the serum and blood corpuscle of goslings infected Goose parvovirus respectively.There were deleted 1 slow-zone zymoprotein band in the serum of goslings infected GPV,and increased 2 slow-zone zymoprotein band in the blood corpuscle of goslings infected GPV.Those suggested that the interaction of GPV stress and host protein/enzymes and isozyme gene expression,through unique host dynamic balance of metabolic network directly or indirectly regulated cell disturbance susceptible performance.
Key words:Gosling;Goose parvovirus;Protein/Enzymes;Isozyme;Metabolic network
doi:10.7668/hbnxb.2016.02.032
中图分类号:S852.3
文献标识码:A
文章编号:1000-7091(2016)02-0195-10
作者简介:朱新产(1959-),男,陕西武功人,教授,博士,主要从事病毒感染致病机制研究。
基金项目:山东省自然科学基金项目(ZR2011CM008);青岛市科技发展计划项目(12-1-4-5-(2)-jch)
收稿日期:2015-12-04
