高效液相色谱法测定西柚不同组织中的10种柑橘黄酮类化合物
2016-05-30王智聪沙跃兵余笑波王珂
王智聪 沙跃兵 余笑波 王珂
摘 要:该文建立了圣草次苷、柚皮芸香苷、柚皮苷、橙皮苷、新橙皮苷、香风草苷、枸橘苷、甜橙黄酮、川皮苷和蜜橘黄酮等10种柑橘黄酮类化合物同时测定的高效液相色谱方法。色谱柱为Welch Ultimate XB-C18(5μm,4.6×150mm),采用甲醇-水(含0.1%甲酸)流动相体系,梯度洗脱,检测波长为280nm。方法学考察结果表明,对10种柑橘黄酮类化合物,提取效率均大于95%;在给定的范围内线性关系良好,相关系数r2均大于0.99;方法的精密度和重现性良好,相对标准偏差(RSD)分别小于5.4%和7.1%。该方法用于西柚不同组织中柑橘黄酮类化合物含量的测定,结果显示,柑橘黄酮类化合物在西柚果皮、囊衣和果瓣中的含量和分布差异显著。
关键词:柑橘黄酮类化合物;西柚;不同组织;高效液相色谱法
中图分类号 TS201.1 文献标识码 A 文章编号 1007-7731(2016)18-0099-06
Determination of 10 Citrus Flavonoids in Different Parts of Grapefruit by High Performance Liquid Chromatography
Wang Zhicong et al.
(Zhejiang Province Institute of Metrology,Hangzhou 310018,China)
Abstract:A simple method was developed in this paper for simultaneous determination of 10 citrus flavonoids by high performance liquid chromatography,the compounds includes eriocitrin,narirutin,naringin,hesperidin,neohesperidin,didymin,poncirin,sinensetin,nobiletion and tangeretin. The samples were separated by Welch Ultimate XB-C18 column(5μm,4.6×150mm)using methanol and 0.1% formic acid aqueous solution as mobile phases by gradient elution detected by 280nm. The results showed that there are good extraction efficiencies greater than 95%,good linear ranges with good correlation coefficients(r2)greater than 0.99,and good precisions and repeatabilities with relative standard deviations(RSD)less than 5.4% and 7.1% for all 10 citrus flavonoids. The method was used for citrus flavonoids determination in various parts of grapefruit,the results showed that the amounts and distributions of citrus flavonoids have significant differences in grapefruit peel,utricle and pulp.
Key words:Citrus flavonoids;Grapefruit;Different parts;High performance liquid chromatography
西柚,又称葡萄柚,属芸香科柑桔属植物,由橙和柚天然杂交而成。西柚果实皮薄汁多,酸甜略带苦味,风味独特、口感好,具有较高的营养价值和药用价值,深受国内老百姓的喜爱。李时珍在《本草纲目》中记载:“柚,功能消食,解酒毒,去肠胃中恶气,长发滋燥,疗妊妇不思食口淡”。柚中含有多种对人体健康有益的活性物质,如黄酮类化合物、柠檬苦素类化合物和精油等[1-2]。现代医学研究表明,柚皮提取物具有抗氧化、清除自由基、抗癌、抗衰老、抑酶、降血糖和降血压等多种功能活性[3-7]。柑橘中的黄酮类化合物主要包括两类,一是黄烷酮类化合物,多以糖苷的型式存在,如圣草次苷、橙皮苷、新橙皮苷、柚皮芸香苷、柚皮苷、香风草苷和枸橘苷等,其主要区别是黄酮母体结构A环-7位和C环-3′、-4′位置取代基因的差异;其中A环-7位以芸香糖苷和新橙皮糖苷为主,形成多种同分异构体,如橙皮苷/新橙皮苷、柚皮芸香苷/柚皮苷、香风草苷/枸橘苷等;二是多甲氧基黄酮类化合物,如甜橙黄酮、川皮苷和蜜橘黄酮等,主要区别在于黄酮母体结构A环-8位和C环-3′位甲氧基数目和位置的差异。
目前柑橘黄酮类化合物的测定方法主要有高效液相色谱法[8-11]和液相色谱-质谱联用法[12]等。李利改等[13]研究了不同种类柑橘的花、皮和叶中柑橘黄酮类化合物的分布;吴倩等[14]研究了常山胡柚的皮、肉和籽中柚皮苷、橙皮苷和新橙皮苷等三种柑橘黄酮的含量分布。本文以西柚整果为研究对象,探讨了西柚可食部分(果瓣)及副产物(果皮和囊衣)等不同组织中柑橘黄酮类化合物的分布特征。
1 材料与方法
1.1 仪器与试剂 Alliance e2695高效液相色谱,配光电二极管阵列检测器和Empower 3数据处理系统(美国Waters公司);AG285精密电子天平(瑞士Mettler Toledo公司);5810R高速冷冻离心机(德国Eppendorf公司);Christ冷冻干燥浓缩仪(德国Christ公司);KQ-100DE数控超声仪(昆山超声仪器有限公司);Milli-Q超纯水系统(美国Millipore公司)。甲醇(色谱纯)购自德国Merck公司;甲酸(分析纯)购自美国Sigma-Aldrich公司;氨水(分析纯)购自上海国药集团;圣草次苷、柚皮芸香苷、柚皮苷、橙皮苷、新橙皮苷、香风草苷和枸橘苷标准品购自上海诗丹德生物技术有限公司;甜橙黄酮、川皮苷和蜜橘黄酮标准品购自上海同田生物技术有限公司;西柚购自当地超市。
1.2 实验方法
1.2.1 标准工作溶液的配制 分别称取适量圣草次苷、柚皮芸香苷、柚皮苷、橙皮苷、新橙皮苷、香风草苷、枸橘苷、甜橙黄酮、川皮苷和蜜橘黄酮标准品,加适量甲醇(对橙皮苷,添加少量氨水)漩涡震荡、超声溶解,配制浓度均为2.00mg/mL的母液;再用甲醇和水序列稀释,配制浓度分别为10.0、15.0、20.0、30.0、50.0、100和200μg/mL的混合标准工作溶液,对橙皮苷,增加400、750和1 000μg/mL的标准曲线工作点,所有标准工作溶液中甲醇的体积含量约为50%。
1.2.2 样品的制备 取个头适中的西柚数个,用超纯水清洗外皮,并擦干;小心剥离果皮,果瓣去除囊衣;分别收集果皮、囊衣和果瓣,置于-35℃冰箱冷冻12h;再冷冻干燥72h;取出置于粉碎机粉碎,干燥密闭保存。分别称取适量上述制备的干燥果皮、囊衣和果瓣样品,按照1∶25的料液比,加50%的甲醇-水(体积比)溶液,超声提取30min,取出于7 000rpm离心10min,倒出上清液;残渣再按照上述方法提取1次;合并上清液,混匀,用超纯水稀释2倍后进行测定。
1.2.3 液相色谱分析条件 色谱柱:Welch Ultimate XB-C18(5μm,4.6×150mm);柱温:35℃;流速:1.0mL/min;流动相A:含0.1%甲酸的水溶液;流动相B:甲醇;梯度洗脱:30%B(0min)~30%B(2min)~50%B(15min)~70%B(18min)~90%B(25min)~98%B(26min)~98%B(30min)~30%B(31min)~30%B(35min);紫外检测波长:280nm;进样体积:10μL。
2 结果与分析
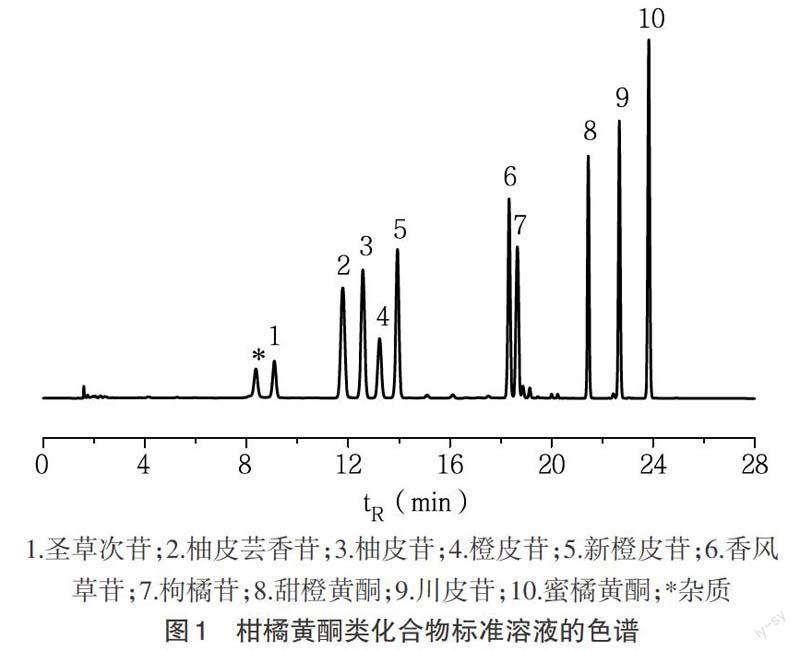
2.1 液相色谱分析方法的建立 柑橘类水果成分复杂,既有极性较大的糖类、氨基酸类、有机酸类和酚酸类等,又有极性适中的黄烷酮类和极性较小的多甲氧基黄酮等,为了有效地进行组分的分离,实验比较了不同梯度洗脱方式对分离的影响。在梯度开始前采用较低比例的甲醇洗脱一定时间,有利于洗脱极性较大的干扰杂质而不影响目标组分的分离,待测化合物中圣草次苷的极性最大,保留因子k为3.14。待测化合物中有多种同分异构体,如柚皮芸香苷和柚皮苷、橙皮苷和新橙皮苷、香风草苷和枸橘苷、甜橙黄酮和蜜橘黄酮等,在优化的梯度条件下各组分均得到了良好的分离。10种柑橘黄酮类化合物的色谱如图1所示。
2.2 样品提取条件的优化 以西柚果皮为例,考察提取溶剂、料液比、提取时间及提取次数等对提取效率的影响。
2.2.1 提取溶剂的优化 称取冷冻干燥粉碎后的果皮样品1g(精确至0.001g)6份,按照1∶25的料液比,分别加入25mL 40%、50%、60%、70%、80%和90%的甲醇-水溶液(体积比),超声提取30min;取出于7 000r离心10min,上清液用超纯水稀释2倍后,进行液相色谱分析。在提取方法优化中,选择黄烷酮糖苷类化合物柚皮苷为代表,以及多甲氧基黄酮类化合物蜜橘黄酮为代表。以柚皮苷和蜜橘黄酮为例,在不同提取溶剂的情况下,柚皮苷和蜜橘黄酮提取含量的变化如图2所示。从图2可以看出,柚皮苷和蜜橘黄酮含量随提取溶剂中甲醇含量的增加先增大后减少,在50%甲醇含量的情况下,柑橘黄酮类化合物的提取含量最大。增加提取溶剂中甲醇的含量,有利于柑橘中柑橘黄酮类化合物的浸出;但提取溶剂中甲醇含量太高,柑橘黄酮类化合物的含量反而降低,其原因可能是甲醇的极性较大,反而不利于其浸出。因此,试验中采用甲醇含量为50%的提取溶剂。
2.2.2 料液比的优化 称取冷冻干燥粉碎后的果皮样品1g(精确至0.001g)6份,按照1∶10、1∶20、1∶25、1∶30、1∶40和1∶50的料液比,分别加入10、20、25、30、40和50mL的50%甲醇-水溶液(体积比),超声提取30min;取出于7 000r离心10min,上清液用超纯水稀释2倍后,进行液相色谱分析。以柚皮苷和蜜橘黄酮为例,在不同料液比的情况下,其含量变化如图3所示。从图3可以看出,柑橘黄酮类化合物的含量随料液比的增加而增加,但料液比大于25后,其含量变化不大。总体来看,增大料液比,提取效率有所增加,但提取液中柑橘黄酮类化合物的浓度变低,考虑到西柚中某些柑橘黄酮类化合物的含量较低,提取液浓度太低,不利于其测定。因此,试验中采用1∶25的料液比。
2.2.3 提取时间的优化 称取冷冻干燥粉碎后的果皮样品1g(精确至0.001g)6份,按照1∶25的料液比,加入25mL 50%的甲醇-水溶液,分别超声5、10、20、30、45和60min;取出于7 000r离心10min,上清液用超纯水稀释2倍后,进行液相色谱分析。以柚皮苷和蜜橘黄酮为例,其含量变化如图4所示。从图4可以看出,超声时间小于20min,各种柑橘黄酮类化合物的变化差异较大,超声30min后,其提取效率趋于一致,因此,试验中选择超声30min。
2.2.4 提取次数的优化 称取冷冻干燥粉碎后的果皮样品1g(精确至0.001g),按照1∶25的料液比,加入25mL 50%的甲醇-水溶液,超声提取30min,取出于7 000r离心10min,倒出上清液;残渣再加入25mL 50%的甲醇-水溶液分别提取3次。对每次提取离心后的上清液,用超纯水稀释2倍后进行液相色谱分析。以柚皮苷和蜜橘黄酮为例,其提取效率如图5所示。从图5可以看出,柑橘黄酮类化合物的含量随提取次数的增加而增加,提取2次后,提取回收率大于95%,提取3次后,提取回收率大于99%,试验中选择提取2次。
2.3 线性关系、线性范围和检出限 对1.2.1节配制的标准工作溶液,按照1.2.3节的色谱方法进行分析,以标准品的浓度为横坐标,以峰面积为纵坐标,进行线性回归。以标准曲线的最低点为最低定量浓度,以3倍信噪比(S/N)计算检出限。各柑橘黄酮类化合物的回归方程、线性范围、相关系数和检出限如表1所示,结果表明各柑橘黄酮类化合物在给定浓度范围内线性关系良好,相关系数(r2)大于0.99,方法的检出限小于1μg/mL。
2.4 方法精密度 对1.2.1节配制的10种柑橘黄酮类化合物的储备液,用甲醇和水进行稀释,配制浓度均为25.0和150μg/mL的混合质量控制溶液,按照1.2.3节的色谱方法进行分析,重复进样5针,考察各柑橘黄酮类化合物峰面积的变化。对25.0μg/mL和150μg/mL两种不同浓度的混合质量控制溶液,10种柑橘黄酮类化合物测定结果的相对标准偏差(RSD)均小于5.4%和3.9%,表明方法的精密度良好。
2.5 方法重现性 以西柚果皮为例,称取5份样品,按照1.2.2节的提取方法,独立进行提取和分析,考察各柑橘黄酮类化合物峰面积的变化。对10种柑橘黄酮类化合物,测定结果的相对标准偏差(RSD)均小于7.1%,表明方法的重现性良好。
2.6 样品的测定 对1.2.2节制备的西柚果皮、囊衣和果瓣冷冻干燥样品,每个样品独立提取3次,按照1.2.3节的色谱方法进行分析,其色谱如图6所示。
按照2.3节所述方法进行外标法定量分析,对西柚果皮、囊衣和果瓣等不同组织,柑橘黄酮类化合物的含量按照公式1进行计算。
[C=C'×V×Dm] (1)
式中:C表示西柚各组织中柑橘黄酮类化合物的含量(mg/kg),C'表示由标准曲线读出的含量(μg/mL),V表示样品提取的总体积(mL),D表示进样前的稀释倍数,m表示样品的称取质量(g)。
西柚冷冻干燥果皮、囊衣和果瓣中柑橘黄酮类化合物的含量测定结果如表2所示。从表2可以看出,西柚各组织的冻干产品,囊衣中的总黄酮(10种柑橘黄酮的总量)含量最高,达73.8mg/kg,其次是果皮,总黄酮含量为61.6mg/kg,果瓣中总黄酮含量最低,为6.57mg/kg。在总黄酮含量的比例中,三种组织中柚皮芸香苷和柚皮苷的含量最高,所占比例大体一致,为87.4%~89.0%。在果皮、囊衣和果瓣中,柚皮苷的含量比例递减,分别为80.7%、75.0%和61.2%;而柚皮芸香苷的含量比例递增,分别为8.5%、12.7%和26.3%,其中果瓣中柚皮芸香苷的含量分别是囊衣和果皮的2倍和3倍。枸橘苷的含量仅次于柚皮芸香苷,在果皮、囊衣和果瓣中其占总黄酮的比例分别为7.2%、9.1%和4.0%。橙皮苷和新橙皮苷的含量在三种组织中的含量为0.5%~3.4%,其中果瓣中橙皮苷和新橙皮苷的含量较果皮和囊衣中的含量多5~7倍。三种甲氧基黄酮的含量之和均小于0.5%,其中囊衣中含量最低,接近于0。
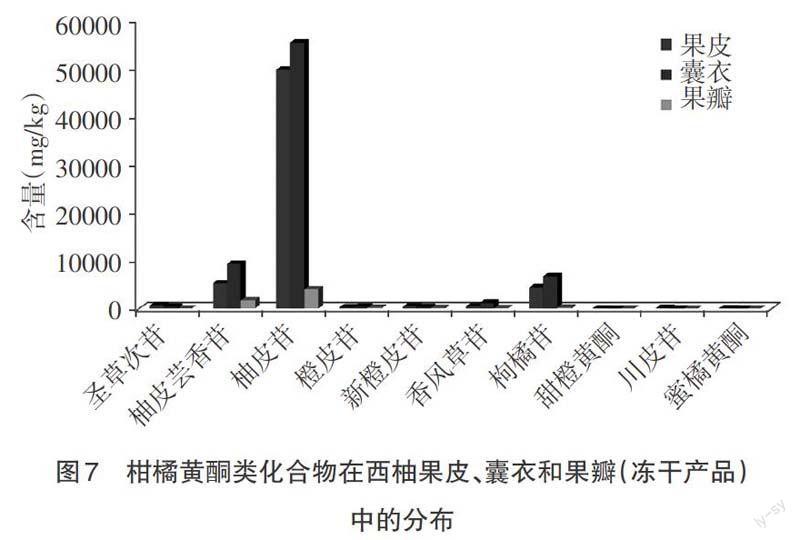
通过上述分析可以看出,西柚的不同组织如果皮、囊衣和果瓣,其中柑橘黄酮类化合物的含量和分布差异显著,如图7所示。
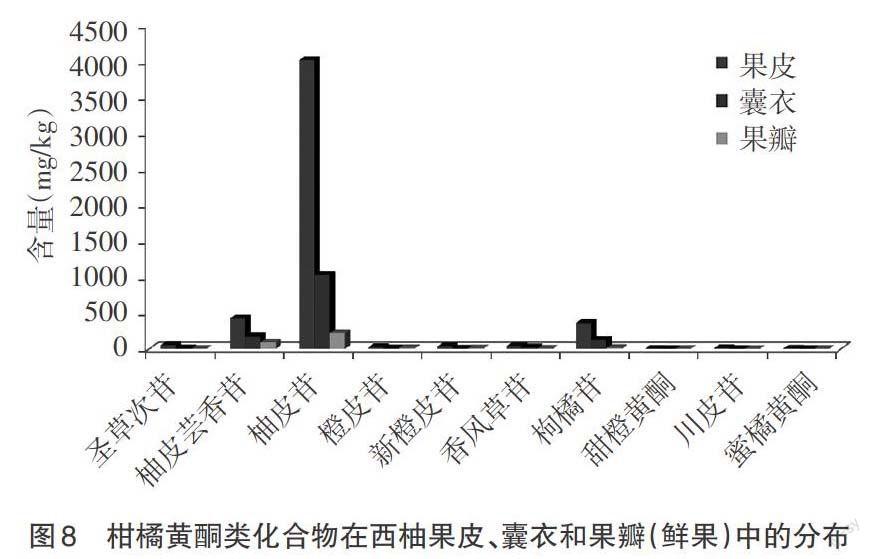
西柚鲜果中果皮约占总重的21.4%,囊衣约占8.1%,果瓣约占70.5%;对各组织冷冻干燥后,果皮失重62.2%,囊衣失重70.0%,果瓣失重92.3%。通过表2的分析可以看出,柑橘黄酮在冻干后西柚不同组织如果皮、囊衣和果瓣中的含量及其分布,由于各组织在鲜果中重量的不同和含水量的不同,柑橘黄酮类化合物在鲜果中的分布表现出另外的特点,如图8所示。
比较图7和图8可以看出,在西柚不同组织的冻干产品中,果皮、囊衣和果瓣中柑橘黄酮类化合物的总量分别占西柚总黄酮含量的43.4%、52.0%和4.6%;而在鲜果中,果皮、囊衣和果瓣中柑橘黄酮类化合物的总量分别占西柚总黄酮含量的74.2%、20.4%和5.3%。由于果皮和囊衣含水量相近,而果皮比囊衣所占西柚总质量的比重较大,导致鲜果中果皮所含黄酮的总量占比加大,从43.4%上升至74.2%,相反,囊衣所含黄酮的总量从52.0%下降至20.4%。对总黄酮中含量较高的柚皮芸香苷和柚皮苷来讲,有相同的变化趋势。果瓣为西柚鲜果的可食部分,其中柑橘黄酮的含量约占西柚鲜果总黄酮含量的5.3%,西柚中大部分的柑橘黄酮存在于果皮和囊衣中。另外,西柚不同组织中所含柚皮芸香苷和柚皮苷的含量差异巨大,果瓣中含有较多的柚皮芸香苷,在柑橘类水果中呈现出西柚独特的口感和风味。
3 结论
本文建立了西柚不同组织中10种柑橘黄酮类化合物的测定方法,通过色谱分离条件的优化,各组分取得了良好的分离度,该方法提取效率高、线性关系好、检出限低、精密度高。该方法用于西柚不同组织中柑橘黄酮类化合物含量的测定,结果显示西柚果皮、囊衣和果瓣中柑橘黄酮类化合物的含量和分布特征差异显著。所建立的方法对西柚加工副产物的综合利用,西柚产品的基础营养、保健和药理研究,以及柑橘黄酮类化合物标准品的纯化制备等具有重要的意义。
参考文献
[1]史海芝,刘惠民,李贤忠.引进美国葡萄柚果实营养分析[J].山东林业科技,2009,181(2):28-31.
[2]邓婷婷,刘素纯,贺建华.柚皮提取物有效成分的研究概况[J].中国食物与营养,2008,22(6):16-19.
[3]万利秀,肖更生,徐玉娟,等.不同品种柑橘皮中黄酮化合物含量及抗氧化性分析[J].食品与发酵工艺,2011,37(4):73-77.
[4]张桂伟,张秋云,江东,等.中国主栽葡萄柚果肉酚类物质组成及其抗氧化活性[J].中国农业科学,2015,48(9):1785-1794.
[5]Khan M K,Huma Z E,Dangles O.A comprehensive review on flavanones,the major citrus polyphenols[J].Journal of Food Composition and Analysis,2014,33:85-104.
[6]黄明发,苏学素,焦比宁,等.柑橘多甲氧基黄酮的检测及分离纯化技术研究进展[J].食品科学,2009,30(1):275-281.
[7]Tripoli E,Guardia M,Giammanco S,et al.Citrus flavonoids:molecular structure,biological activity and nutritional properties:A review[J].Food Chemistry,2007,104:466-479.
[8]Moulya P,Gaydou E M,Auffray A.Simultaneous separation of flavanoneglycosides and polymethoxylated flavones in citrus juices using liquid chromatography[J].Journal of Chromatography A,1998,800:171-179.
[9]张元梅,周志钦,孙玉敬,等.高效液相色谱法同时测定柑橘果实中18种类黄酮的含量[J].中国农业科学,2012,45(17):3558-3565.
[10]郑洁,赵其阳,张耀海,等.超高效液相色谱法同时测定柑橘中主要酚酸和类黄酮物质[J].中国农业科学,2014,47(23):4706-4717.
[11]Remon A M,Tulipani S,Ribalta M R,et al.A fast method coupling ultrahigh performance liquid chromatography with diode array detection for flavonoid quantification in citrus fruit extracts[J].Journal of Agricultural and Food Chemistry,2011,59:6353-6359.
[12]Bilbao M L,Lacueva C A,Jauregui O,et al.Determination of flavonoids in a Citrus fruit extract by LC-DAD and LC-MS[J].Food Chemistry,2007,101:1742-1747.
[13]李利改,席万鹏,张元梅,等.中国特有柑橘属植物基本类型不同组织类黄酮含量分析[J].中国农业科学,2013,46(22):4753-4762.
[14]吴倩,朴香兰,杨静.胡柚中3种主要黄酮类物质的含量测定[J].食品科学,2011,32(18):168-170. (责编:张宏民)
