利用cDNA阵列初步发掘橡胶树抗寒相关基因
2016-05-30程汉张燕燕蔡海滨安泽伟胡彦师黄华孙
程汉 张燕燕 蔡海滨 安泽伟 胡彦师 黄华孙


摘 要 通过橡胶树低温诱导全长cDNA文库,构建了1个含有11 708个Unigene的cDNA阵列。使用这些cDNA阵列对橡胶树抗寒品种93-114和低温敏感种质材料热垦501进行基因表达谱研究。结果表明,在低温诱导情况下,共有84个基因差异表达,其中52个上调表达,32个下调表达。在抗寒品种和低温敏感种质材料间的差异基因有21个,其中在93-114中上调的有12个,下调的有9个。进一步对这些基因进行了功能注释。
关键词 橡胶树;cDNA文库;cDNA阵列;抗寒;差异基因
中图分类号 Q78;S794.1 文献标识码 A
Abstract The rubber tree cDNA arrays containing 11 708 unigenes were constructed using a cold inducing cDNA library. The arrays were used to study the gene expression in rubber tree cold resistant clone 93-114 and cold sensitive clone Reken 501. The results demonstrated that 84 genes differentially expressed under cold treatment, in which 52 genes were up-regulated, while 32 down-regulated. The differentially expressing gene number between 93-114 and Reken 501 was 21, in which 12 genes were highly expressed and 9 lowly expressed in 93-114. These genes were further functionally annotated. This study provides empirical evidence for the development of gene microarray in rubber tree, and also contribute the data for the identification of cold resistant genes in Hevea brasiliensis.
Key words Hevea brasiliensis; cDNA library; cDNA array; Cold resistance; Differential gene
doi 10.3969/j.issn.1000-2561.2016.06.007
低溫是影响植物分布、生长发育和产量的重要环境限制因子。对于原产于亚马逊河流域的巴西橡胶树来说,低温更是限制其地理分布的重要因子。在我国,适宜种植橡胶的栽培区域主要分布在海南、云南和广东等热带北缘地区,低温寒害每年都会发生,严重影响到橡胶树的产量及其经济寿命,特别是较大寒潮来袭时,往往有成片胶园遭受毁灭性的破坏。因此,低温寒害是制约我国橡胶产业发展的最主要的环境限制因子。
近年来,借助分子生物学手段,植物抗寒机制研究进展迅速。目前已经分离鉴定出一系列低温诱导功能基因,同时也发现多条低温信号途径[1-7]。然而这些研究大多集中在拟南芥等温带植物中,在非低温驯化植物如热带起源的橡胶树中的研究较少。在多条冷诱导途径中,拟南芥的CBF信号途径研究较为透彻[5,8-9]。然而由于植物抗寒是个复杂性状,是多个基因协调作用的结果,在抗寒育种中转入单个抗寒基因往往达不到较好的抗寒效果。因此,要想有效地提高植物的抗寒性,必须深入研究植物感受和传导低温信号的机制,以及植物抗寒的分子机理。进一步探索植物抗寒机理不仅在理论上具有重要意义,在生产实践中也具有广泛的应用价值。
本研究以低温诱导巴西橡胶树cDNA文库为基础[10],利用cDNA阵列的方法,从巴西橡胶树低温cDNA文库中筛选冷应答基因调控网络中的一些抗寒相关基因,分析其功能及各个基因之间的相互关系,为研究橡胶树抗寒胁迫的分子机理打下基础,并最终为橡胶树抗寒分子辅助育种提供理论依据和基因材料准备。
1 材料与方法
1.1 材料
实验所用巴西橡胶树93-114、热垦501,由中国热带农业科学院橡胶研究所橡胶树国家种质资源圃提供。93-114是中国热带农业科学院从杂交组合天任31-45×合口3-11中选育的抗寒品种,热垦501是引进的低温敏感材料,来自RRIM600×PB260杂交组合。二者间没有共同父母本,相对亲缘关系较远。以抗寒品种93-114和低温敏感材料热垦501进行低温和常温对照两种处理。常温处理在大棚内温度为28 ℃,低温处理方法是当苗木长至第二蓬叶稳定时,在人工气候箱中4 ℃处理24 h。叶片用液氮收集,-80 ℃保存备用。
1.2 方法
1.2.1 cDNA阵列的制备 从构建的巴西橡胶树低温诱导全长cDNA文库中选取11 708个Unigene,将其代表的cDNA克隆合并转移-至新的384孔板,形成核心cDNA文库。将这些核心cDNA文库在尼龙膜上形成cDNA阵列,具体方法如下:
在384孔板中加入50 μL LB培养基,将核心cDNA文库接种至已经编好顺序的384孔板中,于37 ℃培养箱中100 r/min震荡培养16~20 h。使用384孔针将养好的cDNA克隆点在12 cm×8 cm带正电的硝酸纤维尼龙膜(Hybond-N+,英国Amersham Pharmacia biotech公司)上形成cDNA阵列,放入已倒好固体LB的培养皿中,在37 ℃培养箱中培养18~24 h。之后进行膜上裂解提取DNA,包括膜上质粒裂解变性、中和、洗去细胞碎片。具体操作步骤如下:把膜正面朝上依次放入已经加好下列溶液的放有3MM层析纸的平底容器里,所有溶液应刚好浸湿3MM层析纸,依次进行下面操作:(1)10% SDS 3 min;(2)变性液5 min;(3)中和液5 min;(4)2×SSC,0.1% SDS 5 min;(5)2×SSC 5 min;(6)0.4 mol/L NaOH 20 min。然后在平底容器里依次加入下列溶液,所加溶液量应能淹没尼龙膜,并在摇床上洗涤:(7)5×SSC,0.1% SDS 20 min;(8)5×SSC,0.1% SDS 20 min;(9)2×SSC 10 min;(10)2×SSC 10 min。
最后进行紫外交联固定。用滤纸吸去尼龙膜上多余水分。风干后,将尼龙膜置于一张干的3MM滤纸上,用紫外交联仪1.2 J/cm2照射。彻底干燥后4 ℃保存备用。
1.2.2 探针制备 利用CTAB法提取橡胶树叶片总RNA,每个样品使用2 μg总RNA进行探针制备。先用Oligo(dT)18引物将总RNA反转录成cDNA,经过纯化后,使用Roche地高辛标记与检测试剂盒(Roche Applied Science,美国),进行标记。检测探针的标记效率,将探针稀释至1 ng/μL后备用。
1.2.3 杂交洗涤 cDNA阵列的杂交采用地高辛杂交试剂盒进行(Roche Applied Science,美国)。预杂交和杂交温度为42 ℃,洗膜温度为65 ℃。洗膜完成后,使用地高辛检测试剂盒(Roche Applied Science,美国)进行信号检测、曝光成像。
1.2.4 图片扫描及数据获取 用光密度扫描仪GS800扫描杂交显影后的X光胶片,用PDQuestTM 2-D Analysis Software(Bio-Rad,美国)软件分析每个杂交点,读取每个杂交点的灰度值,随后进行数据分析和处理。每张384点的矩阵上均匀分布了5个ACTIN管家基因作为内参。使用内参基因的灰度值进行均一化处理。均一化处理后,得到每个Unigene的校正灰度值。对校正灰度值取对数,降低数据间的偏差。然后计算同类型样本间的标准差和平均值,用标准差除以平均值得出数值的偏差范围,如果同类型间偏差过大,则抛弃该数值,以减少假阳性。设置偏差取值范围R≤0.5或R≥2。最后进行方差分析,选取p<0.05且R≤0.5或R≥2的Unigene。对其纠正灰度值取对数,算出低温和常温处理的比值,定义差异比值大于2倍为差异表达基因,即比值大于等于2为上调表达,小于等于0.5为下调表达。
1.2.5 生物信息学分析 基因注释使用本地化的BlastX进行。聚类分析使用R程序包进行,聚类热图使用R语言中gplots程序包。
2 结果与分析
2.1 cDNA阵列的质量监控和表达数据获取
图1是一张代表性的cDNA杂交矩阵图。图中信号强度高,背景较为均一,没有明显缺陷。每张杂交图中包含24×16个杂交斑点,分别代表了384个基因在该样品中的表达水平。本实验共完成了巴西橡胶树低温诱导全长cDNA文库中11 708个Unigene在93-114和热垦501的低温和常温下的表达分析,每个样品材料得到31张杂交图,共124张杂交信号图。图中个别杂交斑点出现了信号过强从而导致斑点过大的问题,在后期分析中采用手工修正的方法,对这些斑点的识别区域进行了调整,以避免机器自动识别的偏差。
2.2 橡胶树低温诱导文库Unigene表达谱分析
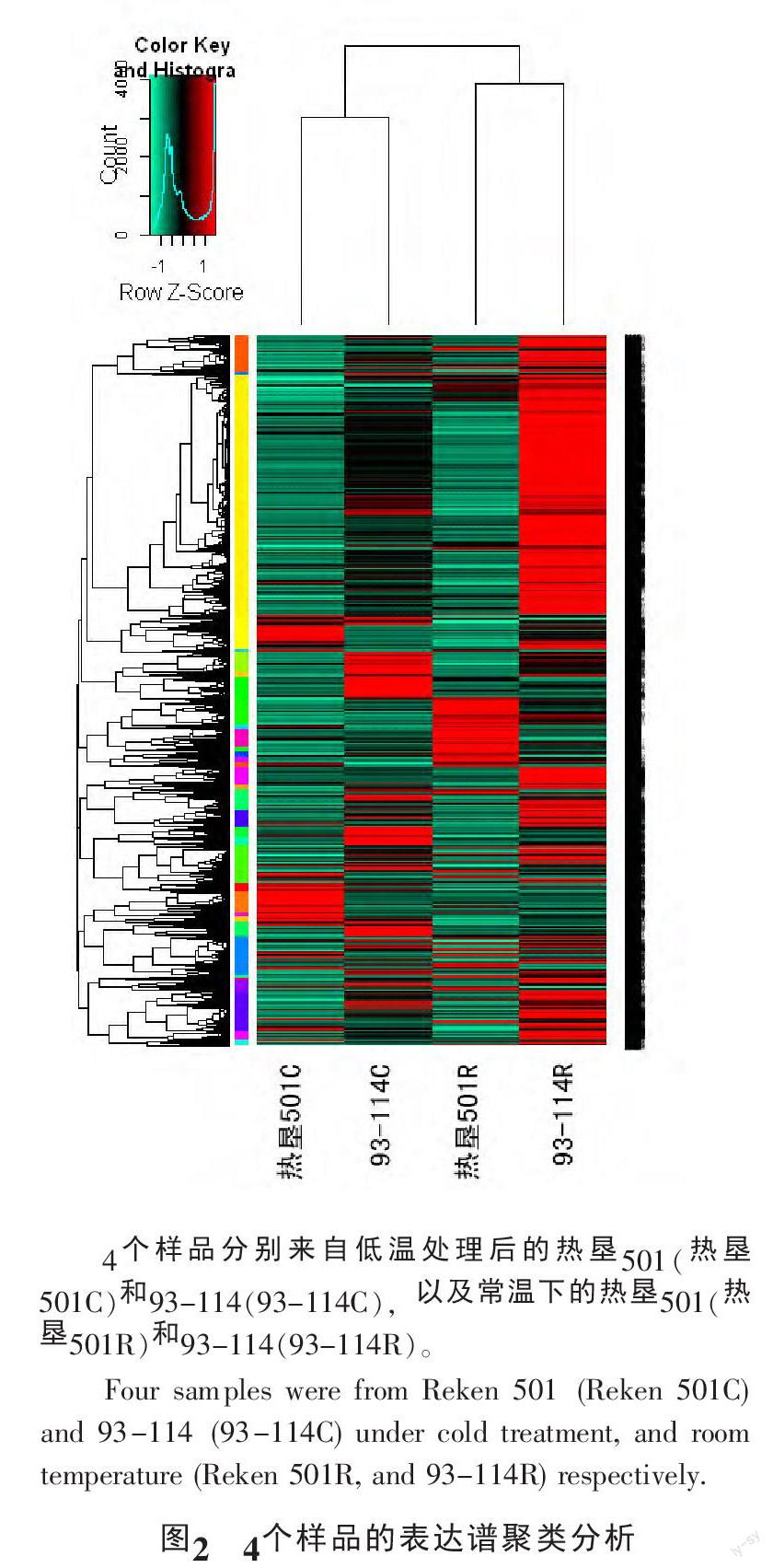
使用经过均一化处理后的橡胶树表达数据进行聚类分析,基因间的相似分值使用Pearson相关分析得到,样品间相似分值使用Spearman相关分析得到。从图2可以看出,在所使用的4个样品中,经过低温处理后的93-114和热垦501的表达谱数据以及常温下的93-114和热垦501聚在一起。表明在橡胶树低温敏感材料热垦501和抗寒品种93-114中,低温处理对于基因表达谱的影响明显超过了材料之间的差异,从而进一步说明,橡胶树品种抗寒性状很可能是由少数基因决定的。
2.3 低温胁迫和常温条件的基因表达差异分析
分析橡胶树低温胁迫和常温条件下的基因表达差异情况,总共发现了84个差异表达的基因,其中52个基因上调表达,32个下调表达。上调表达基因中,有9个注释为已知功能基因,20个注释功能不清楚,21个是未能注释的新基因。在32个下调表达基因中,能注释为已知功能的有8个,注释为未知功能的有16个,未能注释的新基因有8个。详细结果如表1和表2所示。
根据功能分类,可将52条上调表达的差异基因归为以下三类: (1)新陈代谢相关基因,包括质体蓝素A、烯酰-CoA水合酶/异构酶家族蛋白、氨基酸氨基转移酶相关蛋白、烯醇酶2、乳酰谷胱甘肽裂解酶/乙二醛酶I、D-3-磷酸甘油酸脱氢酶等;(2)信息储存与处理,包括核仁RNA结合蛋白Nop10p家族蛋白、延生因子2(EF-2)、内皮分化相关因子1(EDF-1)等;(3)功能未知,核内RNA结合蛋白(RGGA)、马铃薯块茎类似蛋白、线粒体基质载体家族蛋白、tRNA/rRNA甲基化酶家族蛋白(SpoU)、内膜家族蛋白、60S酸性核糖体蛋白P3等。
32条下调表达基因大概可以归为下述几类:(1)新陈代谢(Metabolism),包括乙醇脱氢酶1、酰基载体蛋白、线粒体前体蛋白(ACP)等;(2)细胞过程和信号(Cell processes and singnaling),包括ATP依赖的Clp蛋白酶ATP结合亚基(ClpC1)、肽基脯氨酰基顺式反式异构酶(CYP19-4)前体、蔗糖异构酶蛋白等;(3)信息储存和处理,60S核糖体蛋白L9-2、真核起始因子4A、60S酸性核糖体蛋白P1(L12)等;(4)功能未知,U盒結构域蛋白、叶绿素a-b结合蛋白40、Dof型锌指蛋白、寡聚多糖转移酶STT3亚基、亮氨酸富含重复蛋白、NAM家族蛋白等。
2.4 低温抗性与敏感橡胶品种差异表达分析
在抗寒材料与低温敏感材料基因表达差异分析中,总共检测到21个差异表达基因,其中12个在抗寒材料中上调表达,9个下调表达。上调表达的12个差异基因中,只有1个基因注释为已知功能,8个功能注释为未知,另外有3个未能成功注释。下调表达的9个差异基因中,注释为已知功能的有2个,注释为未知功能的有3个,未能成功注释的新基因有4个。上调和下调表达的已知基因信息详见表3和表4。从差异基因数量和注释情况来看,橡胶树品系间差异明显较低温胁迫处理小。这可能与橡胶树遗传背景单一,品系间亲缘关系相近有关。
3 讨论
随着分子生物学技术的发展,新的研究手段层出不穷。已经从过去的克隆单个基因进入组学时代。基因芯片、转录组测序等技术的应用,更是大大推动基因表达调控网络的研究。然而,这些新技术方法往往在研究较为透彻的模式生物中应用较广,而在橡胶树等研究较为落后的非模式生物中研究较为落后。虽然转录组测序技术的应用,大大推进了橡胶树基因表达调控网络的研究[11-14],然而由于橡胶树基因组测序未能有较大突破,严重阻碍了上述研究数据的进一步分析和应用。基因芯片技术通过特定算法,能针对特定基因分析其表达、转录后编辑和拼接等信息,具有针对性强、通量高等特点, 在二代测序技术广泛应用的今天,仍然有较高的应用价值。然而,基因芯片的设计和制作需要大量的前期基础工作。
本研究通过cDNA阵列的方法,探索了在橡胶树中使用生物芯片研究基因表达的可行性,分析得到84个在低温表达前后有差异表达的基因,以及21个在抗寒和低温敏感材料间有差异表达的基因。本研究发现的差异表达基因数目较少,究其原因,一方面原因可能是技术层面上,使用384针手工点膜,相对误差较大。菌落在尼龙膜上的生长不完全一致,后续的裂解和洗涤会造成尼龙膜上部分克隆丢失,因而造成数据缺失或偏差过大。另一方面,在后续数据分析上,笔者采用了较为严谨的标准。只有在ttest分析达到显著性差异(p<0.05)且基因表达差异达到2倍以上(R≤0.5或R≥2)时才被认定为差异表达基因。从橡胶树本身来说,低温诱导和抗寒相关基因数目可能偏少,也是造成差异基因数量少的一个原因。在对所分析的样品表达谱数据进行聚类时发现,低温处理对表达谱所造成的影响远远大于品种之间的差异。低温诱导差异基因数目(84个)大于抗性差异品种之间的差异基因数目(21个),也从侧面证明了上述观点。
从差异表达基因类别来看,低温胁迫引起上調基因主要为代谢相关基因、信息处理相关基因等。其中低温胁迫下质体蓝素基因高表达,可能是在低温下植物光和作用加强,合成更多的能量以应对不良环境的影响。而烯脂酰辅酶A水化酶则参与脂肪酸β-氧化,在拟南芥中发现该基因突变会造成植株抗寒能力下降,而过量表达则能增强转基因植株的抗寒能力[15]。烯醇酶和蔗糖合成酶参与碳水化合物代谢,为植物提供能量。其中烯醇酶可以催化磷酸甘油酸脱水形成磷酸烯醇式丙酮酸,该反应是糖酵解途径中唯一的一步脱水反应。有研究表明,植物在厌氧、高盐、干旱、低温等胁迫条件下,烯醇酶基因的表达量及酶活均会产生相应的变化,从而为逆境条件下植物产生大量自由基而导致的光合系统损伤的修复提供能量。因而该基因被广泛认为是与植物抗逆性相关的基因。一些研究发现玉米在厌氧条件下烯醇酶的转录水平和酶活均会有明显的提高,油菜在盐诱导的条件下烯醇酶基因的表达量也会有所提高。在拟南芥中烯醇酶由LOS2基因编码,参与低温反应基因的转录激活[16]。乙二醛酶是一种胞内酶,能够分解植物体内的乙二醛,从而减轻非生物胁迫产生的醛基毒害。将香蕉的乙二醛酶基因在酿酒酵母中增强表达,能够提高其对非生物胁迫的抵抗能力[17]。综上,从这些上调基因的生物学功能来看,它们很可能从各自不同的生物学途径参与了橡胶树的抗寒反应。
然而由于抗寒性状的复杂性,可能涉及到多个生物学途径。本研究由于在技术方面存在限制,未能大规模发掘抗寒相关基因。采用新的技术手段,特别是第二代测序技术在橡胶树中系统应用,无疑能大大推进橡胶树抗寒性状研究,发掘更多的抗寒相关基因。另外,对本研究初步发掘的抗寒相关基因——特别是低温诱导上调表达基因,进行深入研究,也将为橡胶树抗寒机理研究补充新的内容。
参考文献
[1] Hu Y, Jiang L, Wang F, et al. Jasmonate regulates the inducer of cbf expression-C-repeat binding factor/DRE binding factor1 cascade and freezing tolerance in Arabidopsis[J]. The Plant Cell, 2013, 25(8): 2 907-2 924.
[2] Yuan Y, Teng Q, Zhong R, et al. The Arabidopsis DUF231 domain-containing protein ESK1 mediates 2-O- and 3-O-acetylation of xylosyl residues in xylan[J]. Plant and Cell Physiology, 2013, 54(7): 1 186-1 199.
[3] Achard P, Renou J P, Berthomé R, et al. Plant DELLAs restrain growth and promote survival of adversity by reducing the levels of reactive oxygen species[J]. Current Biology, 2008, 18(9): 656-660.
[4] Thorlby G, Fourrier N, Warren G. The SENSITIVE TO FREEZING2 gene, required for freezing tolerance in Arabidopsis thaliana, encodes a {beta}-glucosidase[J]. Plant Cell, 2004, 16(8): 2 192-2 203.
[5] Chinnusamy V, Ohta M, Kanrar S, et al. ICE1: a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes & Development, 2003, 17(8): 1 043-1 054.
[6] Jaglo-Ottosen K R, Gilmour S J, Zarka D G, et al. Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance[J]. Science, 1998, 280(5360): 104-106.
[7] Yamaguchi-Shinozaki K, Shinozaki K. Arabidopsis DNA encoding two desiccation-responsive rd29 genes[J]. Plant Physiology, 1993, 101(3): 1 119-1 120.
[8] Yamaguchi-Shinozaki K, Shinozaki K. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought, low-temperature, or high-salt stress[J]. Plant Cell, 1994, 6(2): 251-264.
[9] Gilmour S J, Zarka D G, Stockinger E J, et al. Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J]. The Plant Journal, 1998, 16(4): 433-442.
[10] 程 汉, 蔡海滨, 黄华孙. 巴西橡胶树低温诱导全长cDNA文库构建[J]. 热带作物学报, 2008, 29(4): 410-414.
[11] Li D, Deng Z, Qin B, et al. De novo assembly and characterization of bark transcriptome using illumina sequencing and development of EST-SSR markers in rubber tree(Hevea brasiliensis Müll. Arg.)[J]. BMC Genomics, 2012, 13(1): 192.
[12] Chao J, Chen Y, Wu S, et al. Comparative transcriptome analysis of latex from rubber tree clone CATAS8-79 and PR107 reveals new cues for the regulation of latex regeneration and duration of latex flow[J]. BMC Plant Biology, 2015, 5: 120-121.
[13] Liu J P, Xia Z Q, Tian X Y, et al. Transcriptome sequencing and analysis of rubber tree(Hevea brasiliensis Müll.)to discover putative genes associated with tapping panel dryness(TPD)[J]. BMC Genomics, 2015, 16(1): 398.
[14] Duan C, Argout X, Gébelin V, et al. Identification of the Hevea brasiliensis AP2/ERF superfamily by RNA sequencing[J]. BMC Genomics, 2013, 14(1): 30.
[15] Amid A, Lytovchenko A, Fernie A R, et al. The sensitive to freezing3 mutation of Arabidopsis thaliana is a cold-sensitive allele of homomeric acetyl-CoA carboxylase that results in cold-induced cuticle deficiencies[J]. Journal of Experimental Botany, 2012, 63(14): 5 289-5 299.
[16] Lee H, Guo Y, Ohta M, et al. LOS2, a genetic locus required for cold‐responsive gene transcription encodes a bi‐functional enolase[J]. The EMBO Journal, 2002, 21(11): 2 692-2 702.
[17] 鄧成菊, 张建斌, 贾彩红, 等. 香蕉乙二醛酶基因增强酿酒酵母对非生物胁迫抵抗能力的研究[J]. 中国生物工程杂志, 2010(8): 22-26.
