发酵苹果汁的抗氧化性能变化
2016-05-24叶盼吴慧王德纯赵黎明蒋丽华
叶盼,吴慧,王德纯,赵黎明,蒋丽华*
1(华东理工大学 生物工程学院发酵工业分离提取技术研发中心,生物反应器工程国家重点实验室,上海,200237)2(杜邦营养与健康中心(原丹尼斯克(中国)有限公司),上海,200335)
发酵苹果汁的抗氧化性能变化
叶盼,吴慧2,王德纯2,赵黎明1,蒋丽华1*
1(华东理工大学 生物工程学院发酵工业分离提取技术研发中心,生物反应器工程国家重点实验室,上海,200237)2(杜邦营养与健康中心(原丹尼斯克(中国)有限公司),上海,200335)
摘要选取植物乳杆菌(Lactobacillus plantarum)对苹果汁进行发酵,以1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力,2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸二铵盐) (2,2′-amino-di(2-ethyl-benzothiazolin esulphonic acid-6)ammonium salt,ABTS)自由基清除能力以及铁离子还原能力为指标,考察了发酵后苹果汁抗氧化性能的变化,并测定其总酚和总黄酮含量。结果表明,发酵后苹果汁的抗氧化活性较发酵前有所提高。发酵第9天,苹果汁的DPPH和ABTS自由基清除能力最强,较发酵前分别提高了(35.3±3.3)%和(64.9±3.5)%。而发酵第5天苹果汁的铁离子还原能力最强,比发酵前提高了(37.4±3.7)%。发酵后苹果汁的总酚含量出现明显变化,发酵第9天总酚含量达到最大值,比发酵前增加了(52.1±9.6)%。发酵后苹果汁的总黄酮含量呈下降趋势,发酵至第23天,其含量比发酵前降低了(17.9±6.6)%。经相关性分析可知,发酵苹果汁的总酚含量与DPPH清除能力呈显著正相关,与ABTS清除能力和还原能力之间相关性不高。
关键词抗氧化活性;植物乳杆菌;苹果汁;总酚;总黄酮
近年来,由台湾地区、日本等地兴起的酵素饮料风靡东南亚。这类以果蔬为基质,通过益生菌发酵而得的果蔬饮料也因此受到广泛的关注。果蔬发酵饮料种类丰富,常根据发酵时间、使用果蔬基质以及益生菌的不同而不同。常用的益生菌有醋酸菌、乳酸菌以及酵母等。
乳酸菌作为一类最广泛使用的益生菌,早期用于发酵乳类食品[1]。现在人们也逐渐将它应用于果汁或蔬菜汁中,如YOON[2]等人比较了不同乳酸菌发酵的卷心菜汁,得到了一种风味良好的卷心菜发酵饮料。DEMIR[3]等以胡萝卜为基质,探讨了接种量对发酵胡萝卜汁的影响,确定了最佳接种量,并得到口感良好的胡萝卜汁发酵饮料。随着发酵工艺的研究日益完善,人们开始将注意力转移到发酵果蔬饮料的生理功能上。ANKOLEKAR[4]等通过实验发现嗜酸乳杆菌发酵的梨汁具有潜在的降糖作用。SIMSEK[5]等人比较蔬菜汁发酵前后的诸多生理功能变化,结果表明发酵后蔬菜汁具有较好的降压效果。
苹果是人们日常生活中最常见、消费最多的水果之一,也是日常饮食中外源性抗氧化物质的主要来源[6-7]。科学研究表明,适量的补充抗氧化食品是清除人体自由基,增强抗氧化防御系统,延缓衰老,预防疾病的最佳保健方法[8]。
本文选用了植物乳杆菌对苹果汁进行发酵,通过测定苹果汁中pH,固形物含量及生物量等指标,观察菌种在发酵过程中的生长变化。分析发酵过程中苹果汁对1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸二铵盐) (2,2'-amino-di(2-ethyl-benzothiazolin esulphonic acid-6)ammonium salt,ABTS)自由基的清除能力及铁离子的还原能力,期望为乳杆菌在果汁发酵饮品中的进一步开发应用提供一定的理论基础和技术依据。
1材料与方法
1.1材料与试剂
1,1-二苯基-2-三硝基苯肼(DPPH),2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),三吡啶基三吖嗪(TPTZ),2,6-二叔丁基-4-甲基苯酚(BHT),3-叔丁基-4-羟基苯甲醚(BHA):TCI化成工业发展公司;芦丁,水溶性维生素E(Trolox):西格玛奥德里奇贸易有限公司;抗坏血酸(VC),福林酚试剂,K2S2O8,Na2CO3,NaNO2,Al(NO3)3,NaOH,无水乙醇:化学纯,国药集团化学试剂有限公司;没食子酸一水,三氯化铁,醋酸钠,冰醋酸:化学纯,上海凌峰化学试剂有限公司。
1.2仪器与设备
CP214C电子天平(0.000 1 g),Sout SE电子天平(0.01 g),奥豪斯仪器(上海)有限公司;高速大容量离心机5810R,艾本德中国有限公司;电热恒温水浴锅DK-S24,上海精宏实验设备有限公司;UV-2000紫外分光光度计,尤尼克上海仪器有限公司;FE20精密pH计,梅特勒-托利多仪器有限公司;PAL-LOOP迷你数显折射器,ATAGO(爱拓)中国分公司;移液枪,Dragon Lab;DHP-9162电热恒温培养箱,上海齐欣仪器科技有限公司;MJ-25BM02C搅拌机,广东美的精品电器制造有限公司。
1.3实验方法
1.3.1苹果汁发酵
本实验所用植物乳杆菌为直投式菌粉,由杜邦营养与健康中心提供。
将新鲜的富士苹果去皮、去核,与去离子水按体积比1∶1榨汁。用食用碱(Na2CO3)调节苹果汁pH值至6.5左右后于65 ℃下杀菌35 min。待果汁冷却,接种,接种量为107CFU/mL。于35 ℃下恒温发酵,定期观察取样。样品于转速4 000 r/min离心10 min,得上清液,于-4 ℃下冷冻保存,待用。
1.3.2pH、固形物含量以及生物量的测定
(1)pH测定:使用FE20 精密pH计测定。
(2)固形物含量(Brix):使用PAL-LOOP迷你数显折射器测定。
(3)生物量测定[9]:通过比浊法测定OD值来表征发酵果汁的生物量。将样品与去离子水按体积比1∶10稀释,以去离子水为空白,测其在590 nm波长下的OD值。每个样品平行测定3次。
1.3.3生物活性物质测定
总酚的测定:福林酚法[10]。取0.1 mL样品用去离子水1∶1稀释,与体积分数50%的福林酚溶液混合均匀。5 min后,加入2 mL质量分数7.5%的Na2CO3,避光条件下反应30 min,于760 nm波长下测吸光值。以没食子酸(Gallic acid)为标准品,制作标准曲线。果汁中总酚的含量表示为:1 L果汁中含有的GAE(gallic acid equivalent)的质量(mg),计为mg/L。每个样品平行测定3次。
总黄酮的测定:主要参考ABIRAMI等[11]报道的方法。1 mL样品中加入4 mL去离子水和0.3 mL质量分数5%的NaNO2,混匀放置5 min。加入0.3 mL质量分数10%的Al(NO3)3,反应6 min,加入2 mL 1 mol/L NaOH终止反应,加水定量至10 mL,于510 nm波长下测吸光值。以芦丁(rutin)为标准品,作标准曲线。果汁中总黄酮的含量表示为:1 L果汁中含有的rutin的质量,计为mg/L。每个样品平行测定3次。
1.3.4抗氧化活性
DPPH清除能力:参考AABIRAMI等[11]报道的方法。0.1 mL样品中加入3.9 mL 0.025 g/L DPPH溶液,常温下避光反应30 min,于515 nm波长下测吸光值。0.1 mL无水乙醇和3.9 mL DPPH溶液混合作为空白对照。水溶性维生素E(Trolox),BHA,BHT,VC等抗氧化剂为阳性对照。每个样品平行测定3次。
DPPH自由基的清除率由公式(1)计算而得:

(1)
式中:A0,对照样品吸光度值;A1,待测样品吸光度值。
ABTS清除能力:主要参考HUANG等[12]所报道的方法。配制7 mmol/L ABTS和2.45 mmol/L的过硫酸钾溶液,混合后避光放置12~16 h,获得ABTS自由基引发液。用无水乙醇稀释ABTS自由基引发液,于734 nm处,吸光值达到0.7左右方可使用。取0.1 mL样品和3.9 mL ABTS溶液,室温下反应10 min,734 nm波长下测吸光值。0.1 mL无水乙醇和3.9 mL ABTS反应液作为空白对照。Trolox,BHA,BHT,VC为阳性对照。每个样品平行测定3次。
ABTS自由基的清除率由公式(2)计算而得:

(2)
式中:A0,对照样品吸光度值;A1,待测样品吸光度值。
铁离子还原能力(FRAP):主要参考BENZIE等[13]的方法。用去离子水1∶1稀释0.5 mL样品,与3 mL TPTZ工作液充分混合,37 ℃下反应4 min,于593 nm波长处测吸光度。TPTZ工作液由醋酸缓冲液(pH=3.6),10 mmol/L的TPTZ溶液(用40 mmol/L的HCl配置),FeCl3溶液(20 mmol/L)按10∶1∶1的比例混合所得。以Trolox为标准品,作标准曲线。BHA,BHT,VC为阳性对照。果汁的铁离子还原能力表示为mg(Trolox)/L(果汁)。每个样品平行测定3次。
1.4数据统计与分析
实验数据以实验平均值±标准差(SD)的形式表示。使用单因素方差分析,LSD法和Duncan等多重方法对数据进行比较,其中P<0.05为差异显著,P>0.05为差异不显著。
2结果与分析
2.1发酵苹果汁pH,固形物含量以及OD值的变化
发酵前苹果汁和发酵3,5,7,9,16 d以及23 d苹果汁的pH,固形物含量以及生物量如图1所示。发酵到第5天,苹果汁pH值从6.55快速降低至3.88,之后略有下降,但无明显变化。在发酵期间固形物含量整体呈下降趋势,但变化不显著。OD值一直呈上升趋势,前期上升较快,后期变平缓。乳杆菌发酵过程中有机酸大量生成[14],会导致pH下降。当pH稳定不再降低,乳杆菌的发酵或将变缓,此时可做为发酵终点。实验中所得发酵苹果汁风味状态均良好,发酵过程稳定。
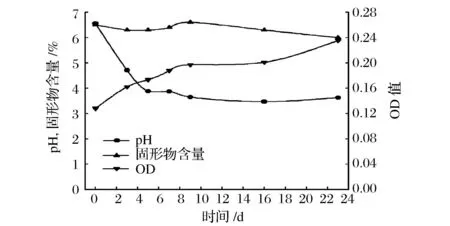
图1 发酵过程中pH,固形物含量和OD值的变化Fig.1 Changes in pH, Brix and OD value during fermentation
2.2发酵苹果汁的抗氧化活性
目前常用的体外测定抗氧化能力的方法主要基于样品对检测体系中自由基的清除能力和对铁离子的还原能力[15]等机理。本文分别选取了DPPH法,ABTS法以及FRAP法来检测样品的自由基清除能力和铁离子还原能力。
2.2.1DPPH清除能力
发酵不同时间的苹果汁和0.1 mg/mL BHA、BHT、VC以及Trolox对DPPH自由基的清除率如图2所示。发酵后苹果汁DPPH自由基清除率均高于发酵前,且在发酵前期呈逐渐上升趋势,随后降低。发酵到第9天苹果汁DPPH清除率最高,比未发酵苹果汁高出(35.3±3.3)%。发酵后苹果汁的DPPH清除率均高于4种抗氧化剂,且具有显著性差异(P<0.05)。

图2 发酵过程中DPPH自由基清除能力的变化Fig.2 Changes in DPPH radical scavenging ability during fermentation
2.2.2ABTS清除能力
发酵不同时间的苹果汁对ABTS自由基的清除率如图3所示。发酵后苹果汁ABTS自由基清除率均高于发酵前,与DPPH自由基清除能力的变化相似,发酵前期呈逐渐上升趋势,随后下降,趋于平缓。发酵第9 d的苹果汁ABTS自由基清除率最高,比发酵前提高了(64.9±3.5)%,仅次于0.1 mg/mL VC溶液。
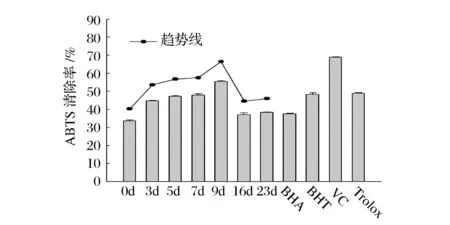
图3 发酵过程中ABTS自由基清除能力的变化Fig.3 Changes in ABTS radical scavenging ability during fermentation
2.2.3铁离子还原能力(FRAP)
抗氧化能力的表达方式主要有TEAC(Trolox equivalent antioxidant capacity),抑制率以及半抑制系数等[16]。铁离子还原能力的表达通常采用TEAC的方式。以Trolox(0~0.1 mg/mL)为标准品,绘制标准曲线,标准曲线回归方程为:y=16.358x-0.040,R2=0.997。
发酵前后苹果汁的铁离子还原能力如图4。发酵后苹果汁的铁离子还原能力均高于发酵前。发酵前5 d,苹果汁的铁离子还原能力呈上升趋势,随后缓慢下降。发酵第5 d的苹果汁的铁离子还原能力最强,比发酵前提高了(37.4±3.7)%,与0.1 mg/mL VC还原能力相当,且无显著差异(P>0.05)。
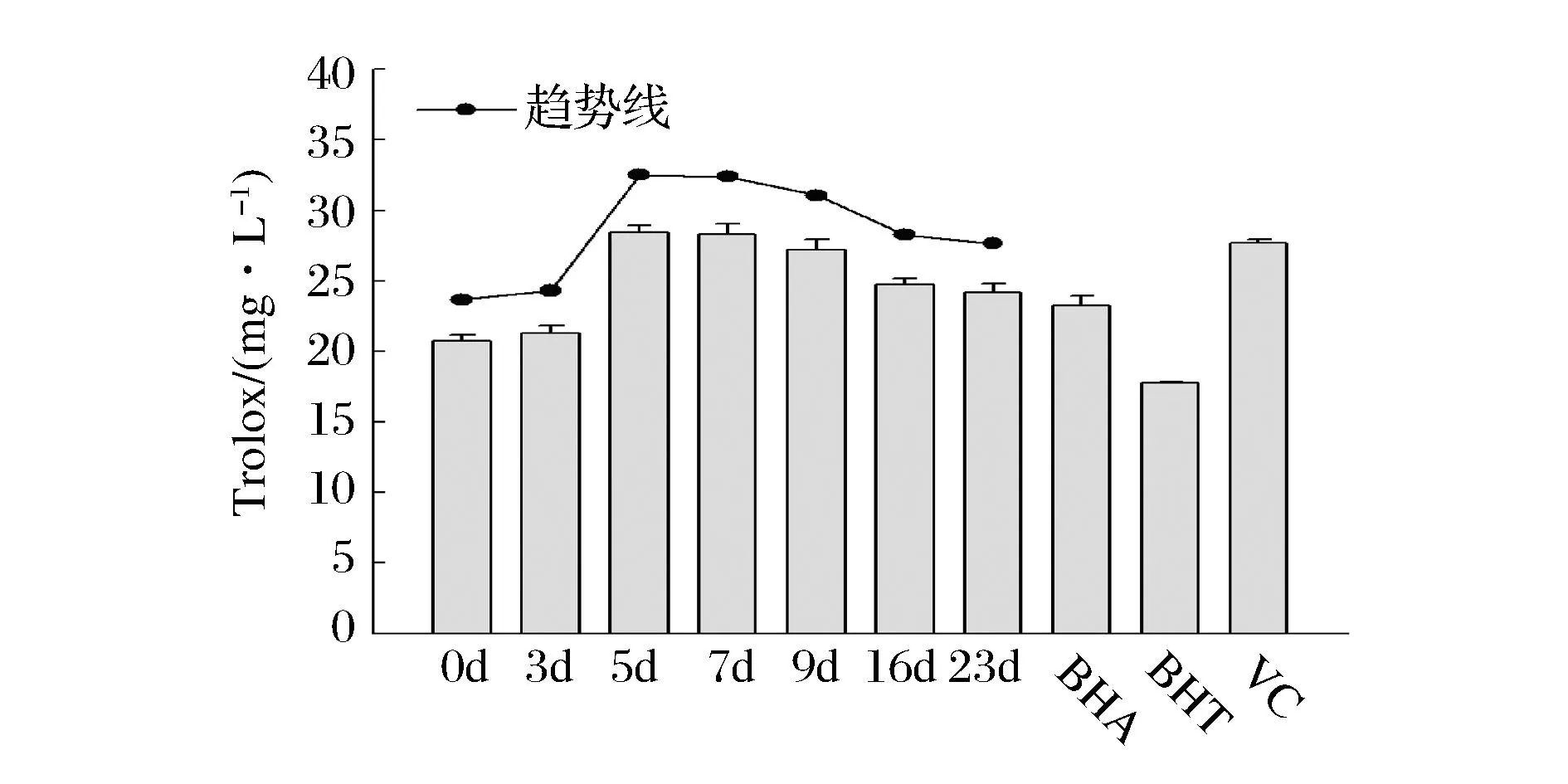
图4 发酵过程中铁离子还原能力的变化Fig.4 Changes in reducing power during fermentation
综合以上3种抗氧化评价体系的结果可知,发酵后苹果汁的DPPH自由基清除能力,ABTS自由基清除能力以及铁离子还原能力均高于发酵前,且在发酵第5至9 d内达到较高峰值。与一定浓度的抗氧化剂相比,发酵苹果汁具有良好的抗氧化性能。
2.3发酵过程中总酚和总黄酮的变化
苹果多酚是苹果的主要抗氧化物质之一,按其酸碱性可分为:酚酸和中性黄酮类物质两大类[17]。本文采用福林酚法和ABIRAMI等[11]报道的方法分别测定苹果汁总酚和总黄酮含量如图5所示。
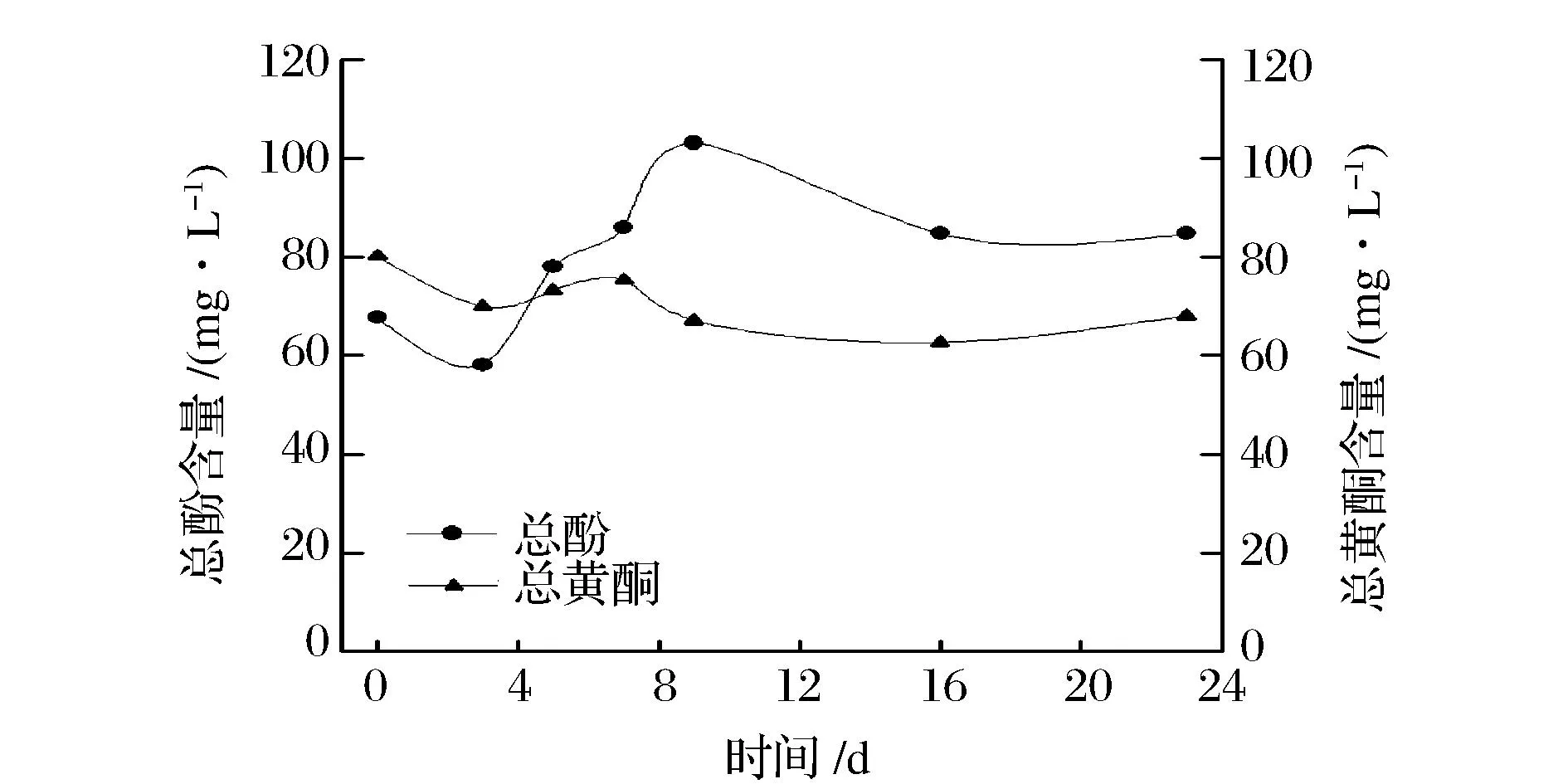
图5 发酵过程中总酚和总黄酮含量变化Fig.5 Changes in total phenolic compounds and flavonoids during fermentation
发酵过程中,苹果汁的总酚含量呈先降低再升高后缓慢降低的趋势。发酵第9天其含量达到最高,由发酵前的(67.7±4.3) mg/L增加到(103.1±11.3) mg/L,发酵前后增加了(52.1±9.6)%。而果汁中总黄酮含量呈缓慢下降趋势。发酵至23 d,总黄酮含量由发酵前的(80.2±4.2) mg/L降低到(68.0±0.6) mg/L,发酵前后降低了(17.9±6.6)%。
引起果汁中总酚含量变化的原因诸多,如酚类物质会与果汁中蛋白结合,形成大分子聚合物,使得总酚含量降低[18]。而在发酵过程中,一定浓度的酚类物质会产生抑菌作用,乳酸菌为保持生长会降解酚类物质,这种“自我解毒”行为会使总酚含量降低[19-20]。同时,CHU[21]等人的研究表明,发酵过程中微生物会把复杂的大分子酚类物质转化成小分子酚类物质,从而使总酚含量增加。因此,发酵苹果汁中总酚含量的变化,不仅与果汁自身的物理化学性状有关,也与微生物的作用相关。关于总黄酮含量在发酵过程中的变化机理,目前尚未见详细报道,有待于进一步探究。
2.4发酵苹果汁总酚总黄酮含量与抗氧化活性相关性分析
通过对发酵苹果汁的总酚含量与抗氧化活性进行相关性分析,得表1。由表1可知,发酵后苹果汁的DPPH自由基清除能力与总酚含量具有显著正相关,r=0.757(P<0.05)。ABTS自由基清除能力和铁离子还原能力与总酚含量的相关性不高,相关系数分别为r=0.656(P>0.05),r=0.358(P>0.05)。而对样品中总黄酮含量与抗氧化活性进行相关性分析可得,发酵后苹果汁的DPPH、ABTS自由基清除能力以及铁离子还原能力与总黄酮含量基本不呈线性相关,相关系数分别为r=0.170(P=0.715>0.05);r=0.319(P=0.486>0.05);r=0.256(P=0.580>0.05)。

表1 抗氧化性能与总酚含量的相关性
SHAHIDI等[22]人曾报道酚类物质的增加很可能是DPPH自由基清除能力提高的重要原因,认为酚类物质很容易给出1个H+,通过与DPPH自由基共振杂化而形成稳定物质。EREL等[23]人研究也表明,高浓度的酚类物质具有较高的ABTS自由基清除能力。但是,它们之间的作用还取决于分子质量、芳香环的数量和羟基取代基的性质[24]。因此,苹果汁在植物乳杆菌发酵过程中抗氧化活性的提高除了与酚类物质的含量有关,也可能与发酵过程中微生物的作用下酚类物质的相互转化有关。
3结论
本文通过植物乳杆菌发酵苹果汁,研究了苹果汁抗氧化性能的变化。结果表明,发酵后苹果汁的抗氧化性能得到了提高,总酚含量有所增加,其DPPH自由基清除能力,ABTS自由基清除能力以及铁离子还原能力均高于发酵前,且在发酵第5~9天达到最大的抗氧化活力。本研究为阐明发酵果蔬饮料的生理功能提供了一定的理论基础,也为发酵果蔬饮料的综合开发利用提供了一定的科学依据。
参考文献
[1]SHAH N P.Functional foods from probiotics and prebiotics[J].Food Technology, 2001, 55(11): 46-53.
[2]YOON K Y,WOODAMS E E,HANG Y D.Production of probiotic cabbage juice by lactic acid bacteria[J].Bioresource Technology, 2006, 97(12): 1427-1430.
[4]ANKOLEKAR C,PINTO M,GREENE D,et al.Invitrobioassay based screening of anti- hyperglycemia and antihypertensive activities ofLactobacillusacidophilusfermented pear juice[J].Innovative Food Science & Emerging Technologies, 2012, 13: 221-230.
[5]SIMSEK S,El S N,KILINC A K,et al.Vegetable and fermented vegetable juices containing germinated seeds and sprouts of lentil and cowpea[J].Food Chemistry, 2014, 156: 289-295.
[6]BRAT P,GEORGÉ S,BELLAMY A,et al.Daily polyphenol intake in France from fruit and vegetables[J].The Journal of Nutrition, 2006, 136(9): 2 368-2 373.
[7]LEE K W,KIM Y J,KIM D O,et al.Major phenolics in apple and their contribution to the total antioxidant capacity[J].Journal of Agricultural and Food Chemistry, 2003, 51(22): 6 516-6 520.
[8]蔡旋,陈小连,杨帆,等.微生物源性抗氧化剂体外抗氧化能力的初步研究[J].生物技术, 2011, 21(6): 84-87.
[9]RODRIGUES S,LONA L M F,FRANCO T T.Effect of phosphate concentration on the production of dextransucrase byLeuconostocmesenteroidesNRRL B512F[J].Bioprocess and Biosystems Engineering, 2003, 26(1): 57-62.
[10]MEDA A,LAMIEN C E,ROMITO M,et al.Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity[J].Food Chemistry, 2005, 91(3): 571-577.
[11]ABIRAMI A,NAGARANI G,SIDDHURAJU P.Invitroantioxidant, anti-diabetic, cholinesterase and tyrosinase inhibitory potential of fresh juice fromCitrushystrixandC.maximafruits[J].Food Science and Human Wellness, 2014,3(1): 16-25.
[12]HUANG Hai-zhi,SUN Yu-jing,LOU Shu-ting,et al.Invitrodigestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry (MyricarubraSieb. et Zucc.) fruits: a comparison with traditional methods[J].Food Chemistry, 2014, 146: 363-370.
[13]BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J].Analytical Biochemistry, 1996, 239(1): 70-76.
[14]JAYABALAN R,SUBATHRADEVI P,MARIMUTHU S,et al.Changes in free-radical scavenging ability of kombucha tea during fermentation[J].Food Chemistry, 2008, 109(1): 227-234.
[15]刘志东,郭本恒,王荫榆.抗氧化活性检测方法的研究进展[J].天然产物研究与开发, 2008, 20(3): 563-567.
[16]徐贵华,张凤梅,张磊.果蔬食品体外抗氧化方法研究进展[J].食品研究与开发, 2010, 31(11): 215-219.
[18]孙海峰,吕海涛,周莎莎,等.HPLC 法测定苹果浓缩汁中的多酚类物质[J].食品科学, 2008, 29(4): 314-317.
[20]MCCUE P P,SHETTY K.Phenolic antioxidant mobilization during yogurt production from soymilk using Kefir cultures[J].Process Biochemistry, 2005, 40(5): 1 791-1 797.
[21]CHU Sheng-che,CHEN Chin-shuh.Effects of origins and fermentation time on the antioxidant activities of kombucha[J].Food Chemistry, 2006, 98(3): 502-507.
[22]SHAHIDI F,ALASALVAR C,LIYANA-PATHIRANA C M.Antioxidant phytochemicals in Hazelnut Kernel(CorylusavellanaL.)and hazelnut byproducts[J].Journal of Agricultural and Food Chemistry, 2007, 55(4): 1 212-1 220.
[23]EREL O.A novel automated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation[J].Clinical Biochemistry, 2004, 37(4): 277-285.
[24]HAGERMAN A E,RIEDL K M,JONES G A,et al.High molecular weight plant polyphenolics (tannins)as biological antioxidants[J].Journal of Agricultural and Food Chemistry, 1998, 46(5): 1 887-1 892.
Changes on antioxidant activity of fermented apple juice
YE Pan1, WU Hui2, WANG De-chun2, ZHAO Li-ming1, JIANG Li-hua1*
1(State Key Laboratory of Bioreactor Engineering, R&D Center of Separation and Extration Technology in Fermentation Industry,School of Biotechnology of East China University of Science and Technology, Shanghai 200237,China) 2(DuPont Nutrition & Health (Danisco (China) Co. Ltd.), Shanghai 200335,China)
ABSTRACTResearch was undertaken to determine the changes on antioxidant activity of apple juice (AJ) fermented by Lactobacillus plantarum. Scavenging activity on DPPH (1,1-Diphenyl-2-picrylhydrazyl) radical, ABTS (2,2′-amino-di(2-ethyl-benzothiazolin esulphonic acid-6) ammonium salt) radical and ferric reducing power were investigated, while the contents of total phenolic compounds and flavonoids were measured. The results showed that the antioxidant activity of fermented AJ increased, compared with the beginning of fementation. AJ fermented after 9 days had the strongest scavenging activity on DPPH radical and ABTS radical, which increased by (35.3±3.3)% and (64.9±3.5)%, respectively. The ferric reducing power of AJ reached the highest after fermentation for 5 days, which increased 37.4(±3.7)% compared with unfermented AJ. The content of phenolic compounds had remarkable changes during fermentation and reached the highest after 9 days, which increased by (52.1±9.6)%. The content of flavonoids reduced during fermentation and decreased 17.9(±6.6)% after 23 days. The results from correlation analysis showed that the content of total phenolic compounds in fermented AJ had a significantly positively correlation with DPPH radical scavenging activity, but was not highly relevant to ABTS radical scavenging activity and ferric reducing power.
Key wordsantioxidant activity; Lactobacillus plantarum; apple juice; total phenolic compounds; total flavonoids
收稿日期:2015-10-09,改回日期:2015-12-18
基金项目:国家自然科学基金(31371725);国家863计划项目(2014AA021202)
DOI:10.13995/j.cnki.11-1802/ts.201604021
第一作者:硕士研究生(蒋丽华教授为通讯作者,E-mail:lhjiang@ecust.edu.cn)。
