叶酸在MNNG致哈萨克族食管上皮细胞增殖、周期及凋亡中的作用
2016-05-18凯德丽艳阿布都外力张慧霞李旭峰新疆医科大学公共卫生学院毒理教研室乌鲁木齐8300浙江省嘉兴学院医学院浙江嘉兴34000
凯德丽艳·阿布都外力,张慧霞,李旭峰,陈 丹,陈 艳,(新疆医科大学公共卫生学院毒理教研室,乌鲁木齐 8300;浙江省嘉兴学院医学院,浙江 嘉兴 34000)
叶酸在MNNG致哈萨克族食管上皮细胞增殖、周期及凋亡中的作用
凯德丽艳·阿布都外力1,张慧霞1,李旭峰1,陈丹1,陈艳1,2
(1新疆医科大学公共卫生学院毒理教研室,乌鲁木齐830011;2浙江省嘉兴学院医学院,浙江嘉兴314000)
摘要:目的探讨叶酸在N-甲基-N-硝基-N-亚硝基胍(MNNG)致哈萨克族(哈族)食管正常上皮细胞增殖、细胞周期及凋亡中的作用。方法采用3因素3水平(33)析因设计将体外培养的哈族食管正常上皮细胞暴露于不同浓度叶酸(0.000、0.400、0.800μg/mL)和MNNG(0.000、0.750、1.500μg/mL)的培养液中作用48、72和96 h后,采用噻唑蓝(MTT)法检测叶酸及MNNG对哈族食管上皮增殖的影响,流式细胞术检测细胞周期和细胞凋亡。结果
随着叶酸浓度的降低和MNNG浓度增加,哈族食管正常上皮细胞形态发生了明显的变化,死细胞数目逐渐增多,细胞核出现不同程度的破裂,胞质不匀和细胞完整性损伤,细胞对MNNG损害的敏感性明显增加,96 h时尤为严重;哈族食管正常上皮细胞的抑制率升高,差异有统计学意义(P<0.05);哈族食管正常上皮细胞G0+G1期、S期和G2+M期细胞比例不同,差异有统计学意义(P<0.05),细胞周期阻滞在S期和G2+M期;哈族食管正常上皮细胞的凋亡率升高,差异有统计学意义(P<0.05)。结论叶酸浓度降低对MNNG致哈族食管正常上皮细胞损伤有一定的促进作用。
关键词:叶酸;MNNG;食管上皮细胞;细胞凋亡;哈萨克族
食管癌是常见的消化系统恶性肿瘤之一,在我国,食管癌发病率位居恶性肿瘤第5位,死亡率为13.4/10万,居第4位[1]。食管癌的发病率在地区及民族之间也不尽相同,其中苗族发病率最低,哈萨克族(哈族)最高,其死亡率高达155.9/10万,是全国平均水平(14.59/10万)[2]的10倍以上。在新疆地区,哈族的调整死亡率达68.88/10万[3]。一般认为食管癌在哈族人群中的高发主要与其日常食用含具有致癌作用的常见的烷化剂—N-亚硝胺类化合物的熏制肉类食品、高氮饮水、叶酸摄入缺乏等因素有关[4]。叶酸作为一种B族维生素,多存在于新鲜蔬果中,人体摄入适量的叶酸可能对食管癌的生长、恶化具有抑制作用[5]。因此,本研究主要是探讨在叶酸缺乏的情况下,MNNG对哈族食管正常上皮细胞增殖、周期和凋亡的影响,为食管癌的预防和治疗提供科学依据。
1 材料与方法
1.1试剂哈族食管正常上皮细胞株(自制),MNNG(日本TCI公司)。EPiCM-2培养基(美国ScienCell公司),RPMI 1640培养液(美国Gbico公司),胎牛血清(美国Gibco公司),0.25%胰蛋白酶,二甲基亚砜(DMSO),噻唑蓝(MTT),叶酸粉(美国Sigma公司),凋亡检测试剂盒(美国BD公司),细胞周期检测试剂盒(南京凯基生物科技有限公司)。仪器:荧光倒置显微镜(Olympus),CO2恒温孵育箱(日本SANYO公司),低温离心机(日本SONY公司),酶标仪(上海新振仪器有限公司),流式细胞仪(美国Beckman Coulter公司)。
1.2方法
1.2.1细胞培养哈族食管正常上皮细胞常规培养于1×EpicM-2与1×EpicM-2(w/o)无血清培养基中(EpicM-2培养基叶酸含量为0.800μg/mL,EpicM-2(w/o)培养基中无叶酸)。37℃、5%CO2孵育箱中培养,当细胞生长汇合至90%左右时按1∶2传代培养。
1.2.2实验分组及干预以3因素3水平析因设计对实验进行分组(表1),将对数生长期的哈族食管上皮细胞分别加入含叶酸浓度(因素A)为0.000(1 ×EpicM-2(w/o)培养基中所含叶酸浓度)、0.400(1/ 2 1×EpicM-2正常培养基中所含叶酸浓度)、 0.800μg/mL(1×EpicM-2正常培养基中所含叶酸浓度)的培养基进行分组培养14 d,期间正常培养和传代。14 d后,在含有原有叶酸浓度的基础上再加入含MNNG浓度(因素B)为0.000(B1)、0.750 (B2)、1.500μg/mL(B3)的培养基进行染毒处理,各组分别在48、72和96 h后观察细胞形态和相关检测指标的变化。

表1 实验分组
1.2.3细胞一般形态学观察收集细胞,调整细胞密度,按5×105个/mL接种至25 cm2培养瓶,待细胞生长至对数生长期后,分别在培养基中加入不同浓度叶酸培养14 d,再加入不同浓度MNNG,分别在48、72和96 h后在倒置显微镜下观察细胞形态的改变。
1.2.4叶酸对MNNG致哈族食管正常上皮细胞增殖的影响采用MTT法检测细胞增殖的变化。收集不同叶酸干预后的细胞,调整为104个/孔,按照每孔200μL接种于96孔板中。24 h后加入含不同浓度MNNG的培养液200μL染毒48、72和96 h,加入MTT溶液20μL,继续培养4 h后,弃上清,每孔加入150μL/孔二甲基亚砜(DMSO),在490 nm波长下测定各孔的OD值,计算抑制率,抑制率(%)= (OD值对照孔-OD值加样孔)/OD值对照孔×100%。
1.2.5叶酸对MNNG致哈族食管正常上皮细胞周期的影响收集不同浓度叶酸干预后的细胞,按5× 105个接种于25 cm2培养瓶,待细胞生长至对数期时时分别加入含不同浓度MNNG的培养液5 mL,作用48、72和96 h后收集细胞,按照周期试剂盒说明书进行操作。
1.2.6叶酸对MNNG致哈族食管正常上皮细胞凋亡的影响细胞收集同上。各组细胞准备好后,按照凋亡试剂盒说明书进行操作,室温避光15min,于30 min内检测各组细胞凋亡情况。
1.3统计学处理独立实验均重复3次,采用SPSS17.0统计软件进行统计学分析,测得的数据用均数加减标准差(±s)表示,采用三因素三水平析因设计的方差分析进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1叶酸对MNNG致哈族食管正常上皮细胞的形态学影响在不同浓度叶酸(A1、A2、A3)和MNNG (B1、B2、B3)作用下,经不同时间(C1、C2、C3)后,哈族食管正常上皮细胞的形态发生了明显的变化。在叶酸浓度不变的条件下,随着MNNG浓度的增高,死细胞数目逐渐增多,出现细胞核破裂和胞质不匀等,细胞完整性损伤,且这种现象随着MNNG染毒时间的增加趋于严重,但在MNNG浓度和时间一定的条件下,与0.400μg/mL叶酸组(A2)和0.000 μg/mL叶酸组(A3)相比,0.800μg/mL叶酸组(A1)的细胞坏死相对较少,细胞形态和完整性相对其他两组稍好;0.000μg/mL叶酸组(A3)细胞对MNNG损害的敏感性明显增加,见图1。
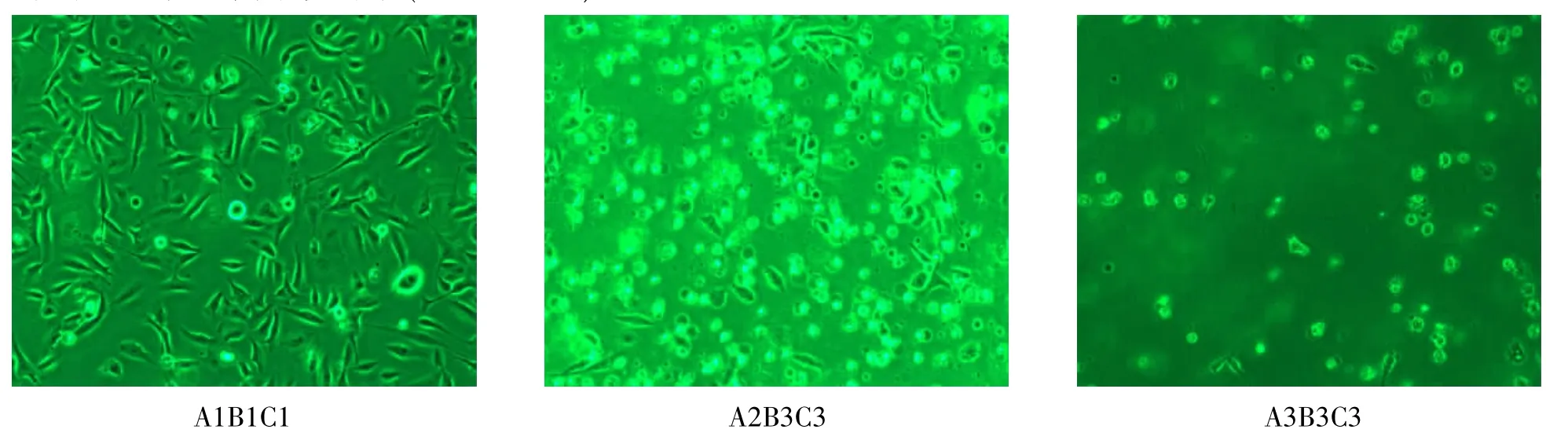
图1 不同浓度叶酸及MNNG作用细胞不同时间后细胞形态的改变(部分图)
2.2叶酸对MNNG致哈族食管正常上皮细胞增殖的影响不同浓度叶酸及MNNG作用细胞不同时间后,在固定MNNG及时间的条件下,不同叶酸浓度作用下的哈族食管正常上皮细胞的抑制率差异有统计学意义(F=111.309,P<0.01),随着叶酸浓度的增加细胞抑制率逐渐降低;在固定叶酸及时间的条件下,不同MNNG浓度作用下的哈族食管正常上皮细胞的抑制率差异有统计学意义(F=1 392.294, P<0.01),随着MNNG浓度的增加细胞抑制率逐渐升高;在固定叶酸和MNNG的条件下,不同时间作用下的哈族食管正常上皮细胞的凋亡率差异有统计学意义(F=20.133,P<0.01),随着干预时间的延长细胞抑制率逐渐升高。不同浓度叶酸、不同浓度MNNG及不同作用时间之间存在交互作用,差异有统计学意义(F=5.768,P<0.01),见表2。

表2 不同浓度叶酸及MNNG作用细胞不同时间后细胞抑制率的改变(n=6,?
2.3叶酸在MNNG致哈族食管正常上皮细胞周期中的作用不同浓度叶酸及不同浓度MNNG作用细胞不同时间后,在固定MNNG和时间的条件下,不同叶酸浓度作用下的哈族食管正常上皮细胞G0+ G1期、S期和G2+M期细胞比例不同,差异有统计学意义(F=1851.500,P<0.01;F=779.534,P<0.01;F=393.463,P<0.01),随着叶酸浓度的增加,G0+G1期细胞比例逐渐升高,S期和G2+M期细胞比例逐渐降低;在固定叶酸和时间的条件下,不同MNNG浓度作用下的哈族食管正常上皮细胞G0+G1期、S期和G2+M期细胞比例不同,差异有统计学意义(F=48.700,P<0.01;F=80.903,P<0.01;F= 14.333,P<0.01);随着MNNG浓度的增加,G0+G1期细胞比例逐渐降低,S期和G2+M期细胞比例逐渐升高;在固定叶酸和MNNG的条件下,不同时间点作用下的哈族食管正常上皮细胞G0+G1期、S期和G2+M期细胞比例不同,差异有统计学意义(F= 394.771,P<0.01;F=138.498,P<0.01;F=359. 689,P<0.01);随着时间的延长,G0+G1期细胞比例逐渐降低,S期和G2+M期细胞比例有逐步上升趋势。在S期和G2+M期,不同叶酸浓度与不同MNNG浓度之间、不同叶酸浓度与不同作用时间之间、不同MNNG浓度与不同作用时间之间均存在交互作用,差异均有统计学意义(S期:F=7.211,P<0.01;F=58.582,P<0.01;F=31.766,P<0.01;G2+ M期:F=10.470,P<0.01;F=144.177,P<0.01; F=81.536,P<0.01)。在S期与G2+M期,不同浓度叶酸、不同浓度MNNG及不同作用时间之间存在交互作用,差异有统计学意义(F=28.335,P<0.01;F=45.876,P<0.01);在G0+G1期,不同叶酸浓度与不同MNNG浓度之间、不同叶酸浓度与不同作用时间之间存在交互作用,差异有统计学意义(F= 3.159,P<0.05;F=3.256,P<0.05),见表3、图2。

表3 不同浓度叶酸及MNNG作用细胞不同时间后细胞周期变化的比较(n=3,?

注:A1B1C1:叶酸浓度为0.800μg/mL,MNNG浓度为0.000μg/mL,时间为48 h; A2B3C2:叶酸浓度为0.400μg/mL,MNNG浓度为1.500μg/mL,时间为72 h; A3B3C3:叶酸浓度为0.000μg/mL,MNNG浓度为1.500μg/mL,时间为96 h
2.4叶酸对MNNG致哈族食管正常上皮细胞凋亡的影响不同浓度叶酸及不同浓度MNNG作用细胞不同时间后,在固定MNNG和时间的条件下,不同叶酸浓度作用下的哈族食管正常上皮细胞的凋亡率不同,差异有统计学意义(F=40.786,P<0.01),随着叶酸浓度的增加细胞凋亡率逐渐降低;在固定叶酸和时间的条件下,不同MNNG浓度作用下的哈族食管正常上皮细胞的凋亡率不同,差异有统计学意义(F=43.522,P<0.01),随着MNNG浓度的增加细胞凋亡率逐渐升高;在固定MNNG和叶酸的条件下,不同时间点作用下的哈族食管正常上皮细胞的凋亡率不同,差异有统计学意义(F= 1 634.726 4,P<0.01),随着培养时间的延长细胞凋亡率逐渐升高。不同叶酸浓度与不同MNNG浓度之间、不同叶酸浓度与不同作用时间之间、不同MNNG浓度与不同作用时间之间均存在交互作用,差异均有统计学意义(F=3.076,P<0.05;F= 6.342,P<0.01;F=7.711,P<0.01)。不同浓度叶酸、不同浓度MNNG及不同作用时间之间不存在交互作用,差异无统计学意义(F=1.936,P>0.05),见表4、图3。
表4 不同浓度叶酸及MNNG作用细胞不同时间后细胞凋亡率的改变(n=3,

表4 不同浓度叶酸及MNNG作用细胞不同时间后细胞凋亡率的改变(n=3,
叶酸浓度/(μg/mL) MNNG浓度/(μg/mL)细胞凋亡率(%) 48 h 72 h 96 h 0.000 2.472±0.232 10.067±1.877 34.093±3.424 0.800 0.750 4.283±0.280 11.533±0.971 38.070±4.170 1.500 4.123±0.246 20.033±2.203 43.517±3.463 0.000 3.683±0.315 11.367±1.301 42.160±3.653 0.400 0.750 3.197±0.241 15.599±1.670 41.747±2.862 1.500 4.850±0.259 22.600±2.707 42.643±4.269 0.000 3.737±0.286 15.401±1.609 41.160±3.619 0.000 0.750 4.227±0.245 25.533±1.222 49.647±4.357 1.500 6.933±0.220 27.301±2.100 49.190±4.963

图3 不同浓度叶酸及MNNG作用细胞不同时间后细胞凋亡率变化的比较(部分图)
3 讨论
一般认为食管癌的发生是与遗传因素和环境因素密不可分的。在遗传因素中,发现食管癌患者体内p53[6]、Atp5a1[7]等基因呈现高表达;在环境因素中,过快饮食、吸烟、酗酒也是引起食管癌发生的危险因素。近年来有学者提出亚硝酸胺类化合物可能是引起食管癌的病因之一[8],在此理论基础上进行的动物实验与食管癌高发人群的居住环境及膳食调查都充分显示:过多摄入亚硝胺类物质是引起食管癌的有力证据之一[9-10]。本课题组前期研究在对哈族食管癌高发区进行居民饮用水检测时,发现“三氮”是当地食管癌高发的第一因子[4]。
叶酸作为一种B族维生素,最早发现其对治疗巨幼红细胞贫血[11]及预防胎儿神经管畸形[12]等有重要的作用。随着对叶酸的深入研究,Walters等[13]发现在防治卵巢癌等妇科肿瘤的进一步恶化中有着一定的抑制作用。郝婷等[10]对哈族食管癌患者血清维生素含量的研究结果显示:哈族食管癌患者血清叶酸水平普遍偏低。
本研究通过体外细胞实验发现,在未对细胞进行叶酸干预之前,所有细胞在显微镜下均表现为细胞核完整、胞质均匀、细胞分界清晰、呈梭形排列状态。在经叶酸干预2 w后,0.400μg/mL叶酸组0.000μg/mL叶酸组较0.800μg/mL叶酸组在形态上表现为死细胞数相对增多,细胞数量较少;经MNNG染毒后,不论叶酸浓度为多少,0.750μg/mL MNNG组及1.500μg/mLMNNG组的细胞开始出现细胞核固缩、胞质不匀等,随着时间的增长,死细胞数目较染毒前明显增多,尤其是1.500μg/mL MNNG无叶酸组表现得更为敏感,当到96 h时,细胞形态已完全破坏,细胞核固缩及胞质不匀现象严重,死细胞数目几乎占总细胞数目的90%左右,0.800μg/mL叶酸组的细胞虽有细胞死亡情况,但较之0.400μg/mL叶酸组与无0.000μg/mL叶酸组,细胞在形态破坏程度尚可,可以认为0.800μg/mL叶酸组对MNNG致哈族食管正常上皮细胞有保护作用;经MNNG干预后的细胞,都会呈现药物时间依赖性,随着毒物作用时间的延长,MNNG对细胞造成的不可逆性损伤作用会增加,在经叶酸干预后,叶酸可通过与MNNG发生拮抗作用而抑制致癌物对食管上皮的进一步损伤,但随着时间的增加,这种拮抗作用就会减弱。
MNNG是一种人工合成的亚硝胺类化合物,常被用于研究亚硝胺类化合物诱发肿瘤的工具。一般认为其诱发正常细胞癌变的基本特征为引起细胞失控性生长,最基本原因是造成细胞周期调节、控制机制紊乱,阻止细胞正常周期,从而导致细胞发生凋亡。本研究结果表明MNNG在不同叶酸浓度下,可明显引起S期细胞及G2+M期细胞比例上升,表现为在同一叶酸浓度下,G0+G1期细胞DNA含量随MNNG浓度的升高而减少,S与G2+M期细胞DNA含量随MNNG浓度的升高而增多。当MNNG作用细胞到96 h时,0.000μg/mL叶酸1.500μg/mL MNNG(A3B3)的S期与G2+M期的DNA含量相较于0.800μg/mL叶酸0.000μg/mLMNNG组(A1B1) 的S期与G2+M的DNA含量将近多了1倍,呈现较强的浓度抑制性,同时G0+G1期有不同水平的降低,总体上呈现一定的剂量依赖性。这可能是亚硝胺类化合物能够促进处于静止期的细胞进入DNA合成期,促使细胞发生有丝分裂而发生细胞凋亡及坏死,这种现象在细胞处于低浓度的叶酸状态下更明显。本研究中,在叶酸浓度一定的条件下,随着MNNG作用浓度的增高和作用时间的延长,凋亡率增加。这可能是因为当亚硝胺类化合物长期作用于食管上皮时,会刺激食管正常黏膜并引起炎症反应,导致食管黏膜变性或异常增生,从而在诱发癌变的过程中,可能会引起凋亡调控蛋白因子c-IAP2[3]和促凋亡基因PDCD5[2]的过度表达。本研究发现随着叶酸浓度的降低细胞凋亡率明显增加,说明叶酸缺乏可促进MNNG致哈族食管正常上皮细胞的毒性作用。但在这一过程中其他指标及相关机制有待于进一步探讨。
参考文献:
[1]杨锋,王磊,钟代星,等.MACC1和C-met蛋白在食管癌中的表达及意义[J].现代肿瘤医学,2015,23(13):11843-1846.
[2]郭辉,丁剑冰,孙伟,等.促凋亡基因PDCD5在新疆哈萨克族与汉族食管癌中的表达及临床意义[J].中国肿瘤临床,2010,37(4):213-215.
[3]陈艳,王洪江,李卉,等.凋亡蛋白因子c-IAP2在新疆哈萨克族食管癌中的表达及临床意义[J].新疆医科大学学报,2010,33(7):743-745.
[4]陈艳,刘真群.伊犁地区哈萨克族食管癌高发区饮用水水质多元分析[J].环境与健康杂志,2015,32(2):162-164.
[5]鲍刘莉,彭景,黄桂玲,等.血清叶酸和VB2水平与食管癌关系的研究[J].2013,542(3):451-454.
[6]江舟,黄江琼,许杨,等.P53基因表达与食管癌放化疗敏感性关系的研究[J].中国临床新医学,2015,8(1):29-32.
[7]张景萍,李卉,孙晓宏,等.Atp5a1基因在新疆哈萨克族食管癌中的表达分析[J].新疆医科大学学报,2015,38(7): 828-834.
[8]吴岩,贺宇彤.食管癌病因学[J].食管外科电子杂志,2014,2 (3):114-120.
[9]周政华,江岩,朱文艺,等.盐亭食管癌高发区饮食喂饲大鼠血清叶酸水平及添加叶酸等维生素的影响[J].北医学院学报,2011,26(4):295-298.
[10]郝婷,吐尔逊江·买买提明,王艳萍,等.新疆新源县234名哈萨克族居民营养状况及叶酸水平与食管癌关系的研究[J].新疆医科大学学报,2011,34(4):429-434.
[11]蔡新.血清铁蛋白、叶酸与维生素B12联合检测对贫血诊断价值[J].数理医药学杂志,2015,28(1):36-37.
[12]Osterhues A,AliNS,Michels KB.The role of folic acid fortificationin neural tube defects:a review[J].Crit Rev Food Sci Nutr,2013,53(11):1180-1190.
[13]Walters CL,Arend RC,Armstrong DK,et al.Folate and folate receptor alpha antagonistsmechanism of action in ovarian cancer [J].Gynecol Oncol,2013,131(2):493-498.
(本文编辑杨晨晨)
·基础医学研究·
The role of folic acid in MNNG induced proliferation,cell cycle and apoptosis of Kazakh normal esophageal epithelial cell
Kadirya Abduwali1,ZHANG Huixia1,LIXufeng1,CHEN Dan1,CHEN Yan1,2
(1Department of Toxicology,School of Public Health,Xinjiang Medical University,Urumqi 830011,China;2Medicine School of Jiaxing University,Jiaxing 314000,China)
Abstract:Objective To investigate the role of folic acid in MNNG-induced proliferation,cell cycle and apoptosis of Kazakh normal esophageal epithelial cell.M ethods Using 3 factors3 level(33)factorial design,Kazak normal esophageal epithelial cellswere treated with different concentrations of folic acid(0.000,0.400 and 0.800μg/mL) and MNNG(0.000,0.750 and 1.500μg/mL),cultured 48,72 and 96 h,MTT assay was used to measure cell proliferation,and cell cycle and apoptosis rate were detected by flow cytometry and Annexin V-FITC/PI staining.
Results With decreasing of folic acid concentration and increasing of MNNG concentration:Morphogenesis of Kazakh normal esophageal epithelial cell had significant changes,number of the dead cellswere gradually increased,nuclei ruptured in varying degrees,cytoplasm was uneven and cell integrity was destroyed.Cell sensitivity to MNNG damage were increased significantly,particularly on 96 h;Kazakh normal esophageal epithelium inhibition rate increased,which therewas a significant difference(P<0.05);Proportion of G0+G1phase,Sphase and G2+M phaseof cellswere significantly different(P<0.05),cell cycle arrest in Sand G2+M phase;Apoptosis rate of Kazakh normal esophageal epithelium cellwere increased,which therewas a significant difference(P<0.05).Conclusion Reduction of folic acid concentrations promoted MNNG-induced Kazak normal esophageal epithelial cell injury.
Keywords:Folic acid;MNNG;Esophageal epithelial cell;Cell apoptosis;Kazakh
[收稿日期:2015-12-05]
通信作者:陈艳,女,博士,教授,博士生导师,研究方向:化学致癌与干预,E-mall:ychen88@sina.com。
作者简介:凯德丽艳·阿布都外力(1990-),女(维吾尔族),在读硕士,研究方向:环境毒理学。
基金项目:国家自然科学基金(81460502);新疆维吾尔自治区自然科学基金(2014211C002)
doi:10.3969/j.issn.1009-5551.2016.03.006
中图分类号:R735.1
文献标识码:A
文章编号:1009-5551(2016)03-0283-06
