滨麦草特异标记的开发及验证
2016-05-14孙文静王洪刚李兴锋
孙文静 王洪刚 李兴锋

摘要:滨麦草[Leymus mollis(Trin.)Hara]具有抗病耐逆等多种优良特性,是进行普通小麦遗传改良的重要基因资源之一。本研究选用757对EST-SSR、STS引物,对滨麦草、华山新麦草(Psathyrostachys huashanica)以及普通小麦品种中国春、辉县红、烟农15、济麦22进行扩增,从中筛选和鉴定滨麦草特异分子标记,推断其染色体基组归属。结果共筛选获得193个滨麦草特异分子标记,其中包括36个滨麦草Ns基组的特异标记。该研究结果对于促进滨麦草优异基因向小麦的转移、培育小滨麦新种质具有一定的实践价值和意义。
关键词:滨麦草;普通小麦;特异分子标记
中图分类号:S512.9文献标识号:A文章编号:1001-4942(2016)08-0005-05
AbstractLeymus mollis (Trin.) Hara (2n=28, NsNsXmXm) is one of the important genetic resources for wheat genetic improvement, which possesses a variety of excellent antiviral properties such as disease resistance and adversity tolerance. In this study, 757 pairs of EST-SSR and STS primers were used to amplify the genomic DNA of L. mollis, Psathyrostachys huashanica and wheat varieties China Spring, Huixianhong, Yannong 15 and Jimai 22. And the specific molecular makers were screened for L. mollis, and were used to infer the chromosome-based group home. The results showed that 193 specific markers of L. mollis were screened out including 36 specific markers belonging to Ns group. The results have some practical values and significances to promoting the excellent gene of L. mollis transfer into wheat and breeding new Tritileymus germplasms.
KeywordsLeymus mollis; Common wheat; Specific molecular markers
小麦是世界重要粮食作物之一,是我国北方地区的主要粮食作物。目前,生产上推广使用的小麦品种遗传基础单一,能被育种利用的品种资源日益匮乏,严重制约小麦育种工作进展。拓宽小麦的遗传基础,丰富小麦的遗传多样性是当前小麦育种和遗传改良的重要内容之一。小麦的近缘物种类型繁多,变异多样,含有一系列在小麦育种中具有重要利用价值的抗病、耐逆优良基因[1,2]。利用多种手段将小麦近缘物种中蕴藏的多种有益基因转移进栽培小麦,丰富小麦育种的遗传基础,是进行小麦遗传改良的有效途径和重要方向。
滨麦草[Leymus mollis(Trin.)Hara,NsNsXmXm,2n=4x=28]主要生长在沿海和内陆干旱地区,具有抗条锈病、白粉病、赤霉病、蚜虫和抗旱、耐盐碱、大穗多花等优良特性,是小麦重要的近缘植物之一[3-10]。早在20世纪50年代,前苏联的齐津等就通过胚培养获得了四倍体、六倍体小麦与滨麦草的杂种[11];60年代获得了杂种的双二倍体[2];70年代获得了硬粒小麦与滨麦草的不完全双二倍体[2];傅杰等通过八倍体小滨麦与普通小麦和缺体杂交、回交,创制了一些农艺性状优良的滨麦草异源种质系,经鉴定仍带有滨麦草的一些特性,尤其对条锈病具有良好的抗性[12]。 以往研究将滨麦草染色体组成表示为JJNN,之后又将滨麦草染色体组成表示为NsNsXmXm。本实验室通过杂交、回交等技术也创制了一些农艺性状优良的滨麦草异源种质系,可作为向小麦中转移滨麦草优良基因的桥梁材料。
本研究通过对滨麦草、华山新麦草及普通小麦的全基因组扫描,筛选得到特异分子标记,可用来检测小麦背景中的滨麦草染色体片段,也可用于基因定位、滨麦草染色体追踪、基因的转移和种质系的鉴定等,进而提高小麦遗传背景下滨麦草基因组成分的检测效率,为滨麦草优良性状/基因的进一步开发利用奠定基础。
1材料与方法
1.1材料与试剂
本试验所用材料为滨麦草(L. mollis)、华山新麦草(Psathyrostachys huashanica)、八倍体小滨麦950059、八倍体小滨麦20000302、烟农15、济麦22、中国春、辉县红。其中滨麦草引自西北农林科技大学,华山新麦草引自四川农业大学,均种植于山东农业大学校内网室。八倍体小滨麦950059、20000302均由国家小麦改良中心山东(泰安)分中心创制,其余材料均由该分中心保存。
1.2试验方法
1.2.1基因组DNA提取按Sharp等[13]的方法进行,稍有改动。
1.2.2PCR 扩增及引物筛选选用本实验室的757对EST-SSR、STS引物,由生工生物工程(上海)有限公司合成,参照Luan等[14]描述的PCR 体系和程序,用 ABI 公司 9700 型 PCR 仪进行扩增反应。PCR 扩增体系为20 μL,含10×PCR buffer 2 μL,dNTP 0.2 mmol/L,引物0.25 μmol/L,模板 DNA 60 ng,Taq DNA 聚合酶1 U (鼎国生物技术公司)。反应程序为 94℃预变性5 min;94℃ 1 min,55~60℃ 1 min,72℃ 1 min,35个循环;72℃延伸10 min。扩增产物经8%聚丙烯酰胺凝胶电泳分离,银染显带。筛选出在辉县红、烟农15、中国春、济麦22中不能扩增出特异条带而在滨麦草中能扩增出特异条带的引物。
1.2.3原位杂交(1)染色体制片。按照普通细胞学压片处理根尖的步骤,充分水洗后用2%纤维素酶和果胶酶(Yakult公司)37℃下酶解1 h,70%酒精冲洗2次,以45%醋酸为浸润液在相差显微镜下镜检(或将卡诺液固定1~3 d的根尖不经酶解,直接用45%醋酸压片),选择处于减数分裂中期细胞较多、并且染色体分散比较好的制片,用酒精灯来回考3~5次后压片,液氮冷冻揭片,气干备用。
(2)探针标记。将纯化的供试材料总基因组DNA,用DIG-Nick Translation Mix 试剂盒(Roche公司)通过缺刻平移法进行标记。反应体系(20 μL)包含模板DNA 2 μg,2 mmol/L dNTP 2 μL,DNApolⅠ 5 μL,DNaseⅠ (100 mU/μL) 0.5 μL,488-5-dUTP 1 μL, ddH2O 补齐至20 μL。
将配制好的体系混匀,稍离心,15℃水浴标记1.5 h后,加入0.5 mol/L EDTA(pH 8.0)1 μL,65℃处理10 min终止反应,稍离心后,将标记的探针-20℃冰箱中储存备用。
(3)杂交。每张玻片加入RNA酶(100 μg/mL)100 μL,盖上塑料盖片,37℃处理1 h,然后用2×SSC在室温下漂洗5 min,重复2次,分别用70%、100%乙醇脱水3 min,晾干。
杂交液配制(40 μL体系):100%甲酰胺20 μL,50%DS 8 μL,20×SSC 4 μL,10% SDS 1 μL,ssDNA 1 μL,探针DNA 100 ng,封阻DNA 8 000 ng。
杂交液90℃变性5 min,置于碎冰中6 min后加到载玻片上,盖上塑料盖片,置于原位PCR仪中杂交过夜。
(4)信号检测。按照以下步骤洗片:室温2×SSC浸泡3 min;37℃ 10%甲酰胺溶液浸泡3 min;37℃ 0.1×SSC溶液浸泡3 min,重复2次;37℃ 2×SSC溶液浸泡5 min;室温4×SSC溶液浸泡5 min。
洗片后,每张载片加5%BSA溶液100 μL,盖塑料膜后37℃温育15 min;然后甩干BSA,避光条件下每片加DAPI 10 μL,盖片,最后在OLYMPUS BX-61型荧光显微镜下观察,CCD机(DS-Ri1,Nikon)采集图像。
2结果与分析
2.1滨麦草特异标记的开发
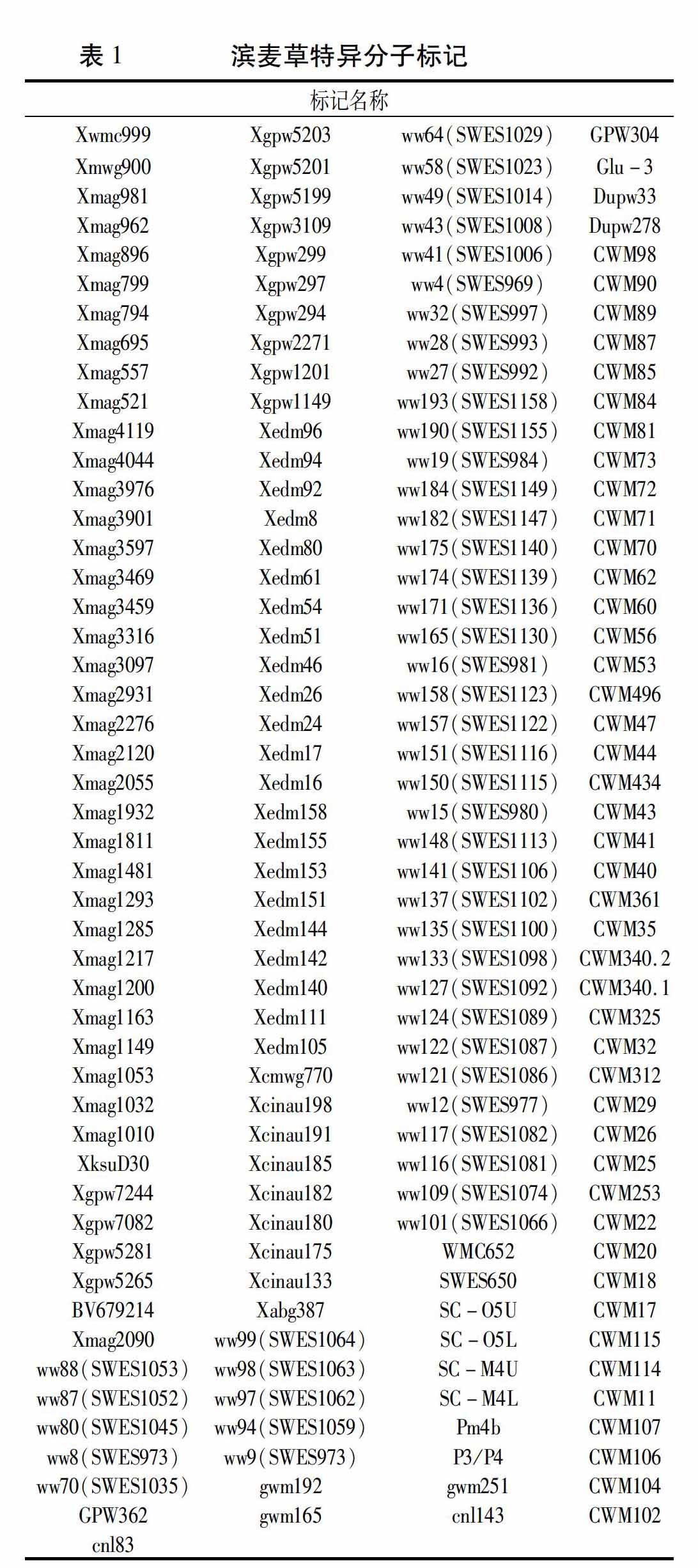
利用本实验室的757对EST-SSR、STS引物对滨麦草、华山新麦草、辉县红、烟农15、中国春、济麦22全基因组进行扫描,筛选得到215对滨麦草的特异引物。其中有39对引物(图1 CWM115)在滨麦草、华山新麦草中都能扩增出特异条带,有176对引物(图1 SWES1147)仅在滨麦草中扩增出特异条带。
2.2特异标记的验证
以荧光标记的滨麦草基因组DNA为探针,对八倍体小滨麦950059、20000302进行基因组原位杂交,结果表明,八倍体小滨麦950059、20000302均含有14条外源滨麦草染色体(图2)。
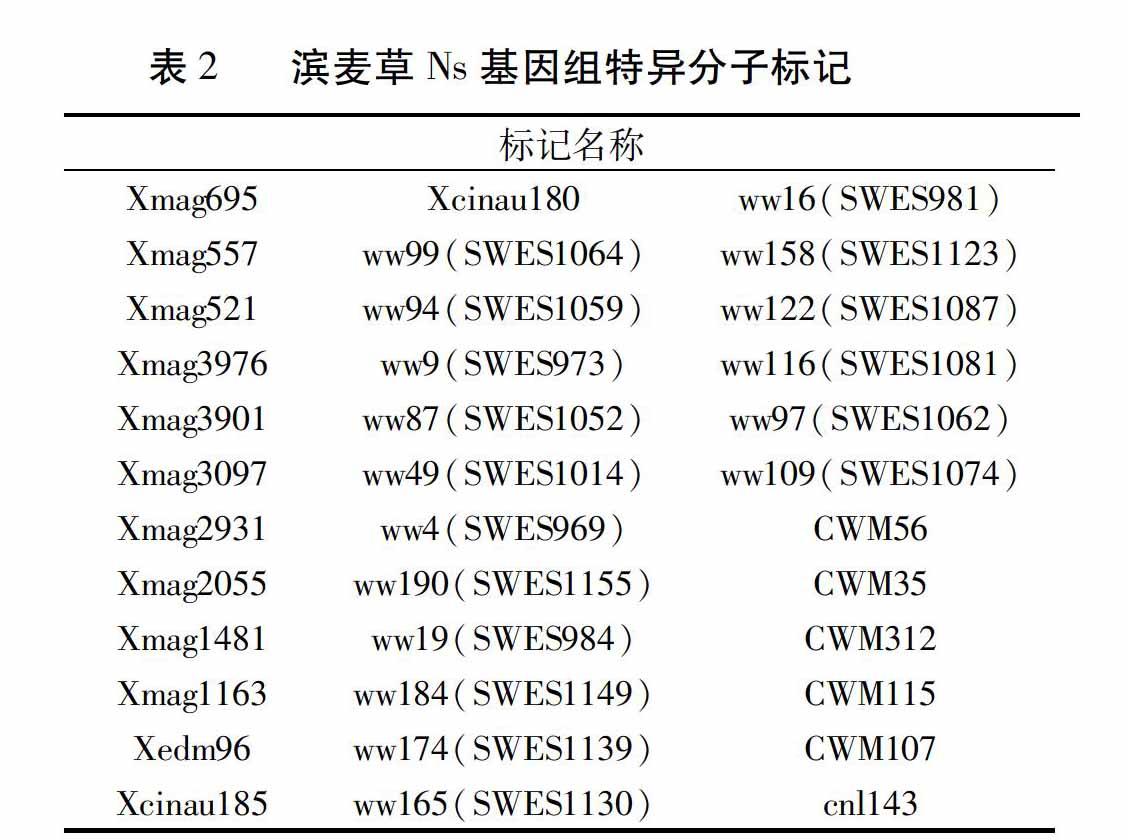
利用筛选出的215对特异引物对八倍体小滨麦950059、20000302、滨麦草、华山新麦草、烟农15、中国春进行全基因组扫描,验证筛得的特异标记的有效性。最终统计得到193个有效特异标记(表1),其中包括36个滨麦草Ns基组的特异分子标记(表2)。这193个特异标记分为四种类型:(1)仅在滨麦草中扩增出特异条带(图3中Xmag3459);(2)仅在滨麦草、华山新麦草中扩增出特异条带(图3中Xmag557);(3)在八倍体小滨麦950059、20000302、滨麦草、华山新麦草中都能扩增出特异条带(图4中CWM107);(4)在八倍体小滨麦950059、20000302、滨麦草中扩增特异条带(图4中SWES969)。
3讨论与结论
随着分子生物学的发展,目前用于鉴定小麦背景中外源染色体片段/遗传物质的分子标记越来越多。STS标记来自基因的转录区,分布于整个基因组中,通常其序列保守性程度较高[15,16],可以保证有扩增产物。选用本实验室757对EST-SSR、STS引物在滨麦草、华山新麦草、济麦22、中国春、辉县红、烟农15中进行滨麦草的特异性引物的初次筛选,获得215个滨麦草特异分子标记。华山新麦草是滨麦草Ns染色体基组的供体,如引物CWM115对滨麦草、华山新麦草都扩增出特异条带,可以确定这一类特异标记归属于滨麦草Ns基组,共39个。
以滨麦草基因组DNA为探针对八倍体小滨麦950059、20000302进行基因组原位杂交,确定八倍体小滨麦950059、20000302含有滨麦草染色体,可用于检测筛选得到的滨麦草特异标记的有效性。利用获得的滨麦草特异性引物进一步在八倍体小滨麦950059、20000302和滨麦草、华山新麦草、烟农15、中国春中进行全基因组扫描,最终统计得到193个有效滨麦草特异分子标记,其中包括36个滨麦草Ns基组的特异标记。这一验证结果说明初步筛选有效性高、可重复性强。
筛选得到的滨麦草特异分子标记可用来检测小麦背景中的滨麦草染色体片段,也可用于基因定位、滨麦草染色体追踪、基因的转移和种质系的鉴定等。
参考文献:
[1]齐津 H B.多年生小麦[M].北京:农业出版社, 1982.
[2]李振声.小麦远缘杂交[M]. 北京:科学出版社, 1985.
[3]Fan X, Sha L N, Yang R W, et al. Phylogeny and evolutionary history of Leymus (Triticeae; Poaceae) based on a single-copy nuclear gene encoding plastid acetyl-CoA carboxylase [J]. BMC Evol. Biol., 2009, 9: 247.
[4]Yang X F, Wang C Y, Li X, et al. Development and molecular cytogenetic 352 identification of a novel wheat-Leymus mollis Lm#7Ns (7D) disomic substitution line with stripe rust resistance [J]. PLoS ONE, 2015, 10(10):e0140227.
[5]Yang X F, Wang C Y, Chen C H, et al. Chromosome constitution and origin analysis in three derivatives of Triticum aestivum-Leymus mollis by molecular cytogenetic identification [J]. Genome, 2014, 57(11/12): 583-591.
[6]Faith A M B. Analysis of the breeding potential of wheat-Agropyron and wheat-Elymus derivatives. I. Agronomic and quality characteristics [J]. Hereditas, 1983, 98: 287-295.
[7]何方. 小麦-滨麦草中间材料的创制及鉴定 [D]. 泰安: 山东农业大学,2008.
[8]Habora M E E, Eltayeb A E, Oka M, et al. Cloning of allene oxide cyclase gene from Leymus mollis and analysis of its expression in wheat-Leymus chromosome addition lines [J].Breeding Science, 2013, 63: 68-76.
[9]Mujeeb-Kazi A,Bernard M, Bekele G T, et al. Incorporation of alien genetic information from Elymus giganteus into Triticum aestivum[C]//Sakamoto S. Proceedings of the 6th International Wheat Genetic Symposium.Kyoto, Maruzen, 1983:223-231.
[10]Aptekar R, Rejmánek M. The effect of sea-water submergence on rhizome bud viability of the introduced Ammophila arenaria and the native Leymus mollis in California [J]. Coastal Conserv., 2000, 6: 107-111.
[11]齐津 H B, 彼特罗娃 K A. 禾本科植物的远缘杂交[M]. 王怀名, 蔡起贵,译. 北京:科学出版社, 1961:17-42.
[12]傅杰, 陈漱阳, 张安静. 八倍体小滨麦的形成及细胞遗传学研究[J]. 遗传学报, 1993,20(4): 317-323.
[13]Sharp P J, Kreis M, Shewry P. Location of β-amylase sequence in wheat and its relatives [J]. Theor. Appl. Genet., 1988, 75: 289-290.
[14]Luan Y, Wang X G, Liu W H, et al. Production and identification of wheat-Agropyron cristatum 6P translocation lines [J].Planta, 2010, 232: 501-510.
[15]Devos K M, Gale M D. Comparative genetics in the grasses[J]. Plant Mol. Biol., 1997, 35: 3-15.
[16]Leister D, Kurth J, Laurice D. RFLP and physical mapping of resistance gene homologues in rice (O. sativa) and barley (H.vulgare)[J]. Theor. Appl. Genet., 1999, 98: 509-520.
