外源苯甲酸对烟草幼苗素质及生理生化的影响
2016-05-03李理李鑫周冀衡
李理+李鑫+周冀衡

摘要: 通过在K326烟草品种幼苗生长过程中施加不同浓度苯甲酸处理液,分析苯甲酸处理液对烟草幼苗物理产量、结构及生理化学反应等主要指标的影响。结果表明:苯甲酸处理液在低浓度(0~400 μmol/L)范围内能够通过提高烟草幼苗生物量、根系结构、根系活力、光合特性、叶绿素含量以及叶绿素荧光参数等重要指标促进烟草幼苗生长;高浓度(800~1 000 μmol/L)范围内降低烟草幼苗生物量、根系结构、光合特性及叶绿素含量来抑制烟草幼苗生长;中间浓度(400~600 μmol/L)范围内,苯甲酸液可以促进烟草幼苗生长。
关键词: 苯甲酸;烟草;幼苗生物量;生理生化;叶绿素荧光;根系活力
中图分类号: S572.01 文献标志码: A 文章编号:1002-1302(2016)03-0124-04
研究表明,作物根系分泌物中含有自毒物质,这些物质主要是酚类物质[1-4]。水稻秸秆腐解以及根系分泌物中的自毒物质包括对羟基苯甲酸、香豆酸、丁香酸、香草酸、杏仁酸、阿魏酸等[5]。吴凤芝等从多种蔬菜的根系分泌物中分离出数十种酚酸类物质,其中有93.7%的物质有不同程度的毒性,对羟基苯甲酸、苯丙烯酸毒性最为强烈[6]。大豆根系分泌物中的对羟基苯甲酸、香豆酸、香豆醛直接抑制大豆幼苗的生长[7]。Yu从黄瓜根系分泌物中鉴定出了对羟基苯甲酸、苯甲酸、苯丙烯酸等多种酚酸类物质,这些物质对黄瓜根系养分的吸收等生理活动以及幼苗生长有直接影响[8]。本试验探讨苯甲酸对烟草幼苗生理生化特性的影响,旨在为减轻烟草连作带来的土壤环境恶化提供理论依据。
1 材料与方法
1.1 供试材料
供试烟草品种为K326(Nicotiana tobacum L. K326),由贵州省烟草科学研究院提供。苯甲酸标准品由贵州省烟草科学研究院提供。
1.2 试验方法
1.2.1 不同浓度苯甲酸处理的稀释 称取定量苯甲酸,用去离子水将其分别配制成200、400、600、800、1 000 μmol/L 5个浓度处理液,并以去离子水为空白对照(CK),4 ℃冰箱中冷藏备用。
1.2.2 试验设计 幼苗生长试验于2014年4月至2014年8月进行,在贵州省烟草科学研究院顶层育苗大棚中进行育苗,采用育苗盘(12孔/盘,规格:长190 mm×宽145 mm,孔径35 mm,孔深45 mm)育苗,育苗基质由广州肥苗农业科技有限公司提供。4月1日播种,育苗15 d后间苗(4月 15日),育苗后每穴留1株烟苗,后向育苗盘中每天18:00浇灌 100 mL 对应浓度的苯甲酸处理液。采用随机区组设计,共设6个处理(包括CK处理),每个处理3次重复(即3盘幼苗),每个重复12株。6个处理分别与苯甲酸液浓度对应,为CK(0 μmol/L)、200、400、600、800、1 000 μmol/L处理。待烟草生长60 d(6月1日)后测量生物量、根系形态结构、根系活力、过氧化酶类、光合指标、相对叶绿素、叶绿素荧光等指标。
1.3 测定项目
1.3.1 幼苗生物量测定 测量鲜质量时用蒸馏水将幼苗清洗干净,用吸水纸吸干,在百分之一天平上测量,在105 ℃热风循环烘箱中烘烤30 min,测定干质量,干鲜比直接计算到小数点后两位。每处理测3株,3次重复(下同)。
1.3.2 幼苗根系结构测定 将选取的幼苗洗净后直接将其根部剪掉,再次进行冲洗,待洗净后编号规则放入数字化扫描仪( EPSON Expression 1000XL),按照WinRHIZO 根系分析系统专业版2009b的使用手册进行扫描,用WinRHIZO根系分析系统软件( Regent Instruments Canada Inc. )对根系图进行根系总长度、总根表面积、总根体积、根尖数、根平均直径、根系交叉数测量和分析。根系测定时各处理选取长相一致、具有代表性的烟苗根系。
1.3.3 幼苗根系活力的测定 待烟草幼苗生长60 d,每处理取相同部位的鲜根系,先用自来水冲洗干净,再用蒸馏水漂洗,最后用吸水纸吸干水分,采用氧化三苯基四氮唑(TTC)[9]测定活力。
1.3.4 POD、SOD活性及MDA含量测定 分别采用南京建成生物工程研究所生产的过氧化物酶(POD)、超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒测定。
1.3.5 幼苗光合指标的测定 采用LI-6400便携式光合指标测定仪测定幼苗净光合速率(Pn)、气孔导度(Cond)、蒸腾速率(Tr)和细胞间隙二氧化碳浓度(Ci)。在每株烟苗相同部位选取1张烟叶(从下到上数第4张功能叶)。
1.3.6 幼苗相对叶绿素值的测定 用叶绿素仪SPAD-502测定选定烟苗功能叶的相对叶绿素含量,待测定的每株烟苗在相同部位选取1张烟叶(从下向上数第4张功能叶)。
1.3.7 叶绿素荧光参数测定 待测定叶片经暗适应30 min后,采用M系列IMAGING-PAM(德国WALZ公司)调制叶绿素荧光成像系统,选择烟苗第 2~3张叶自上而下测定叶绿素荧光动力学参数。
1.4 数据处理
采用Microsoft Excel 2003软件处理数据,采用DPS 9.05软件进行差异显著性分析。
2 结果与分析
2.1 不同浓度苯甲酸处理对烟草幼苗生物量的影响
由表1可以看出,不同浓度苯甲酸对烟草幼苗生物量各类指标总体呈现低浓度促进高浓度抑制的趋势。其中幼苗叶鲜质量在200 μmol/L浓度处理下呈增加趋势,但与对照处理无显著性差异,在600 ~1 000 μmol/L浓度处理下呈降低趋势,且与对照处理差异显著;根鲜质量与叶鲜质量表现类似趋势,在200~400 μmol/L浓度处理下均表现增加趋势,600~1 000 μmol/L浓度处理下抑制根生长,与对照处理差异不显著;叶干质量在200~400 μmol/L浓度处理下一直呈增加趋势,在600 ~1 000 μmol/L浓度处理下一直呈降低趋势,且在1 000 μmol/L浓度处理下抑制达到最低;根干质量在不同浓度处理下的变化趋势与根鲜质量一致,在1 000 μmol/L浓度处理下抑制程度达到最大,且与对照处理差异不显著;鲜干比越大表示鲜质量越大,干质量越小,生物量积累量越小。
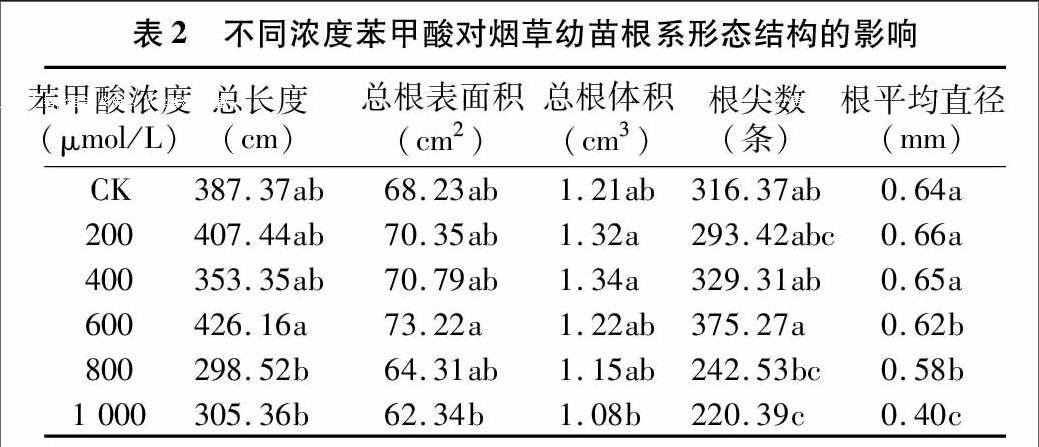
2.2 不同浓度苯甲酸处理对烟草幼苗根系形态结构的影响
由表2可以看出,不同浓度苯甲酸处理对烟草幼苗根系结构中的根系总长度、总根表面积、总根体积、根尖数、根系平均直径的影响趋势相同。随着苯甲酸浓度的不断增加,烟草幼苗根系总长度、总根表面积、根尖数在600 μmol/L浓度处理下达到最大,分别是对照的1.10、1.07、1.19倍;烟草幼苗根系总根体积在1 000 μmol/L浓度处理范围内总体呈先促进后抑制的趋势,在400 μmol/L浓度处理下达到最大,后逐渐呈现抑制态势,在1 000 μmol/L浓度处理下抑制程度达到最大,仅为对照的89%;烟草幼苗根系平均直径总体也呈低浓度促进高浓度抑制的趋势,但是促进作用不明显,与对照无显著性差异;1 000 μmol/L浓度处理下烟草幼苗根系平均直径为对照的62.5%。
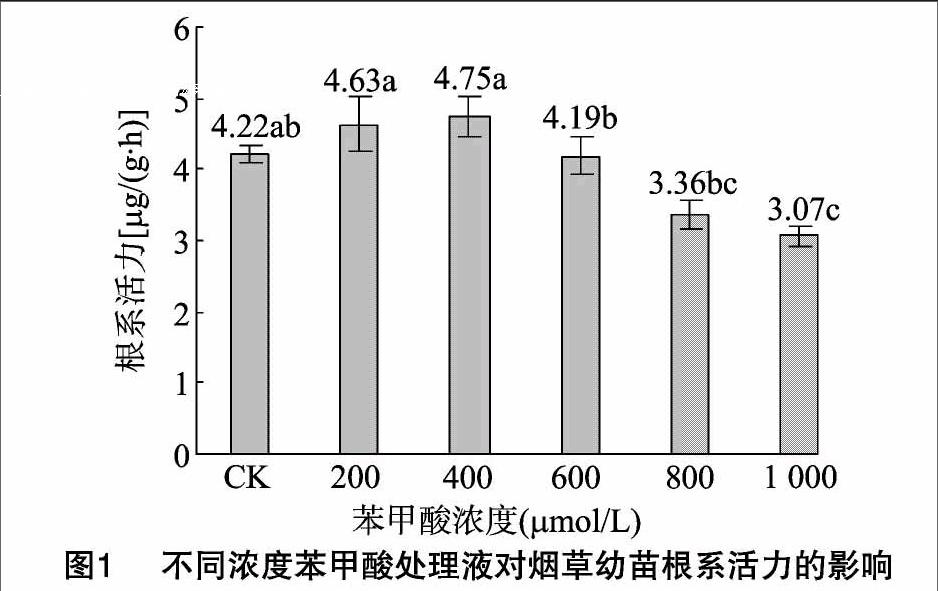
2.3 不同浓度苯甲酸处理对烟草幼苗根系活力的影响
植物根系是活跃的吸收器官、合成器官,根的生长情况和活力水平直接影响植株地上部分的营养状况及产量水平,是表征植物根系的量,其活力提高对烟叶的光合强度和叶绿素含量均有十分重要的意义[10]。从图1可以看出,各处理间烟草幼苗根系活力表现为400 μmol/L>200 μmol/L>CK>600 μmol/L>800 μmol/L>1 000 μmol/L,不同浓度苯甲酸处理下对烟草幼苗根系活力呈现出的抑制作用明显大于促进作用,在1 000 μmol/L时抑制作用最大,在400 μmol/L浓度处理内根系活力一直呈增加趋势,烟草幼苗根系最大活力为 4.75 μg/(g·h),随着苯甲酸浓度增加,抑制作用逐渐增强。
2.4 不同浓度苯甲酸处理对烟草幼苗酶活性的影响
从表3可以得出,烟草SOD、POD分别在200、400 μmol/L浓度下达到最大,分别为3.33、15.22 U/mg,与对照差异不显著,均在 1 000 μmol/L 浓度时达到最大抑制程度,分别为1.37、7.41 U/mg。烟草幼苗MDA含量在1 000 μmol/L浓度范围内呈先降低后增大的趋势,在400 μmol/L时降低到最小,然后随着苯甲酸浓度的不断增大,MDA含量一直呈增加趋势,1 000 μmol/L时MDA含量达0.85 nmol/mg,与CK处理差异显著。
2.5 不同浓度苯甲酸处理对烟草幼苗光合特性的影响
由表4可知,不同浓度苯甲酸处理液下烟草幼苗净光合速率、气孔导度变化趋势类似,低浓度处理下起促进作用,高浓度处理下受到抑制。1 000 μmol/L浓度下抑制程度达到最大。烟草幼苗蒸腾速率在800 μmol/L浓度范围内一直呈增加趋势,在800 μmol/L浓度时与CK无差异,1 000 μmol/L浓度时则降到1.79 mmol/(m2·s),与其他各处理间差异显著。胞间CO2浓度在1 000 μmol/L浓度范围内随苯甲酸浓度的不断增加呈现促进趋势,1 000 μmol/L浓度处理下达到300.5 μmol/ mol,为对照的111.58%。
2.6 不同苯甲酸浓度处理对烟草幼苗叶绿素含量的影响
相对叶绿素含量(SPAD值)与叶绿素浓度、叶片全氮浓度之间有稳定的极显著相关性,可间接反映烟草的氮素营养状况[11]。从图2可以看出,当苯甲酸浓度为600 μmol/L时,烟草幼苗相对叶绿素含量最大,是CK处理的1.25倍,且差异显著;当苯甲酸浓度为1 000 μmol/L时,烟草幼苗相对叶绿素含量为26.27,与CK差异不显著。其他处理间烟草幼苗相对叶绿素含量无显著差异,且与CK差异不显著。
2.7 不同苯甲酸浓度处理对幼苗叶绿素荧光的影响
PSⅡ最大光化学量子产量(Fv/Fm) 反映了反应中心内禀光能转换效率或称最大PSⅡ的光能转换效率[12]。非胁迫条件下PSⅡ最大光化学量子产量的变化极小,不受物种和生长条件的影响,胁迫条件下该参数明显下降,当该参数值下降时则表明植物受到胁迫,参数下降越明显,植物受到的胁迫越大[13-14]。由表5可以看出,CK的Fv/Fm与200、400、600、800 μmol/L浓度处理无显著差异,分别为0.63、0.62、0.63、0.65,1 000 μmol/L苯甲酸浓度处理时烟草幼苗叶片Fv/Fm只有0.58,受到的胁迫较大,且与CK处理差异显著,说明在1 000 μmol/L苯甲酸浓度范围内,低浓度苯甲酸处理下幼苗叶片PSⅡ具有较高的光能转换效率,高浓度苯甲酸处理下幼苗叶片PSⅡ具有较低的光能转换效率。
光化学淬灭系数(qP)是PSⅡ天线色素吸收的光能用于光化学电子传递的份额,较低的光化学淬灭系数反映PSⅡ中开放的反应中心和参与二氧化碳固定的电子减少[15]。由表5可以看出,CK光化学淬灭系数值高于400 μmol/L苯甲酸处理,两者差异不显著。200 μmol/L苯甲酸处理下烟苗qP高于对照,且差异显著。600、800、1 000 μmol/L苯甲酸处理下幼苗qP显著低于对照,分别只有0.28、0.34、0.29。说明低浓度苯甲酸处理下qP提高了光合作用中二氧化碳固定电子的能力,高浓度苯甲酸处理下降低了光合作用中二氧化碳固定电子的能力,胁迫作用越强,二氧化碳固定电子能力越弱。
调节性能量耗散量子产量(YNPQ)是光保护的重要指标,若YNPQ较高,一方面表明植物接收的光强过剩,另一方面说明植物仍可以通过调节作用(如将过剩光能耗散为热)来保护自身[16]。由表5可以看出,随着苯甲酸浓度不断增大,YNPQ也随之增大。1 000 μmol/L苯甲酸处理下烟草幼苗叶片YNPQ达到最大,且与对照差异显著。说明在一定苯甲酸浓度处理范围内,烟草幼苗叶片接收的过剩强光较多,吸收的光量子很少通过光化学途径转化为能量。
PSⅡ实际光合效率(YⅡ)表示植物将吸收光能进行转化的能力。从表5可以看出,对照YⅡ与其他所有浓度处理均大,且差异显著,1 000 μmol/L苯甲酸处理下烟草幼苗达到最小,说明苯甲酸降低了幼苗叶片PSⅡ反应中心的实际光合能力。
3 结论与讨论
根系分泌物对作物的化感作用复杂多变,不同环境下不仅对不同植物具有选择性、专一性,而且对同一植物高浓度和低浓度化感作用存在差异,并且多种成分符合化感效应有所不同[17]。本研究结果表明,不同浓度苯甲酸对烟草幼苗生长过程中各项生理生化等指标的影响规律大体相似,均表现为低浓度促进高浓度抑制。这一结论与李翠香等的研究结论[18]相似。蔺琰东等研究表明,苯甲酸对马铃薯组培苗有明显抑制作用,且随着化感物质浓度的增加,当多种抑制物质同时培苗时抑制作用更明显[19]。Choesin等认为,较低含量的化感物质可以促进植物的生长[20]。本研究结果表明,在1 000 μmol/L苯甲酸浓度范围内,对K326品种烟草的多种生理生化指标测定中起主要促进作用的浓度集中在400~600 μmol/L范围内。孙颖颖等研究对羟基苯甲酸对赤潮微藻—米氏凯伦藻、塔玛亚历山大藻生长的影响,结果表明,当对羟基苯甲酸浓度>1.6 mmol/L时,对羟基苯甲酸能明显抑制2种微藻的生长[21]。韩春梅研究认为,随着苯甲酸浓度的增加,白菜幼苗的根长和苗长均呈降低趋势[22]。本研究结果表明,苯甲酸在0~400 μmol/L浓度范围内的幼苗根系生长中,表现为根尖数、总根长、根表面积、根体积增大,与前人研究结果类似,主要原因是较低浓度的苯甲酸处理引起幼苗代谢出现异常,导致脂类化合物增加,或者是由于自毒物质导致植物不能有效利用营养物质和代谢途径的一种自我保护机制[23-25]。随着苯甲酸浓度的不断增大,烟草的自我保护机制受到破坏,直接影响根系的生长,600~1 000 μmol/L苯甲酸处理对烟草幼苗的叶绿素含量有抑制作用,影响叶绿素的生长合成。相对叶绿素含量直接表征叶片内的氮含量,硝酸还原酶是硝基同化过程中的关键酶,也是植物体内同化硝酸盐过程的限速酶,其活性强弱与植物体内的氮同化能力密切相关[26-27]。本试验中,高浓度苯甲酸处理液通过抑制硝酸还原酶的活性来影响氮同化,进而抑制幼苗相对叶绿素含量和与相对叶绿素有关的光合作用以及叶绿素荧光等反应。SOD、POD 2种过氧化物酶在低浓度下促进烟草幼苗生长,高浓度下抑制其生长,这主要是由于在低浓度苯甲酸液下烟草幼苗可以通过增加POD、SOD等活性酶清除活性氧维持自身稳定的内环境,当苯甲酸浓度过高时胁迫作用加大,产生的毒害效应直接导致POD、SOD下降,MDA直接表征幼苗受到的胁迫作用强弱,当幼苗受到外界的胁迫作用较弱时,MDA含量较低,当胁迫作用较大时,MDA含量增大,自由基含量也不断增多。自由基可以直接攻击叶绿素,导致叶绿素遭到破坏[28],光合作用场所发生在叶绿素类囊体膜上,叶绿素降解必将导致光合速率下降。高浓度苯甲酸可以降低光合作用中的关键反应酶RuBP羧化酶的活性,直接导致光合速率下降[29]。本试验只研究了0~1 000 μmol/L浓度范围内的苯甲酸对烟草幼苗生物量、根系物理结构生长、根系活力、相对叶绿素含量、叶绿素荧光特性、光合特性影响,所得出的结论有一定的局限性,由于本试验均是在烟草幼苗期的理想环境下进行的,对苯甲酸应用于大田成熟期的情况势必会有一些外界因素造成干扰和影响,且大田成熟期是否能通过烟草自身的生理反应消除这种障碍还需要进一步探讨。
参考文献:
[1]Debbie J R,Cherney J J. Fibre and soluble phenolic monomer composition of morphological components of sorghum stover[J]. Journal of the Science of Food and Agriculture,1991,54(4):645-649.
[2]史刚荣. 植物根系分泌物的生态效应[J]. 生态学杂志,2004,23(1):97-101.
[3]吴凤芝,赵凤艳. 根系分泌物与连作障碍[J]. 东北农业大学学报,2003,34(1):114-118.
[4]黄高宝,柴 强. 植物化感作用表现形式及其开发应用研究[J]. 中国生态农业学报,2003,11(3):172-174.
[5]杜英君,靳月华. 连作大豆植株化感作用的模拟研究[J]. 应用生态学报,1999,10(2):209-212.
[6]吴凤芝,黄彩红,赵凤艳. 对羟基苯甲酸对黄瓜幼苗生长及保护酶活性的影响[C]//中国园艺学会第九届学术年会论文集,2010.
[7]吴凤芝,黄彩红,赵凤艳. 酚酸类物质对黄瓜幼苗生长及保护酶活性的影响[J]. 中国农业科学,2002,35(7):821-825.
[8]Yu J Q. Effects of root exudates of cucumber and allelochemicals onion uptake by cucumber seeding[J]. Chemistry and Ecology,1997,23(3):817-827.
[9]卢敏敏,潘文杰,王 丰. 油菜秸秆浸提液及残渣对烤烟幼苗生长的影响[J]. 贵州农业科学,2011,39(10):57-60,63.
[10]郑丽锦,张学英,葛会波,等. 果树盐胁迫生理生化特性的研究进展[J]. 河北农业大学学报,2003,26(增刊1):41-44.
[11]艾天成,李方敏,周治安,等. 作物叶片叶绿素含量与SPAD值相关性研究[J]. 湖北农学院学报,2000,20(1):6-8.
[12]张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444.
[13]张 依,卓丽环,汪成忠. 遮光对紫叶加拿大紫荆光合速率及叶绿素荧光参数的影响[J]. 河北农业大学学报,2009,32(6):52-56.
[14]刘丽贞,秦伯强,朱广伟,等. 太湖蓝藻死亡腐烂产物对狐尾藻和水质的影响[J]. 生态学报,2012,32(10):3154-3159.
[15]杨文斌,王国祥,郑海洋,等. 菹草石芽萌发及幼苗生长对光、温因子的响应[J]. 生态与农村环境学报,2009,25(1):96-100,105.
[16]姚 娟,王茂胜,石俊雄,等. AM真菌对烟苗生长及叶绿素荧光特性的影响[J]. 贵州农业科学,2012,40(9):109-114.
[17]徐 鹏,程智慧,梁 静,等. 百合根系分泌物中不同组分的化感作用[J]. 西北农林科技大学学报:自然科学版,2011,39(11):167-172.
[18]李翠香,刘 娜,宋 威,等. 对羟基苯甲酸对小麦幼苗生长及其生理特性的影响[J]. 河南工业大学学报:自然科学版,2009,30(1):62-65.
[19]蔺琰东,秦舒浩,王 丽,等. 外源邻苯二甲酸二甲酯和苯甲酸对马铃薯组培苗生长的化感效应[J]. 广东农业科学,2011,38(9):17-20.
[20]Choesin D N,Boerner R E,Boerner A J,et al.Allylisothiocyanate release and the allelopathic potentica of Brassica napus(Brassicaceae) [J]. American Journal of Botany,1991,78:1083-1090.
[21]孙颖颖,刘筱潇,阎斌伦,等. 对羟基苯甲酸对2种赤潮微藻生长的影响[J]. 环境科学与技术,2010,33(7):36-39,124.
[22]韩春梅. 苯甲酸对白菜种子萌发及抗氧化酶活性的影响[J]. 种子,2012,31(10):114-115.
[23]孙会军,孙令强,王 倩. 苯甲酸、肉桂酸对西瓜幼根生长、显微及超微结构的影响[J]. 华北农学报,2006,21(增刊):77-80.
[24]Lober P,Muller W. Volatile growth inhibitors produced by Salvia leucophylla:Effects on seeding root tip ultra structure[J]. American Journal of Botany,1976,63(2):196-200.
[25]Cruz O R,Ananya A L,Hernandez B B,et al. Effect of allelochemical stress produced by sioy deppei on seedling root ultrastructure of Phaselous vulgaris and Cucurbita ficifolia[J]. Journal of Chemical Ecology,1998,24(12):2039-2057.
[26]张润花,郭世荣,樊怀福. 外源亚精胺对盐胁迫下黄瓜植株氮化合物含量和硝酸还原酶活性的影响[J]. 武汉植物学研究,2006,24(4):381-384.
[27]李继强,曾秀存,李彩霞,等. 苯甲酸对黄瓜幼苗叶绿素含量、氮代谢及膜透性的影响[J]. 西南农业学报,2010,23(2):371-374.
[28]高 旭,张古文,胡齐赞,等. 自毒物质肉桂酸对豌豆幼苗生长及叶绿素荧光特性的影响[J]. 中国蔬菜,2013(8):44-49.
[29]Amarject B,Mohini S,Sangeeta S. Allelopathic effects of Parthenium hysterophorous on the chlorophyl,nitrogen,protein and ascorbic acid content of Lantana canara[J].Allelopathy Journal,2005,15:305-310.
