肝星形细胞条件培养液对肝癌细胞上皮-间质转化的影响*
2016-04-13徐国强黄小琼孙达权陈腾祥
徐国强, 黄小琼, 孙达权, 王 伟, 陈腾祥
(1.贵州医科大学 生理学教研室, 贵州 贵阳 550025; 2.贵州医科大学 生物化学与分子生物学教研室, 贵州 贵阳 550025)
肝星形细胞条件培养液对肝癌细胞上皮-间质转化的影响*
徐国强1**, 黄小琼1, 孙达权2, 王伟1, 陈腾祥1
(1.贵州医科大学 生理学教研室, 贵州 贵阳550025; 2.贵州医科大学 生物化学与分子生物学教研室, 贵州 贵阳550025)
[摘要]目的: 探讨人肝星形细胞条件培养液(HSC-CM)对肝癌细胞(HCC)上皮-间质转化的影响。方法: 采用HSC-CM培养肝癌细胞(SMMC-7721),细胞划痕实验和transwell小室侵袭实验检测HSC-CM对SMMC-7721迁移和侵袭的影响,激光共聚焦显微术(LSCM)和Western blot分析CM培养下SMMC-7721中上皮标志物E-cadherin、间质标志物N-cadherin和Vimentin的表达变化,Western blot检测核转录因子Snail的表达水平。结果: HSC-CM培养的SMMC-7721细胞迁移和侵袭能力增强,和常规培养的SMMC-7721细胞比较,差异有统计学意义(P<0.05);SMMC-7721上皮标志物E-cadherin蛋白表达下调、间质标志物N-cadherin蛋白和Vimentin蛋白表达上调,核转录因子Snail表达上调,与常规培养组比较,差异有统计学意义(P<0.05)。结论: HSC-CM促进了SMMC-7721的上皮-间质转化。
[关键词]癌,肝细胞; 星形细胞; 上皮-间质转化; 细胞培养; 培养基,条件性
肝癌转移和浸润(metastasis and invasion)是术后高复发和5年存活率低下的主要原因,肝癌细胞(hepatoma carcinoma cells,HCC )发生侵袭的基础是癌细胞发生上皮-间质细胞转化(epithelial-mesenchymal transitions,EMT)[1-2]。HCC发生EMT是内因和外因共同作用的结果,内因主要包括肝癌细胞自身基因突变或者基因表达紊乱而引起胞内正常蛋白组学发生改变,进而影响细胞生物学特性和行为[3-4];外因主要是指肝癌细胞生存的微环境(tumor microenvironment)发生变化,包括细胞外基质、胞外体液pH值、激素、细胞因子等各种生物信号小分子的改变[5-7]。改变肝癌细胞生存微环境,可以延缓甚至抑制肝癌细胞恶化及侵袭。肝癌细胞微环境可分为非细胞组分和细胞组分两大类:非细胞组分主要包括肝癌细胞本身与多种癌旁细胞分泌的生长因子、细胞因子、细胞外基质以及体循环运输而来的激素等;细胞组分主要包括肝星形细胞、肝实质细胞、成纤维细胞、血管内皮细胞和间充质细胞、巨噬细胞、枯否式细胞、T细胞等;其中肝星形细胞(hepatic stellate cell,HSC)在肝癌微环境中起着十分重要的调控作用[6]。HSC在正常的肝组织中处于静息状态[8]。肝脏一旦受到炎症、化学、病理因素等侵袭时会使HSC发生活化,分泌多种细胞因子、趋化因子、生长因子和胞外基质,影响细胞外基质的代谢,导致肝癌细胞发生EMT,促进肝癌细胞转移和浸润[9-12]。HSC与肝癌细胞之间进行双向调控,活化的HSC诱导肝癌发生EMT及其侵袭,肝癌细胞又作用于HSC使其进一步活化和促进其旁分泌,进而加剧肝癌恶化[13]。本实验主要研究肝星形细胞条件培养液对人肝癌细胞系SMMC-7721上皮-间质转化的影响,为寻找和阻断肝癌转移和浸润提供可能靶点。
1材料与方法
1.1材料和设备
人肝星形细胞LX2购于香港大学临床实验中心,人肝癌细胞系SMMC-7721购于中国科学院上海生命科学研究院细胞库,Transwell小室购自Millipore公司,兔抗人E-cadherin抗体,N-cadherin抗体,Vimentin抗体,SNAI 1(A242)抗体均系多克隆抗体(Bioworld公司,1∶500稀释),鼠抗人GAPDH单克隆抗体(Bioworlde公司,1∶10 000稀释)。电泳仪及微型垂直电泳槽购于美国 GE公司,GBOXiChemiXR化学发光及凝胶成像仪购于美国 Syngene公司,FV1000 激光共聚焦扫描显微镜、倒置荧光显微镜购于奥林巴斯公司,高速冷冻离心机购于美国 Beckman 公司。
1.2肝星形细胞及SMMC-7721的培养
SMMC-7721培养用添加10% FBS(GIBCO公司)的DMEM培养基(HyClone公司);肝星形细胞用添加10% FBS的RPMI-1640培养基,在37 ℃、5% CO2培养箱内培养,根据细胞的生长情况2~3 d更换新鲜培养基继续培养或细胞传代培养。肝星形细胞条件培养液(HSC-CM)收集是指将肝星形细胞铺在细胞培养皿中置于37 ℃,5% CO2孵箱中进行常规培养,待细胞长80%密度后,弃旧培养液,加无血清无酚红的RPMI-1640,培养24~48 h后,收集上清,离心5 min,1 000 r/min,0.22 μm过滤,即为肝星型细胞条件培养基(HSC-CM),-20 ℃冷冻并在一星期内使用。SMMC-7721的条件培养是指将细胞常规培养至生长期、细胞密度在70%左右时弃去旧培养基,加HSC-CM培养72 h。
1.3肝癌细胞迁移和侵袭实验
细胞迁移实验设常规组、条件培养组,分别将已长至80%密度的各组细胞消化计数,均匀的铺到24孔板(1×105个细胞/孔),每组设3个复孔,次日,待细胞长满后,用20 μL的加样枪头,紧贴直尺于24孔板轻轻划一痕,用PBS洗2遍除去划痕上的细胞,加新鲜不含血清培养基常规培养,显微镜下每0、24、48、72 h各拍照1次,观察细胞的迁移情况。细胞侵袭实验分组同迁移实验,小室上层Matrigel胶:DMEM培养基以1∶6冰上稀释,100 μL/每孔铺成单层,37 ℃温箱40 min。将条件分组培养好的细胞消化制备细胞悬液,每孔5×105个/mL,取细胞悬液每孔400 μL加入Transwell小室孔径8 μm,24孔板中。下室加600 μL含10% FBS的培养基,放入孵箱培养24~28 h后,用棉签在小室内层轻轻擦试胶,用甲醇固定10 min,苏木精染核8~10 min,伊红染浆3~5 min,最后用70%乙醇洗涤两遍;在20倍显微镜下拍照,每个小室至少拍3~5个视野,数穿越的细胞个数。
1.4肝癌细胞计数
常规和HSC-CM培养后的肝癌细胞计数,每个激光共聚焦扫描显微镜专用的玻底皿铺入1×105个细胞,用含10% FBS的DMEM培养2~3 d,用4%多聚甲醛室温固定20 min。冷PBST洗3次,5 min/次。3% BSA室温封闭1 h,冷PBST洗3次,5 min/次,加入一抗4 ℃孵育过夜。次日用PBS洗涤3次后,给细胞上带有荧光基团的Dylight 549 标记山羊抗兔IgG(H+L)免疫荧光二抗温育2 h和DAPI用于染色细胞核15 min。4 ℃避光保存。激光共聚焦扫描显微镜计数肝癌细胞。
1.5E-cadherin、N-cadherin、Vimentin 蛋白及核转录因子Snail蛋白分析
HSC-CM采用抗原浓缩法,将肝癌细胞冰上裂解10 min,刮取裂解物,4 ℃,12 000r/min离心30 min,上样行SDS-PAGE电泳后转至PVDF膜,室温封闭1 h,加一抗稀释液4 ℃孵育过夜。洗膜后加入二抗稀释液室温孵育2 h,膜上均匀加入ECL发光液,放入曝光仪内进行检测,用图像分析软件对目的蛋白进行灰度定量,计算相对灰度值。每组Western blot实验重复3次。
1.6统计学分析
计量资料以均数±标准差表示,采用SPSS 17.0统计软件分析,两样本比较采用t检验,多样本组间比较采用单因素方差分析(one way ANOVA),P<0.05 表示差异具有统计学意义。
2结果
2.1肝星形细胞LX2促进肝癌细胞SMMC-7721迁移
与常规培养组相比,HSC-CM培养的肝癌细胞SMMC-7721迁移能力增强,培养48 h和72 h时差异具有统计学意义(P<0.05)。见图1。
2.2肝星形细胞LX2促进肝癌细胞SMMC-7721侵袭
transwell侵袭实验结果显示,HSC-CM培养的肝癌细胞SMMC-7721比常规培养的细胞更具有侵袭能力,差异有统计学意义(P<0.05)。见图2。
2.3肝星形细胞LX2诱导肝癌细胞SMMC-7721间质化
激光共聚焦扫描显微镜免疫荧光实验结果显示,与常规培养组比较,HSC-CM培养的SMMC-7721细胞中上皮标志物E-cadherin表达下调,间质标志物N-cadherin和Vimentin表达上调。见图3。Western blot实验结果显示,与常规培养组比较,HSC-CM培养的SMMC-7721细胞中上皮标志物E-cadherin表达下调,N-cadherin、Vimentin和核转录因子Snail表达水平上调。见图4。
3讨论
HSC活化是肝癌细胞发生EMT的重要诱因,活化的HSC能够分泌细胞外基质如胶原蛋白Ⅰ、多种MMPs、各种细胞因子和生长因子,这些分子与肝癌细胞表面抗原或受体相结合,通过肝癌细胞内多种信号转导途径影响肝癌细胞基因表达谱,如黏着斑和黏着带相关蛋白,从而降低细胞与胞外基质和细胞与细胞之间的黏附连接;同时,活化的肝癌细胞又分泌化学信号分子进一步促进HSC活化,从而进一步改变肝癌细胞蛋白组学,最终使肝癌细胞发生EMT和转移浸润[7]。
本研究常规培养HSC生长至细胞密度70%~80%后,用无血清培养基培养48 h,使其充分活化,收集其培养上清液,即HSC-CM,用于肝癌细胞培养;条件培养的肝癌细胞采用划痕实验和transwell实验证实,HSC-CM使肝癌细胞迁移和侵袭能力增强。另外,免疫荧光检测条件培养的肝癌细胞的3个EMT标志蛋白上皮标志物E-cadherin表达下调、间质标志物N-cadherin和Vimentin表达上调;western blot检测条件培养的肝癌细胞的3个EMT标志蛋白变化与免疫荧光检测结果相一致;更重要的是调控EMT的核转录因子Snail蛋白表达也明显上调,证明肝星形细胞条件培养液可以诱导肝癌细胞发生EMT。这些结果与文献所报道的结果是一致的,即从培养的HSC细胞上收集的条件培养基(CM)培养单层肝癌细胞,可显著诱导肝癌细胞增殖和迁移[11]。此外,肝癌内部HSC与肝癌细胞共培养后,使肝癌细胞活力和生存力、迁移和侵袭能力增加并伴随肝癌细胞获得EMT[14]。Yang等[15]发现,用HSC-T6细胞的条件培养液培养肝癌细胞ML1,其细胞生长速度变慢,但是瘤形成结节数目增多,同时,体外培养的细胞形态发生变化,细胞学行为也发生了一定的改变,EMT明显。进一步研究发现,这种条件培养基中胶原蛋白I的含量明显增多[10]。用RNAi的方法抑制HSC-T6细胞内胶原蛋白I的表达,条件培养基中胶原蛋白I也随之减少,用这种条件培养基培养肝癌细胞ML1后,其EMT现象显著减弱,证明HSC-T6细胞分泌的胶原蛋白I在诱导肝癌细胞EMT过程中起着重要的调控作用[15]。另外,还有人证明活化的HSC分泌的细胞因子SDF-1/CXC在肝癌细胞EMT进程中也起着重要的调控作用[16]。活性HSC分泌的SDF-1/CXC与肝癌细胞表面受体CXCR4相互作用,诱导肝癌细胞发生EMT,促进细胞转移和浸润,这种现象能够在单独培养的肝癌细胞培养基中添加SDF-1细胞因子实现,也能够被CXCR4特异性拮抗剂AMD3100和RNAi技术抑制CXCR4蛋白表达所阻断[16]。此外,Dai等[17]也发现肝癌细胞EMT与HSC内miRNAs表达也密切相关。HSC活化是肝癌细胞EMT的充分条件,而miR-155表达水平直接决定HSC是否活化;在正常条件下,HSC转录生成的miR-155能够与细胞内的TCF4和AGTR1的mRNA的3’UTR相互作用,通过miRISC抑制TCF4和AGTR1蛋白表达,而肝硬化条件下的HSC以及TGFβ1处理的原代HSC和HSC-T6细胞,其蛋白表达水平显著上升,包括TCF4、 AGTR1、ERK1、T GFβ1、a-smooth muscle actin (a-SMA)、TIMP1和间质细胞标记物等,这些蛋白使HSC发生活化和促进肝癌细胞EMT,而这一过程能够被miR-155模拟物所逆转[17]。
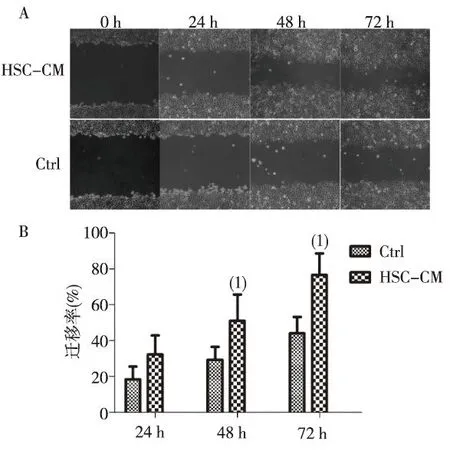
(1)与对照组比较,P <0.05图1 常规培养和条件培养的肝癌细胞SMMC-7721的迁移能力Fig.1 Migration of SMMC-7721 cells cultured with regular medium or conditional medium
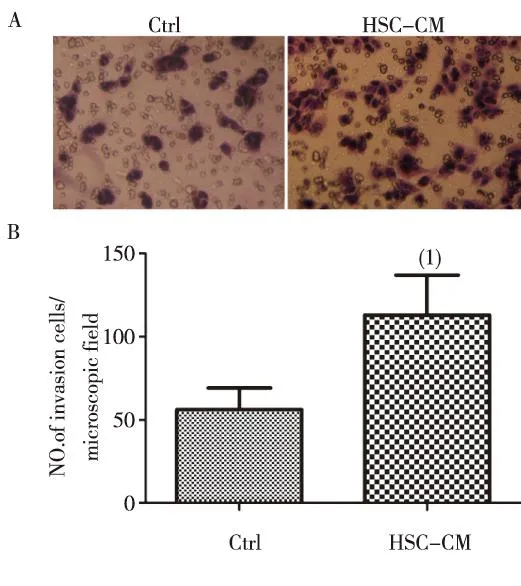
(1) 与对照组比较,P <0.05图2 常规和条件培养SMMC-7721细胞的侵袭能力(20×,孵育24~28 h)Fig.2 Invasion of SMMC-7721 cells cultured with regular medium or conditional medium for 24~28 h
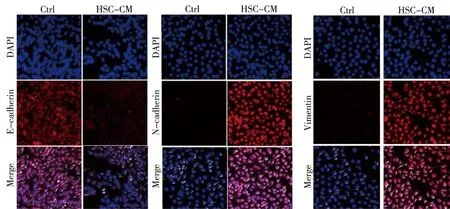
注:E-cadherin、N-cadherin、Vimentin 是目的蛋白,DAPI是细胞核,Merge为相应的目的蛋白和DAPI观察图的叠加图3 免疫荧光观察E-cadherin、N-cadherin和Vimentin在SMMC-7721细胞中的表达(10×)Fig.3 The expression of E-cadherin, N-cadherin and Vimentin in SMMC-7721 detected by immunofluorescence
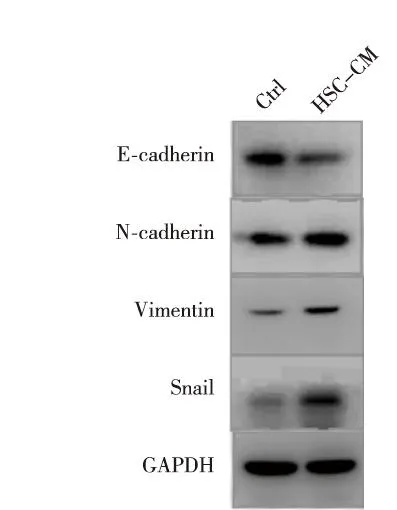
图4 Western blot实验观察E-cadherin、N-cadherin、Vimentin和Snail在SMMC-7721细胞中的表达Fig.4 The expression of E-cadherin, N-cadherin,Vimentin and snail in SMMC-7721 cells detected by Western blot
以上事实证明HSC诱导肝癌细胞发生EMT的原因和机制是复杂多样的,而上述研究得出的机制也不一定是全面的,其完整的分子机制需要继续探索。本研究只是证实了肝星形细胞条件培养液对肝癌细胞的影响,并未探讨活化的肝星形细胞促进肝癌细胞迁移、侵袭和上皮-间质转化的具体分子机制,相关研究有待进一步制定、实施和论证。
4参考文献
[1] Fassina A,Cappellesso R,Guzzardo V,et al. Epithelial-mesenchymal transition in malignant mesothelioma[J].Modern Pathology, 2012(1):86-99.
[2] Scheel C,Eaton EN, Li SJ, et al. Paracrine and autocrine signals induce and maintain mesenchymal and stem cell tates in the breast[J].Cell, 2011(6): 926-940.
[3] Liang B, Jia C, Huang Y, et al. TPX2 level correlates with hepatocellular carcinoma cell proliferation, apoptosis, and EMT[J]. Dig Dis Sci, 2015(8):2360-2372.
[4] Dai W, Wang F, He L, et al. Genistein inhibits hepatocellular carcinoma cell migration by reversing the epithelial-mesenchymal transition: partial mediation by the transcription factor NFAT1[J]. Mol Carcinog, 2015(4):301-311.
[5] Tu T, Budzinska MA, Maczurek AE, et al. Novel aspects of the liver microenvironment in hepatocellular carcinoma pathogenesis and development[J]. Int J Mol Sci, 2014(6):9422-9458.
[6] Carloni V, Luong TV, Rombouts K. Hepatic stellate cells and extracellular matrix in hepatocellular carcinoma: more complicated than ever[J]. Liver Int, 2014(6):834-843.
[7] Wang H, Chen L. Tumor microenviroment and hepatocellular carcinoma metastasis[J]. J Gastroenterol Hepatol, 2013(1):43-48.
[8] Suh YG, Jeong WI. Hepatic stellate cells and innate immunity in alcoholic iver disease[J].World J Gastroenterol, 2011(20):2543-2551.
[9] Neaud V, Faouzi S, Guirouilh J, et al.Human hepatic myofibroblasts increase invasiveness of hepatocellular carcinoma cells: evidence for a role of hepatocyte growth factor[J]. Hepatology, 1997(6):1458-1466.
[10]Mikula M, Proell V, Fischer AN, et al. Activated hepaticstellate cells induce tumor progression of neoplastichepatocytes in a TGF-beta dependent fashion[J]. J Cell Physiol, 2006(2):560-567.
[11]Amann T, Bataille F, Spruss T, et al. Activated hepatic stellate cells promote tumorigenicity of hepatocellular carcinoma[J].Cancer Sci, 2009(4):646-653.
[12]Coulouarn C, Corlu A, Glaise D, et al. Hepatocyte-stellate cell cross-talk in the liver engenders apermissive inflammatory microenvironment that drives progression in hepatocellular carcinoma[J].Cancer Res, 2012(10):2533-2542.
[13]Santamato A, Fransvea E, Dituri F, et al. Hepatic stellate cells stimulate HCC cell migration via laminin-5 production[J].Clinical Science, 2011(4):159-168.
[14]Sun B, Zhang X, Cheng X,et al.Intratumoral Hepatic Stellate Cells as a Poor Prognostic a New Tre Marker and atment Target for Hepatocellular Carcinoma[J]. PLoS One, 2013(11):e80212.
[15]Yang MC, Wang CJ, Liao PC, et al. Hepatic stellate cells secretes type I collagen to trigger epithelial mesenchymal transition of hepatoma cells[J]. Am J Cancer Res, 2014(6):751-673.
[16]Li X, Li P, Chang Y, et al. The SDF-1/CXCR4 axis induces epithelial-mesenchymal transition in hepatocellular carcinoma[J]. Mol Cell Biochem, 2014(1-2):77-84.
[17]Dai WL, Zhao J, Tang N, et al. MicroRNA-155 attenuates activation of hepatic stellate cell by simultaneously preventing EMT process and ERK1 signalling pathway. Liver Int, 2015(4):1234-1243.
(2015-07-23收稿,2015-09-16修回)
中文编辑: 刘平; 英文编辑: 刘华
Influence of Hepatic Stellate Cell Conditional Culture Medium on HCC's Epithelial-Mesenchymal Transition
XU Guoqiang1, HUANG Xiaoqiong1, SUN Daquan2, WANG Wei1, CHEN Tengxiang1
(1.DepartmentofPhysiology,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China; 2.DepartmentofBiochemistry&MolecularBiology,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China)
[Abstract]Objective: To investigate the effect of HSC conditional medium on hepatocellular carcinoma cell's (HCC) epithelial-mesenchymal transition. Methods: HCCs were cultured in HSC conditional medium, and their migration and invasion were detected by methods of cell wound healing and transwell chamber assay. Besides, laser scanning confocal microscopy (LSCM) and western blot were also adopted to detect expressions of E-cadherin (the epithelial marker), and N-cadherin and Vimentin (the mesenchymal markers) of HCCs cultivated in conditional culture medium. Snail, the nuclear transcription factor, was also detected by western blot under conditional cultivation. Results: Compared with HCCs cultivated in conventional culture medium, the ability of migration and invasion of HCC cultivated in conditional culture medium was significantly enhanced (P<0.05), the expression of E-cadherin downregulated, the expression of N-cadherin and Vimentin upregulated in and the expression of snail upregulated (P<0.05). Conclusion: Conditional medium of HSC conditional medium can promote HCC epithelial-mesenchymal transition.
[Key words]carcinoma,hepatocellular; astrocytes; epithelial-mesenchymal transition; cell culture; culture media,conditioned
[中图分类号]R735.7.023
[文献标识码]A
[文章编号]1000-2707(2016)01-0032-05
*[基金项目]贵州省科学技术基金项目[黔科合LG字(2012)007];贵州省教育厅自然科学研究项目[黔教科(2008)022号]
**通信作者 E-mail:gqxu@gmc.edu.cn网络出版时间:2016-01-07
网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160107.1953.020.html
