玉米秸秆对土壤有机质含量及微生物群落结构的影响
2016-04-11丁红利马晓玥李玖然
丁红利,马晓玥,李玖然,张 磊*
(西南大学资源环境学院,重庆北碚400715)
玉米秸秆对土壤有机质含量及微生物群落结构的影响
丁红利1,马晓玥1,李玖然1,张 磊1*
(西南大学资源环境学院,重庆北碚400715)
为秸秆还田改善土壤生态功能提供理论依据,以添加秸秆后不同有机质含量变化的土壤为研究对象,利用磷脂脂肪酸(PLFA)法测定土壤微生物群落结构的分布,分析土壤微生物结构与有机质含量变化的关系。结果表明:玉米秸秆添加后引起土壤有机质呈大幅正向增加(I1)、小幅度正向增加(I2)和负向变化(I3)3种趋势,其中小幅度正向增加的I2磷脂脂肪酸的种类和绝对含量均低于I1和I3,而直链单不饱和脂肪酸/环丙烷脂肪酸(A/B)、直链饱和脂肪酸/直链单不饱和脂肪酸(C/A)、支链异构饱和脂肪酸/支链反异构饱和脂肪酸(iso/anteiso)值均高于I1和I3;有机质大幅正向增加的I1磷脂脂肪酸的种类和绝对含量为3组中最高,且玉米秸秆处理过程中刺激16:0、18:1w6c、18:1w9c、16:0 10-methyl和19:0cyclo w8c所表征的优势类群的增殖,特征性菌群细菌/真菌和革兰氏阳性菌/革兰氏阴性菌(G+/G—)比值较I1和I2低;有机质负向变化的I3土壤中表征优势类群的磷脂脂肪酸的绝对含量均低于I1,且支链饱和脂肪酸绝对含量为3组土壤中最高;主成分分析表明,I1和I3土壤微生物种类间无明显差别。土壤初始有机质含量高,玉米秸秆添加后土壤有机质变化幅度大,土壤微生物种类及丰度高。
玉米秸秆;土壤有机质;含量变化;土壤微生物群落结构;磷脂脂肪酸
向健康土壤中添加有机物料能够调控微生物群落的代谢和功能,改善土壤质量[1]。土壤微生物对有机物料经过分解转变过程后少部分作为自身的营养物质,大部分保留在土壤中保持土壤肥力。大量有机物料长期进入土壤使其有机质改变后形成的微环境是否会给微生物群落的生存带来威胁或改变,已逐渐成为众多研究者关注的热点[2-3]。
对土壤微生物群落的研究从传统的平板计数法逐渐发展为由分子生物学、生物化学及生理学等多种手段相结合的方法,明显推动对微生物群落的研究,但由于微生物群落庞大,生存状况复杂、种类繁多,加之微生物本身缺乏可以直观区分的明显特征,因此任何一种分析方法都存在其局限性[4]。目前的研究及成果多集中于外因,而对土壤微生物群落的实际生存机制缺乏一定的理论支撑,但相比较而言,磷脂脂肪酸(PLFA)方法根据磷脂是构成生物细胞膜的重要组成部分,只存在于所有活的细胞膜中,一旦生物细胞死亡,其中的磷脂类化合物会同时消失的原理[5],以及不同种类的微生物细胞中磷脂脂肪酸组成及含量存在极大差异,可直接用于估计其微生物数量及群落结构,是一种较为有效的研究方法[4]。
土壤微生物群落可以敏感地反映出不同土壤生态系统间的差异,土壤有机质含量与土壤微生物活动密切相关。Steenwerth等[6]对9种不同土地利用方式的土壤微生物群落结构分析后发现,土壤微生物群落组成受土壤有机质变化的影响且与PLFA总量高度相关。Kourtev等[7]通过检测到的99种不同的PLFA发现,在新泽西北部阔叶林中受地表凋落物影响,土壤微生物群落结构发生了明显改变。Saetre等[8]也研究发现,不同植被林中PLFA存在差异,除了植被不同外,更大程度与其土壤有机质含量差异相关。而本研究通过利用磷脂脂肪酸(PLFA)法探讨玉米秸秆添加后不同有机质变化的土壤对微生物群落结构的影响,旨在揭示添加有机物料后不同有机质变化土壤中微生物生物量、微生物多样性及群落结构的差异状况,为秸秆还田改善土壤生态功能提供理论依据。
1 材料与方法
1.1 供试材料
土壤样品为西南大学资源环境学院微生物实验室于2013年9月在山西、甘肃、河南、重庆、山东、四川、陕西、湖北、贵州、云南、福建、内蒙古、广东、安徽、新疆、湖南和广西17个省市收集的85个土样,其中,林地土壤21个,菜地土壤20个,耕地土壤32个,水田土壤12个。有机物料玉米秸秆采集自玉米成熟后的地上部分,70℃烘干后剪至3cm待用,其养分含量为(%干基)全磷0.231、全氮1.068、全钾1.405。试验对象为添加玉米秸秆后的土壤样品,供试土壤秸秆添加前后基本养分变化幅度见表1。
1.2 试验设计
采用室内模拟恒温培养方法,分别称取土样150g和玉米秸秆4g,逐次加入蒸馏水,使土壤和玉米秸秆充分混匀,将混合样品装入玻璃罐(高10cm,直径8cm)中,然后用滴管加入剩余的水量使之达到田间持水量的60%左右,最后用带气孔的封口膜封住罐口,于恒温培养箱(30℃)培养90d,每隔7d采用重量法补足失去的水分。培养90d时,将每个玻璃罐中的土壤全部取出后各自充分混匀,取部分土壤过2mm筛以弃去玉米秸秆残体,测定秸秆添加后土壤有机质含量。

表1 供试土壤的基本养分性状Table1 Basic nutrients of tested soil
根据玉米秸秆添加前后土壤有机质的变化幅度,将土壤样品分为3组:第一组大幅正向变化(I1),有机质(OM)变化量I1>12.05g/kg;第二组小幅度正向变化(I2),OM变化量为0.25g/kg<I2<9.00g/kg;第三组负向变化(I3),OM变化量为-0.30g/kg<I3<-112.30g/kg。分别选取I1、I2和I3OM变化幅度最大的土壤样品各3个(表2),取部分土壤过2mm筛,冷冻干燥后装入封口袋,置于-20℃保存,用于PLFA测定分析,3次重复。
1.3 项目测定
土壤有机质的测定采用重铬酸钾容量法(K2Cr2O7-H2SO4法)[9],磷脂脂肪酸采用White的方法加以改进[10]。
提取。称取相当于8g烘干土壤质量的湿润土壤3份,加入按2∶1∶0.8比例混合的进口色谱纯CHCl3、CH3OH和磷酸缓冲液浸提液,26℃、285~320r/min震荡2h,然后25℃、3 500r/min离心10min,收集上层离心液,重复以上操作,再次收集上层离心液体,分别加入12mL CHCl3和磷酸缓冲液,于黑暗中静置过夜。吸取下层溶液进行30~32℃水浴同时氮气吹干。

表2 3组土壤玉米秸秆添加前后有机质的含量Table2 Organic matter content of three soil groups before and after adding cornstalk g/kg
分离。取1 000μL CHCl3分2次将浓缩的磷脂转移至经3mL CHCl3调解淋洗过的萃取小柱,向萃取小柱加入5mL CHCl3用于洗去中性酯,加2次5mL丙酮溶液用于洗去糖性酯,并用1mL甲醇溶液清洗萃取小柱底部并弃去,向萃取小柱加入5mL甲醇溶液淋洗,收集溶液并加入4μL C19:0内标,同样于30~32℃水浴锅中氮气吹干,吹干时气流不宜过大,避免溅出造成系统误差。
甲酯化。向吹干的样品中分别加入(体积比为1∶1)的甲醇甲苯混合液1mL、0.2mol/L KOH溶液1mL,混匀后37℃水浴15min,取出后再分别加入0.3mL 1mol/L醋酸溶液、2mL正己烷溶液、2mL超纯水后低速振荡10min(150~200r/min),吸取上层溶液,将原有液体再次加入2mL正己烷溶液后继续震荡10min,再次收集上层溶液,氮气吹干,加入200μL正己烷冲洗吹干样品,移入GC专用内衬管进行检测。
测定。上机测定用Agilent 6850气相色谱仪(FID检测器)分析PLFA的成分。色谱条件为:HP-5柱(25m×200μm×0.33μm),进样量为1 μL,分流比10∶1,载气(H2),尾吹气(高纯N2),助燃气体(空气),流速0.8mL/min。汽化室温度250℃、检测器温度300℃,柱前压10.0psi(1psi=6.895KPa)。二阶程序升高柱温:起始为170℃,5℃/min升至260℃,而后40℃/min升温至310℃,维持1.5min。各成分脂肪酸通过MIDI Sherlock微生物鉴定系统(Version 6.1,MIDI,Inc,Newark,DE)进行,标准品购于美国MIDI公司的C9-C20的脂肪酸甲酯,PLFA用C19∶0做内标换算其绝对含量(nmol/g)。
1.4 数据处理
采用方差分析、相关分析和主成分分析等统计方法,分析绘图软件为EXCEL、SPSS17.0和Origin6.0。特征性磷脂脂肪酸参照文献[11-15]选取(表3)。
2 结果与分析
2.1 添加玉米秸秆后3组土壤有机质含量的变化
玉米秸秆添加培养后土壤有机质出现大幅正向增加(I1)、小幅度正向增加(I2)和负向变化(I3)3种趋势,其中,玉米秸秆添加后土壤有机质变化幅度较大的I1和I3土壤初始有机质含量也较I2初始有机质高;I1和I3土壤初始有机质含量平均值分别为82.17g/kg和83.91g/kg,玉米秸秆添加后I1土壤有机质含量平均增加49.43g/kg,I3减少23.38g/kg,而I2土壤初始有机质含量平均值仅17.21g/kg,玉米秸秆添加后土壤有机质含量平均仅增加4.67g/kg。
2.2 添加玉米秸秆后3组土壤的PLFA分析图谱
选择绝对含量大于1nmol/g的磷脂脂肪酸作为统计对象(图1),土壤微生物种类在3组土壤中分布类似,磷脂脂肪酸生物标记在3组土壤中共检测到49种,其中,I1、I2和I3分别检测到44种、41种和44种(图1)。分布存在2种类型:一类为完全分布,即磷脂脂肪酸生物标记在所有供试土壤中都有分布,在I1、I2和I3土壤中属全分布的磷脂脂肪酸共有38种,且各特征性磷脂脂肪酸含量I2显著低于I1和I3,I1中除磷脂脂肪酸16∶0、18∶1w6c、18∶1w9c、16∶010-methyl、19∶0cyclow8c的含量显著高于I3外,其余特征性脂肪酸绝对含量二者基本相同;另一类为不完全分布,即磷脂脂肪酸标记只在某些供试土壤中分布,不完全分布的磷脂脂肪酸共计11种,I1、I2和I3分别检测到7种、5种和7种,绝对含量较低且3组土壤差异不显著。可见,添加玉米秸秆处理后3组土壤微生物种类数无明显差异,但相较于I3土壤,I1土壤有机质含量大幅正向增加引起部分优势微生物类群的增殖。

表3 特征性磷脂脂肪酸代表Table3 Representatives of characteristic PLFA
2.3 添加玉米秸秆后3组土壤的PLFA总量
添加玉米秸秆后土壤PLFA总量I1为37.61nmol/g、I2为19.32nmol/g、I3为33.01nmol/g,由此看出,I2土壤微生物量显著低于其他2组,分别与I1和I3形成极显著差异和显著差异。I1土壤脂肪酸总量最高,为37.61nmol/g,比I3高13.9%,但差异不显著。说明,微生物的丰度与玉米秸秆添加后土壤有机质的变化呈正比例关系。

图1 3组土壤特征性PLFA分布情况Fig.1 Characteristic PLFA distribution of three soil groups

图2 3组土壤中表征各微生物群落的PLFA含量Fig.2 PLFA content of different microbial community in three soil groups
2.3.1 土壤微生物群落及磷脂脂肪酸含量3组土壤中各种微生物类群含量趋势相同(图2),均为细菌绝对含量>革兰氏阴性菌(G-)>革兰氏阳性菌(G+)>真菌>放线菌,细菌与G-、G+以及真菌、放线菌绝对含量差异显著。各微生物类群绝对含量I1>I3>I2,I1、I3分别与I2差异显著,I1与I3虽未形成显著差异,但I1细菌、真菌、放线菌、G+和G-绝对含量分别比I3高4.9%、30.3%、26.9%、6.9%和27.0%。且I1土壤中G-绝对含量比G+绝对含量高22%,可知,玉米秸秆添加后有机质积累与G-高度相关。
从图3可知,I1、I3各类脂肪酸含量均显著高于I2,其中,直链饱和脂肪酸、直链单不饱和脂肪酸、多不饱和脂肪酸含量I1比I3分别高20.6%、23.4%和22.6%;I1、I2土壤各脂肪酸绝对含量均表现为直链饱和脂肪酸>支链饱和脂肪酸>直链单不饱和脂肪酸>多不饱和脂肪酸>环丙烷脂肪酸。I3土壤中支链饱和脂肪酸绝对含量最高,达6.73nmol/g,支链脂肪酸绝对含量高,表明I3土壤微生物受到一定程度的环境胁迫。
2.3.2 土壤微生物的相对丰度革兰氏阳性菌/革兰氏阴性菌(G+/G-)和细菌/真菌(Bacteria/Fungi)的比值常用来表征土壤中各微生物群落的相对丰度、微生物量的变化、土壤有机质水平以及土壤微生态系统的稳定性[16],二者比值越低说明土壤有机质含量越高,土壤生态系统越稳定;直链单不饱和脂肪酸/环丙烷脂肪酸(A/B)通常用以表征微生物群落受养分胁迫状况,比值越大表明养分胁迫越严重;支链异构饱和脂肪酸/支链反异构饱和脂肪酸(iso/anteiso)和直链饱和脂肪酸/直链单不饱和脂肪酸(C/A)比值通常表征土壤中微生物受环境胁迫程度,比值越大,受环境胁迫程度越严重。从表4可知,I2和I3之间细菌/真菌、G+/G-差异不明显,但都高于I1处理。结合图3可以看出,I1处理土壤中细菌和真菌的丰度并不低于I2和I3土壤处理,当细菌、真菌丰度较高时,两者比值越小说明I1土壤生态系统更稳定。同时I1和I3之间A/B、C/A、iso/anteiso各比值差异不明显,但均低于I2土壤,尤其是A/B最为明显。说明,I2土壤中微生物群落受养分胁迫和环境胁迫的程度均较高,也表明有机物料添加后土壤有机质含量是否积累与土壤初始有机质含量存在正比例关系,能够反映土壤微生物群落的生存环境。
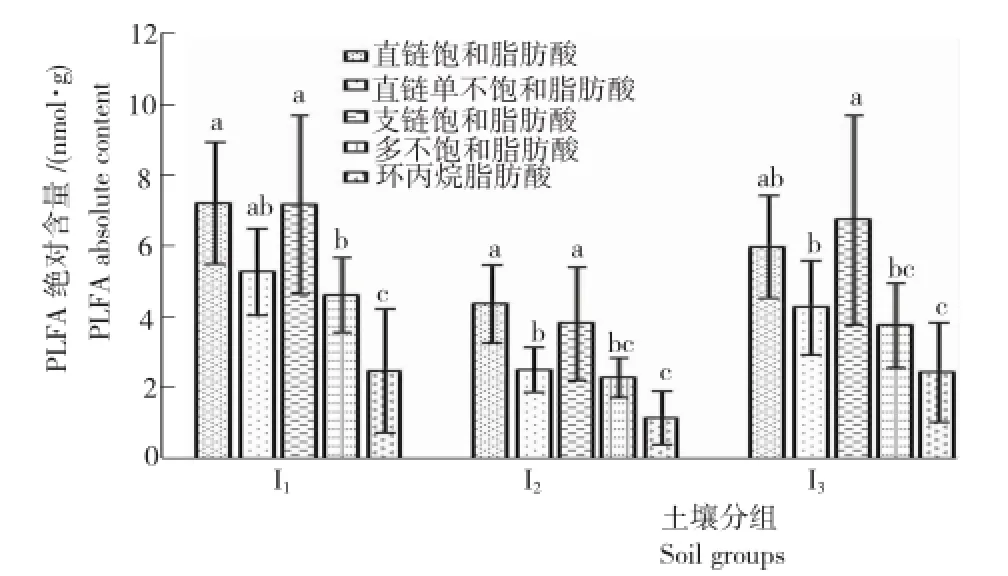
图3 3组土壤中各磷脂脂肪酸含量Fig.3 Different PLFA content in three soil groups

表4 土壤微生物各类群PLFA比值Table4 PLFA ratio between different soil microbial species

图4 3组土壤特殊磷脂脂肪酸含量Fig.4 Special PLFA content in three soil groups
2.4 3组土壤高丰度磷脂脂肪酸含量比较
由于玉米秸秆添加后土壤有机质含量的变化引起部分优势微生物类群的增殖,因此对I1、I2、I3含量高且差异明显的6种磷脂脂肪酸绝对含量进行比较,结果(图4)表明,除嗜热解氢杆菌20∶1w9c绝对含量在I2中显著高于I1和I3外,假单胞菌16:0、甲烷氧化菌18∶1w6c、真菌18∶1w9c、放线菌16∶0 10-methyl、伯克霍尔德细菌19∶0cyclo w8c绝对含量I1均显著高于I3和I2组(p<0.05),其中,I2中20∶1w9c绝对含量分别是I1、I3的3.76倍和5.37倍,但I2中16∶0 10-methyl的含量分别仅为I1和I3组的5.9%、6.4%,这6种特征性脂肪酸的绝对含量为10.06~200.42nmol/g,且这6种磷脂脂肪酸绝对含量是磷脂脂肪酸总含量的主要部分。16∶0、18∶1w6c、18∶1w9c、16∶0 10-methyl、19∶0cyclo w8c在I1、I3中均为优势种群,但在I3中的分布丰度不及I1,进一步表明优势类群的增殖与有机物料添加后土壤有机质的积累密切相关。
2.5 添加玉米秸秆后有机质变化对土壤微生物群落组成的影响
经主成分分析(图5)得出,主成分1和主成分2能够将不同有机质水平区分开。I1和I3与主成分1呈高度正相关;而I2与主成分1呈高度负相关;I1与主成分2之间呈高度正相关关系。通过每种绝对含量大于10nmol/g脂肪酸在主成分上的因子载荷分析结果表明(图6),16∶0、18∶1w9c、16∶0 10-methyl、19∶0cyclo w8c、17∶0cyclo、17∶0anteiso、15∶0anteiso、15∶0iso、16∶0iso和16∶1w5c在主成分1上的载荷值较高,主成分1是其代表因子,其中支链脂肪酸多来自于G+,16∶0 10-methyl是放线菌的标志性脂肪酸,16∶0、18∶1w9c、19∶0cyclo w8c、17∶0cyclo、16∶1w5c均是用来表征G-的脂肪酸,二者载荷值较支链脂肪酸高。而20∶1w9c在主成分1上的载荷值较低,其又是嗜热解氢杆菌真菌的标志性脂肪酸。说明,玉米秸秆添加后有机质含量变化过程中土壤中G-和放线菌含量较高,而真菌含量会减少。16∶1w7c/16∶1w6c、18∶1w6c和20∶1w9c在主成分2上有较高的载荷值,可以认为是主成分2的代表因子,包含G-和真菌,而16∶0 10-methyl、18∶0 10-methyl,TBSA、17∶1w8c在主成分2上的载荷值较低,主要为放线菌类群,说明该类放线菌类群在玉米秸秆降解过程中对有机质的积累无明显作用。

图5 不同土壤有机质水平土壤微生物群落PLFA主成分Fig.5 PLFA principal component of soil microbial community with different organic matter levels

图6 不同土壤有机质水平下土壤微生物群落PLFA载荷因子贡献Fig.6 Contribution of PLFA load factor of soil microbial community under different soil organic matter levels
3 结论与讨论
研究结果表明,土壤中添加有机物料后,土壤有机质出现了不同程度的增加或减少的现象,且土壤有机质的变化量对土壤中微生物群落的多样性产生一定的影响,尤其土壤中优势微生物群落的绝对含量会随有机质含量的变化而变化。在本研究中,添加玉米秸秆处理后有机质大幅正向增加(I1)的土壤微生物总生物量及G-高于小幅度正向增加(I2)和负向变化(I3),土壤生态系统也相对较稳定。有机质含量的积累可提供丰富的碳源,刺激土壤微生物的增殖。Bunemann等[17]研究肯尼亚2种作物轮作与施磷肥对土壤微生物群落结构的影响发现,土壤有机质的积累、土壤微生物生物量与高数量的PLFA有关,并且真菌和G-的丰度也有增长。Griffiths等[18]也发现,向土壤中添加含碳高的物质能使土壤微生物群落中真菌和G-的比例提高,而使放线菌和G-的比例降低。但本研究中代表放线菌的标志性脂肪酸在I1和I3土壤中的含量显著高于I2,原因可能是由于I1和I3土壤有机质含量高,含有腐殖质,16∶0 10-methyl更多来自于腐殖质,而非生物细胞。Guckert等[19]发现,腐殖质可能含有酯键连接的长链脂肪酸。
在自然界中存在种类繁多的某些特殊的土壤微生物类群,其可作为特殊的指示生物,如烃类氧化菌用以指示地下是否存在油气矿藏[20]、Bacillus cereus用以指示金的含量[21]。本研究中,I2嗜热解氢杆菌20∶1w9c的含量最高,说明该微生物种群对生存环境胁迫响应不敏感,生存能力极强,而放线菌16∶0 10-methyl绝对含量在I1和I3中较高,该类微生物对土壤微生态选择性高,土壤养分是其生存的限制因子。本研究还发现,若土壤本自养分充足,初始有机质含量高,则玉米秸秆添加后土壤有机质变化幅度大,微生物群落丰度大、种类多;同时在降解有机物料的过程中,逐渐形成加速降解的优势微生物类群,其含量会随土壤有机质含量的积累而显著增加。研究检测到的16∶0、18∶1w9c、16∶0 10-methyl、19∶0cyclo w8c、17∶0cyclo、17∶0anteiso、15∶0anteiso、15∶0iso、16∶0iso、16∶1w5c为有机物料降解过程中的优势类群,其中主要为G-。
[1]孔维栋,刘可星,廖宗文,等.不同腐熟程度有机物料对土壤微生物群落功能多样性的影响[J].生态学报,2005(9):2291-2296.
[2]陈晓娟,吴小红,刘守龙,等.不同耕地利用方式下土壤微生物活性及群落结构特性分析:基于PLFA和MicroRespTM方法[J].环境科学,2013(6):2375-2382.
[3]郁培义,朱 凡,宿少锋,等.氮素添加对樟树林红壤微生物的影响[J].环境科学,2013(8):3231-3237.
[4]周丽霞,丁明懋.土壤微生物学特性对土壤健康的指示作用[J].生物多样性,2007(2):162-171.
[5]WHITE D C,DAVIS W M,NICKELS J S,et al.Determination of the sedimentary microbial biomass byextractible lipid phosphate[J].Oecologia,1979,40(1):51-62.
[6]STEENWERTH K L,JACKSON L E,FRANCISCO J,et al.Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J].Soil Biology and Biochemistry,2003,35(3):163-175.
[7]KOURTEV P S,EHRENFELD J G,HAEGGBLOM M.Exotic plant species alter the microbial community structure and function in the soil.Ecology,2002,83,3152-3166.
[8]SAETRE,BATH.Spatial variation and patterns of soil microbial community structure in a mixed spruce birch stand[J].Soil Biology and Biochemistry,2000,32(7):321-330.
[9]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[10]WHITE D C,STAIR J O,RINGELBERG D B.Quantitative comparisons of in situ microbial biodiversity by signature biomarker analysis[J].Journal of Industrial Microbiology &Biotechnology,1996,17(3):185-196.
[11]KIMURA M,ASAKAWA S.Comparison of community structures of microbiota at main habitats in rice field ecosystems based on phospholipids fatty acid analysis[J].Biol Fertil Soils,2006,43:20-29.
[12]OHANSEN A,OLSSON S.Using phospholipid fatty aciDTechnique to study short term effects of the biological control agent Pseudomonas fluorescensDR54 on the microbial microbioa in barley rhizosphere[J].Microb Ecol,2005,49:272-281.
[13]WHITE D C,DAVIS W M,NICKELS J S,et al.Determination of the sedimentary microbial biomass by extractible lipid phos-phate[J].Oecologia,1979,40:51-62.
[14]VESTAL J R,WHITE D C.Lipid analysis in microbial ecology:Quantitative approaches to the study of microbial communities[J].Bioscience,1989,39:535-541.
[15]MIETHLING R,WIELAND G,BACKHAUS H,et al.Variation of microbial rhizosphere communities in response to crop species,soil origin,and inoculation with Sinorhizobium melilotiL33[J].microb Ecol,2000,41:43-56.
[16]王 菲,袁 婷,谷守宽,等.有机无机缓释复合肥对不同土壤微生物群落结构的影响[J].环境科学,2015(4):1461-1467.
[17]BüNEMANN E K,BOSSIO D A,SMITHSON P C,et al.Microbial community composition and substrate use in a highly weathered soil as affected by crop rotation and P fertilization[J].Soil Biology and Biochemistry,2004,36(6):4139 4148.
[18]CALDWELL B A,GRIFFITHS R P,SOLLINS P.Soil enzyme response to vegetation disturbance in two lowland CostaRican[J].Soil Biology and Biochemistry,1999,31:1603 1608.
[19]GUCKERT J B,HOOD M A,WHITE D C.Phospholipid ester-linked fatty acid profile changes during nutrient deprivation of Vibrio cholerae:increases in the trans/cis ratio and proportions of cyclopropyl fatty acids.[J].Applied and Environmental Microbiology,1986,52(4):794-801.
[20]金文标,姚建军,陈孟晋,等.天然气微生物勘探指示菌的筛选[J].天然气工业,2002(5):20-22.
[21]王红梅,杨逢清,谢树成,等.第四纪土壤微生物与金离子的相互作用实验:微生物找矿依据[J].海洋地质与第四纪地质,2002(4):107-110.
(责任编辑:姜 萍)
Effects of Cornstalk on Organic Matter Content and Microbial Community Structure in Soil
DING Hongli1,MA Xiaoyue1,LI Jiuran1,ZHANG Lei1*
(College of Resources and Environment,Southwest University,Beibei,Chongqing400715,China)
The correlation between soil microbial structure and organic matter variation after adding cornstalk was analyzed by PLFA methoDTo provide the theoretical basis for biological function of straw turnover to improve soil.Results:Three groups of substantial positive increase(I1),small scale positive increase(I2)and negative change(I3)are divided into according to variation of soil organic matter content after adding cornstalk.The PLFA kind and absolute content of I2both lower than I1and I3but the ratio values of straight chain monounsaturated fatty acid/cyclopropane fatty acid,straight chain saturated fatty acid/straight chain monounsaturated fatty acid and branched isomerism saturated fatty acid(iso)/brancheDTrans-isomerism saturated fatty acid(anteiso)are higher than I1and I3.The PLFA kind and absolute content of I1is the highest among three groups,which can stimulate multiplication of dominant species represented by16:0,18:1w6c,18:1w9c,16:0 10-methyl and 19:0cyclo w8cduring cornstalk treatment process.The ratio values of bacteria/fungi and G+/G-iSLower than I1and I2.The absolute PLFA content of representation dominant species in I3soil iSLower than I1but its branched saturated fatty acid absolute content is the highest among three groups.The principal component analysis indicates there is no obvious difference in soil microbial species between I1and I3.The variation range of soil organic matter content is significant anDThe soil microbial species and abundance increase after adding cornstalk into the soil with higher organic matter content.
cornstalk;soil organic matter;content change;soil microbial community structure;phospholipid fatty acid(PLFA)
S154.36
A
1001-3601(2016)10-0429-0077-07
2015-12-20;2016-09-30修回
“十二五”农村领域国家科技计划项目“城乡统筹区村镇建设与污染源控制关键技术与示范”(2013BAJ11B03)
丁红利(1989-),女,在读硕士,研究方向:土壤微生物。E-mail:dinghongli0102@163.com
*通讯作者:张 磊。E-mail:zhanglei03@aliyun.com
