沉默Ether à go-go 1基因调控VEGF/PI3K/AKT抑制骨肉瘤增殖和血管生成的研究*
2016-02-23刘庆军曾文容吴采荣戴立林陈志达
吴 进,刘庆军,曾文容,吴采荣,戴立林,陈志达
(厦门大学附属东南医院骨科, 福建 漳州 363000)
•应用基础研究•
沉默Ether à go-go 1基因调控VEGF/PI3K/AKT抑制骨肉瘤增殖和血管生成的研究*
吴 进,刘庆军,曾文容,吴采荣,戴立林,陈志达△
(厦门大学附属东南医院骨科, 福建 漳州 363000)
目的:检测沉默Ether à go-go 1 (Eag1) 基因对骨肉瘤增殖和血管生成的影响及其可能的调控机制。方法: 构建抑制Eag1表达的短发卡RNA (short hair RNA, shRNA) 重组腺病毒载体Ad5-Eag1-shRNA并感染骨肉瘤细胞株。采用实时定量聚合酶链反应 (real-time polymerase chain reaction, Real-time PCR) 和蛋白印迹技术 (Western blot analysis, WB) 检测Ad5-Eag1-shRNA的感染效能。采用CCK-8法和裸鼠成瘤实验检测感染前后骨肉瘤细胞增殖和裸鼠骨肉瘤体积的变化。采用免疫组化技术和WB技术分别检测感染前后裸鼠肿瘤组织中微血管密度 (microvessel density, MVD) 和血管内皮生长因子 (vascular endothelial growth factor, VEGF) 表达的变化。采用WB技术检测感染前后骨肉瘤细胞中VEGF、磷脂酰肌醇3-激酶 (phosphoinositide 3-kinase, PI3K) 和蛋白激酶B (protein kinase B, AKT) 的表达变化。结果: 构建的重组腺病毒载体Ad5-Eag1-shRNA具有良好的感染效能。感染Ad5-Eag1-shRNA可沉默骨肉瘤中Eag1的表达并能有效地抑制骨肉瘤细胞增殖和裸鼠骨肉瘤生长 (均P<0.001),同时下调裸鼠骨肉瘤组织中MVD密度和VEGF的表达 (均P<0.001)。感染Ad5-Eag1-shRNA可下调骨肉瘤细胞中VEGF的表达 (P<0.05) 并抑制PI3K和AKT的磷酸化 (均P<0.001)。结论: 沉默Eag1可能通过调控VEGF/PI3K/AKT信号通路抑制骨肉瘤增殖和血管生成。
Ether à go-go 1基因; 血管内皮生长因子; 骨肉瘤; 细胞增殖; 血管生成
骨肉瘤是青少年最常见的原发恶性骨肿瘤,易复发和转移[1]。即使采用外科保肢手术联合新辅助化疗的标准治疗方案,无肺转移患者5年生存率仅为60~75%,发生肺转移患者预后更差[2-3]。近年来,骨肉瘤基因治疗已经取得了一定的进展,但很多基因治疗缺乏特异性靶向,体外实验效果优于体内试验[4],因此,急需要寻找更有效的治疗基因来突破骨肉瘤患者生存预后的瓶颈。
近期的研究发现一些电压门控型钾离子通道的亚型异常表达于多种类型的肿瘤细胞中并参与了肿瘤细胞生物学行为的调节,提示这些电压门控型钾离子通道有可能成为肿瘤分子治疗的新靶点[5]。Eag1电压门控型钾离子通道为Eag1基因编码,是第一个被证明与肿瘤密切相关的电压门控性钾离子通道。我们之前的研究亦证实Eag1基因参与了骨肉瘤增殖、周期等过程[6],但其对骨肉瘤血管生成的作用尚未明确。本研究中,我们首先构建了抑制Eag1表达的shRNA 重组腺病毒载体,之后利用该载体感染骨肉瘤细胞并检测了沉默Eag1表达对骨肉瘤增殖、生长和血管生成的影响,最后初步阐明其可能的调控机制。
1 材料与方法
1.1 实验动物、材料、试剂及仪器
实验动物:无胸腺的BALB/c的雌性裸鼠 (鼠龄4~6周) 购买自厦门大学动物实验中心。细胞:人骨肉瘤细胞MG-63细胞和人源胚胎肾293细胞 (HEK293)购自美国ATCC公司。主要试剂:RPMI-1640培养基和胎牛血清购买自美国Gibco公司,细胞裂解液购买自美国Invitrogen公司,pGeneSil-1质粒和免疫组化试剂盒购买自武汉赛晶公司,反转录试剂盒购买自日本Takara公司,CCK-8试剂盒购买自美国Dojindo公司,琼脂糖购买自美国Sigma公司,Eag1、血管内皮生长因子 (vascular endothelial growth factor, VEGF)、磷酸化的磷脂酰肌醇3-激酶(phospho-phosphoinositide 3-kinase, p-PI3K)、磷酸化的蛋白激酶B (phospho-protein kinase B, p-AKT)、总的PI3K (total-PI3K, t-PI3K)、总的AKT (total-AKT, t-AKT)、GAPDH和其他相关抗体购买自英国Abcam公司,化学发光检测试剂盒购买自美国Millipore公司,Real-time PCR所需的引物设计并购买自上海生工公司。主要仪器:细胞培养箱 (美国Thermo Scientific公司)、GeneAmp 2400 PCR仪 (美国 ABI公司)、凝胶成像系统 (美国Alpha Innotech 公司)、Mini PROTEAN蛋白电泳设备 (美国 Bio Rad 公司)和M200多功能酶标仪(瑞士Tecan公司)。
1.2 细胞培养
人骨肉瘤MG-63细胞和人HEK293细胞培养于RPMI-1640培养基 (含10%小牛血清、100U/mL青霉素和100 mg/L链霉素)。细胞均置于37℃、5% CO2孵育箱中培养及传代。
1.3 重组腺病毒载体的构建和感染
设计并合成针对Eag1的shRNA的靶DNA序列 (根据Eag1基因全序列设计为:AGC CAT CTT GGT CCC TTA TAA),克隆于穿梭载体pAdTrack-CMV中,与腺病毒骨架质粒pAdeasy-1在BJ5183细菌中进行同源重组,转染HEK293细胞,包装得到含sh-Eag1的重组腺病毒并命名为Ad5-Eag1-shRNA。同时设计合成一对照的重组腺病毒并命名为Ad5-Control-shRNA。感染前1天,取处于对数生长期的500μL的骨肉瘤MG-63细胞悬液 (1×106个/mL) 接种于6孔板中,待细胞密度达80%时,使用Ad5-Eag1-shRNA或Ad5-Control-shRNA以5感染复数(multiplicity of infection, MOI) 的浓度进行细胞感染。
1.4 CCK- 8法检测细胞增殖
100μL细胞悬液 (1×105/mL) 均匀分布于96孔培养板中,每组设6个复孔,无血清培养基培养12h后感染Ad5-Eag1-shRNA或Ad5-Control-shRNA。继续培养12、24、36、48或72h后,加入10μL CCK-8试剂,细胞培养箱继续孵育1h,终止培养。在酶联免疫监测仪上测定490 nm波长处各孔光吸收值。与实验平行,加细胞、培养基不加抑制剂的组为阳性对照组;与实验平行,只加培养基不加细胞的组设置为空白对照组,比色时空白对照组调零。按照公式:细胞存活率(%) = 实验组吸光值/阳性对照吸光值×100%。
1.5 Real-time PCR
用Trizol法提取各组细胞的总RNA,按照反转录试剂盒说明书的步骤制备cDNA。在GeneAmp 2400 PCR仪上进行扩增,使用2400 SDSv2.0软件进行数据处理和分析。扩增条件为:95℃变性15s,60℃退火30s,74℃检测3s,重复40个循环。反应结束后,电脑自动得出溶解曲线。采用primer premier 5.0软件参照引物设计原则设计出 PCR引物序列,经序列验证确认引物序列与其他基因无匹配。Eag1上游引物 5’-GCTTTTGAGAACGTGGATGAG-3’,下游引物5’-CGAAGATGGTGGCATAGAGAA-3’。 β-actin 上游引物 5’-TCCACCTTCCAGCAGATGTG-3’,下游引物 5’-GCATTTGCGGTGGACGAT-3’。
1.6 裸鼠成瘤实验
无胸腺的BALB/c的雌性裸鼠 (鼠龄4~6周) 实验和饲养均在 SPF 条件下的超净层流架中进行,灭菌处理的水和饲料供动物自由摄入。将18只裸鼠按简单随机法分为3组,即对照组、Ad5-Eag1-shRNA组和Ad5-Control-shRNA组。实验步骤如下:MG-63细胞感染Ad5-Eag1-shRNA或Ad5-Control-shRNA或未经任何处理后继续培养。取对数生长的骨肉瘤细胞,用 0.02%EDTA和 0.125%的胰蛋白酶联合消化,收集细胞用无血清 RPMI-1640定容。 按1×106mL浓度接种于裸鼠的左后肢背侧。移植完成后,逐日观察移植部有无感染,肿瘤生长后有无自然消退,每周测量肿瘤长径 a 和短径 b。按如下公式计算肿瘤体积曲线:V(肿瘤体积)=ab2/2。
1.7 组织切片和免疫组化
处死裸鼠后取出肿瘤组织,用10%福尔马林溶液固定24~48h。先经梯度乙醇脱水后用二甲苯透明,然后入溶融的石蜡中浸透每次30min,共3次;再包埋。包埋好的石蜡块进行切片;切片的厚度为4μm。切片脱蜡至水后,放入盛有0.01M枸橼酸钠缓冲溶液 (pH6.0,工作液) 沸腾修复抗原, 4℃下CD31抗体孵育过夜,之后步骤参照免疫组化试剂盒说明书进行。采用Image J软件分析10个随机高倍视野下(200 ×) CD31的阳性染色以评估肿瘤组织微血管生成情况。
1.8 蛋白印迹技术(Western bolt analysis, WB)
取5~6×107个对数生长期细胞,用4℃预冷的细胞裂解缓冲液裂解细胞30min,收集裂解物,在 4℃下12 000 r/min离心约10min,取上清液,用二锌可酸(bicinchonininc acid, BCA) 法测定蛋白浓度后,-80℃保存。上样前把样品置于沸水浴中5min,然后进行12%SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamidegel electrophoresis,SDS-PAGE),在100V恒压电泳2h,电转膜仪30V湿法转膜1.5h。用含5%脱脂奶粉的磷酸盐吐温缓冲液盐水(phosphate buffered saline Tween,PBST) 室温封闭1h,倒掉封闭液,然后在室温下分别用Eag1,VEGF,p-PI3K, p-AKT,t-PI3K,t-AKT和GAPDH抗体4℃冰箱孵育过夜,用PBST洗涤3次,10min/次,加入相对应的二抗室温孵育1.5h,用PBST洗涤3次,10min/次;采用ECL显色法检测,内参为GAPDH,用凝胶成像分析软件分析条带净灰度,用各组目的蛋白的灰度值与内参的灰度值相比,所得结果为目的蛋白的相对含量,表示目的蛋白的表达水平。
1.9 统计学分析结果
数据以(均数±标准误) (Mean±SEM) 表示,采用SPSS18.0软件对统计结果进行分析。采用t检验或单因素方差分析 (ANOVA)。以P<0.05为差异有统计学意义。
2 结 果
2.1 重组腺病毒载体效能的检测
Real-time PCR (图1A) 和WB (图1B) 结果显示:构建的抑制Eag1表达的shRNA重组腺病毒载体Ad5-Eag1-shRNA具有良好的效能,能从mRNA和蛋白水平有效地抑制Eag1的表达,与空白组 (未行任何处理) 和Ad5-Control-shRNA组相比,差异有统计学意义 (均P<0.001)。

图1 Ad5-Eag1-shRNA干扰效能的检测
A. mRNA水平检测Ad5-Eag1-shRNA 对Eag1表达的影响 B. 蛋白水平检测Ad5-Eag1-shRNA 对Eag1表达的影响
注:***P<0.001
2.2 Ad5-Eag1-shRNA对骨肉瘤MG-63细胞增殖的影响
CCK-8结果显示:感染Ad5-Eag1-shRNA后,骨肉瘤MG-63细胞存活率在24h[ (87.1±5.1)%,t=4.225,P<0.001]、36h[(79.2±5.2)%,t=7.014,P<0.001]、48h[(65.6±6.9)%,t=9.535,P<0.001] 和72h[ (53.1±5.8)%,t=16.860,P<0.001] 时均明显低于Ad5-Control-shRNA组 [24h:(96.1±1.1)%、36h:(95.6±2.4)%、48h:(94.3±2.6)%、72h:(94.9±1.8)%)],两者差异有统计学意义 (图2)。由此可见,下调Eag1表达可有效地抑制骨肉瘤细胞增殖。

图2 Ad5-Eag1-shRNA对骨肉瘤MG-63细胞增殖的影响
感染Ad5-Eag1-shRNA可有效地抑制骨肉瘤MG-63细胞增殖。从第24 h起,Ad5-Eag1-shRNA组的细胞存活率明显低于Ad5-Control-shRNA组,差异有统计学意义。
注:***P<0.001。
2.3 Ad5-Eag1-shRNA对裸鼠骨肉瘤生长的影响
裸鼠肿瘤结果显示:感染Ad5-Eag1-shRNA后第6天,Ad5-Eag1-shRNA组 (271.922±26.39)mm3裸鼠肿瘤体积明显小于Ad5-Control-shRNA组 (473.1831±32.85 )mm3和对照组 (460.7363±38.89)mm3,差异有统计学意义 (分别为t=11.707,P<0.001;t=5.797,P<0.001)。第8、10、12天,Ad5-Eag1-shRNA组裸鼠肿瘤体积均明显小于Ad5-Control-shRNA组和对照组,差异有统计学意义 (均P<0.001) (图3)。由此可见,下调Eag1表达还可从体内水平有效地抑制骨肉瘤生长。
2.4 Ad5-Eag1-shRNA对裸鼠骨肉瘤组织血管生成的影响
免疫组化结果显示 (图4A):Ad5-Eag1-shRNA组每个高倍视野下MVD数为5.0±2.7 (基于CD31阳性染色率),Ad5-Control-shRNA组每个高倍视野下MVD数为17.8±1.9,对照组每个高倍视野下MVD数为19.5±3.1。与Ad5-Control-shRNA组和对照组相比,Ad5-Eag1-shRNA可明显下调裸鼠骨肉瘤组织微血管的生成,差异有统计学意义 (均P<0.001)。WB结果显示 (图4B):Ad5-Eag1-shRNA组中VEGF的表达量明显低于Ad5-Control-shRNA组和对照组,差异有统计学意义 (均P<0.001)。由此可见,下调Eag1表达可能通过抑制裸鼠骨肉瘤微血管生成抑制肿瘤生长。
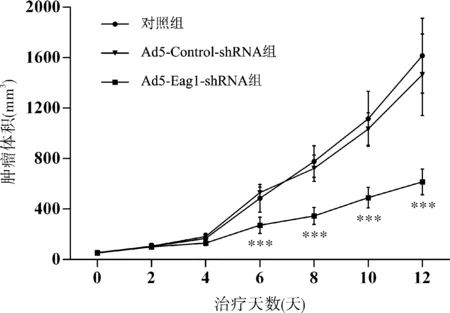
图3 Ad5-Eag1-shRNA对裸鼠骨肉瘤生长的影响
从第6天起,Ad5-Eag1-shRNA组裸鼠骨肉瘤体积明显小于对照组和Ad5-Control-shRNA组。
注:***P<0.001。
2.5 Ad5-Eag1-shRNA对骨肉瘤细胞中VEGF/PI3K/AKT信号通路的影响
WB结果显示:Ad5-Eag1-shRNA可明显抑制骨肉瘤细胞中VEGF的表达并呈时间依赖效应 (均P<0.05) (图5A)。进一步的研究表明:Ad5-Eag1-shRNA对骨肉瘤细胞中t-PI3K和t-AKT的表达无明显影响,但可明显下调p-PI3K和p-AKT的表达,差异有统计学意义 (均P<0.001) (图5B)。
3 讨 论
1969年,Kaplan等在《Genetics》杂志上首次报道了一种可以使成年雄性黑腹果蝇腿部在麻醉状态下发生缓慢而规律运动的基因[7],人们将其命名为ether à go-go (Eag),其性质为一种电压门控性钾离子通道。之后的研究证实Eag亚族包括两个成员:Eag1和Eag2。1999年,Pardo等在《EMBO J》杂志上发表了里程碑式的文章[8],首次证实了Eag1与肿瘤密切相关[9]。进一步的研究表明Eag1在多种人类肿瘤细胞系和肿瘤组织中高表达,而在相应来源的正常细胞和组织中不表达或低表达 (主要表达于脑组织,短暂性表达于胎盘和肌原细胞)[5]。一些致癌因素,如HPV感染、雌激素和致癌物等均可诱导其高表达[10],提示Eag1具有致癌潜能并可作为潜在的肿瘤标志物。

图4 Ad5-Eag1-shRNA对裸鼠骨肉瘤生长的影响
A.肿瘤组织免疫组化CD31染色(200 ×) a:对照组;b: Ad5-Control-shRNA组;c: Ad5-Eag1-shRNA组(箭头所示:CD31阳性染色)。
B.不同组别肿瘤组织内VEGF表达情况。
注:***P<0.001。

图5 Ad5-Eag1-shRNA对骨肉瘤MG-63细胞中VEGF/PI3K/AKT信号通路的影响
A.Ad5-Eag1-shRNA 在不同时间点对骨肉瘤MG-63细胞中VEGF表达的影响。
B.Ad5-Eag1-shRNA对骨肉瘤MG-63细胞中PI3K和AKT表达的影响。
注:*P<0.05,**P<0.01,***P<0.001。
本项目组前期研究亦表明下调人骨肉瘤中异常高表达的Eag1可抑制骨肉瘤恶性表型[6],但其调控骨肉瘤恶性表型的机制尚未明确。
肿瘤新生血管生成是恶性肿瘤生长、侵袭和转移的基础。研究证实有多种活性物质可调节肿瘤血管生成,其中VEGF是肿瘤来源的重要的促血管生成因子,不仅由肿瘤细胞分泌,也可由肿瘤相关的间质细胞分泌,具有刺激血管生成、血管发生、炎症形成和增加血管渗透性等作用[11]。因此,本项目设想Eag1参与了骨肉瘤血管生成的过程并进行了相关的研究。
本研究首先设计并构建了抑制Eag1表达的shRNA重组腺病毒载体Ad5-Eag1-shRNA并检测其效能。结果显示构建的Ad5-Eag1-shRNA可从mRNA和蛋白水平有效地抑制Eag1的表达。之后的研究证实,Ad5-Eag1-shRNA还从体内和体外水平显著地抑制骨肉瘤细胞生长和裸鼠骨肉瘤生长。进一步的研究表明:采用Ad5-Eag1-shRNA下调Eag1表达可抑制裸鼠骨肉瘤微血管生成,这可能与肿瘤组织中VEGF的表达受限有关。在细胞水平,我们证实了上述的结论。感染Ad5-Eag1-shRNA可明显抑制骨肉瘤MG-63细胞中VEGF的表达。最后我们初步探讨了可能的机制。众所周知,PI3K/AKT信号通路是VEGF下游重要的信号通路之一,参与了肿瘤增殖、转移等诸多过程[12]。因此,我们还研究Ad5-Eag1-shRNA对PI3K/AKT信号通路的影响。研究表明:Ad5-Eag1-shRNA可明显地抑制PI3K/AKT信号通路的激活(即抑制PI3K和AKT的磷酸化水平,但对PI3K和AKT的总量确无明显影响),提示VEGF/PI3K/AKT信号通路可能参与了Eag1调控骨肉瘤血管生成的过程。
综上所述,沉默Eag1可能通过调控VEGF/PI3K/AKT信号通路抑制骨肉瘤增殖和血管生成,但具体的调控机制仍需进一步的研究。
[1] 赵亚恒, 冯和林,郑丽华,等. 骨肉瘤发病机制的研究进展 [J]. 肿瘤防治研究, 2014, 41(3):283-286.
[2] Schwab JH, Springfield DS, Raskin KA, et al. What’s new in primary bone tumors [J]. J Bone Joint Surg Am, 2012, 94(20):1913-1919.
[3] Lutetke A, Meyers PA, Lewis I, et al. Osteosarcoma treatment-Where do we stand? A state of the art review [J]. Cancer Treat Rev, 2014, 40(4):523-532.
[4] 浦飞飞, 邵增务.骨肉瘤基因治疗研究进展 [J].国际骨科学杂志, 2013, 34(3): 193-195.
[5] Pardo LA, Sühmer W. The roles of K(+)channels in cancer [J]. Nat Rev Cancer, 2014, 14(1): 39-48.
[6] Wu J, Zhong D, Fu X, et al. Silencing of Ether à Go-Go 1 by shRNA inhibits osteosarcoma growth and cell cycle progression [J]. Int J Mol Sci, 2014,15(4):5570-5581.
[7] Kaplan WD, Trout WE 3rd. The behavior of four neurological mutants of Drosophila [J]. Genetics, 1969,61(2):399-409.
[8] Pardo LA, del Camino D, Sánchez A, et al. Oncogenic potential of EAGK(+) channels [J]. EMBO J, 1999,18(20):5540-5547.
[9] Ding XW, Yan JJ, An P, et al. Aberrant expression of ether à go-go potassium channel in colorectal cancer patients and cell lines [J]. World J Gastroenterol,2007,13(8):1257-1261.

[11]罗翠莲, 文庆莲. 肿瘤抗血管生成治疗耐药分子机制研究进展 [J]. 肿瘤预防与治疗, 2014, 27(1):33-38.
[12]Los M, Voest EE, Borel Rinkes IH. VEGF as a target of therapy in gastrointestinal oncology [J]. Dig Surg, 2005, 22(4):282-293.
Ether à go-go 1 (Eag1) Knockdown Inhibits Human Osteosarcoma Proliferation and Angiogenesis via VEGF/PI3K/AKT Signaling
Wu Jin, Liu Qingjun, Zeng Wenrong, et al
(DepartmentofOrthopaedics,TheAffiliatedSoutheastHospitalofXiamenUniversity,Zhangzhou363000,Fujian,China)
Objective: To detect the influence of Eag1 knockdown on the proliferation and angiogenesis of osteosarcoma and the mechanism of Eag1 regulation. Methods: A recombinant adenovirus vector Ad5-Eag1-shRNA against the expression of Eag1 was constructed and the osteosarcoma cells were infected. The knockdown efficiency of Ad5-Eag1-shRNA was tested by real-time PCR and Western blotting (WB). The influence of Eag1 knockdown on the proliferation and growth of osteosarcoma was measured using CCK-8 and xenograft model of nude mice. The effect of Eag1 silencing on the intratumoral microvessel density (MVD) and vascular endothelial growth factor (VEGF) expression was investigated by the immunohistochemistry and western blot analysis. WB was used to detect the expression of VEGF, phosphoinositide 3-kinase (PI3K) and protein kinase B (AKT) in osteosarcoma cells before and after infected with Ad5-Eag1-shRNA. Results: High knockdown efficiency of Ad5-Eag1-shRNA was shown. Infected with Ad5-Eag1-shRNA inhibited the proliferation and growth of osteosarcoma in vivo and in vitro (allP<0.001). Meanwhile, infected with Ad5-Eag1-shRNA reduced intratumoral MVD and the expression of VEGF (allP<0.001). Moreover, the expression of VEGF (P<0.05), PI3K phosphorylation and AKT phosphorylation (allP<0.001) in osteosarcoma cells were suppressed after infected by Ad5-Eag1-shRNA. Conclusion: Eag1 silencing inhibits tumor proliferation and angiogenesis in osteosarcoma via the down regulation of VEGF/PI3K/AKT signaling.
Ether à go-go 1 Gene; VEGF; Osteosarcoma; Cell Proliferation; Angiogenesis
2016- 05- 17
2016- 08- 05
*国家自然科学基金 (No. 81402217)
吴 进(1983- ),男,江苏镇江人,硕士研究生,主治医师,主要研究方向:恶性骨肿瘤的基础和临床研究。
△陈志达,研究员,E-mail:czd5320@163.com
R738.1;R730.231
A
10.3969/j.issn.1674- 0904.2016.04.001
