恶性卵巢上皮性肿瘤组织中miR-181a、TGF-β1、TGF-βR1的表达变化及意义
2016-01-12李红雨,韩会会,朱海等
恶性卵巢上皮性肿瘤组织中miR-181a、TGF-β1、TGF-βR1的表达变化及意义
李红雨,韩会会,朱海,郭欢欢,曹蒙,刘星烁,张敏
(郑州大学第三附属医院,郑州450052)
摘要:目的观察恶性卵巢上皮性肿瘤组织中miR-181a、TGF-β1、TGF-βR1的表达变化,并探讨其意义。方法良性卵巢上皮性肿瘤26例(良性组)、恶性卵巢上皮性肿瘤59例(恶性组)及子宫良性肿瘤28例(对照组)。用qRT-PCR 法检测各组卵巢组织中的miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA;用免疫组化SP法检测各组卵巢组织中的TGF-β1蛋白和TGF-βR1蛋白。结果恶性组的miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA相对表达量与良性组、对照组相比,P均<0.05。恶性组TGF-β1蛋白、TGF-βR1蛋白的阳性表达率与良性组及对照组相比,P均<0.05。miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA相对表达量及TGF-β1蛋白、TGF-βR1蛋白表达与恶性卵巢上皮性肿瘤的临床分期、组织学分级、淋巴结转移有关(P均<0.05)。恶性组miR-181a与TGF-β1 mRNA的表达水平呈正相关(r=0.810,P<0.05)、与TGF-βR1 mRNA的表达水平呈负相关(r=-0.769,P<0.05),TGF-β1 mRNA与TGF-βR1 mRNA的表达水平呈负相关(r=-0.837,P<0.05)。结论 恶性卵巢上皮性肿瘤组织中miR-181a、TGF-β1高表达,而TGF-βR1低表达,三者的表达有相关关系,可能共同参与了恶性卵巢上皮性肿瘤的发生发展、侵袭转移过程。
关键词:卵巢肿瘤;恶性卵巢上皮性肿瘤;小分子单链RNA;转化生长因子;转化生长因子受体
doi:10.3969/j.issn.1002-266X.2015.43.022
中图分类号:R737.31文献标志码:B
基金项目:2013年度河南省郑州市工程技术研究中心(重点实验室)科研课题。
收稿日期:(2015-06-22)
通信作者:李红雨
miRNA是一类全长约22 nt的非编码小分子单链RNA,在卵巢癌的侵袭、转移中可能发挥着重要作用[1]。研究[2]证实,miR-181a在一些恶性肿瘤中表达升高,而在一些恶性肿瘤中表达下调,这种改变与TGF-β家族的功能密切相关[3],该家族的分泌紊乱及其传导通路的中断与肿瘤的发生发展关系密切[4]。TGF-β1、TGFβR1是TGF-β家族的重要成员,同时是miR-181a的靶基因[5]。本研究对恶性卵巢上皮性肿瘤组织中miR-181a、TGF-β1、TGF-βR1的表达及三者间的表达关系进行了观察,探讨其在恶性卵巢上皮性肿瘤发生发展、侵袭转移过程中可能发挥的作用。
1资料与方法
1.1临床资料2010年3月~2014年9月于郑州大学第三附属医院和郑州大学第一附属医院接受手术治疗的原发性卵巢上皮性肿瘤患者85例(年龄17~76岁)。术前未接受化疗、放疗等治疗,术后病理检查证实为良性卵巢上皮性肿瘤26例(良性组)、恶性卵巢上皮性肿瘤59例(恶性组)。恶性组按FIGO(2000年)分期标准分为Ⅰ、Ⅱ期14例,Ⅲ、Ⅳ期45例;低分化29例,高、中分化30例;浆液性囊腺癌37例,黏液性囊腺癌12例,子宫内膜样癌10例;有淋巴结转移35例,无淋巴结转移24例。接受手术治疗的子宫良性肿瘤患者28例(对照组)三组术中均留取适量卵巢组织并分为两份,一份立即置液氮中速冻后-80 ℃冰箱保存,用于qRT-PCR检测;一份用10%甲醛溶液固定,石蜡包埋,4 μm厚切片,用于免疫组化检测。
1.2主要试剂及仪器TRIzol试剂盒、逆转录试剂盒及SYBR Master Mix购自Tiangen公司;免疫组化SP试剂盒及DAB显色试剂盒购自北京博奥森公司;兔抗人TGF-β1多克隆抗体和兔抗人TGF-βR1多克隆抗体购自武汉三鹰生物技术公司。生物分光光度仪为德国Eppendorf公司产品,qRT-PCR仪为美国ABI公司产品。引物由南京金斯瑞生物有限公司合成。引物序列:miR-181a上游引物为5′-CT-CAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGA-CTCAC-3′、下游引物为5′-ACACTCCAGCTGGGAAC-ATTCAACGCTGTCG-3′;U6上游引物为5′-CTCGCT-TCGGCAGCACA-3′、下游引物为5′-AACGCTTCACG-AATTTGCGT-3′;TGF-β1上游引物为5′-CTAGTCTA-GAATGCCGCCCTCCGGGC-3′、下游引物为5′-AAGG-AAAAAAGCGGCCGCTCAGCTGCACTTGCAGGAGC-G-3′;TGF-βR1上游引物为5′-ACCTTCTGATCCATCCGTT-3′、下游引物为5′-CGCAAAGCTGTCAGCCTAG-3′;GAPDH上游引物为5′-CGCTGAGTACGTCGTGGAGT-3′、下游引物为5′-GTCGCTGTTGAAGTCAGAGGAG-3′。
1.3miR-181a、TGF-β1mRNA、TGF-βR1 mRNA的检测采用qRT-PCR法。①RNA提取、检测:取适量卵巢组织,提取总RNA,紫外分光光度计测定总RNA纯度及浓度。②逆转录、扩增:逆转录反应体系为10 μL。取3 μL总RNA,按逆转录试剂盒说明书逆转录成cDNA。逆转录反应条件为37 ℃孵育60 min。PCR反应:取cDNA 1 μL,总反应体系为20 μL;反应条件为95 ℃ 15 min,95 ℃ 10 s,60 ℃ 60 s,共40个循环。用U6或GAPDH作内参。所有标本设立3个复孔,记录每个PCR反应管中标本的Ct值,以2-ΔΔCT代表目的基因的相对表达量。
1.4TGF-β1蛋白和TGFβR1蛋白的检测采用免疫组化SP法。将石蜡包埋卵巢组织标本的切片脱蜡水化,严格按SP免疫组化试剂盒说明书进行操作。用PBS代替一抗作阴性对照,已知阳性组织切片作阳性对照。显微镜下观察染色切片,细胞呈棕黄色颗粒状或片状者为阳性。在高倍镜下(400×)随机选取5个视野(每个视野观察不少于100个细胞),按细胞着色强度及阳性细胞所占百分比进行结果判定[11]:细胞无着色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分;无阳性细胞为0分,阳性细胞百分比0~25%为1分、~50%为2分、~75%为3分、~100%为4分;上述两项评分的乘积0~1为阴性(-)、2~4为弱阳性(+)、5~8为中度阳性(++)、9~12为强阳性(+++),+、++、+++均为阳性。
1.5统计学方法采用SPSS17.0统计软件。计量资料比较用单因素方差分析,计数资料比较用χ2检验和Fisher精确概率法,相关性分析用Pearson相关分析法。P<0.05为差异有统计学意义。
2结果
2.1各组miR-181a、TGF-β1mRNA、TGF-βR1mRNA的表达比较各组miR-181a、TGF-β1mRNA、TGF-βR1 mRNA的检测结果见表1。
2.2各组TGF-β1蛋白和TGF-βR1蛋白的表达比较恶性组TGF-β1蛋白、TGF-βR1蛋白的阳性表达率分别为69.5%(41/59)、23.7%(14/59),良性组分别为15.4%(4/26)、73.1%(19/26),对照组分别为35.7%(10/28)、57.1%(16/28);恶性组与良性组及对照组相比,P均<0.05;良性组与对照组相比,P均>0.05。
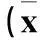
表1 各组miR-181a、TGF-β 1 mRNA、TGF-βR1 mRNA的
注:与良性组、对照组相比,*P<0.05。
2.3miR-181a、TGF-β1、TGF-βR1表达与恶性卵巢上皮性肿瘤临床病理参数的关系miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA相对表达量及TGF-β1蛋白、TGF-βR1蛋白表达与恶性卵巢上皮性肿瘤的临床分期、组织学分级、淋巴结转移有关(P均<0.05),而与组织类型、患者年龄无关(P均>0.05),见表2、3。
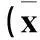
表2 miR-181a、TGF-β 1 mRNA、TGF-βR1 mRNA表达与
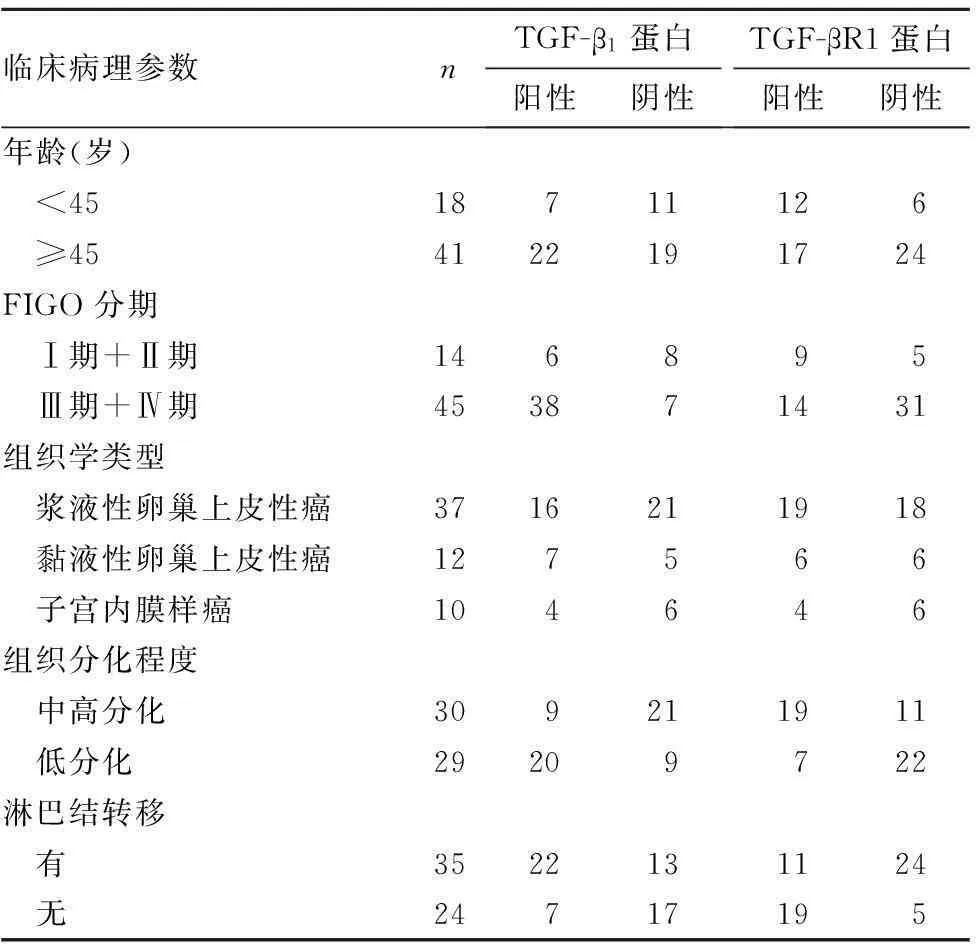
表3 TGF-β 1蛋白、TGF-βR1蛋白表达与恶性卵巢上皮性
2.4恶性卵巢上皮性肿瘤组织miR-181a、TGF-β1mRNA、TGF-βR1 mRNA表达的相关性miR-181a与TGF-β1mRNA的表达水平呈正相关(r=0.810,P<0.05)、与TGF-βR1 mRNA的表达水平呈负相关(r=-0.769,P<0.05);TGF-β1mRNA与TGF-βR1 mRNA的表达水平呈负相关(r=-0.837,P<0.05)。
3讨论
miRNA是一类在动植物中广泛存在、不编码蛋白质的单链小RNA,长度一般为21~25 nt。肿瘤细胞与正常组织细胞的miRNA,表达谱存在明显差异。有研究[4]发现,恶性卵巢上皮性肿瘤中miR-200a、miR-141高表达,而miR-199a、miR-140低表达。miR-181a长度为22 nt,定位于人9号染色体。研究[2]发现,miR-181a与多种肿瘤的发生发展密切相关,如胃癌、乳腺癌、宫颈癌等。本研究结果显示,miR-181a在恶性卵巢上皮性肿瘤组织中的表达明显高于正常卵巢上皮组织和良性卵巢上皮性肿瘤组织,提示miR-181a高表达可能参与了恶性卵巢上皮性肿瘤的发生。miR-181a的表达量与恶性卵巢上皮性肿瘤的临床分期、组织学分级及淋巴结转移明显相关,提示miR-181a可能也参与了恶性卵巢上皮性肿瘤的侵袭转移过程。
TGF-β是一类结构和功能密切相关的活性多肽家族,TGF-β1是miR-181a的靶基因,广泛参与细胞的分化、增殖、形态改变、黏附、转移、细胞外基质产生及凋亡等[5~8]。TGF-βR1是TGF-β家族的另一成员,是TGF-β1最重要的受体,其对TGF-β1信号转导极为重要,缺失TGF-βR1的突变细胞对TGF-β1无反应[9]。在胰腺癌组织中TGF-β1表达上调,TGF-βR1表达降低,TGF-βR1表达降低是可能肿瘤细胞对TGF-β1反应性减弱的原因之一[9]。Grau等[10]报道,胰腺癌细胞存在TGF-β受体表达异常,主要为TGF-βR1基因表达异常,TGF-βR1的低表达可能为胰腺癌逃脱TGF-β负性生长调控的机制之一。本研究结果显示,TGF-β1在恶性卵巢上皮性肿瘤组织中的表达明显高于正常卵巢上皮组织和良性恶性卵巢上皮性肿瘤组织,且TGF-β1的表达与恶性卵巢上皮性肿瘤临床分期、组织学分级及淋巴结转移明显相关,提示TGF-β1高表达可能参与了恶性卵巢上皮性肿瘤的发生和发展。而TGF-βR1在恶性卵巢上皮性肿瘤组织中的表达明显低于正常卵巢上皮组织和良性卵巢上皮性肿瘤肿瘤组织,提示TGF-βR1的低表达可能为恶性卵巢上皮性肿瘤逃脱TGF-β负性生长调控的机制之一。
本研究还发现,恶性卵巢上皮性肿瘤组织中miR-181a与TGF-β1mRNA的表达呈正相关、与TGF-βR1 mRNA的表达呈负相关,TGF-β1mRNA与TGF-βR1 mRNA的表达呈负相关。据此推测miR-181a和TGF-β1mRNA表达的上调以及TGF-βR1 mRNA表达的降低可能起协同作用,三者共同参与恶性卵巢上皮性肿瘤的发生发展、侵袭及转移过程[11]。
参考文献:
[1] Fabian MR, Sonenberg N, Filipowicz W, et al. Regulation of mRNA translation and stability by microRNAs[J]. Annu Rev Biochem, 2010,79(1):351-356.
[2] Yao YH, Liao AJ, Chen J, et al.Expression of miR-181a and miR-181b in human gastric cancer cells and tissues[J]. WCJD, 2015,23(1):30-36.
[3] Tian Q, Huang SL, Liu HS, et al. The study on expression of miR-181a inducted by TGF-β and its function on HCC metastasis [J]. Gynecol Oncol, 2012,112(1):55-59.
[4] Iorio MV, Visone R, Di Leva G, et al. MicroRNA signatures in human ovarain cancer[J]. Cancer Res, 2007,67(18):8699-8707.
[5] Xie JJ, Xu LY, Wu ZY, et al. Prognostic implication of ezrin expres-sion in esophageal squamous cell carcinoma[J]. J Surg Oncol, 2011,104(5):538-543.
[6] Guo LJ,Zhang QY. Decreased serum miR-181a is a potential new tool for breast cancer screening[J]. Int J Mol Med, 2012,30(3):680-685.
[7] Yong QW,Li YM,Hong HX,et al.Hypermethylation of TGF-β1gene promoter in gastric cancer[J].World J Gastroenterl, 2013,4(33):5557-5564.
[8] Corduk N,Abban G, Yildirim B, et al. The Effect of Vitamin D on Expression of TGF-β1in Ovary[J]. Exp Clin Endocrinol, 2012,8(120):490-493.
[9] Zhang L, Yuan SZ. Expressions of tumor growth factor β1 and its receptor in patients with pancreatic cancer[J]. Hepatobilary Pancreat Dis Int, 2002,1(4):620-623.
[10] Grau AM, Zhang I, Wang W, et al. Induction of p21 wafl expression and growlh inhibition by transforming growth factor beta involve the tumor suppressor gene DPC4 in human pancreatic adenocarcinoma cells[J]. Cancer Res, 1997,8(57):3929-3934.
[11] Lou YH, Yang XS, Wang FL, et al. Expression of microRNA-21 in ouarian epithelial carcinoma and its clinical significance[J]. JSMU, 2010,30(3):608-610.
