锰过氧化氢模拟酶合成及应用研究进展
2015-12-24张锋
张锋
(宝鸡文理学院 化学化工学院 陕西省植物化学重点实验室,陕西 宝鸡 721013)
锰是人体内必需的微量元素之一,例如以金属离子的形式作为酶的活性中心和酶蛋白牢固结合,作为激素和维生素的载体或催化剂参与其生理作用,在生物氧化还原反应中起到电子传递和运载作用,维持核酸的正常代谢等。许多生物酶的活性中心都含有锰辅基,例如锰超氧化物歧化酶(Mn-SOD)、锰过氧化氢酶(MnCAT)、核苷酸还原酶等。其中,MnCAT 能够有效催化降解高浓度H2O2,从而阻止其被还原为自由基,保护机体的正常细胞和组织免受自由基的攻击与破坏。此外,过氧化氢酶除了能分解带有过氧基的底物,如过氧化氢、叔丁基过氧化氢之外,还能催化氧化许多化合物,如对甲酚、联苯三酚、对苯二胺等。因此,MnCAT 被广泛用于食品工业、造纸、有机物降解及一切需快速清除H2O2的领域[1]。但天然酶在使用过程中存在分离纯化难、催化活性易受到外界环境如温度、pH 值、有机溶剂等因素抑制,使用成本高等问题[2]。基于上述原因,模拟酶应运而生,大量研究者开始尝试合成不同类型的含锰酶模型配合物来模拟天然酶的结构和功能并取得一些成绩[3-4],这方面的工作不但有利于加深人们对含锰酶的认识,同时也会推动其在食品、化学、工业等方面应用的进步。
本文以MnCAT 模拟酶作为研究对象,讨论模型化合物合成及应用研究进展。
1 MnCAT 存在及作用机理
MnCAT 广泛存在于动植物及微生物中,科学家从Lactobacillus plantarum (Lp)、Thermoleophilum album (Ta)和Thermus thermophilus(Tt)细菌中分离出不同来源的MnCAT,研究结果。图1 晶体结构研究表明,它们的活性中心都含有双核锰的结构,一个MnCAT 由四个反平行的螺旋链构成,而锰离子则位于螺旋链之中。
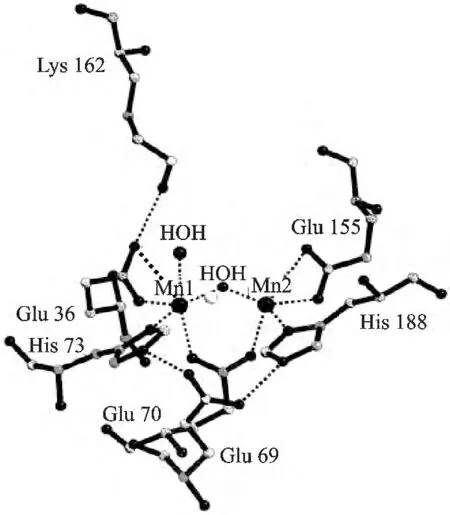
图1 锰过氧化氢酶活性中心结构Fig.1 Active site of MnCAT
已有研究结果表明,MnCAT 有4 种不同的氧化态(MnIIMnII,MnIIMnⅢ,MnⅢMnⅢ和MnⅢMnIV),在催化H2O2分解的过程中,锰离子在不同氧化态间相互转化,促使催化歧化反应的进行[5]。Vincent 等提出了MnCAT 催化过氧化氢歧化反应的Pingpong 机理,Dismukes 则根据实验结果认为该反应由多步构成,并提出可能存在的催化反应机理见图2。
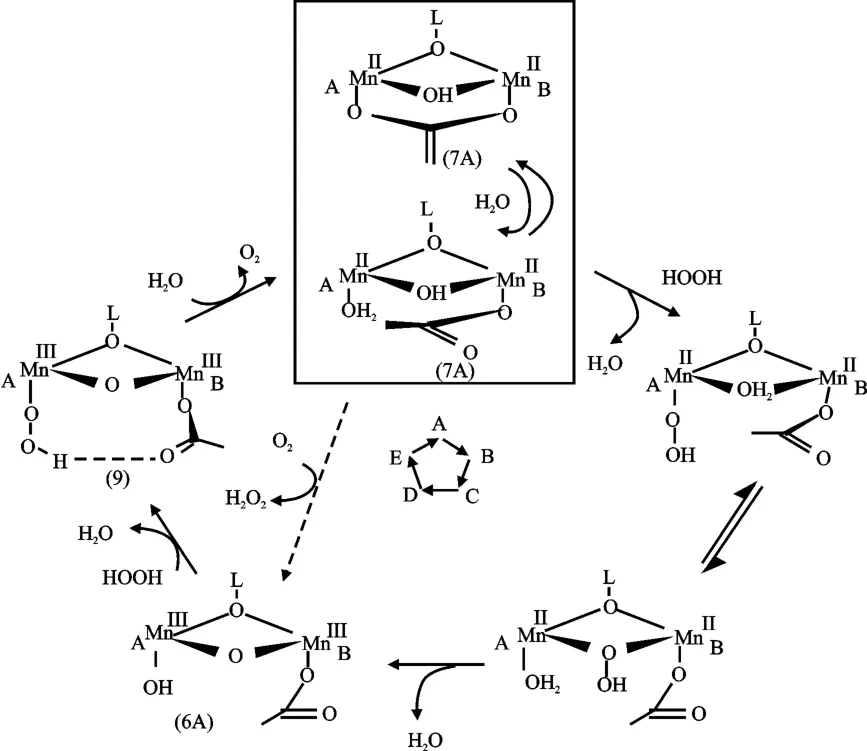
图2 MnCAT 催化反应机理Fig.2 Catalytic reaction mechanism of MnCAT
MnCAT 在闭合状态下(六配位)不具备催化活性,而转变成开环状态下(五配位)则具备催化活性。开环状态配合物A 与底物H2O2反应,一个锰离子上的水分子被过氧根离子取代,形成配合物B,紧接着配合物B 异构为配合物C,随后配合物C 中两个锰离子被氧化成三价,两个过氧基被分别还原为羟基和氧离子并释放出一分子水,配合物C 转变为D。D 首先与另外一分子H2O2结合并脱水形成中间产物E,随后发生氧化还原反应转化成还原态的配合物A,同时释放出O2[6]。由于中间体的结构还未得到,因此该机理还有待进一步研究,但对后续研究者合成MnIIMnII 和MnⅢMnⅢ氧化态的模型配合物具有一定的指导意义。
2 MnCAT 模型化合物的研究
在生物体系中,与金属锰配位的原子一般为蛋白质中的O 和N 原子,这些原子主要来自于羧基、烷氧基、苯氧基、组氨酸中的咪唑基。因此关于Mn-CAT 模型化合物的合成通常先设计并制备合适的配体,再将配体与锰进行络合反应,来合成在结构、光谱学、功能等方面有相似性的模型化合物。按照配体的结构类型,分以下几种类型介绍已知的几类锰过氧化氢酶模型化合物。
2.1 卟啉环类模型化合物
Naruta 等合成出一系列的二卟啉-双锰(Ⅲ)化合物,结构见图3[7],并证实了在水相中能催化H2O2分解。其结构特点在于具有被卟啉环包围的空腔,且两个锰离子之间的间距可变,在催化过程中双锰价态由三价转变为四价,表现出较好的类似过氧化氢酶的催化活性。但不足之处在于必须有甲基咪唑参与的情况下催化活性才能表现出来,并且所合成的配合物的配位环境与天然MnCAT 也不相同,而后者则被认为直接决定催化剂的催化特性。
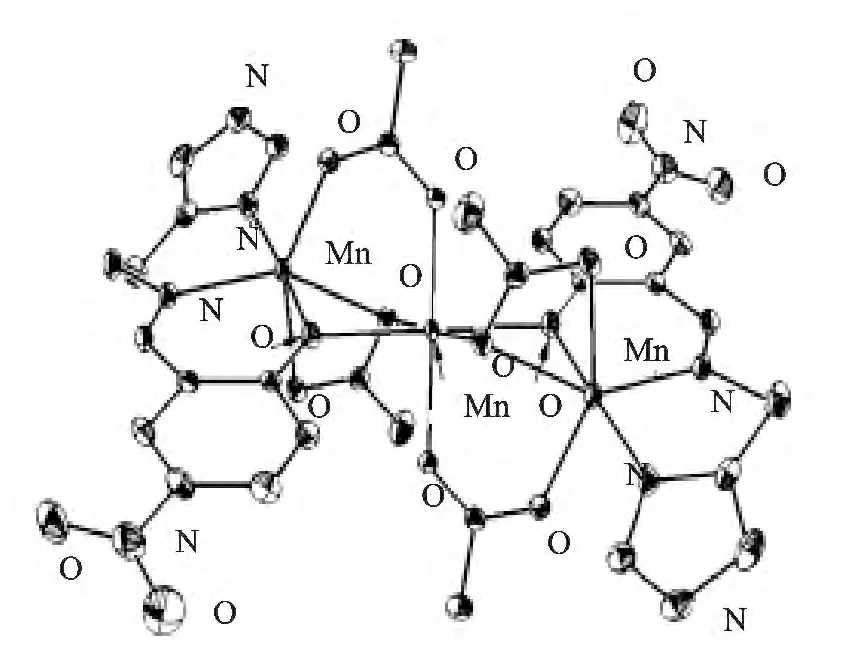
图3 卟啉环模型化合物Fig.3 Porphyrin model complex
2.2 苯并咪唑类模型化合物
苯并咪唑基与酶的组氨酸结构相似,由MnCAT的晶体结构分析可知,天然MnCAT 中锰离子与组氨酸残基中的氮直接发生配位。因此以苯并咪唑环为母体合成各种具有催化活性的配合物已有大量相关研究。Cox 等在Thompson 等的研究基础上合成了铁配合物并测定了儿茶酚胺酶的活性。Manner研究小组合成出Hsal-ambmz,Hsal-aebmz 等配体及相应的配合物,这些配合物也具备一定的催化活性[8]。图4 为苯并咪唑模型化合物的结构。除了氯桥之外,常见的双齿桥联配体还有4,4-二联吡啶、吡嗪、咪唑和二羧酸根离子。研究结果证实不同的桥联基团会造成配合物的催化活性不同。当以乙酸桥代替氯桥时,配合物的表观速率常数下降明显,原因在于乙酸桥配合物的氧化还原电位低,必须在水分子存在的情况下被活化方可催化歧化H2O2。
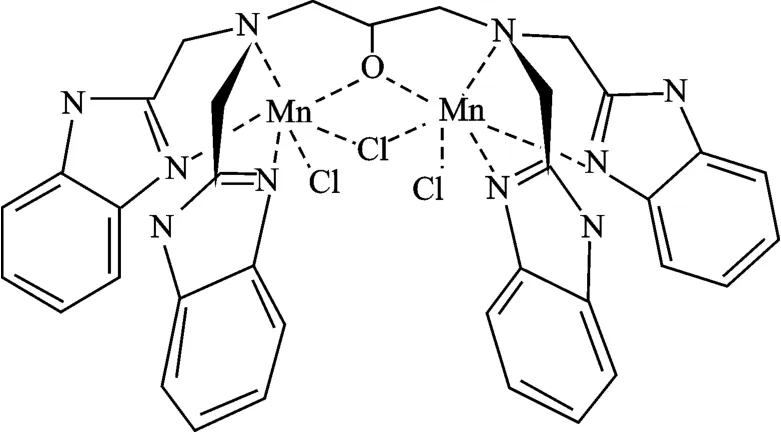
图4 苯并咪唑模型化合物Fig.4 Benzimpn model complex
2.3 水杨醛希夫碱模型
水杨醛希夫碱模型化合物结构见图5。
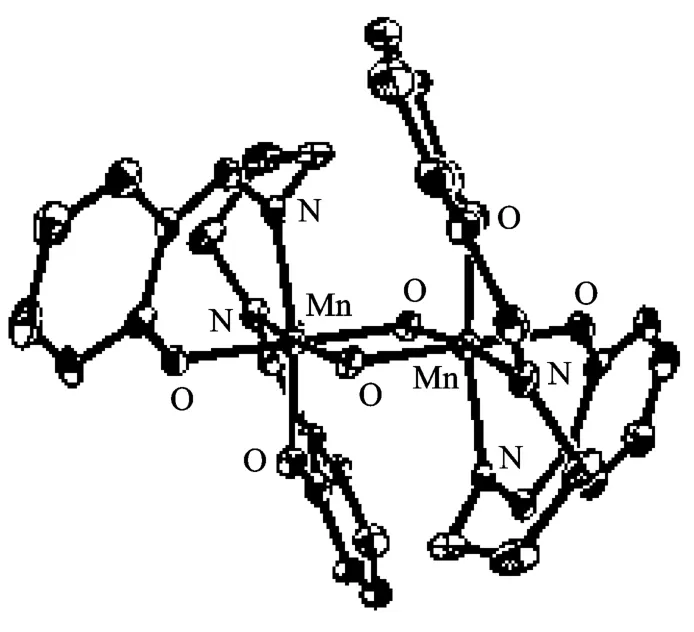
图5 水杨醛希夫碱模型化合物Fig.5 Schiff base ligand model complexes
Horwitz 首先对该类配合物催化烯烃环氧化反应进行了研究,虽然催化效果并不理想。但实验过程中的电化学分析数据证实了该催化反应与细胞色素P450 催化过程类似,证明这类配合物在模拟酶领域具有较大研究潜力。随后Pecoraro 等分别合成了[Mn2Ⅲ(salen)(μ-O)]2,与经过结构修饰的1,3-二(2-羟基苯亚氨基)-2-丙醇为基本配体的锰酶模型物[9-10]。催化实验证明其均具有一定的过氧化氢酶的活性。这类配合物合成过程简单,并且能够通过改变不同类型的配体模拟多种生物催化体系,因此目前大多数的锰模拟酶均采用该种模型结构。
2.4 大环配合物模型
大环配合物具备高稳定性,且其自身能够通过模板缩合反应形成双核、多核配合物,在催化、模拟、材料科学领域受到关注。尤其是双酚亚胺基大环配体,两个氧原子能够形成独特的双室配位结构,有利于形成稳定的双核配位化合物而呈现高催化活性。Robson 等首次合成了席夫碱双酚形式大环配体,实验结果证明该配体能够与Mn(II)、Fe(II)、Cu(II)、Ni(II)、Co(II)等多种金属形成多核配合物且具有较高的稳定性和选择性[11-12]。Okawa 等则在此基础上合成出一系列闭环和开环配体。结果见图6[13]。
图6 双酚亚胺基大环配体结构Fig.6 The structure of polyaza imino macrocyclic ligand
对该类大环配体进行结构改造后可形成不同结构的锰配合物。Riley 等合成出MnII(五氮大环)类衍生物并证实了具有SOD 活性[14]。夏雨佳等利用1,3-丙二胺、2,6-二甲酰基对甲苯酚、二氯化锰为原料制备得到新的双酚多氮亚胺大环双核锰配合物,结构见图7,晶体结构与质谱结果证明该结构具有较高稳定性[15]。
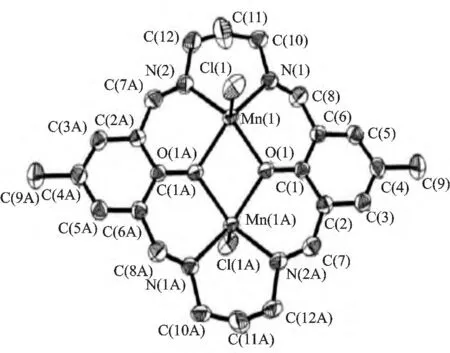
图7 [Mn2LCl2]的晶体结构Fig.7 The crystal structure of[Mn2LCl2]
3 MnCAT 模拟酶应用
3.1 有机催化领域
金属salen 配合物在催化领域的应用已有大量相关报道,而MnCAT 模拟酶中的水杨醛希夫碱模型化合物亦属于该类配合物,因此大量学者针对锰salen 配合物的催化活性展开大量研究。20 世纪80年代,Srinivasan 等率先将锰(Ⅲ)salen 配合物用于催化烯烃环氧化反应,反应15 min 后得到超过60%的收率,且可作用于不同类型的烯烃,如环烯烃、芳香类烯烃、链烯烃等[16]。Jacobsen 等报道了锰(Ⅲ)salen 配合物催化硫醚的不对称氧化反应,获得了较好的实验结果。而翼汝南等则将锰(Ⅲ)salen 配合物通过共价方式固载在炭黑表面并催化不对称烯烃环氧化反应,结果对1-苯基环己烯的氧化具有高选择性,催化效果优于均相催化剂,同时实现了催化剂的循环利用,降低了使用成本[17]。
3.2 环保工业领域
酚类化合物是工业废水中的主要污染成分之一,具有致癌性,对环境与生物有较大危害性。利用锰过氧化氢酶处理能够有效降解该类污染物,但天然酶易失活、成本高,因此采用有催化活性的模拟酶配合物进行降解成为可行的替代措施。姜晓军等将得到的双核锰[MnllZ(bpmapa)2(H2O)2](ClO4)2其中bpmapa =(二(2-吡啶甲基)氨基)乙酸)用于2,6-二甲氧基苯酚的降解,在最佳配比条件下,2,6-二甲氧基苯酚的去除率达到90%。与天然酶相比,配合物在pH 4.0 ~7.0 的范围内均保持较高的催化活性,且降解率随pH 值增大而升高[18]。
3.3 DNA 切割活性
金属配合物小分子与DNA 的作用是生物无机化学的热门研究方向。DNA 骨架上的磷酸根为多聚阴离子,而金属配合物则利用金属离子与DNA 分子之间的静电作用结合,以插入方式与核酸相互作用,从而实现DNA 的切割作用。夏雨佳合成的两种双核大环锰配合物与超螺旋DNA 相互作用后能将其切割成环状DNA,两种锰配合物与DNA 分子的键合常数分别为K1=2.5 ×105L/mol、K2=3.2 ×105L/mol,但其不能将DNA 分子切割成线状,因此该类配合物结构仍有待优化[15]。
3.4 SOD 酶活性
超氧化物歧化酶(SOD)是超氧阴离子自由基O2-最有效的清除剂。研究表明人体许多疾病及功能性障碍均与体内过量的自由基有关。而天然SOD 活性中心原子有Cu 和Mn 两种,合成外源性的SOD 并用于自由基降解的相关研究非常活跃。杜星合成的Mn(Mef)2(MeOH)4与Mn(Mef)2(Bipy)(MeOH)2,其中Mef 为N-(2,3-二甲苯基)2-2-氨基苯甲酸,MeOH 为甲醇,Bipy 为2,2-联吡啶,均表现出较强的清除DPPH 自由基的能力,在DPPH 浓度0.5 mmol/L 时,清除率分别为63%和82%[19]。已知文献中合成的铜、镍、钴、锌甲灭酸配合物降解等浓度的DPPH 的清除率则分别为52.7%,13.1%,10.1%,18.8%。证明含有金属锰原子的甲灭酸配合物表现出较强的自由基清除能力,明显表现出了SOD 酶的活性。
4 结束语
锰在多种生物酶中充当了活性中心,因此关于含锰酶的模拟配合物研究已经相当深入,尤其是MnCAT 的模拟配合物取得了较大进展。研究者们合成出了不同类型的配体与锰形成结构各异的单核、双核、多核锰配合物,很多模拟物均表现出相应的生物催化活性。但酶分子的结构复杂,分子量大,而模拟酶与其相比结构简单,该类配合物普遍稳定性不高,容易分解,该方面的研究仍有待进一步的深入。因此合成出结构复杂,结构与功能更加接近天然酶的多核模型化合物将成为MnCAT 模拟酶的主要研究方向,该方面的研究不但有助于人们更好的认识和了解含锰酶的催化机理,而且对于开发Mn-CAT 模拟酶的应用,实现高效的生物转化开辟了新途径。
[1] Geary W J. The use of conductivity measurements in organic solvents for the characterisation of coordination compounds[J]. Coordination Chemistry Reviews,1971,7(1):81-122.
[2] 张锋,王辉,赵立芳.层状氢氧化氨基苯甲酸锌固定化辣根过氧化物酶及其催化性质[J]. 石油化工,2015,44(3):332-338.
[3] 李军,张毅,尚洪利,等. 模拟过氧化物酶催化苯酚氧化降解的动力学[J].化学工程,2008,36(8):36-39.
[4] 薛征,王志林,罗勤慧.单核锰配合物对几类氧化-还原酶的功能模拟[J]. 无机化学学报,2003,19(10):1033-1039.
[5] Keele J B,Mcord J M,Fridovich L.Superoxide dismutase from Eschefichia Coli,a new manganese containing enzyme[J].Biological Chemistry,1970,245:6176-6181.
[6] Dismukes G C.Manganese enzymes with binuclear active sites[J].Chemical Reviews,1996,96:2909-2929.
[7] Naruta Y,Sasayama M,Sasaki T.Oxygen evolution by oxidation of water with manganese porphyrin dimers[J].Angewandte Chemie,International Edition in English,1994,33:1839-1841.
[8] Mannar R,Amit K,Martin E,et al.Synthesis,characterization,reactivity,and catalytic potential of model Vanadium(IV,V)complexes with benzimidazole-derived ONN donor ligands[J].Inorganic Chemistry,2006,45:5924-5937.
[9] Gelasco A,Pecoraro V L.[Mn(Ⅲ)(2-O Hsalen)]2is an efficient functional model for the manganese catalas[J].Journal of the American Chemical Society,1993,115(17):7928-7929.
[10]Pecoraro V L,Baldwin M J,Gelasco A.Interaction of manganese with dioxygen and its reduced derivatives[J].Chemical Reviews,1994,94(3):807-826.
[11]Pilkington N H,Robson R.Corrigenda-complexes of binucleating igands. Novel complexes of a macrocyclic binucleating ligand[J].Australia Journal of Chemistry,1970,23(11):2225-2236.
[12]Angela C R,Vagner R S,Henrique E T.An unusual vanadium(II)promoted hydrogenation of a magnesium tetraiminediphenolate compound yielding an asymmetric oxovanadium(IV)macrocyclic complex[J]. Polyhedron,2004(23):2069-2074.
[13]Okawa H,Sakiyama H. Dinuclear Mn complexes as functional models of Mn catalases[J]. Pure and Applied Chemistry,1995,67(2):273-280.
[14] Riley D P. Functional mimics of superoxide dismutase as therapeutic agent[J]. Chemical Reviews,1999,99:2573-2580.
[15]夏雨佳.双酚四氮大环双核锰配合物的合成及其性质研究[D].武汉:武汉工程大学,2010.
[16]Srinivasan K,Michaud P,Kochi J K.Epoxidation of olefins with cationic (salen)MnⅢcomplexes-the modulation of catalytic activity by substituents[J].Journal of the American Chemical Society,1986,108(9):2309-2320.
[17]翼汝南.可循环手性Mn(Ⅲ)salen 催化剂催化烯烃不对称环氧化反应研究[D].天津:南开大学,2013.
[18]姜晓军.含锰酶模型化合物的合成、结构、催化活性及其应用研究[D].上海:华东理工大学,2009.
[19]杜星.锰甲灭酸类配合物的合成、表征及其生物活性研究[D].上海:华东理工大学,2012.
