免疫FISH技术检测脑脊液中循环肿瘤细胞在肺癌脑膜转移诊断中的应用*
2015-12-20马春华姜镕吕远穆宁李金铎王斌孙立伟
马春华 姜镕 吕远 穆宁 李金铎 王斌 孙立伟
·临床研究与应用·
免疫FISH技术检测脑脊液中循环肿瘤细胞在肺癌脑膜转移诊断中的应用*
马春华 姜镕 吕远 穆宁 李金铎 王斌 孙立伟
目的:探讨免疫FISH技术检测脑脊液中肿瘤细胞在肺癌脑膜转移诊断中的应用价值。方法:应用免疫FISH技术平台检测16例肺癌脑膜转移患者以及8例脑部非肿瘤疾病患者的脑脊液中循环肿瘤细胞。脑膜转移患者根据神经系统症状、增强MRI检查和脑脊液细胞学检查确诊。结果:肺癌脑膜转移患者的循环肿瘤细胞数目明显高于脑部非肿瘤疾病组,差异具有统计学意义(P<0.01)。根据受试者工作曲线(ROC曲线)确定满足正确诊断指数(Youden指数)最大值的临界点为脑脊液循环肿瘤细胞检测阳性的判定标准,循环肿瘤细胞为1个/7.5 mL脑脊液时曲线下面积(AUC)为0.875,AUC 95%CI为0.705~1.000,诊断的敏感性为75%,特异性为100%,有效性为83.3%,阳性预测值为100.0%,阴性预测值为66.7%。结论:免疫FISH技术检测脑脊液中循环肿瘤细胞对于肺癌脑膜转移的诊断具有重要的临床意义。
循环肿瘤细胞 肺癌 脑膜转移 诊断 免疫荧光
脑膜转移癌(meningeal metastasis,MM)是恶性肿瘤细胞在脑膜和脊髓蛛网膜下腔弥漫性播散或呈局灶浸润的一种中枢神经系统转移癌,常继发于白血病、淋巴瘤、肺癌和乳腺癌[1]。MM进展快,预后极差,未经治疗的脑膜转移癌患者中位生存期仅4~6周[2]。因此,寻找一种灵敏的方法来检测脑膜的潜在转移是十分必要的。近年研究显示血液循环肿瘤细胞(circulating tumor cells,CTCs)即脱落入血的实体肿瘤细胞,与肿瘤诊断[3]、转移和预后[4-6]等有着极大的相关性。本研究应用免疫FISH技术检测肺癌脑膜转
移患者脑脊液中的循环肿瘤细胞,以期评价循环肿瘤细胞检测在肺癌脑膜转移辅助诊断中的应用价值,并选择最理想的脑脊液中循环肿瘤细胞判断标准,以期提高肺癌脑膜转移的早期诊断率。
1 材料与方法
1.1 一般资料
1.1.1 入组标准 1)经组织学或细胞学明确诊断的非小细胞肺癌患者;2)确诊的脑膜转移癌患者;3)MRI检查颅内无直径超过l cm的转移病灶;4)6个月内无脑炎及颅脑外伤病史,未经过脑部手术或者放疗;5)经脱水药物治疗后颅内高压症状可获得控制;6)患者能够耐受腰椎穿刺采集脑脊液;7)排除合并颅内脑膜瘤、室管膜瘤、脊膜瘤等脑脊髓膜病变患者。按此标准共入组16例患者,男性2例,女性14例,中位年龄62(46~76)岁,病理类型均为肺腺癌,5例患者合并脑实质转移。脑膜转移癌诊断标准:1)具有明确的肿瘤病史;2)出现新发神经系统症状与体征;3)典型的脑部MRI增强表现;4)脑脊液细胞学检查发现肿瘤细胞。凡具备前2项及第3或4项中任一项即可确诊[7]。
1.1.2 脑部非肿瘤病变患者入组标准 1)与试验组患者同期住院的脑部非肿瘤病变患者,如脑积水、神经系统变异性疾病等;2)住院期间需进行脑室外引流术、脑室-腹腔分流术、腰大池引流术、腰椎穿刺行脑脊液检查等诊断治疗者。按此标准共入组8例患者,男性6例,女性2例,中位年龄40(35~60)岁,均为交通性脑积水住院治疗。本研究经医院伦理委员会批准,患者签署知情同意书。
1.2 方法
1.2.1 免疫FISH技术检测 所有脑膜转移组患者均通过腰椎穿刺采集脑脊液7.5 mL存于免疫FISH检测专用试管内,脑部非肿瘤病变组均经过脑室外引流管获取7.5 mL脑脊液,均储存于免疫FISH检测专用试管内。常温保存,72 h内应用免疫FISH技术进行肿瘤细胞检测。检测使用试剂:包被CD45抗体的免疫磁珠、4,6-联脒-2-苯基吲哚(DAPI)、8号染色体着丝粒探针(CEP8)、上皮细胞标志物(PAN-CK)以及CD45抗体均购自美国Cytelligen公司。检测步骤分为:1)免疫磁珠阴性筛选法富集细胞:使用抗包被CD45抗体的免疫磁珠去除CD45阳性的白细胞,将7.5 mL脑脊液制备成100 μL细胞悬液。2)细胞计数:固定100 μL细胞悬液滴片,分别采用DAPI染色(阳性表明捕获到的细胞为有核细胞)、CEP8检测细胞8号染色体数目、PAN-CK染色(阳性表明捕获到的细胞为上皮来源)和CD45抗体染色(阴性表明捕获到的细胞为非白细胞)进行免疫荧光分析。Olympus-BX53荧光显微镜(日本Olympus公司)下进行细胞计数,重复计数5次取平均值作为最终值。
1.2.2 循环肿瘤细胞判断标准 荧光显微镜的蓝色通道下观察DAPI染色,蓝色荧光者表明为有核细胞;橙色通道下观察CEP8 FISH信号,橙色亮点数目即为8号染色体数目,大多数CTCs 8号染色体呈多倍体,即CEP8阳性,血源性白细胞8号染色体呈二倍体,即CEP8阴性;绿色通道下观察细胞是否表达PAN-CK,呈绿色荧光即为阳性;红色通道下观察细胞是否表达CD45,呈红色荧光即为阳性。最后在多通道下再次确认细胞为非血源性上皮细胞来源的肿瘤细胞,根据是否将8号染色体为二倍体的有核非血源性细胞判定为循环肿瘤细胞,即DAPI+、CD45-、PAN-CK+或PAN-CK-、CEP8-。将判断循环肿瘤细胞的标准分为标准1:DAPI+、CD45-、PAN-CK+或PAN-CK-、CEP8+或CEP8-;标准2:即DAPI+、CD45-、PAN-CK+或PAN-CK-、CEP8+。呈现DAPI+、CD45+、PAN-CK-、CEP8-时,则表明细胞为白细胞(图1)。

图1 荧光显微镜下富集的细胞图像(DAPI×400)Figure 1 Image of enriched cells under fluorescence microscope(DAPI× 400)
1.3 统计学方法
将各组数据经SPSS 17.0统计软件处理。计量资料以x±s表示,应用秩和检验行统计学分析,并计算诊断敏感性、特异性、有效性、阳性预测值和阴性预测值,P<0.05为差异具有统计学意义。
2 结果
2.1 不同判断标准判定发现CTCs结果
按照判断循环肿瘤细胞的标准1,16例患者脑膜转移组脑脊液标本中有12例脑脊液发现循环肿瘤细胞,8例脑部非肿瘤病变患者脑脊液标本中有2例发现循环肿瘤细胞。按照判断循环肿瘤细胞的标准2,16例患者脑膜转移组脑脊液标本有12例脑脊液发现循环肿瘤细胞,8例脑部非肿瘤病变患者脑脊液标本中未发现循环肿瘤细胞。按照标准1和标准2在脑膜转移组脑脊液中判定发现的肿瘤细胞数均明显高于脑部非肿瘤病变组,差异具有统计学意义(均P<0.05)。脑膜转移组和脑部非肿瘤病变组按照标准1发现的循环肿瘤细胞数均多于按照标准2发现的肿瘤细胞数,但差异无统计学意义(均P>0.05,表1)。
2.2 不同判断标准CTCs诊断临界值的确定
脑脊液肿瘤细胞检测诊断肺癌脑膜转移尚无统一评价标准以及诊断临界值,本研究根据受试者工作曲线(receiver operating characteristic curve,ROC)确定两种判断标准的曲线下面积(area under curve,AUC)以及脑脊液肿瘤细胞检测指标的临界点。标准1的曲线下面积小于标准2的曲线下面积(表2,图2)。

表1 不同判断标准的CTCs检测结果(个/7.5 mL,x±s)Table 1 Detection results of CTCs based on different judging criteria(n/ 7.5 mL,x±s)
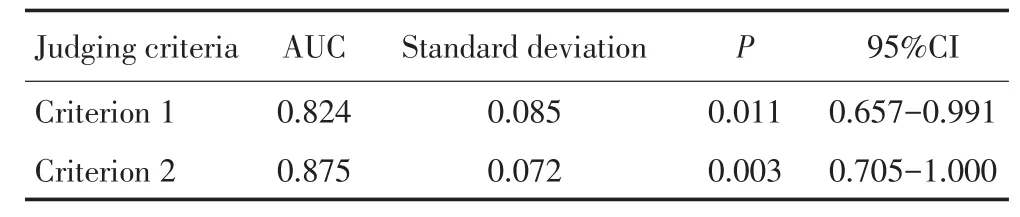
表2 不同判断标准下确定CTCs诊断临界值的相关指标Table 2 Relevant indexes of the CTCs diagnosis critical value based on different judging criteria

图2 免疫FISH检测CTCs诊断脑膜转移的ROC曲线Figure 2 Receiver operating characteristic(ROC)curves of CTCs in diag⁃nosis of meningeal metastasis by immunoFISH technology
在ROC曲线中,满足正确诊断指数(Youden's index)最大值的临界点为本研究阳性判定值。按照标准1判定CTCs诊断脑膜转移时,Youden指数最大值为0.688,CTCs诊断临界值为3个/7.5 mL脑脊液,诊断敏感度为68.8%,特异性为100%。按照标准2判定CTCs诊断脑膜转移时,Youden指数最大值为0.750,CTCs诊断临界值1个/7.5 mL脑脊液,诊断敏感度为75.0%,特异性为100%(表3)。
2.3 脑脊液循环肿瘤细胞对肺癌脑膜转移诊断的相关指标
按照标准2判定脑脊液肿瘤细胞对肺癌脑膜转移的诊断具有较高的特异性、有效性、阳性预测值及阴性预测值(表4)。
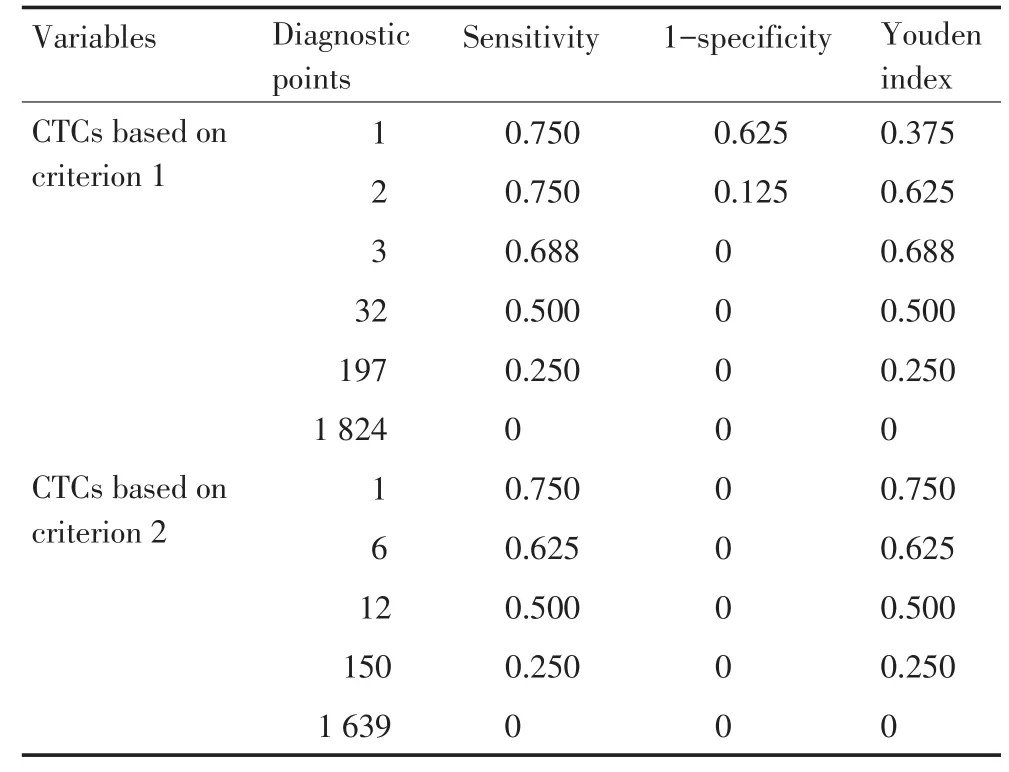
表3 两种标准判定的CTCs变量对应的ROC曲线下坐标点Table 3 Coordinate points of ROC curves corresponding to CTCs based on two judging criteria
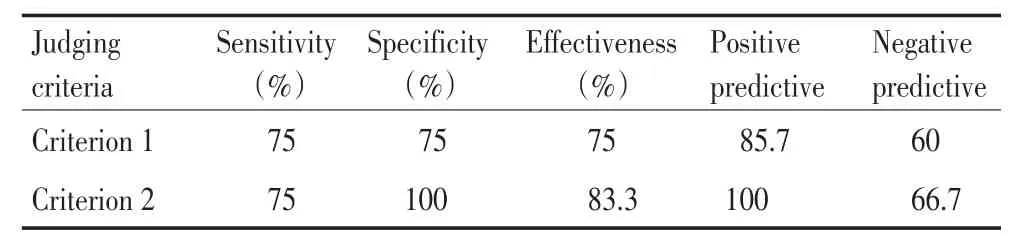
表4 脑脊液肿瘤细胞对肺癌脑膜转移诊断的相关指标Table 4 Relevant indices of CTCs in CSF for diagnosis of meningeal me⁃tastasis from lung cancer
3 讨论
肺癌脑膜转移患者病情进展快,预后极差。早期诊断及治疗可有效延缓因病情进展而导致的神经功能缺损。目前诊断脑膜转移主要采用以下标准[7]:1)具有明确的肿瘤病史;2)出现新发神经系统症状与体征;3)典型的增强MRI表现;4)脑脊液细胞学检查发现肿瘤细胞。凡具备前两项及第3或4项中任一项即可确诊。然而,超过90%脑膜转移瘤患者无典型的中枢神经系统的症状和体征[8-9],脑膜转移癌的临床表现常因肿瘤细胞侵犯的部位不同而复杂多样,缺乏特异性,与脑实质、脊髓转移引起的症状以及治疗原发肿瘤出现的不良反应较难鉴别。脑脊液细胞学首次检查的阳性率仅为55%,再次检查的阳性率达80%,3次以上的脑脊液细胞学检查并不增加检测阳性率[10]。头部强化MRI的特异性几乎能够达到100%,但存在65%假阴性率和10%假阳性率[11]。因此,本研究认为上述诊断方法在脑膜转移癌诊断和疗效评价方面不能满足临床医师的需要,寻找敏感度和特异性更高的检测方式是十分必要的。免疫FISH检测是通过富集技术和分析技术在生物体液标本中有效鉴别各种非血源性肿瘤上皮细胞,研究报道其检测肺癌脑膜转移患者脑脊液中的循环肿瘤细胞具有较高的敏感度[12-13]。应用免疫FISH检测脑膜转移组及脑部非肿瘤病变组患者脑脊液中的循环肿瘤细胞,探讨其在肺癌脑膜转移辅助诊断中的价值。
临床上“理想”的检测方式应具有100%特异性和100%敏感度,且具有可靠的预测价值。由于肿瘤的发生、发展和转归过程十分复杂,临床上很难有“理想”的检测方式。临床上选择灵敏度较高的指标势必增加假阳性率,选择特异性较高的指标又增加假阴性率。阳性预测值(positive predictive value,PPV)是指筛检试验检出的全部阳性例数中,真正患病的例数(真阳性)所占的比例,反映筛检试验结果阳性者患目标疾病的可能性。阴性预测值(negative pre⁃dictive value,NPV)是指筛检试验检验结果为阴性的受试者中真正未患病的比例。诊断试验的预测值受到敏感度、特异度和受试者中患病率的影响。以ROC曲线确定诊断试验临界值,可使假阳性和假阴性的结果控制在较小的范围。本研究选用Youden指数最大值的临界点为脑脊液循环肿瘤细胞阳性判定标准,最大程度兼顾敏感性和特异性[14]。ROC曲线下面积(AUC)作为诊断试验真实性评价的固有准确度指标已被普遍认可,完全无价值的诊断试验AUC为0.5,理想的诊断试验AUC为1,而一般认为对于一个诊断试验,AUC为0.5~0.7时诊断价值较低,0.7~0.9时诊断价值中等,0.9以上时诊断价值较高[15]。
本研究中,标准1和标准2的区别在于是否将8号染色体阴性的非血源性细胞判定为循环肿瘤细胞,按照标准1判定脑脊液中循环肿瘤细胞时发现的细胞数多于按照标准1发现的细胞数,但差异无统计学意义(P>0.05)。在ROC曲线中,按照标准2判定脑脊液肿瘤细胞诊断脑膜转移的各项指标均优于按照标准1所得结果。两种检测标准判断的CTCs诊断脑膜转移的敏感度均为75%,但按照标准2判定脑脊液肿瘤细胞对肺癌脑膜转移的诊断特异性、有效性、阳性预测值及阴性预测值更高。因此,推荐采用标准2(DAPI+、CD45-、PAN-CK+或PAN-CK-、CEP8+)来判定脑脊液中的循环肿瘤细胞。本研究发现,8号染色体阴性的非血源性细胞可能是脱落的脑膜细胞或者腰椎穿刺术、脑室外引流术等临床操作造成的表皮细胞脱落进入脑脊液标本,进而增加了诊断的假阳性率,但由于本研究样本量小,对于去除该类细胞是否会增加假阴性率需要进一步探讨。
在ROC曲线中,按照标准2判定CTCs诊断肺癌脑膜转移,即脑膜转移患者7.5 mL脑脊液中发现1个CTCs诊断脑膜转移的敏感度为75.0%、特异性为100.0%、有效性为83.3%、阳性预测值为100.0%、阴性预测值为66.7%。因此,应用免疫FISH检测脑脊液中的肿瘤细胞诊断肺癌脑膜转移具有较好的临床价值。但由于本研究样本量小,对于同一样本多次检测是否会增加诊断敏感性,以及脑脊液循环肿瘤细胞检测对疗效评价、患者预后有无意义,需加以更多的临床研究。
[1] Leal T,Chang JE,Mehta M,et al.Leptomeningeal metastasis: challenges in diagnosis and treatment[J].Curr Cancer Ther Rev, 2011,7(4):319-327.
[2] Nagpal S,Riess J,Wakelee H.Treatment of leptomeningeal spread of NSCLC:a continuing challenge[J].Curr Treat Options Oncol,2012,13(4):491-504.
[3] Yue Yu,Zhaoli Chen,Jingsi Dong,et al.Folate Receptor-Posi⁃tive Circulating Tumor Cells as a Novel Diagnostic Biomarker in Non-Small Cell Lung Cancer[J].Transl Oncol,2013,6(6):697-702.
[4] Igawa S,Gohda K,Fukui T,et al.Circulating tumor cells as a prognostic factor in patients with small cell lung cancer[J].Oncol Lett,2014,7(5):1469-1473.
[5] Romiti A,Raffa S,Di Rocco R,et al.Circulating tumor cells count predicts survival in colorectal cancer patients[J].J Gastroin⁃testin Liver Dis,2014,23(3):279-284.
[6] Chen P,Li L.Advances in detection of circulating tumor cells in non⁃small cell lung cancer[J].Chinese Journal of Clinical Oncolo⁃gy,2013,40(14):862⁃865.[陈 鹏,李 雷.非小细胞肺癌循环肿瘤细胞检测进展[J].中国肿瘤临床,2013,40(14):862⁃865.]
[7] Wang Y,Gao Y,Zhu YF,et al.The diagnosis and treatments progress of meningeal carcinomatosis[J].Zhongguo Lin Chuang Shen Jing Wai Ke Za Zhi,2013,18(12):760-762.[王 勇,高 烨,朱玉方,等.脑膜癌病的诊治进展[J].中国临床神经外科杂志, 2013,18(12):760-762.]
[8] Ma CH,Jiang R,Li JD,et al.Research progress of lung cancer with leptomeningeal metastasis[J].Zhongguo Fei Ai Za Zhi,2014,17(9):695-700.[马春华,姜 镕,李金铎,等.肺癌脑膜转移的研究进展[J].中国肺癌杂志,2014,17(9):695-700.]
[9]Le Rhun E,Tu Q,De Carvalho Bittencourt M,et al.Detection and quantification of CSF malignant cells by the Cell Search tech⁃nology in patients with melanoma leptomeningeal metastasis[J]. Med Oncol,2013,30(2):538.
[10]Emilie Le Rhun,Frédéric Massin,Qian Tu,et al.Development of a new method for identification and quantification in cerebrospi⁃nal fluid of malignant cells from breast carcinoma leptomeningeal metastasis[J].BMC Clin Pathol,2012,12:21.
[11]Clarke JL,Perez HR,Jacks LM,et al.Leptomeningeal metastases in the MRI era[J].Neurology,2010,74(18):1449-1454.
[12]Jiang R,Ma CH,Zhu ZL,et al.Application of circulating tumor cell detection in cerebrospinal fluid in the diagnosis of meningeal metastasis from non-small cell lung cancer[J].Chinese Journal of Contemporary Neurology and Neurosurgery,2014,14(7):698-701.[姜 镕,马春华,朱子龙,等.脑脊液循环肿瘤细胞检测在非小细胞肺癌脑膜转移诊断中的应用[J].中国现代神经疾病杂志, 2014,14(7):698-701.]
[13]Ma CH,Jiang R,Li JD,et al.A new method for enrichment and calculation of malignant cells in cerebrospinal fluid of patients with meningeal metastasis from lung cancer[J].Tianjin Medical Journal,2015,43(4):419-421.[马春华,姜 镕,李金铎,等.一种新的富集并计数肺癌脑膜转移患者脑脊液中恶性肿瘤细胞的方法[J].天津医药,2015,43(4):419-421.]
[14]Wang P,She CH,Li P,et al.Application of tumor markers in the adjuvant diagnosis of meningeal metastasis from lung cancer[J]. Chinese Journal of Clinical Oncology,2008,35(2):61-64.[王鹏,佘春华,李 鹏,等.肿瘤标志物在肺癌脑膜转移辅助诊断中的应用[J].中国肿瘤临床,2008,35(2):61-64.]
[15]Wang JH.Application of ROC curve in clinical diagnostic experi⁃ments[J].Chinese Journal of Hypertension,2008,16(2):175-177. [王敬瀚.ROC曲线在临床医学诊断实验中的应用[J].中华高血压杂志,2008,16(2):175-177.]
(2015-05-14收稿)
(2015-06-08修回)
(编辑:杨红欣)

马春华 专业方向为中晚期肺癌的治疗及基础研究。
E-mail:mch8178@163.com
放疗应为头颈部恶性肿瘤治疗首选
2015年5月,国际肿瘤放射治疗新进展论坛在天津召开。中国抗癌协会肿瘤放射治疗专业委员会候任主任委员、天津医科大学肿瘤医院院长王平教授报告提出,由于头颈部肿瘤部位特殊且多数肿瘤对放疗敏感,放疗应成为治疗的首选方案,而非继外科手术后的“备选”。
头颈部肿瘤包括发生于眼球、耳鼻喉、副鼻窦、颜面部等的恶性肿瘤。由于头颈部集中了视神经、垂体、脑干、脊髓等大量重要器官和组织,会限制扩大切除手术的应用,影响手术疗效。而上述大部分肿瘤可通过放疗有效治疗,甚至治愈。王平教授指出,以鼻咽癌为例,放疗已成为公认的唯一可以治愈鼻咽癌的手段,患者5年控制率可达80%以上,早期病例5年控制率更是高达90%。但个别医院对此病认识不足,对早期鼻咽癌患者采用复杂手术治疗或内镜下手术治疗,易造成短期时间内肿瘤复发及进展。
王平教授表示,对喉癌、口咽癌、下咽癌、舌根癌、舌癌、儿童视网膜母细胞瘤、颜面部皮肤癌等头颈部恶性肿瘤,放疗也能取得与手术相同的治疗效果。以早期喉癌为例,手术治疗以及放射治疗均可实现5年生存率90%左右的治疗效果。而放疗能够保留喉功能,使患者基本能够正常发音且远期副作用轻微。
天津医科大学肿瘤医院放疗科副主任王佩国指出,放疗也不可避免地存在一些不良反应。如何更加精准地对肿瘤进行靶向打击,降低不良反应,如何与手术治疗、化疗等传统手段联合使用,如何与免疫治疗等新型技术“捆绑应用”等,仍是放疗学科需要解决的问题。
——引自“天津医科大学肿瘤医院”网站
ImmunoFISH technology for detection of circulating tumor cells in cerebrospinal fluid to diagnose meningeal metastasis from lung cancer
Chunhua MA,Rong JIANG,Yuan LV,Ning MU,Jinduo LI,Bin WANG,Liwei SUN
Department of Intervention,Tianjin HuanHu Hospital,Tianjin Key Laboratory of Cerebral Vascular and Neurodegenerative Diseases,Tianjin 300060,China.
This work was supported by grants from the Science and Technology Foundation of Tianjin Municipal Health Bureau (2014kz042).
Jiang Rong,E-mail:jiangrong1989@sina.com
Objective:To investigate the effectiveness of immunoFISH technology in detecting tumor cells in cerebrospinal fluid (CSF)for adjuvant diagnosis of meningeal metastasis from lung cancer.Methods:Circulating tumor cells(CTCs)were detected by immunoFISH technology in CSF samples from 16 patients with meningeal metastasis from lung cancer and 8 patients with non-tumorous brain diseases.Meningeal metastasis from lung cancer was diagnosed on the basis of neurological symptoms and confirmed by enhanced magnetic resonance imaging and CSF cytological examination.Results:The number of CTCs was significantly greater in patients with meningeal metastasis from lung cancer than in those with non-tumorous brain diseases(P<0.01).The critical point of the maximum correct diagnosis index(Youden index)was regarded as the judging criterion for the positive tumor cells in CSF based on the receiver operating characteristic curve.When one tumor cell existed in 7.5 mL of CSF,the area under the curve was 0.875,and the 95% confidence interval ranged from 0.705 to 1.000.The diagnostic sensitivity,specificity,effectiveness,positive predictive values,and negative predictive values were 75.0%,100.0%,83.3%,100.0%,and 66.7%,respectively.Conclusion:ImmunoFISH technology provides great significance in detecting CTCs in CSF to diagnose meningeal metastasis from lung cancer.
circulating tumor cells,lung cancer,meningeal metastasis,diagnosis,immunoFISH
10.3969/j.issn.1000-8179.20150550
天津市环湖医院肿瘤介入科,天津市脑血管与神经变性重点实验室(天津市300060)
*本文课题受天津市卫生局科技基金项目(编号:2014KZ042)资助
姜镕 jiangrong1989@sina.com
