离子排斥色谱法对发酵液中的L—赤藓酮糖及赤藓糖醇的测定
2015-12-18潘龙祁静靳魁奇郑小娟张磊刘宇鹏
潘龙 祁静 靳魁奇 郑小娟 张磊 刘宇鹏
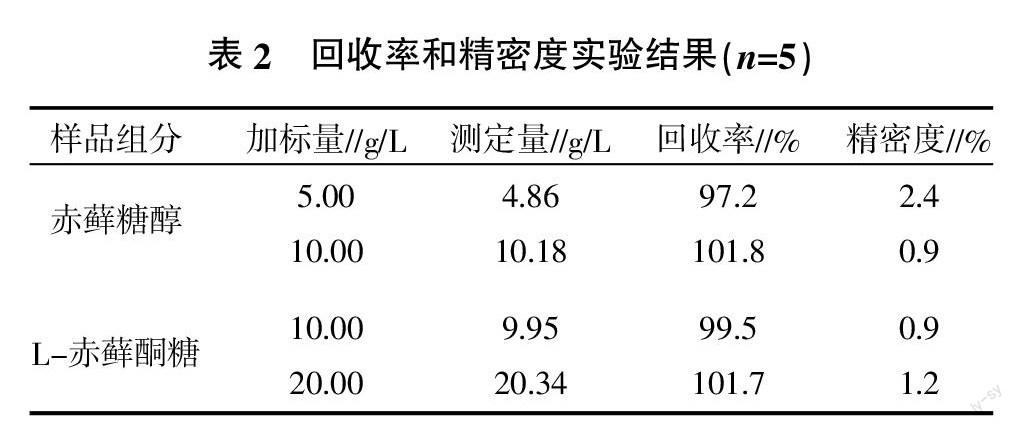

摘要:采用离子排斥色谱法对赤藓糖醇及发酵产物L-赤藓酮糖进行了分析。以高交联度磺化苯乙烯-二乙烯基苯共聚物多孔微球作为固定相的Aminex HPX-87C离子色谱柱为分析柱,利用示差折光检测器分析了发酵液中赤藓糖醇和L-赤藓酮糖。通过色谱条件优化,选定了60 ℃柱温和30%(V/ V)乙腈作为流动相。发酵液样品中赤藓糖醇和L-赤藓酮糖的平均回收率在97.2%~101.8%,精密度偏差在0.9%~2.4%范围内。
关键词:L-赤藓酮糖;赤藓糖醇;示差折光检测器;离子排斥色谱法
中图分类号:O657.7+5 文献标识码:A 文章编号:0439-8114(2015)22-5719-03
Abstract:A method using ion exclusion chromatography was described for the simultaneous determination of erythritol and its metabolites L-erythrulose as products of fermentation. Erythritol and L-erythrulose were analyzed by a sulfonated polystyrene divinylbenzene column (Aminex HPX-87C) with a refractive index detector. It was found that the optimal conditions for separation were 60 ℃ column temperature and 30%(V/V) acetonitrile as mobile phase,which applied to the quantification. The results showed that the recoveries were in the range of 97.2%~101.8% and the precision CV ranged from 0.9%to 2.4%.
Key words: L-erythrulose; erythritol; refractive index detector; ion-exclusion liquid chromatography
赤藓糖醇(Erythritol)[1]是一种具有清凉口感的填充型甜味剂,不仅拥有糖醇类产品的防止龋齿、适宜糖尿病患者等优点,其相对甜度0.65,有清凉感,发热量低,约为蔗糖发热量的1/10。赤藓糖醇溶于水(37%,25 ℃),溶解度低于蔗糖,易结晶,不易被酶降解,结肠中不发酵,只能透过肾排出,不参与糖代谢和血糖变化,宜于糖尿病患者食用。L-赤藓酮糖(L-erythrulose)[2]是一种天然四碳酮醣,呈黏稠液态,溶于水,其醛糖形式是L-赤藓糖。L-赤藓酮糖可与皮肤外部或者老死表层中的角蛋白氨基酸发生反应(表皮的角质层),在化妆品工业中作为二羟基丙酮的替代品,解决了多数人群对二羟基丙酮的过敏问题。目前,L-赤藓酮糖一般以赤藓糖醇(meso-erythritol)为原料化学合成[3],但此法繁琐,且产物为消旋体手性化合物,拆分困难。微生物转化法[4]合成,可通过发酵过程中的酶促反应选择性生成L型产物,且该法操作简便,绿色环保。因此,以赤藓糖醇为底物,通过微生物发酵转化生产L-赤藓酮糖逐渐引起人们的关注。
测定发酵液中L-赤藓酮糖的方法包括HPLC法[5]、薄层色谱法[6]和容量分析法[7],其中薄层色谱法只能定性分析,无法精确定量;容量分析法易受发酵液中的杂质干扰,无法精确测定;HPLC可直接进样,样品不需要复杂前处理,因此更快捷和准确。尽管国内已有HPLC法分析赤藓糖醇和L-赤藓酮糖的报道[5],但一般采用氨基柱分析。
该试验选用了高交联度磺化苯乙烯-二乙烯基苯共聚物多孔微球的minex HPX-87C离子色谱柱[8],分析了发酵液中的赤藓糖醇和L-赤藓酮糖。该法集合离子排斥,离子交换、配位体交换等多种分离机制,提供了较好的分离能力,分离效率大为提高。该研究可为赤藓糖醇和L-赤藓酮糖的定量分析提供参考。
1 材料与方法
1.1 仪器与试剂
1515型高效液相色谱仪,配备2414型示差折光检测器,2489型紫外可见光检测器,2707型自动进样器(美国Waters),Breeze色譜工作站。
L-赤藓酮糖购于美国Sigma公司;赤藓糖醇购于山东三元生物科技有限公司。
乙腈、甲醇均为色谱纯试剂,蛋白胨和磷酸二氢钾均为分析纯,酵母粉为生化试剂,去离子水。
1.2 菌种
氧化葡萄糖酸杆菌(Gluconobacter oxydans 1.637)购于中国普通微生物菌种保藏管理中心。
1.3 方法
1.3.1 色谱分析 色谱柱BioRad公司Aminex HPX-87C柱,(300 mm×7.8 mm,9 μm);柱温40~60 ℃;流动相:乙腈-水梯度洗脱,流速0.6 mL/min,进样量20 μL;折光检测器检测赤藓糖醇和L-赤藓酮糖;检测器温度50 ℃。
1.3.2 发酵条件 发酵培养基配方(质量百分数)为赤藓糖醇5%,蛋白胨0.5%,酵母粉1%,无水磷酸二氢钾0.1%,碳酸钙0.3%,pH 6.8;发酵条件:取对数期种子液,按5%接种量接入250 mL三角瓶,装液量30 mL,pH 6.8,30 ℃振荡(220 r/min)培养28 h。
1.3.3 样品处理 取10 mL发酵液,离心除去菌体和沉淀,然后将上清液稀释,再用0.45 μm的微孔滤膜过滤备用。
1.3.4 标准溶液的配制 称取一定量标准品,用去离子水配成标准溶液,所有标准品浓度均为1.0 g/L。
2 结果与分析
2.1 赤藓糖醇与L-赤藓酮糖分离条件的研究
预试验比较了C8和Aminex HPX-87C柱的分离效果,结果表明,Aminex HPX-87C分析发酵液中赤藓糖醇与L-赤藓酮糖,其目标物和杂质的分离度大于1,满足分析要求。
L-赤藓酮糖一般采用紫外检测器测定[9],但培养基中的酵母粉、蛋白胨中的组分对于定量分析干扰较大,为此,试验选择了示差折光检测器分析发酵液中L-赤藓酮糖及糖醇。该检测器不仅可排除培养基中的成分干扰,并且能同时测定赤藓糖醇和代谢产物L-赤藓酮糖,其检测准确度优于紫外检测器。
据报道,AminexHPX-87C色谱柱分析发酵液中的各种糖类[10]。此色谱柱推荐使用流动相为去离子水。由于赤藓糖醇与L-赤藓酮糖的结构式相似,在色谱图中这两种物质未能完全分开,在流动相中加入乙腈后(最大含量30%),赤藓糖醇与L-赤藓酮糖的分离度大于1。
柱温和流动相中乙腈的浓度对离子色谱分离效果影响显著[11]。试验分析了流动相乙腈的浓度分别为10%、20%、30%,柱温分别为40、50和60 ℃等9个条件,结果见图1。
由图1可知,在较低温度和流动相浓度时,赤藓糖醇与L-赤藓酮糖的分离效果不佳。当升高柱温和增加流动相浓度时,赤藓糖醇与L-赤藓酮糖的分离较好,故选择柱温60 ℃,30%乙腈-水分析,该条件下的色谱图见图2。
2.2 外标工作曲线和线性范围的确定
将混合标准溶液在上述色谱条件下分析,以峰面积外标法定量,赤藓糖醇与L-赤藓酮糖的标准曲线方程和参数见表1,由表1可知,该方法的线性较好,满足分析需要。
2.3 样品分析
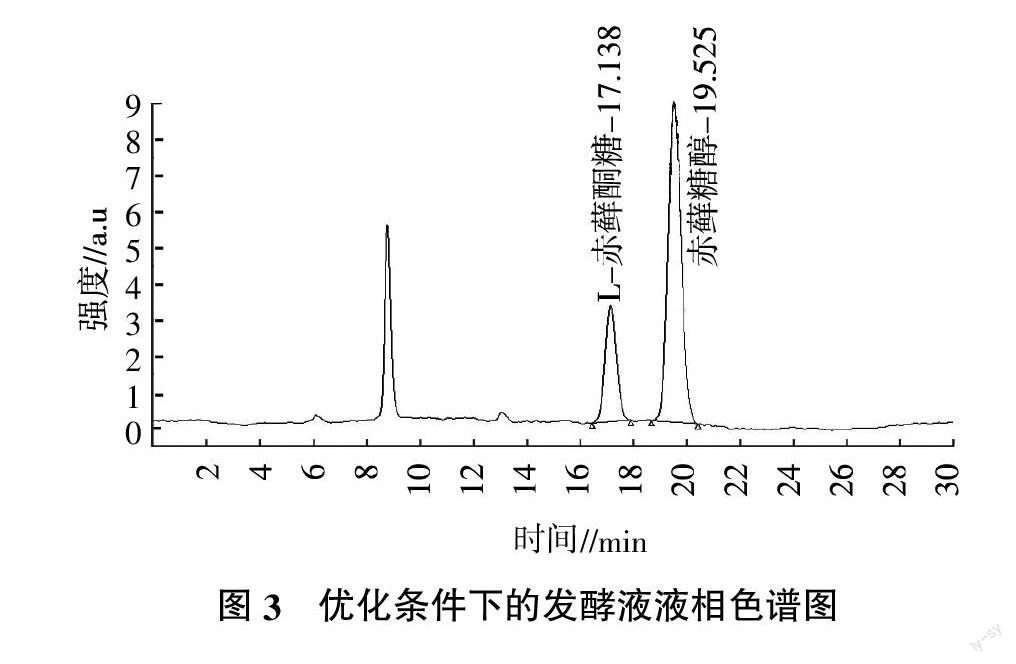
以50 g/L的赤藓糖醇为碳源,取发酵20 h的发酵液(稀释50倍)进行色谱分析,样品色谱图见图3。
结果表明,样品中的杂质对分离无干扰,氧化葡萄糖酸杆菌发酵液样品中的L-赤藓酮糖达34.40 g/L,赤藓糖醇达14.30 g/L。
经回收分析,赤蘚糖醇和L-赤藓酮的加标回收率大于97%(表2),满足分析要求。
3 小结
该法可同时定量分析发酵液中的L-赤藓酮糖和残余的底物赤藓糖醇,发酵液中其他组分对测定不干扰。本研究采用的色谱条件不需对发酵液进行处理,且能够把赤藓糖醇和L-赤藓酮糖完全分开,分辨率高,线性范围宽,能够实时提供发酵液中底物和产物含量变化的数据,结果可靠,该方法将为开发相关天然产物提供技术基础。
参考文献:
[1] 徐 莹,李景军,何国庆.赤藓糖醇研究进展及在食品中的应用[J]. 中国食品添加剂,2005,32(3):92-95.
[2] IMFELD D,SCHMIDHALTER D,MARIE L.Process for the biotechnological preparation of L-erythrulose[P].世界专利,WO2001042483 A1,2001-06-14.
[3] 张永勤,薛长湖,汤浩源,等. 还原糖的可见分光光度法研究进展[J].食品与发酵工业,2007,33(5):97-100.
[4] 魏 群.基础生物化学实验[M].第三版.北京:高等教育出版社,2009.
[5] 葛驰宇,张君丽,陈建华.高效液相色谱法同时测定发酵液中赤藓糖醇和L-赤藓酮糖的含量[J].色谱,2012,30(8):843-846.
[6] 张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[7] 张永勤,王哲平,宋雨梅,等.还原糖测定方法的比较研究[J].食品工业科技,2010,31(6):323-325.
[8] 刘宇鹏,郑 璞,孙志浩,等.采用离子排斥色谱法分析发酵液中的琥珀酸等代谢产物[J].食品与发酵工业,2006,32(12):119-123.
[9] 袁 野,应向贤.高碘酸氧化法直接测定发酵液中赤藓糖醇[J].无锡轻工大学学报,2000,19(1):72-75.
[10] CHINNICI F,SPINABELLI U,RIPONI C,et al.Optimization of the determination of organic acids and sugars in fruit juices by ion-exclusion liquid chromatography[J]. Journal of food composition and analysis,2005,18(2):121-130.
[11] QIU J,JIN X.Development and optimization of organic acid analysis in tobacco with ion chromatography and suppressed conductivity detection[J]. Journal of Chromatography A,2002, 950(1): 81-88.
(责任编辑 周有祥)
