2 种红芸豆蛋白的提取及组分分析
2015-12-10陈晓萌王常青李小凡郝志萍
陈晓萌,王常青*,訾 艳,李小凡,郝志萍,陈 彤
(山西大学生命科学学院,山西 太原 030006)
2 种红芸豆蛋白的提取及组分分析
陈晓萌,王常青*,訾 艳,李小凡,郝志萍,陈 彤
(山西大学生命科学学院,山西 太原 030006)
分析比较了英国大红芸豆和山西小红芸豆主要营养成分和可溶性蛋白含量。并对2 种红芸豆清蛋白提取工艺及功能性质、亚基组成进行了研究。结果表明:大小红芸豆主要营养成分具有显著性差异,可溶性蛋白含量均为清蛋白含量最高,分别为74.08%和66.50%;球蛋白含量分别为10.08%和13.05%;谷蛋白含量分别为7.23%和7.24%;醇溶蛋白含量分别为6.79%和6.12%。2 种红芸豆提取优化结果表明:料液比对大红芸豆清蛋白提取率具有极显著影响(P<0.01),对小红芸豆清蛋白提取率具有显著影响(P<0.05);提取温度、提取时间只对大红芸豆清蛋白的提取率有显著影响(P<0.05)。溶解性分析表明:2 种红芸豆的等电点均为pH 4.7。电泳分析表明,英国大红芸豆和山西小红芸豆清蛋白组成在19.0~44.0 kD范围有3个条带分布基本一致,分别为19、23、43 kD左右,在44.0~97.4 kD的分布不同。
英国大红芸豆;山西小红芸豆;营养成分;蛋白提取;功能性质;电泳
红芸豆(Phaseolus vulgaris Linn. sp.)学名红菜豆,为蝶形花亚科(Faboideae)菜豆属(Phaseolus L.)植物,根据籽粒大小不同可分为大红芸豆和小红芸豆2种[1]。本实验中的小红芸豆原产于山西,百粒质量37~38 g,每百克籽粒数为260~300。大红芸豆原产美洲,1986年由山西省粮油食品进出口公司从英国引进,百粒质量49~50g,百克籽粒数为200~201。山西为全国红芸豆出口基地,全省红芸豆种植面积约为23万亩,每年的出口量为3万 t,占全国芸豆出口量的50%以上。目前国内已有不少白芸豆蛋白组成及营养成分的研究,但是有关红芸豆蛋白组成及营养成分的研究报道却很少。有研究表明,红芸豆蛋白含量为24%左右[2],不但含有丰富的B、C族维生素,钙、铁含量分别是鸡肉的4 倍和7 倍[3],而且也是镁、钾、钠的良好来源[4]。由于英国大红芸豆的亩产量高、经济效益好,所以,近年来,在红芸豆主产地的山西,当地的小红芸豆的种植面积逐渐减少;当地对小红芸豆和英国大红芸豆之间是否存在营养和品质上的较大差异持不同意见。本实验通过研究对比大、小2种红芸豆主要营养成分含量及可溶性蛋白(清蛋白、谷蛋白、球蛋白和醇溶蛋白)含量对2 种红芸豆营养和品质做出评价。并通过研究清蛋白的提取优化、功能性质,及用电泳技术比较2种红芸豆清蛋白亚基的组成,旨在为大小红芸豆的深加工产品的开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
山西小红芸豆和英国大红芸豆均购自山西天镇县创凯谷物贸易有限公司,样品经筛选去杂、烘干、粉碎过筛后备用。
蛋白质电泳Marker 上海升正科技有限公司;氢氧化钠、盐酸等试剂均为国产分析纯。
1.2 仪器与设备
DRZ-4型马弗炉 天津市中环设备厂;数显恒温水浴提取器 国华电器有限公司;MODEL818型精密pH计 杭州奥立龙仪器有限公司;MR23冷冻离心机美国热电公司;旋转蒸发仪 上海申生科技有限公司;UV-2600型紫外-可见分光光度计 尤尼科(上海)仪器有限公司;DYCZ-23A型电泳仪 北京市六一仪器厂。
1.3 方法
1.3.1 2 种红芸豆中主要营养成分的测定
蛋白质测定采用GB/T 5009.5—2010《食品中蛋白质的测定》;淀粉测定采用GB/T 5009.9—2008《食品中淀粉的测定》;水分测定采用GB/T 5009.3—2010《食品中水分的测定》;灰分测定采用GB/T 5009.4—2010《食品中灰分的测定》;脂肪测定采用GB/T 5009.6—2003《食品中脂肪的测定》。
1.3.2 2 种红芸豆清蛋白质提取的单因素试验[5]
准确称取红芸豆粉5.0 g,以蒸馏水为提取溶剂,分别以提取时间(1、2、3、4、5 h)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30 (g/mL))、提取温度(30、40、50、60、70、80 ℃)作为考察对象进行单因素试验。
1.3.3 2 种红芸豆清蛋白质提取的正交试验
为了进一步验证大小红芸豆清蛋白的最佳提取条件,在单因素试验的基础上,对提取时间、料液比和提取温度采用L9(33)进行正交试验,通过SPSS软件进行方差分析。
1.3.4 2 种红芸豆4 种蛋白的提取工艺流程
根据Osborne的蛋白溶解性分类方法[6]。取大小红芸豆各100 g,在以上正交试验最佳条件下提取红芸豆清蛋白后,按以下工艺提取得清蛋白、球蛋白、醇溶蛋白和谷蛋白,测定蛋白含量。工艺流程见图1。

图 1 芸豆蛋白分级提取工艺流程图Fig.1 Flow diagram for fractional extraction of kidney bean proteins
1.3.5 2 种红芸豆清蛋白等电点的测定[7]
准确称取红芸豆粉5.0 g,加10 倍的蒸馏水为提取溶剂,分别用0.1 mol/L盐酸和氢氧化钠溶液调节调pH值至3.5、3.8、4.1、4.4、4.7、5.0,室温条件下2 000r/min搅拌1h,3 000 r/min离心20 min后,福林-酚法测定上清液中蛋白质含量,以牛血清蛋白质为标准。重复测定3 次,上清液中蛋白含量最低点对应的pH值即为该蛋白质的等电点。
1.3.6 2 种红芸豆清蛋白起泡性和起泡稳定性[8]
起泡性:取一定量的清蛋白溶液,分别在pH 3、5、7、9,5 000 r/min条件下室温均质2 min,测定搅拌停止30 s时的体积(V30s),每个样品重复测定3次,用体积的增加量与原来体积(V原)的百分比值表示为起泡能力。

起泡稳定性:静置30、60min后的泡沫体积(V)与搅拌停止30s时体积(V30s)的百分比值表示泡沫稳定性。

1.3.7 2 种红芸豆清蛋白乳化性及乳化稳定性[9]
乳化性:取一定量150 mL的清蛋白溶液,加入色拉油30 mL,分别在pH 3、5、7、9,5 000 r/min条件下室温均质2 min。取样,用pH 7.0、质量分数0.1%十二烷基磺酸钠(sodium dodecyl sulfate,SDS)按1∶100稀释,放置1 min后,500 nm处测定吸光度,SDS溶液作空白。重复测定3次。以1 min时的吸光度(A1)乘以稀释倍数表示乳化性。

乳化稳定性:取样,用pH 7.0、质量分数0.1% SDS稀释100倍,放置10 min后,500 nm处测定吸光度,SDS溶液作空白。重复测定3次。以10 min时的吸光度(A10)乘以稀释倍数表示乳化稳定性。
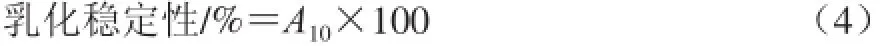
1.3.8 2 种红芸豆清蛋白的电泳分析
芸豆蛋白组分的分子质量测定采用聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)法[10],浓缩胶5%,分离胶12%。蛋白样品(1~2 mg/mL)溶于0.025 mol/L pH 8.3 Tris-Gly缓冲液中,每孔加10 μL样品进行电泳,电泳恒压120 V进行,浓缩胶10 mA,分离胶20 mA。利用一元线性回归分析方法,将蛋白质标准品的相对迁移率对分子质量的对数作图得标准曲线,再根据该标准曲线的回归方程计算清蛋白亚基的分子质量。
2 结果与分析
2.1 大小红芸豆的部分营养成分
大小红芸豆2 种原料的主要营养成分含量及对比见表1(结果均为干基含量)。大小红芸豆的营养组分比例基本相似,均以淀粉为主,含量占到45%以上,符合豆类物质营养成分的基本规律。其次为蛋白质,含量为22%~24.6%,与Wani等[11]报道相近,但大红芸豆的蛋白质、脂肪、矿物质、淀粉含量分别是小红芸豆的1.01、1.11、1.10、1.03 倍,且通过方差分析证明大小红芸豆营养组分之间具有极显著的差异(P<0.01)。其余未测定物质主要为粗纤维[12]。

表 1 大小红芸豆营养组成成分分析表Table 1 Nutritional composition of different red kidney beans
2.2 清蛋白单因素提取试验结果
2.2.1 浸提时间对2 种红芸豆清蛋白提取的影响
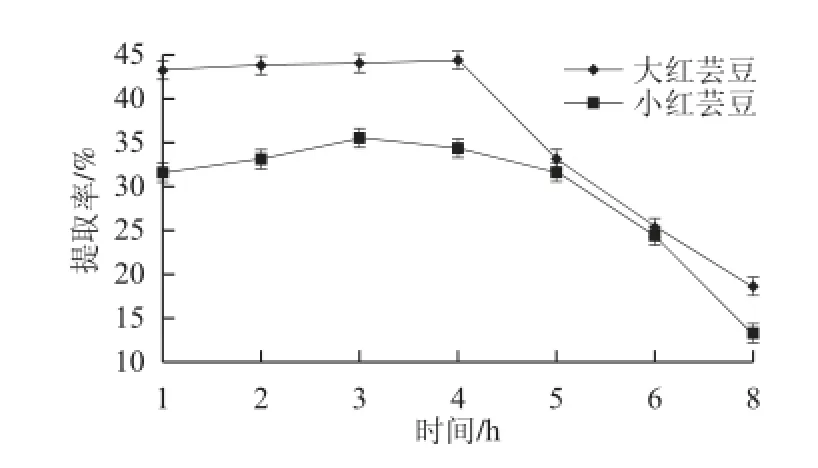
图 2 浸提时间对大小红芸豆清蛋白提取率影响对比图Fig.2 Effect of extraction time on the extraction rate of albumin from red kidney beans
由图2可知,大小红芸豆清蛋白在一定时间内均随着时间的延长,提取率提高,这是因为蛋白质在一定时间内,随着时间的延长,浸提入提取液的蛋白质也会随之增加,但浸提时间过长,会发生蛋白质部分分解和变性,所以提取率先升后降[13]。大红芸豆在4 h左右时提取率达到最大,随后急剧下降;小红芸豆则在3h左右时提取率达到最大。

图 3 料液比对大小红芸豆清蛋白提取率影响对比图Fig.3 Effect of solid-to-liquid ratio on the extraction rate of albumin from red kidney beans
2.2.2 料液比对2 种红芸豆清蛋白提取的影响由图3可知,随着提取溶液使用量的增大,清蛋白的提取率增大,当料液比达到1∶30时,蛋白质提取率达到最大值。但过高的提取溶液使用量会增大蛋白浓缩的负荷,即增大提取成本。所以在其他因素不变的条件下,提取溶液使用量不宜太高。
2.2.3 提取温度对2 种红芸豆清蛋白提取的影响

图 4 浸提温度对大小红芸豆清蛋白提取率影响对比图Fig.4 Effect of extraction temperature on the extraction rate of albumin from red kidney beans
随着提取温度的升高,蛋白质的提取率迅速增大,见图4。大小红芸豆提取温度分别在40 ℃和60 ℃时,蛋白质提取率达到最大,温度继续升高,蛋白质的溶解指数降低,且过高的温度不仅使蛋白质变性,而且已有研究表明,高温会影响蛋白品质、口感等,所以提取不宜采用过高的温度。
2.3 清蛋白提取率正交试验结果与分析
在单因素试验的基础上,采用L9(33)正交试验进一步考察了不同因素对提取率的影响。
2.3.1 小红芸豆清蛋白正交试验结果
由表2可以看出,影响小红芸豆清蛋白的提取率大小顺序为C>A>B,即料液比>提取温度>提取时间,最优组合为A3B2C3,即料液比1∶30、提取温度65 ℃、提取时间3h。在此条件下小红芸豆清蛋白的提取率为57.65%。结合方差分析可知,料液比对小红芸豆清蛋白提取率的影响极显著(P<0.01),其余两因素对小红芸豆清蛋白提取率的影响不显著。
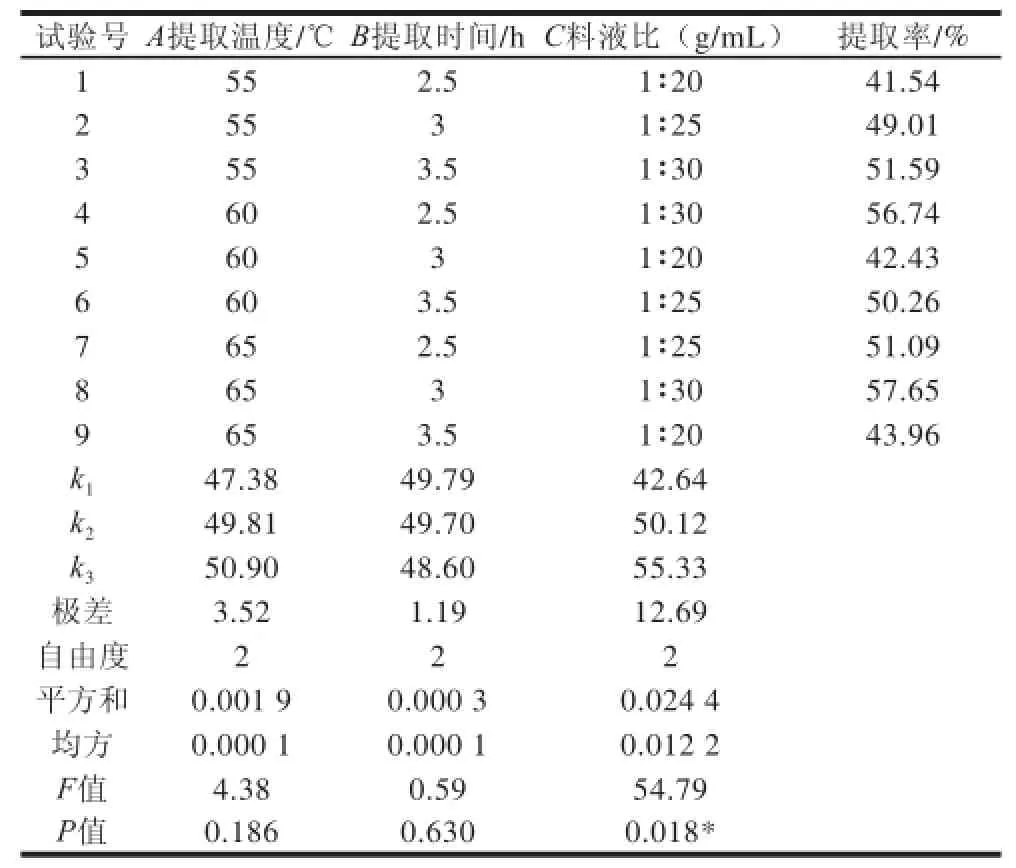
表 2 小红芸豆清蛋白提取正交试验设计结果与方差分析Table 2 Results and analysis of variance of orthogonal array design for albumin extraction from Shanxi red kidney beans
2.3.2 大红芸豆清蛋白正交试验结果

表 3 大红芸豆清蛋白提取正交试验结果及方差分析Table 3 Results and analysis of variance of orthogonal array design for albumin extraction from British red kidney beans
如表3所示,大红芸豆清蛋白提取的最优工艺参数为A2B1C3,即提取温度45℃、提取时间3h、料液比1∶30。在此条件下大红芸豆清蛋白的提取率为66.81%。极差分析可知,影响大红芸豆清蛋白质提取效果的各因素顺序为:C(料液比)>B(提取时间)>A(提取温度)。方差分析表明,料液比对蛋白质的提取效果极显著(P<0.01),提取时间和提取温度有着显著影响(P<0.05),与极差分析结果一致。
2.4 2 种红芸豆蛋白组成分析结果
根据组成红芸豆中各种蛋白的溶解性,在正交试验提取清蛋白的基础上,分别用NaCl溶液、乙醇溶液、和pH 10的蒸馏水提取,得到了球蛋白、醇溶蛋白和谷蛋白。结果如表4所示,大小红芸豆中清蛋白含量最高,远高于其他蛋白组分,分别为74.08%和66.50%,其次是球蛋白,但大红芸豆的球蛋白则比小红芸豆少2.97%,谷蛋白和醇溶蛋白含量接近均在7.0%左右。方差分析表明,2种红芸豆可溶性蛋白中,清蛋白、球蛋白、醇溶性蛋白含量之间都有极显著的差异(P<0.01),谷蛋白含量不具有显著性差异。

表 4 大小红芸豆4 种可溶性蛋白组成差异及显著性分析表Table 4 Difference and signififi cance analysis of four soluble proteins in red kidney beans
2.5 2 种红芸豆清蛋白等电点的测定结果

图 5 大小红芸豆清蛋白等电点对比图Fig.5 Isoelectric points of albumin from different red kidney beans
蛋白质的溶解性是功能性质中最重要的一个性质,它会极大地影响其他功能性质,同时又受pH值的影响。大小红芸豆清蛋白溶解性随pH值变化曲线如图5所示。小红芸豆清蛋白在pH 3.5~5.0时,溶解度均低于大红芸豆清蛋白,再次表明小红芸豆清蛋白含量低于大红芸豆清蛋白含量。随着pH值的增加,溶解度先降低后上升。在pH 4.7时,蛋白溶解度呈现最低值。这与周大寨等[14]报道的芸豆蛋白等电点为pH 4.7研究结果一致。一般而言,蛋白质的溶解度在其等电点附近是最低的,越远离等电点,溶解性越好。原因是在等电点时,电荷斥力消失,从而导致蛋白分子表面电荷为零[15]。
2.6 2 种红芸豆清蛋白的功能性实验
2.6.1 起泡性和起泡稳定性
蛋白含有疏水基团和亲水基团,因而具有表面活性,能降低水的表面张力,在剧烈搅拌时可形成泡沫[16]。从图6可以看出,清蛋白在中性pH值时的起泡性较低,酸性或碱性环境中均增强,似于溶解度曲线,等电点附近起泡活性差,偏离等电点起泡活性增强。这是因为蛋白质在它的表面性质起作用之前必须先溶解和移动到表面,因此蛋白质的起泡活性和溶解度之间通常呈正相关[17]。
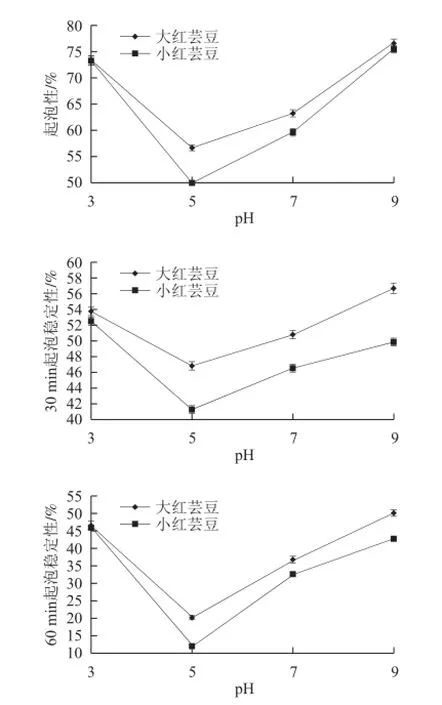
图 6 大小红芸豆清蛋白起泡性及起泡稳定性对比图Fig.6 Foaming capacity and forming stability of albumin from different red kidney beans
2.6.2 乳化性和乳化稳定性
相同条件下不同pH值蛋白的乳化活性和乳化稳定性结果见图7。当蛋白质pH值达9时,乳化性和乳化稳定性增加趋势最大;同时在实验pH值范围内,乳化能力及其稳定性均随蛋白pH值的增大先减小后增大,这是因为蛋白质在界面上的吸附特点为分级吸附,随着蛋白质浓度的增加,单分子吸附层变为多分子吸附层,继而形成排列更加紧密的有一定强度的界面膜,使得乳化能力和乳化稳定性增加[18-19]。从图7可以看出,清蛋白在中性pH值时的乳化活性较低,酸性或碱性环境中均增强。其他几种蛋白质的乳化曲线类似于溶解度曲线,等电点附近乳化活性差,偏离等电点乳化活性增强。许多食物蛋白的乳化活性均有类似的变化规律。这是因为蛋白质在它的表面性质起作用之前必须先溶解和移动到表面,不溶性的蛋白对乳化作用的贡献很小,因此蛋白质的乳化性质和溶解度之间通常呈正相关[13]。此外,pH值的改变还直接影响到蛋白质分子的柔性及亲水-亲油性的平衡,这些因素都与蛋白质的乳化能力息息相关[20]。

图 7 大小红芸豆乳化性及乳化稳定性对比图Fig.7 Emulsifying capacity and emulsion stability of albumin from different red kidney beans
2.7 2 种红芸豆清蛋白亚基的电泳分析结果

图 8 大小红芸豆蛋白SDS-PAGE电泳图谱Fig.8 SDS-PAGE profi le of the proteins from different red kidney beans
由图8可知,大小红芸豆清蛋白的分子质量分布均在97.4 kD以下,其中3 个条带分布基本一致,分别为19、23、43 kD左右。大红芸豆清蛋白组分从小到大分别对应为19.78、22.24、23.61、35.97、43.56、47.35 kD左右,小红芸豆清蛋白组分从小到大分别为19.18、23.62、34.57、43.87、79.99 kD。由此可见,在25.0~34.0、44.0~66.2 kD分子质量之间大红芸豆比小红芸豆清蛋白分别多出一个条带,但在66.2~97.4 kD之间,大红芸豆则没有条带,说明大、小红芸豆清蛋白的组成差异较大。
3 结 论
大小红芸豆的营养组分比例相似,但大红芸豆的蛋白质、脂肪、矿物质、淀粉含量高于小红芸豆,且具有极显著的差异。清蛋白提取实验表明,小红芸豆清蛋白的最佳提取条件为65 ℃、提取3 h、料液比1∶30(g/mL),此时清蛋白的提取率为57.65%;大红芸豆清蛋白的最佳提取条件为45 ℃、提取3 h、料液比1∶30(g/mL),此时清蛋白的提取率为66.81%。在2种红芸豆中,清蛋白含量最高,其次是球蛋白。但大红芸豆的清蛋白含量比小红芸豆高7.58%,而球蛋白则比小红芸豆少2.97%,且出谷蛋白外都具有极显著的差异。大小红芸豆清蛋白均在pH 4.7时溶解度最低,因此等点电均为pH 4.7。大、小红芸豆清蛋白中,有19.78、23.61、43.56 kD 3 个蛋白亚基相同,大红芸豆清蛋白比小红芸豆多22.24、35.97、47.35 kD的3 个亚基;小红芸豆清蛋白有1 个79 kD的亚基是大红芸豆没有的。
[1] 柴岩, 冯佰利, 孙世贤. 中国小杂粮品种[M]. 北京: 中国农业出版社, 2007: 1-20.
[2] 聂刚, 杜双奎, 任美娟, 等. 常见杂豆的蛋白质与矿物质评价[J]. 西北农业学报, 2013, 22(12): 31-35.
[3] 任海伟, 陈晓沛, 张飞, 等. 反胶束法提取红芸豆蛋白的前萃工艺优化[J]. 食品工业科技, 2012, 33(23): 281-285.
[4] HAYAT I, AHMAD A, AHMED A, et al. Exploring the potential of red kidney beans (Phaseolus vulgaris L.) to develop protein based product for food applications[J]. Journal of Animal and Plant Sciences, 2014, 24(3): 860-868.
[5] 马文鹏, 任海伟. 芸豆蛋白的提取及其营养价值评价[J]. 食品科技, 2013, 38(1): 75-79.
[6] 管骁, 姚惠源. 燕麦麸蛋白的组成及功能性质研究[J]. 食品科学, 2006, 27(7): 72-76.
[7] 曹晓虹, 温焕斌, 李翠娟, 等. 稻米蛋白提取工艺及其特性研究[J].食品科学, 2009, 30(14): 62-66.
[8] 郭庆启, 张娜, 赵新淮. 大豆分级蛋白的功能性质评价[J]. 食品工业科技, 2006, 27(10): 74-79.
[9] 张丙云, 袁亚兰, 高芸璟. 芸豆蛋白的营养价值和功能特性研究[J].食品工业科技, 2010, 31(11): 347-350.
[10] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 1999: 54; 123; 161.
[11] WANI I A, SOGI D S, WANI A A, et al. Physico-chemical and functional properties of flours from Indian kidney bean (Phaseolus vulgaris L.) cultivars[J]. LWT-Food Science and Technology, 2013, 53(1): 278-284.
[12] SINGH N, LIU M S, HALL C, et al. Extrudability of four common beans (Phaseolus vulgaris L.)[J]. Journal of Food Processing and Preservation, 2013, 37(5): 676-683.
[13] 荣先萍, 彭奇均. 米渣蛋白组成成分及提取工艺研究[J]. 应用化工, 2010, 39(6): 800-805.
[14] 周大寨, 朱玉昌, 周毅锋. 芸豆蛋白质的提取及超滤分离研究[J]. 食品科学, 2008, 29(8): 386-390.
[15] 史卿, 杜研学, 赵强, 等. 白木通籽分离蛋白的理化与功能性质研究[J].食品工业科技, 2012, 33(23): 76-80.
[16] 黄友如, 华欲飞, 裘爱泳. 大豆分离蛋白功能性质及其影响因素[J].粮食与油脂, 2003(5): 12-15.
[17] 杨湘庆, 沈悦玉, 徐仲莉, 等. 蛋白质的表面活性及其应用机理[J].冷饮与速冻食品工业, 2006, 12(3): 1-5.
[18] 管军军, 裘爱咏, 周瑞宝. 提高大豆分离蛋白乳化性和乳化稳定性的研究[J]. 中国油脂, 2003, 28(11): 38-41.
[19] LAN Shen, CHUAN Hetang. Emulsifying properties of vicilins: dependence on the protein type and concentration[J]. Food Hydrocolloids, 2014, 36: 278-286.
[20] PATWARDHAN V N. Pulses and beans in human nutrition[J]. American Journal of Clinical Nutrition, 1962, 11: 12-30.
Extraction and Analysis of Proteins from Red Kidney Beans from Different Growing Regions
CHEN Xiaomeng, WANG Changqing*, ZI Yan, LI Xiaofan, HAO Zhiping, CHEN Tong
(College of Life Science, Shanxi University, Taiyuan 030006, China)
In this experiment, the major nutrients and soluble protein contents in red kidney beans from the United Kingdom and Shanxi province, China were analyzed. The extraction, functional properties and subunit composition of albumin in red kidney beans from the two geographic origins were studied. The results showed that the major nutritional composition of British red kidney beans was signifi cantly different from that of those from Shanxi, and albumin was the most abundant soluble protein in both samples, accounting for 74.08% and 66.50% of the total amount of soluble proteins, respectively, which also contained 10.08% and 13.05% globulin, 7.23% and 7.24% gluten, and 6.79% and 6.12% prolamin, respectively. Material-to-liquid ratio had an extremely signifi cant impact (P < 0.01) on the extraction rate of albumin from British red kidney beans and a signifi cant impact (P < 0.05) on the extraction rate of albumin from Shanxi red kidney beans. Extraction temperature and time were also signifi cant factors for the extraction of albumin from British rather than Shanxi red kidney beans (P < 0.05). Protein Isoelectric point for both samples was pH 4.7. Electrophoresis analysis showed that the distribution of albumin in these two samples was substantially the same in the range of 19.0–44.0 kD, although differences in the range of 44.0–97.4 kD were observed.
British red kidney bean; Shanxi small red kidney bean; nutrients; protein extraction; functional properties; electrophoresis
TS201.1
A
1002-6630(2015)02-0149-06
10.7506/spkx1002-6630-201502029
2014-06-28
陈晓萌(1989—),女,硕士研究生,研究方向为食品生物技术与功能食品开发。E-mail:richuriluo.ok@163.com
*通信作者:王常青(1956—),男,教授,学士,研究方向为食品生物技术与功能食品开发。E-mail:wcq@sxu.edu.cn
