几株烟草根际促生细菌的挥发性物质对拟南芥根构型的影响
2015-11-28李敏张鹏鹏刘凯邵兰军姚良同杜秉海丁延芹
李敏,张鹏鹏,刘凯,邵兰军,姚良同,杜秉海,丁延芹*
1.广东中烟工业有限责任公司,广东广州510000
2.青岛明月蓝海生物科技有限公司,山东青岛266400
3.山东农业大学生命科学学院/山东省农业微生物重点实验室,山东泰安271018
几株烟草根际促生细菌的挥发性物质对拟南芥根构型的影响
李敏1,张鹏鹏2,刘凯3,邵兰军1,姚良同3,杜秉海3,丁延芹3*
1.广东中烟工业有限责任公司,广东广州510000
2.青岛明月蓝海生物科技有限公司,山东青岛266400
3.山东农业大学生命科学学院/山东省农业微生物重点实验室,山东泰安271018
为研究13株植物根际促生细菌(PGPR)产生的挥发性物质(VOCs)对拟南芥的生长促进作用,通过二分格培养法筛选出对拟南芥生长有影响的菌株,采用SPME-GC-MS对植物根际促生细菌产生的VOCs进行鉴定。结果表明,供试的13株植物根际促生细菌产生的VOCs能够不同程度的促进拟南芥的生长、改变拟南芥的根构型。P1、MD8和FGH19菌株产生的挥发性物质对拟南芥的促生作用十分显著,平均拟南芥鲜重达38.78、30.58、23.70 mg/株,分别比对照增加了5.71、4.29、3.10倍。DZQ8菌株处理的拟南芥PRL为8.03 cm,比对照处理增长了0.85倍,TZQ33和TZQ36菌株的处理对拟南芥LRN影响最为明显,LRN分别为37.50和40.50,比对照处理分别增长了1.17和1.35倍,MTQ8、MD8、TZQ33和TZQ36菌株处理的拟南芥LRD分别为6.20、7.07、7.35和7.33 cm-1,比对照处理分别增大了0.55、0.77、0.84和0.83倍。因此,植物根际促生细菌产生的一些挥发性物质可以促进植物的生长、重塑根构型。通过对挥发性物质的分析及验证,首次发现MTQ8产生的1,3-丁二醇对拟南芥植株有很明显的促生作用,且确定1,3-丁二醇可以促进拟南芥的生长、调整根构型。
植物根际促生细菌(PGPR);挥发性物质(VOCs);促生作用;拟南芥
植物根际促生细菌(Plant growth-promoting rhizobacteria,PGPR)是指生活在植物根际的一类可促进植物生长、防治病害、增加作物产量的有益菌类[1-4]。大量研究表明,PGPR具有提供植物营养、促进植物根系发育、防治植物土传病害的能力。产生挥发性物质是PGPR的促生机制之一,揭示PGPR具有促生作用的挥发性物质,不仅具有重要的理论价值,而且对于PGPR制剂的开发利用具有重要的实践意义。
近年来,人们开始关注微生物产生的某些挥发性物质对植物的生防与促生作用。2002年,Schller等[5]采用气相色谱-质谱联用技术,首次分析了26种放线菌产生的挥发性物质(Volatile organic compounds,VOCs)。目前大量的研究集中于PGPR产生的一些VOCs对植物病原菌的抑制作用[6-10]。但对微生物产生的VOCs调节植物生长发育的报道较少。Ryu等[11]报道了枯草芽孢杆菌GB03和解淀粉芽孢杆菌IN937a产生的2,3-丁二醇和乙酰甲基原醇能促进拟南芥的生长,表明VOCs可作为参与调节植物与微生物互作的信号分子。Farag等[12]采用顶空固相微萃取并结合交气相色谱-质谱联用的新技术,研究了枯草芽孢杆菌株GB03和解淀粉芽孢杆菌IN937a的VOCs 2,3-丁二醇和乙酰甲基原醇对拟南芥的促生作用。Kai等[13]报道不同种类的细菌能产生l-30种VOCs,而且大多数化合物是特有的。Francisca M等[14]研究了温室条件下的柠檬土壤根际中的几种芽孢杆菌属的细菌对拟南芥根构型的影响,表明VOCs可以通过改变拟南芥根构型影响植物的生长。目前为止,大量PGPR菌株产生的VOCs对植物的促生作用尚不太清楚。本试验以拟南芥作为模式植物,对13株不同属种的植物根际促生细菌产生的挥发性物质进行促生试验,研究这些菌株产生的挥发性物质对拟南芥根系生长发育及根构型的影响,并分析其所产生的挥发性化学组分,可望发现产生具有促生作用VOCs的新菌株和具有促生作用的新挥发性化合物。
1 材料与方法
1.1 供试菌株(表1)
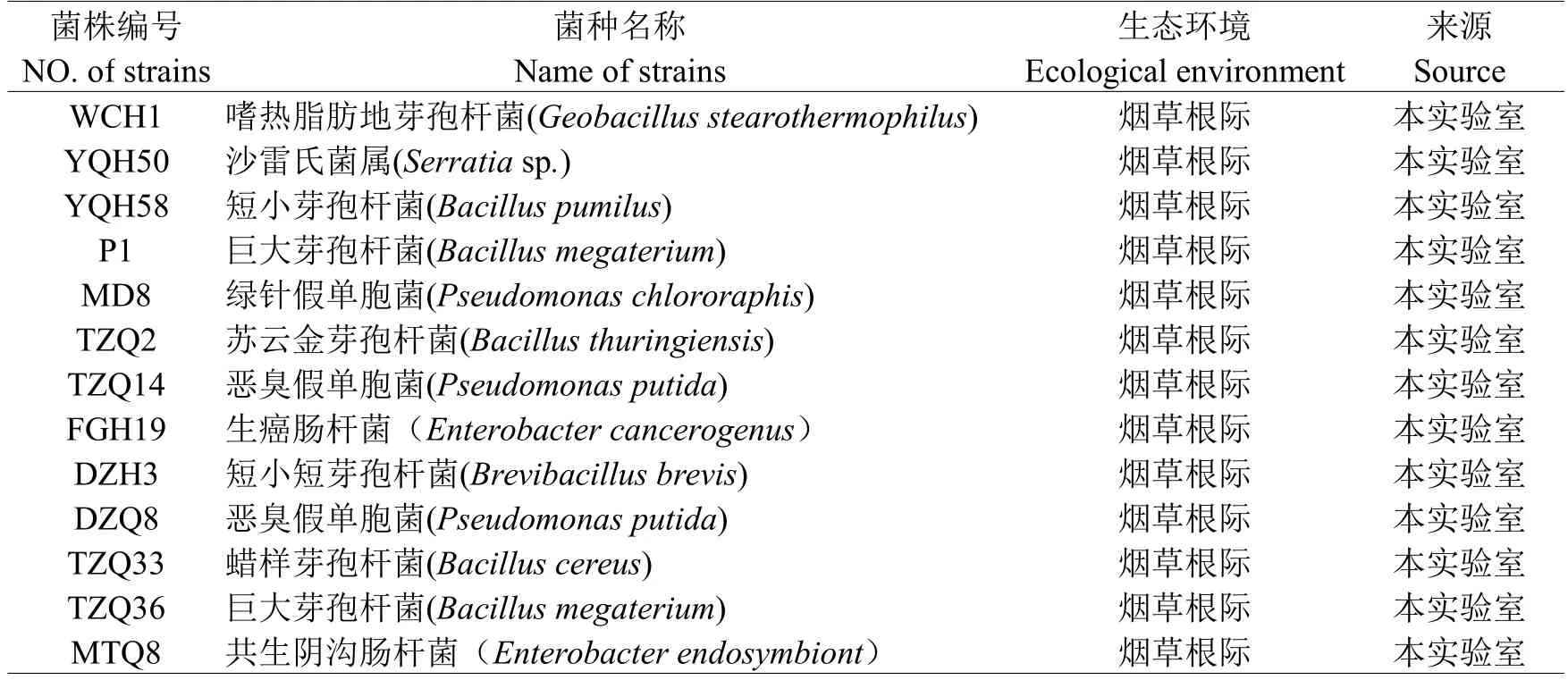
表1 供试的植物根际促生细菌Table 1 Strains of plant growth promoting rhizobacteria tested in the study
1.2 植物材料和生长条件
选择拟南芥(Arabidopsis thaliana)(野生型Col-0)作为模式植物进行研究。将拟南芥种子用70%的乙醇处理5 min,2.6%的次氯酸钠处理10 min,无菌水冲洗7~8遍进行表面杀菌。将消毒后的拟南芥种子铺在含有0.5×MS培养基的培养皿中。将培养皿竖直放置在光照培养箱中,使根能沿培养基表面不受到阻力的生长。光照培养箱的条件设置为白天16 h,黑夜8 h,光照强度H1,温度22℃。
1.3 培养试验
为了研究PGPR释放的VOCs对拟南芥生长发育的影响,本试验采用二分格培养皿进行培养。培养皿被分成两部分,其中一部分是0.5×MS培养基,另一部分是PDA培养基。将培养了4 d的拟南芥移栽到含有0.5×MS培养基的一室中,每皿移栽五株。在另一室中加入20µL菌液,菌含量约为109CFU,每皿做四个平行。参见Francisca等[14]的培养方法将培养皿用封口膜封口竖直培养。10 d后,测拟南芥主根长度(PRL)、侧根数目(LRN)、侧根密度(LRD)和总生物量。
1.4 VOCs分析
将PGPR接种至含有20 mLPDA液体培养基的50 mL三角瓶中,用锡箔纸封口,在摇床中振荡培养2 d,然后用兰色的SPME萃取头萃取产生的VOCs,进行气相质谱分析。
1.5 统计分析
将拟南芥不同生长发育的参数用SPSS.v16.0软件进行分析。
1.6 单一气体对拟南芥的促生试验
参照1.3方法,分别以1,3-丁二醇、2-甲基丁酸、2-庚酮、正戊醇、2,5-二甲基吡嗪、甲基壬基甲酮、癸醛和苯甲酸取代菌液,验证其对拟南芥的促生作用。
2 结果
2.1 PGPR产生的挥发性物质促进拟南芥生长
试验结果(图1、2)表明,与对照相比,13个供试菌株中,除DZH3和DZQ8没有明显差异外,其它11个菌株产生的挥发性物质对拟南芥的生长均有不同程度的促进作用。其中P1菌株产生的挥发性物质对拟南芥的促生作用最为显著,平均拟南芥鲜重达38.78 mg/株,比对照处理(5.78 mg/株)增加了5.71倍;MD8、FGH19、TZQ36、WCH1产生的挥发性物质对拟南芥的促生作用也十分显著,平均拟南芥鲜重分别为30.58、23.70、22.03和16.80 mg/株,分别比对照增加了4.29、3.10、2.81和1.91倍。
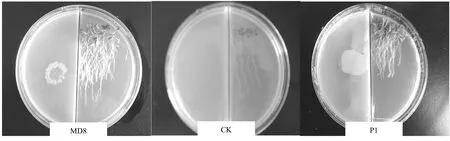
图1 部分菌株对拟南芥的促生效果Fig.1 Growth promotion of some strains on Arabidopsis thaliana
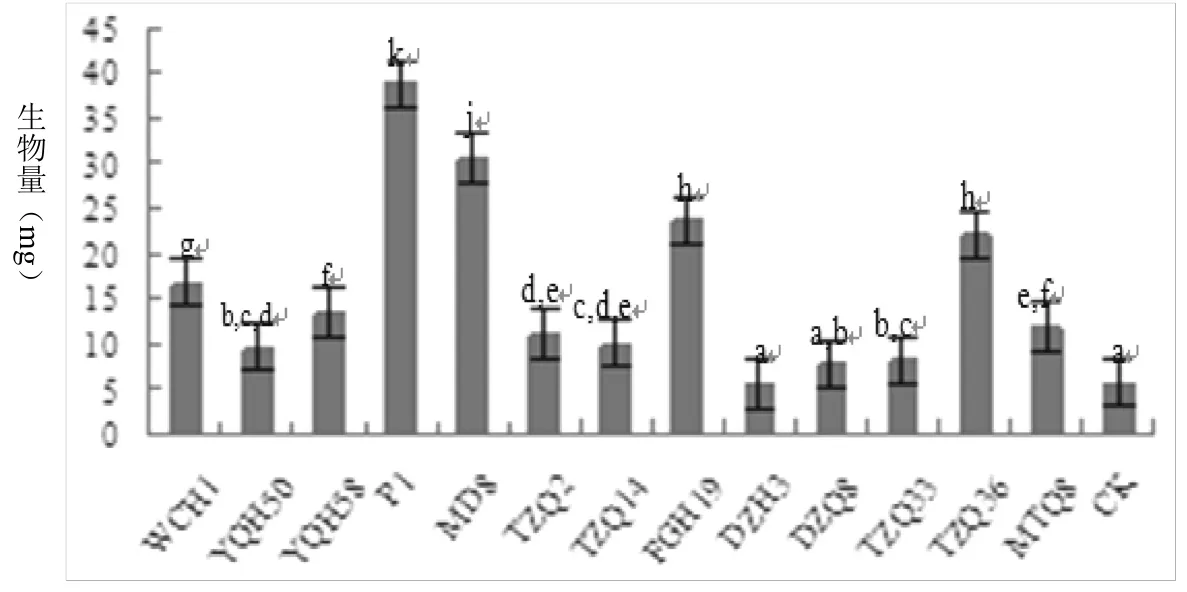
图2 接种PGPR菌株对拟南芥的影响与空白对照的对比(LSD,P=0.05,n=20)Fig.2 Total fresh weight of Arabidopsis thaliana seedlings inoculated or not with PGPR strains(LSD,P=0.05,
2.2 PGPR产生的挥发性物质对拟南芥根构型的影响
13个PGPR菌株产生的挥发性物质对拟南芥根尖根毛发育有不同程度的影响(图3)。DZH3和FGH19处理的拟南芥植株根尖根毛十分密集,WCH1处理的拟南芥植株根尖根毛长度增加明显。

图3 接种不同菌种对拟南芥根尖根毛的影响(放大倍数为10倍)Fig.3 Effect of different PGPR strains inoculation on Arabidopsis thaliana root hair of root tip(10 magnifications)
测定了PGPR菌株产生的挥发性物质对拟南芥的主根长度(PRL)、侧根数目(LRN)和侧根密度(LRD)的影响(图4)。试验结果表明,YQH58处理的拟南芥的PRL为3.68 cm比对照处理(4.33 cm)短一些,MD8、FGH19、DZH3和MTQ8处理的拟南芥PRL分别为4.58、4.45、4.05和3.88 cm与对照相比影响不大,差异不显著,DZQ8菌株处理的拟南芥PRL为8.03 cm,与对照相比差异显著,比对照处理增长了0.85倍;TZQ33和TZQ36菌株的处理对拟南芥LRN影响显著,LRN分别为37.50和40.50,比对照处理(17.25)分别增长了1.17和1.35倍,YQH58和DZH3处理的拟南芥LRN分别为15.50和15.25,与对照相比,差异不显著;MTQ8、MD8、TZQ33和TZQ36菌株处理的拟南芥LRD分别为6.20、7.07、7.35和7.33 cm-1,比对照处理(3.99 cm-1)分别增大了0.55、0.77、0.84和0.83倍,差异显著,DZQ8菌株处理的拟南芥LRD为3.00 cm-1,比对照处理减小了0.25倍,DZH3、YQH58处理的拟南芥LRD分别为3.76、4.15和4.72 cm-1,DZH3比对照处理减小了0.06倍,YQH58和P1比对照处理分别增大了0.04和0.18倍,这三株菌产生的VOCs对LRD的影响相对较小。
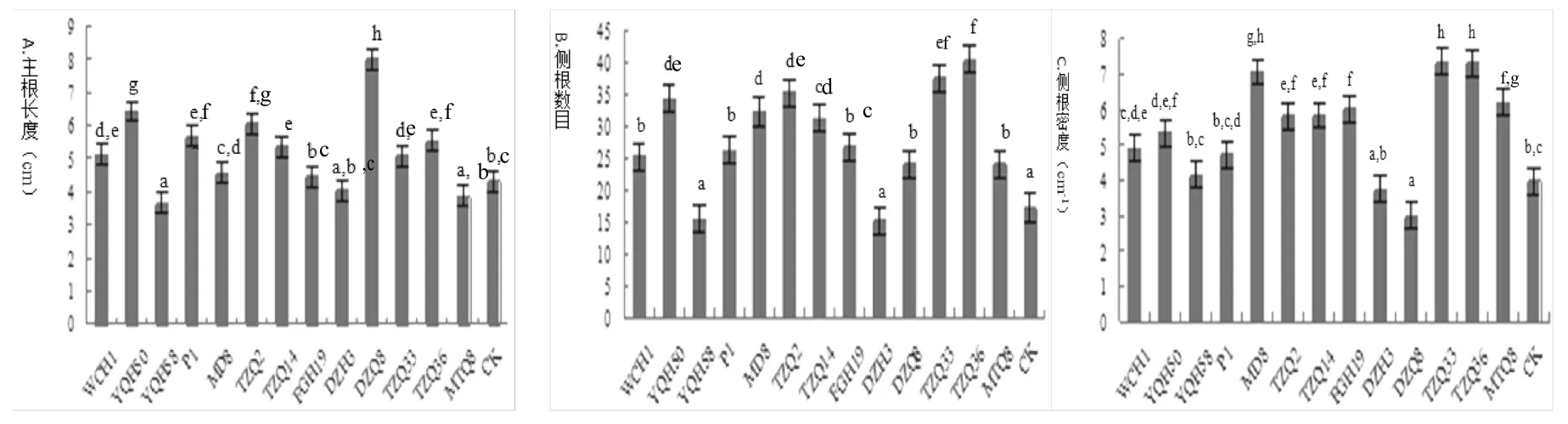
图4 不同菌株对拟南芥根构型的影响(LSD,P=0.05,n=20)A.主根长度、B.侧根数目和C.侧根密度Fig.4 Effect of different strains on Arabidopsis thaliana root developmental parameters(LSD,P=0.05,n=20)A.primary root length,B.lateral root number,C.lateral root density
2.3 PGPR产生的VOCs分析
通过SPME-GC-MS分析了13个PGPR菌株产生的挥发性物质。结果表明,大部分是醛类、酮类、醇类、酸类、酯类、烃类等化合物。TZQ36、WCH1和YQH58产生的挥发性物质大部分为酸类,其中酸类化合物分别占总化合物的62.66%、47.12%和49.55%。TZQ36产生的挥发性物质主要是3-甲基-丁酸(24.43%)和2-甲基-丁酸(38.23%),WCH1产生的挥发性物质主要是3-甲基-丁酸(20.17%)、2-甲基四氢噻吩-3酮(26.23%)和2-甲基-丁酸(26.95%),YQH58产生的挥发性物质主要是甲基糖醛酸(30.98%)。TZQ33、DZH3、YQH50、TZQ14和DZQ8产生的化合物大部分为酮类,其中测出的酮类化合物分别占总化合物的30.08%、28.26%、44.9%、56.91%和39.2%。TZQ33产生的挥发性物质主要是2-甲基四氢噻吩-3-酮(28.5%),DZH3产生的挥发性物质主要是3-甲基戊酮(9.26%)、2-癸酮(7.27%)和2-十二酮(4.25%)等酮类化合物,YQH50产生的挥发性物质主要是2-十一酮(21.66%),TZQ14产生的挥发性物质主要是4-壬酮(31.31%)和4-十一酮(13.68%),DZQ8产生的挥发性物质主要是3-甲基-2-戊酮(11.76%)和2-十九烷酮(9.95%)。TZQ2产生的化合物大部分为醛类,占总化合物的20.84%。主要为苯甲醛(17.92%)。FGH19产生的气体大部分为醇类,占总化合物的29%。主要为3-甲基-1-丁醇(23.11%)。P1、MD8和MTQ8产生的气体种类比较多,个别气体结构比较复杂,很难分类讨论。
2.4 单一挥发性化合物对拟南芥生长的的影响
为探索PGPR产生的具有植物促生作用的挥发性化合物,对检测出的各菌株主要挥发性化合物进行了单一组分的促生试验。结果表明,5~20µL/皿的1,3-丁二醇能促进拟南芥的生长,拟南芥的鲜重增加明显,LRN和PRL也有不同程度增加;1~2µL/皿的2-庚酮处理的拟南芥LRN增多;1µL/皿的2,5-二甲基吡嗪处理的拟南芥鲜重、LRN和PRL均有所增加。加入2µL正戊醇,拟南芥苗就发黄,侧根几乎不长。加入2µL甲基壬基甲酮就造成拟南芥死亡。癸醛的致死率很高,加入0.5µL就造成拟南芥的死亡。2-甲基丁酸和苯甲酸对拟南芥的生长并没有明显的影响。
3 讨论
植物根系是植物吸收营养物质和水分的主要器官,同时也是一些代谢物如细胞分裂素和激素的合成位点,因此植物根系对其生长和发育过程起着重要的作用。植物根系为了适应环境条件的变化在形态学和生理学方面显示出了重要的可塑性。主根的发生虽然早在胚胎发育过程中就已经被决定,但是也会受到一些调控物质的影响,而会影响到植物在不同生长条件下生活的侧根的发生与生长环境密切相关,受到植物激素的调控[15],侧根主要影响植物接触营养和水分的面积,对农作物的生长极为重要[16]。目前已知调控侧根发生和发育的植物激素主要是生长素,而且对生长素控制侧根发育的路径和分子机理的研究已经取得了显著的进展[17,18]。
VOCs在生命王国里是一种有效的化学交流介质,它通常作为引诱剂、防腐剂或者警告信号。众所周知,植物能够向环境中释放VOCs,同时它们也能检测的到环境中的VOCs。植物产生的VOCs已经被证明做为它们自己特定物种的膜或者其他器官的交流信号。微生物菌株也可以释放出VOCs用来交流、防御等目的。有一些VOCs可以刺激拟南芥根系中生长素的产生和运输,使得侧根增多,长度增加;还有一些VOCs对拟南芥有轻微的毒害作用,这种毒害作用很微小,反而刺激拟南芥改变了一些代谢途径,诱导拟南芥产生系统抗性,促进侧根的生长和根尖根毛的生长。侧根数目和长度的增加以及根尖根毛的增加大大增加了拟南芥吸收水分和营养物质的能力,从而促进了拟南芥的生长。但是并不是所有的菌株产生的VOCs都有可以促进拟南芥的生长,如DZH3和DZQ8对拟南芥的生物量并没有太大的影响,但是它们却使得根尖根毛增加。这说明特定菌株对于拟南芥的生长促进作用具有特异性。
在试验中还发现了一个有趣的现象,接种了一些PGPR菌株的拟南芥叶柄和叶片背面会出现紫色。这种紫色是植物经由苯基丙酸途径和类黄酮途径产生的一类天然的水溶性色素花色素苷所呈现的颜色,花色素苷主要存在于植物的花、果实、叶以及根、茎等器官细胞的液泡中,一般呈现红色、蓝色或紫色[19]。大量研究表明作为植物次生代谢产物,花色素苷是有多种生理功能的一类保护因子:(1)增强植物的抗氧化能力[20];(2)增强植物的光保护能力[21];(3)增强植物的抗虫抗病及抗机械损伤能力[22];(4)增强植物的抗旱能力[23];(5)成为植物细胞和某些真菌共生基因的信号分子[24]。当植物受多种胁迫条件的诱导,叶片可产生中花色素苷,对植物适应环境条件的改变有重要作用。在本试验中P1菌株对拟南芥的促生效果非常明显,对根构型的影响表现为LRN和侧根长度有了比较明显的增加。这可能是其产生的某种或几种VOCs能诱导植物体内花色素苷的合成或者积累。
Ryu等[11]和Farag等[12]研究证明,细菌产生的挥发物2,3-丁二醇和3-羟基-2-丁酮对拟南芥有促生效果。本次试验并没有发现这两种挥发性气体,但是却检测出了这两种气体的相似物质1,3-丁二醇,将拟南芥暴露于1,3-丁二醇中培养,结果发现1,3-丁二醇也可以促进拟南芥的生长、调整根构型。一些PGPR菌株产生的酸性物质,通过试验表明大部分是没有效果的,推测这些酸性气体应该是细菌发酵产生的,与细菌间信息的交流有关系,对植物的影响不大。
一些PGPR菌株产生的VOCs也能抑制某些病原菌的生长,间接的促进植物的生长。Fernando等[25]鉴定的抑制菌丝生长和菌核的生成的6类物质分别为苯丙噻唑、环己醇、癸醛、二甲基三硫化物、2-乙基-1-己醇和壬醛。本试验也证明癸醛能够在很微量的情况下杀死拟南芥,这说明癸醛是一种有毒气体,不仅对病原菌而且对植物也有很强的毒害作用。但奇怪的是有六株PGPR菌株都产生了癸醛,拟南芥长势却很好,对病原菌也有很明显的抑制作用。这可能是因为有的气体可以降低癸醛对植物的危害,但是却没有降低其对病原菌的毒害作用。
现在测VOCs常用的方法是GC/MS法,然而很多气体由于不存在于已知数据库中而很难被测定,还有一些气体因为太微量而无法测出。故这项工作还有很大的研究空间。
4 结论
本试验首次验证了13株不同属种的PGPR菌株对拟南芥有不同程度的促生作用,检测出其产生的VOCs成分,证明了1,3-丁二醇对拟南芥有很明显的促生作用。
[1]孙磊,宋未.非培养方法在植物内生和根际细菌研究中的应用[J].自然科学进展,2006(12):140-145
[2]胡小加.根际微生物与植物营养[J].中国油料作物学报,1999(3):77-79
[3]Shafiq H,Mirza M S,Malik K A.Production of phytohor-mones by the nitrogen fixation bacteria isloated from sugarcane[J].Biohorizons,1999,2(1-4):61-76
[4]夏铁骑.植物根际促生菌及其应用研究[J].济源职业技术学院学报,2008,7(3):7-11
[5]刘淑琮,冯炘,于洁.植物根际促生菌的研究进展及其环境作用[J].湖北农业科学,2009,48(11):2882-2887
[6]陈华,郑之明,余增亮.枯草芽孢杆菌JA脂肽类及挥发性物质抑菌效应的研究[J].微生物学通报,2008,35(1):11-14
[7]吴艳,闫豫君,赵思峰.组合芽孢杆菌抑菌物质特性及其抑菌效果研究[J].西北农学报,2007,16(5):266-270
[8]郭华,侯冬岩,回瑞华,等.环棱褐孔菌挥发性化学成分的分析[J].鞍山师范学院学报,2005,7(6):49-51
[9]刘高强,王晓玲.顶空气相色谱-质谱联用法分析灵芝发酵物中的挥发性物质[J].菌物学报,2007,26(3):389-395
[10]Bhaskar C,Anita P,Lok M S.Diffusible and volatile compounds produced by an antagonistic Bacillus subtilis strain cause structural deformations in pathogenic fungi in vitro[J].Mycological Research,2005(160):75-78
[11]Ryu C M,Farag M A,Hu C H,et al.Bacterial volatiles promote growth in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(8):4927-4932
[12]Farag M A,Ryu C M,Sumner L W,et al.GC-MS SPME profiling of rhizobacterial volatiles reveals prospective inducers of growth promotion and induced systemic resistance in plants[J].Phytochemistry,2006,67(20):2262-2268
[13]Kai M,Effmert U,Berg G,et al.Volatiles of baeterial antagonists inhibit mycelial growth of the Plant Pathogen Rhizoctonia solani[J].Arch Microbiol,2007,187(5):35l-360
[14]Francisca M,Gutiérrez L,José L B,et al.Plant growth-promoting rhizobacteria modulate root-system architecture in Arabidopsis thaliana through volatile organic compound emission[J].Symbiosis,2010,51:75-83
[15]罗琎,孙长忠,王琦,等.根系的发育及其激素调控研究[J].安徽农业科学,2008,36(26):11219-11222
[16]潘瑞炽.植物生理学.第5版.北京:高等教育出版社,2004:174-175
[17]Brocard-Gifford I,Lynch T J,Garcia M E,et al.The Arabidopsis thaliana ABSCISIC ACIDINSENSITIVE 8 locus enc odes a novel protein mediating abscisic acid and sugar responses essential for growth[J].Plant Cell,2004,16:406-421
[18]Kim S,Kang J Y,Cho D I,et al.ABF2,an ABRE binding b ZIP factor,is an essential component of glucose signaling and its overexpression affects multiple stress tolerance[J].Plant J,2004,40:75-87
[19]杜艳,余迪求.β-氨基丁酸对拟南芥叶片花色素苷的影响[J].云南植物研究,2010,32(3):263-269
[20]Shaheen F,Ali L,Ali S,et al.Antioxidant flavonoids from Tamus communis ssp.Cretica[J].Chemistry of Natural Compound,2009,45:346-349
[21]Smillie R,Hetherington S.Phtoabatement by anthocyanin shields photosynthetic systems from lights tress[J]. Photosynthetica,1999,36(3):451-463
[22]Gould K S,McKelvie J,Markham K R.Do anthocyanins function as antioxidants in leaves?Imaging of H2O2in red and green leave safter mechanical injury[J].Plant,Cell&Environment,2002,25(10):1261-1269
[23]Linda C S.Environmental Significance of anthocyaninsin plant stress responses[J].Photochemistry and Photobiology, 1999,70:1-9
[24]Chen Q F,Dai L Y,Xiao S,et al.The COI1 and DFR genes are essential for regulation of jasmonate-induced anthocyanin accumulation in Arabidopsis[J].Journal of Integrative Plant Biology,2007,49(9):1370-1377
[25]Fernando W G,Ramarathnam R,Krishnamoorthy A S,et al.Identification and use of potential bacterial organic antifungal volatiles in biocontrol[J],Soil Biology and Biochemistry,2005(37):955-964
Effects of Volatiles Produced by Some Plant Growth-promoting Rhizobacteria of Tobacco on Root Architecture of Arabidopsis thaliana
LI Min1,ZHANG Peng-peng2,LIU Kai3,SHAO Lan-jun1,YAO Liang-tong3, DU Bing-hai3,DING Yan-qin3*
1.China Tobacco Hunan Industry Co.Ltd.,Guangzhou 510000,China
2.Qingdao Mingyue BlueOcean Bio-technology Co.Ltd.,Qingdao 266400,China
3.College of life science,Shandong Agricultural University/Shandong Key Laboratory of Agricultural Microbiology,Taian 271018,China
To studied the performance of volatiles from 13 kinds of plant growth-promoting rhizobacteria(PGPR)for promoting growth of Arabidopsis thaliana,the bacteria were screened out using special divided plastic petir dishes and volatile organic compounds were identified by SPMS-GC-MS.Results showed that the VOCs produced by the 13 strains could promote growth and modulate root-system architecture of A.thalianain in different degree.Effects of volatiles produced by P1,MD8 and FGH19 strains on A.thaliana were very remarkable,with average A.thaliana fresh weight 38.78, 30.58 and 23.70 mg/strains respectively,increased 5.71,4.29 and 3.10 times compared with the control,respectively.PRL of A.thalianaline with DZQ8 treated was 8.03 cm,increasing 0.85 times compared to the control.The LRN of A.thaliana with TZQ33 and TZQ36 treated were more obviously,37.50 and 40.50,respectively,increasing 1.17 and 1.35 times.the LRD of MTQ8,MD8,TZQ33 and TZQ36 treated A.t haliana were 6.20,7.07,7.35 and 7.33 cm-1,respectively,and increased 0.55, 0.77,0.84 and 0.83 times compared to the control.Based on the analysis and verification of volatile organic compounds,we are first to discover that 1,3-Butanediol produced by MTQ8 can obviously promote the growth of A.Thaliana.The VOCs can promote growth and modulate root-system architecture of A.Thalianaandwehave identifiedinfirsttimethatthe 1,3-butanediolcan promotethe growthofA.Thalianaand adjusttheroot architecture.
Plant growth-promoting rhizobacteria(PGPR);volatile organic compounds(VOCs);growth-promoting effect; Arabidopsis thaliana
S154.38+1
A
1000-2324(2015)03-0347-06
2013-07-25
2013-08-11
广东中烟工业有限责任公司资助项目(粤烟工15XM-QK[2011]-001)
李敏(1980-),男,湖北广水人,本科,农艺师,主要从事原料研究和烟叶计划工作;张鹏鹏(1987-),女,山东泰安人,硕士,研发员,主要从事植物根际促生细菌研发工作.
*通讯作者:Author for correspondence.E-mail:dingyq6885@163.com
