交替呼吸途径对低温弱光下黄瓜叶片光合作用的保护研究
2015-11-08王旭明胡文海闫小红
王旭明,胡文海,2,闫小红,2
交替呼吸途径对低温弱光下黄瓜叶片光合作用的保护研究
王旭明1,*胡文海1,2,闫小红1,2
(1. 井冈山大学生命科学学院,江西,吉安 343009;2. 江西省生物多样性与生态工程重点实验室,江西,吉安 343009)
以津研4号黄瓜品种为实验材料,采用1 mM的水杨基氧肟酸(SHAM)抑制47%~48%交替呼吸途径(AOX途径)活性,研究了交替呼吸途径对低温弱光(100 μmol· m-2· s-1,8 ℃)下黄瓜叶片光合作用的保护作用。结果表明,低温弱光处理虽然降低了净光合速率,但未引起光化学反应、热耗散和光合电子传递的变化,也未改变弱光下吸收光能在PSII光化学反应Y(II)、PSII调节性能量耗散Y (NPQ)和非调节性能量耗散部分Y(NO)之间的分配比例,这可能归功于低温弱光诱导交替呼吸途径的上调。低温弱光下抑制AOX活性虽然完全抑制了光化学反应和光合电子传递,并限制了净光合速率,但诱导了热耗散能力的增强,从而未引起光抑制的发生。由此可见,低温弱光下AOX途径活性的上调可有效地保护黄瓜叶片的光合电子传递链,并优化光合作用;而抑制AOX活性后,黄瓜叶片也可通过促进热耗散防御低温弱光下光抑制的发生。
黄瓜;低温弱光;交替呼吸途径;光合作用;水杨基氧肟酸
作为植物绿色细胞中主要的能量与物质代谢中心,叶绿体和线粒体之间具有密切的联系[1-2]。叶绿体光化学反应所形成的还原性物质NADPH以苹果酸的形式通过苹果酸-草酰乙酸穿梭转移到胞液中,并被其它细胞器如线粒体等所利用[3-5]。线粒体电子传递与氧化磷酸化过程被认为在消耗叶绿体内过量还原性物质、优化光合碳同化和防御光抑制等方面具有重要作用[2]。植物线粒体拥有细胞色素途径和交替途径两条主要的电子传递链[6-7],其中交替途径通过交替氧化酶(AOX)将电子直接传递给分子氧,并不引起质子的跨膜转移和ATP的形成,从而被认为有利于叶绿体内过量还原性物质的消耗,并在防御植物光抑制中具有重要的作用[8-9]。研究表明,交替途径的降低减少了叶绿体内还原性物质的输出,增加了叶绿体内NADPH/NADP+的比率[1]。干旱或强光胁迫下,抑制AOX活性也导致了植物叶片光合电子传递链的过度还原和光抑制程度的加剧[8,10]。
近年来逆境胁迫下植物叶片线粒体AOX途径对叶绿体能量代谢的影响越来越受到人们的关注,但相关研究多集中于逆境胁迫下AOX途径的增强缓解过剩光能对叶片造成的光抑制方面[7-8,11],而对于叶片吸收光能未过剩的逆境胁迫下AOX途径与叶绿体内能量代谢的关系却鲜有研究。低温是限制作物生长发育的主要环境因子,冬春季节的低温弱光是我国设施蔬菜生产的最大障碍之一[12]。我们前期研究表明,低温弱光虽然抑制了光合作用碳同化的进行,但由于入射光强较弱,并未引进叶片光合机构的伤害[13],并且低温弱光诱导了黄瓜叶片线粒体交替呼吸的增强[14]。为此我们以黄瓜为材料,利用AOX抑制剂SHAM控制叶片内AOX活性,通过研究低温弱光胁迫下抑制叶片AOX活性后光合作用碳同化、光合电子传递和叶绿体内能量分配的变化,以探明在低温弱光胁迫下交替呼吸对叶绿体能量代谢与分配的影响。
1 材料与方法
1.1 供试材料
试验于2014年6~8月在井冈山大学生物园进行,供试黄瓜品种为津研四号(L. cv Jingyan No.4)。种子浸种催芽后播种于草碳土中,两片子叶充分展开时移入15 cm × 15 cm的花盆中,培养基质为菜园土,正常水肥管理。待黄瓜幼苗培养至三叶一心时,选择生长一致的植株进行以下四种处理:处理1(常温弱光,NT):植株置于人工培养箱中25 ℃,100 µmol·m-2·s-1条件下培养;处理2(常温弱光+SHAM,NT-SHAM):植株叶片喷施0.1 mM SHAM后,置于25 ℃,100 µmol·m-2·s-1条件下培养;处理3(低温弱光,LT):植株置于人工培养箱中8 ℃,100 µmol·m-2·s-1下培养;处理4(低温弱光+ SHAM,LT-SHAM):植株叶片喷施0.1 mM SHAM后,置于人工培养箱中8 ℃,100 µmol·m-2·s-1下培养。于处理的第4 d分别测定各处理植株完全展开叶的交替呼吸途径活性、净光合速率和叶绿素荧光参数。试验共5次重复。
1.2 测定方法
1.2.1 交替呼吸途径活性的测定
为了评价交替呼吸途径的最大活性,取完全展开叶中部0.1 g,剪成2 mm的组织切段,加入2 mL反应介质(20 mM、pH7.2的磷酸缓冲液),采用1 mM的KCN抑制细胞色素氧化酶(COX)活性,利用Clark型液相氧电极(Oxygenlab,Hansatech, England),在25 ℃下测量组织耗氧量。
1.2.2 净光合速率的测
选择植株完全展开叶,避开叶中脉,采用Licor-6400XT(LI-COR,Lincoln,USA),利用仪器控制叶室CO2浓度为380 μmol·mol-1,光强为600 μmol·m-2·s-1,相对湿度为55%,叶室温度25℃,测定叶片净光合速率。
1.2.3 叶绿素荧光参数的测定
选择测定净光合速率的同一叶片及相同部位,采用Dual-PAM-100/F(Heinz Walz GmbH, Effeltrich, Germany)进行叶绿素荧光参数的测定。首先将植株叶片暗适应30 min后,测定其最小荧光Fo、最大荧光Fm和PSII最大光化学效率Fv/Fm,然后开启120 μmol·m-2·s-1的光化光照射5 min后测定光适应下叶绿素荧光,记录Y(II)、qP、NPQ和ETR等叶绿素荧光参数。将叶片再次暗适应30 min后,测定其最小荧光Fo、最大荧光Fm和PSII最大光化学效率Fv/Fm,然后依次开启由7~1450 μmol·m-2·s-1的光化光,每个强度的光化光照射叶片10s后,依据Dual-PAM-100使用说明进行叶绿素荧光快速光曲线的测定,记录Y(II)、Y(NO)、Y(NPQ)和ETR等叶绿素荧光参数的快速光曲线。光化光由仪器内置的LED光源提供635 nm光线。利用Ye等[15]光合电子流对光响应的机理模型,由模型建立者叶子飘博士提供的计算软件(光合计算4.1.1版本),计算最大光合电子流max和饱和光强PARsat。
1.3 数据处理和分析
采用SPSS11.5软件进行方差分析,差异显著性采用最小显著性差异(LSD)检验在< 0.05水平上进行分析。数据为平均值±标准差,图表中不同字母表示在5%水平上处理间具有显著性差异。
2 结果与分析
2.1 低温弱光和SHAM对交替呼吸的影响
由图1可知,常温弱光下黄瓜叶片交替呼吸途径活性(VKCN)为11.46 μmolO2·g-1FW·h-1,低温弱光处理诱导了VKCN上升到17.85 μmolO2·g-1FW·h-1,增幅为55.7%。经SHAM处理后,常温和低温下叶片VKCN为5.95 μmolO2·g-1FW·h-1和9.46 μmolO2·g-1FW·h-1,其AOX活性抑制率分别为48.1%和47.0%。
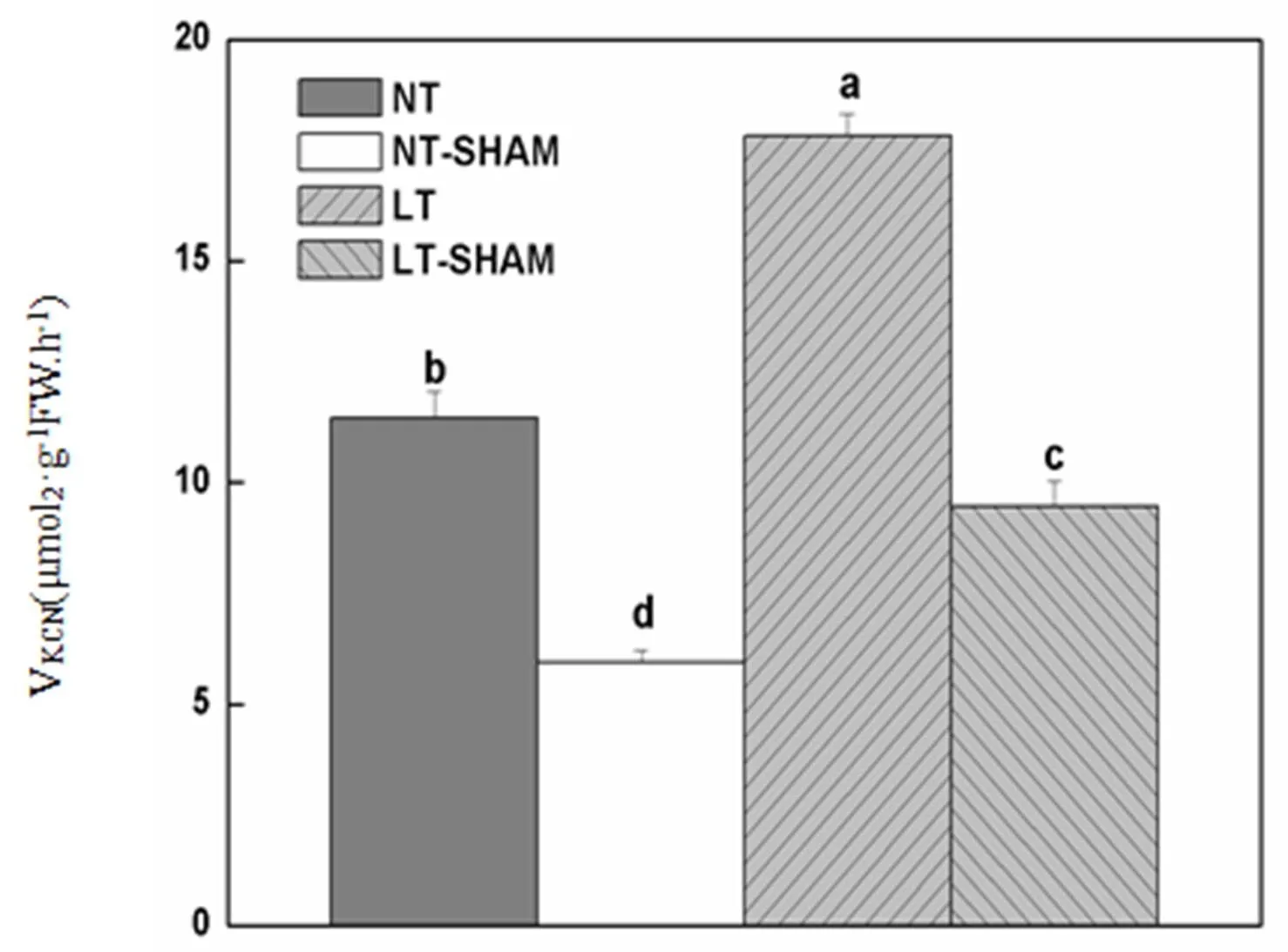
图1 低温弱光和SHAM对黄瓜叶片交替呼吸途径活性的影响
2.2 低温弱光和SHAM对净光合速率和叶绿素荧光参数的影响
低温弱光处理使得黄瓜叶片净光合速率(n)由常温弱光下的4.96 μmol·m-2·s-1下降为3.59 μmol·m-2·s-1,降幅为27.3%;抑制AOX活性并未引起常温弱光下n的明显下降,加剧了低温弱光下n的下降,在本实验条件处理下已完全测不出(表1)。常温弱光下抑制AOX活性和低温弱光处理均未引起黄瓜叶片Fv/Fm,以及120 μmol·m-2·s-1的弱光下Y(II)、qP、NPQ和ETR的变化;低温弱光下抑制AOX活性虽然未引起Fv/Fm的下降,但导致了Y(II)、qP和ETR的下降,以及NPQ的增强(结果见表1)。

表1 低温弱光和SHAM对黄瓜叶片净光合速率和叶绿素荧光参数的影响
2.3 低温弱光和SHAM对电子传递速率快速光响应的影响
低温弱光处理未引起弱光下叶片ETR的下降,只有在高于800 μmol·m-2·s-1光照下ETR才随着光强的增加而低于常温弱光下叶片;抑制AOX活性未引起常温弱光下叶片ETR的变化,但低温弱光下抑制AOX活性则加剧了ETR的下降(图2)。低温弱光处理和常温弱光下抑制AOX活性均未降低叶片max,但低温弱光下抑制AOX活性显著降低了max;而低温弱光处理、常温弱光和低温弱光下抑制AOX活性均降低了PARsat(图3)。

图2 低温弱光和SHAM对黄瓜叶片光合电子传递速率快速光曲线的影响
2.4低温弱光和SHAM对快速光曲线的影响
由图4可知,常温弱光下抑制AOX活性并未引起Y(II)的变化,也未对弱光下Y(NPQ)和Y(NO)产生影响,但当光强超过400 μmol·m-2·s-1时Y(NPQ)则明显降低,并导致Y(NO)的增加;与正常温度下相比,低温弱光未引起Y(II)、Y(NPQ)和Y(NO)的明显变化,而低温弱光处理下抑制AOX活性显著降低了Y(II),并促进了Y(NO)的增加,而Y(NPQ)则表现为弱光下得到增加强光下有所下降。
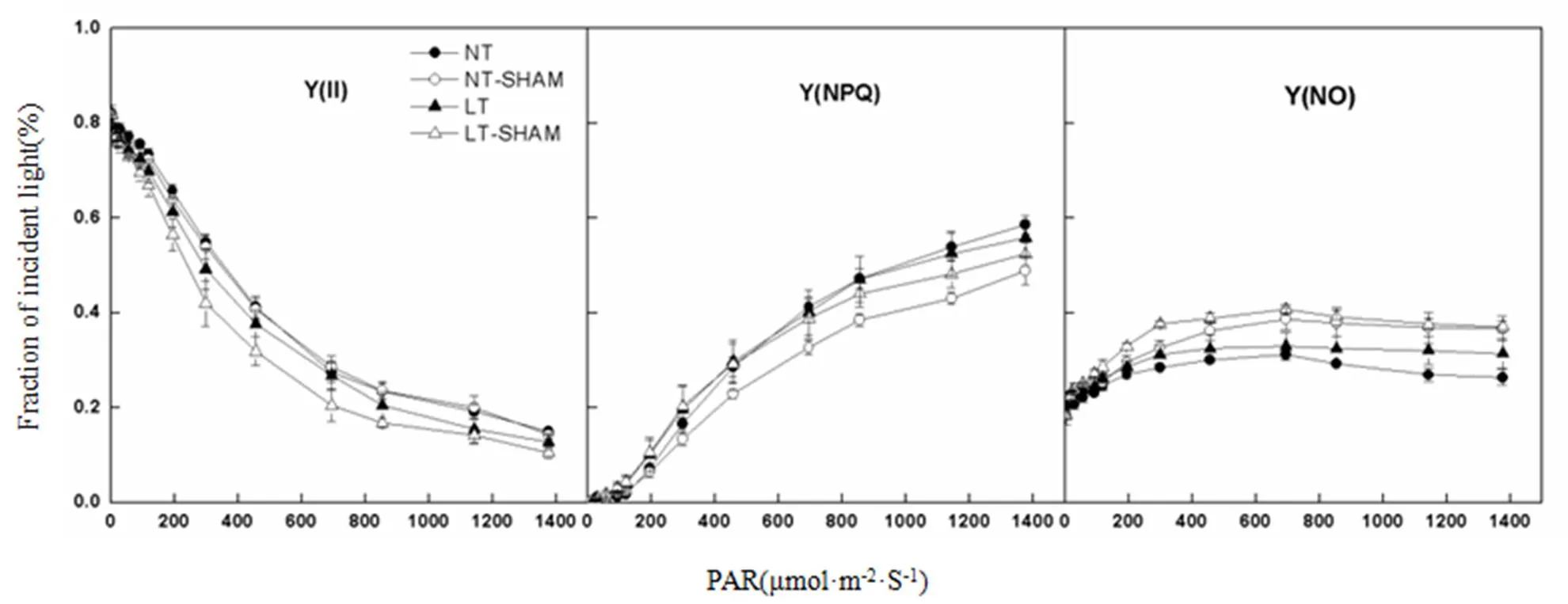
图4 低温弱光和SHAM对黄瓜叶片Y(II)、Y(NPQ) 和Y(NO)快速光曲线的影响
3 讨论
光合作用包括光反应和碳同化两个阶段,光反应通过光合电子传递和磷酸化将叶片吸收光能转变为NADPH和ATP等还原力,碳同化则利用还原力进行CO2的固定[2,16]。逆境胁迫下植物光合碳同化能力的下降导致了Calvin循环对NADPH和ATP需求的减少,从而引起叶绿体内吸收光能利用能力的下降,并造成光抑制的发生[17-19]。植物既可通过热耗散等叶绿体内能量耗散途径以减少还原力的形成[20],也可通过交替呼吸等线粒体内能量耗散途径消耗叶绿体内部分过剩的还原力,以减缓叶绿体内还原力形成与利用的失衡,从而缓解光抑制[2]。本试验中,低温弱光处理诱导了黄瓜叶片交替呼吸途径活性上调了55.7%(图1),降低了P,但未引起Fv/Fm,以及弱光下(120 μmol·m-2·s-1)Y(II)、qP、NPQ和ETR的变化。这表明100 μmol·m-2·s-1入射光强和8oC低温弱光处理下,光合碳同化限制所积累的还原力可通过交替呼吸的上调所消耗,因而未对光合电子传递造成明显影响。而利用SHAM抑制了47.1%交替呼吸途径活性后的黄瓜叶片在低温弱光下其光合作用完全被限制,Y(II)、qP和ETR也明显下降,但诱导了NPQ的增强,并且未引起Fv/Fm的下降(表1)。由此可见,交替呼吸途径的顺利进行有利于优化低温弱光下黄瓜叶片的光合作用和光合电子传递的进行,然而抑制交替呼吸后黄瓜叶片也可通过促进热耗散能力消耗过剩光能以保护光合机构。
利用调制叶绿素荧光技术测量的快速光曲线由于测量时间短,测量过程对光合状态的影响小,能够很好地反映样品的实时光合状态[21-22]。通过比较叶绿素荧光ETR快速光曲线可知,低温弱光处理并未引起低于800 μmol·m-2·s-1光强下叶片ETR的下降,也未降低其max,只是降低了其PARsat;而抑制AOX活性则明显抑制了低温弱光下黄瓜叶片的ETR、max和PARsat(图2、3)。由此可见,交替呼吸活性的上调有利于维持低温弱光下黄瓜叶片光合电子传递的顺利进行,只有当叶片吸收光能超过其可利用和消耗的范围后过剩光能才会对光合电子传递起到抑制作用。
PSII反应中心吸收光能主要有三个去处,即PSII光化学反应所利用的能量部分Y(II)、PSII调节性能量耗散(如热耗散等)部分Y(NPQ)和非调节性的能量耗散部分Y(NO),Y(II)+Y(NPQ)+ Y(NO) = 1[23]。进一步分析叶片吸收光能分配的快速光曲线(图4)可知,与正常温度下黄瓜叶片相比,低温弱光处理未引起Y(II)和Y(NPQ)的显著差异,并且弱光下(低于800 μmol·m-2·s-1)Y(NO)也没有差异,但当光强高于800 μmol·m-2·s-1时低温弱光导致了Y(NO)的增加;而抑制交替呼吸则明显降低了弱光及强光下黄瓜叶片Y(II),显著地提高了Y(NO),对Y(NPQ)则表现为弱光下增大强光下降低的现象。Y(NO)较高表明植物叶片的光化学反应能力和具有保护作用的调节性能量耗散机制不足以将吸收光能安全地消耗掉,将会造成吸收光能的过剩并对光合机构产生伤害[23]。由此可推测,低温弱光所诱导的AOX活性上调有效地维持了弱光下叶片吸收光能的分配,但当吸收光能过高时仍会有过剩光能的产生;而抑制AOX活性则会减少叶绿体内还原物质的消耗,从而不利于光化学反应的顺利进行,在较弱光照条件下即会造成吸收光能的过剩。这也表明交替呼吸途径的顺利进行有利于优化低温弱光下黄瓜叶片的光化学反应和光合电子传递的进行,而低温弱光下抑制AOX活性可通过促进热耗散等保护性调节机制以减轻过剩光能的积累。
而正常温度下抑制AOX活性并未引起黄瓜叶片n、Fv/Fm、qP、NPQ、max,以及ETR和Y(II)快速光曲线的变化,也未对弱光下Y(NPQ)和Y(NO)产生影响,只是促进了较强光照下Y(NPQ)的降低和Y(NO)的增加。这结果说明在常温下当叶片吸收光强较弱时,植物叶片光合电子传递所产生的同化力NADPH主要被碳同化所利用,因此抑制AOX途径并未对叶绿体光化学反应和光合电子传递产生影响,也不需要通过增强热耗散等保护机制以减少还原力的形成。孟祥龙等[24]的研究也表明,弱光下抑制AOX活性所引起的苹果酸-草酰乙酸穿梭系统的两个关键酶NADP-MDH和NAD-MDH的活性,以及ΦPSII(即Y(II))、ETR和光合放氧速率的变化均显著低于强光处理。由此可见,交替呼吸的顺利进行对于光能过剩环境下植物光合作用的优化和光合机构的保护作用更具重要意义。
综合上述分析,我们推测当黄瓜叶片吸收光能较弱时,低温弱光诱导增强的交替呼吸可有效地消耗因碳同化下降所积累的那部分叶绿体内过剩还原力,从而维持了光合电子传递的顺利进行,此时无需通过增强热耗散等保护性能量耗散途径以消耗过量光能,这将有利于保持植物叶片较强的光能吸收与利用能力;而当AOX活性受到抑制时,叶绿体可通过诱导热耗散能力的增强以消耗过剩光能,此时虽然光合电子传递和光化学能力受到了抑制,但并未对光合电子传递链造成进一步的伤害。
参考文献:
[1] Padmasree K.Padmavathi L,Raghavendra A S. Essentiality of mitochondrial oxidative metabolism for photosynthesis: optimization of carbon assimilation and protection against photoinhibition [J]. Critical Reviews in Biochemistry and Molecular Biology, 2002, 37(2): 71-119.
[2] Raghavendra A S, Padmasree K. Beneficial interactions of mitochondrial metabolism with photosynthetic carbon assimilation [J].Trends in Plant Science,2003, 8(11):546- 553.
[3] Guillaume T, Edouard B,Aline M, et al. Respiratory carbon fluxes in leaves [J]. Current Opinion in Plant Biology, 2012, 15(3): 308-314.
[4] Hoefnagel M H N,Atkin O K,Wiskich J T. Interdependence between chloroplasts and mitochondria in the light and the dark [J]. Biochimica et Biophysica Acta, 1998, 1366(3): 235–255.
[5] Noguchi K,Yoshida K.Interaction between photosynthesis and respiration in illuminated leaves [J]. Mitochondrion, 2008, 8(1):87-99.
[6] Vanlerberghe G C. Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants [J]. International Journal of Molecular Sciences, 2013, 14(4):6805-6847.
[7] Yoshida K, Terashima I, Noguchi K. Distinct role of the cytochrome pathway and alternative oxidase in leaf photosynthesis [J]. Plant and Cell Physiology, 2006, 47(1): 22-31.
[8] Yosida Y,Terashima I,Noguchi K. Up-regulation of mitochondrial alternative oxidase concomitant with chloroplast over-reduction by excess light [J]. Plant and Cell Physiology, 2007, 48(4): 606-614.
[9] Zhang L T, Gao H Y, Zhang Z S, et al. Multiple effects of inhibition of mitochondrial alternative oxidase pathway on photosynthetic apparatus inleaves [J]. Biologia Plantarum, 2012, 56(2):365-368.
[10] Bartoli C G, Gomez F, Gergoff G, et al. Up-regulation of the mitochondrial alternative oxidase pathway enhances photosynthetic electron transport under drought conditions [J]. Journal of Experimental Botany, 2005, 56(415): 1269-1276.
[11] 孟祥龙,张子山,高辉远,等.温度上升提高了黄瓜叶片线粒体交替氧化酶呼吸途径对光破坏防御作用的贡献[J].植物生理学报,2013, 49(1):63-69.
[12] 张福墁.强化科技创新,大力提升我国设施园艺现代化水平[J].沈阳农业大学学报,2006, 37(3):261-264.
[13] 胡文海,闫小红,袁丽芳,等. 光强在低温弱光胁迫后番茄叶片光合作用恢复中的作用[J].植物研究,2011,31(2): 164-168.
[14] Hu W H,Shi K,Song X S, et al. Different effects of chilling on respiration in leaves and roots of cucumber () [J]. Plant Physiology and Biochemistry, 2006, 44(11): 837-843.
[15] Ye Z P,Robakowski P, Suggett D J. A mehcanistic model for the light response of photosynthetic electron transport rate based on light harvesting properties of photosynthetic pigment molecules [J]. Planta, 2013, 237(3):837-847.
[16] Sunil B,Talla S K,Aswani V, et al. Optimization of photosynthesis by multiple metabolic pathways involving interorganelle interactions: resource sharing and ROS maintenance as the bases [J]. Photosynthesis Research, 2013,117 (1-3):61-71.
[17] Nikolai G,Bukhov,Robert C. Heteogeneity of photosystem II reaction centers as influenced by heat treatment of barley leaves [J]. Physiologia Plantarum, 2000, 110(2): 279-285.
[18] Sharkey T D. Effects of moderate heat stress on photosynthesis: importance of thylakoid reactions, rubisco deactivation, reactive oxygen species, and thermotolerance provided by isoprene [J]. Plant, Cell and Environment, 2005, 28(3): 267-277.
[19] Terashima L, Noguchi K, Itoh-Nemoto T, et al. The cause ofphotoinbition at low temperatures in leaves of, a chilling-sensitive plant [J]. Physiologia Plantarum, 1998, 103(3): 295-303.
[20] Ishida A,Yamazaki J Y,Harayama H, et al. Photoprotection of evergreen and drought-deciduous tree leaves to overcome the dry season in monsoonal tropical dry forests in Thailand[J]. Tree Physiology,2014,34 (1): 15-18.
[21] 韩志国. 20种湿地植物的叶绿素荧光特性[D].广州:暨南大学, 2006.
[22] Ralph P J, Gademann R. Rapid light curves: A powerful tool to assess photosynthetic activity [J]. Aquatic Botany, 2005, 82(3):222-237.
[23] Kramer D M,Johnson G,Kiirats O,et al. New fluorescence parameters for the determination of QAredox state and excitation energy fluxes[J]. Photosynthesis Research, 2004, 79(2):209-218.
[24] 孟祥龙,张立涛,张子山,等.杂交酸模叶片线粒体交替氧化酶呼吸途径在光破坏防御中的作用[J].应用生态学报,2012, 23(7):1803-1808.
PROTECTIVE ROLES OF ALTERNATIVE OXIDASE PATHWAY IN PHOTOSYNTHESIS OF CUCUMBER LEAVES UNDER LOW TEMPERATURE AND WEAK LIGHT
WANG Xu-ming1,*HU Wen-hai1,2, YAN Xiao-hong1,2
(1. School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi 343009, China; 2. Key Laboratory for Biodiversity Science and Ecological Engineering, Ji’an, Jiangxi 343009, China)
In order to study the protective roles of alternative oxidase pathway in photosynthesis of cucumber leaves under low temperature (LT, 8 ℃) and weak light (100 μmol·m-2·s-1), a cucumber cultivar “Jinyan No. 4” was selected as experimental material, and the AOX inhibitor salicylhydroxamic acid (1 mM; SHAM) was used to inhibit AOX activityin both normal temperature (NT) and LT leaves. The results indicated that leaf AOX pathway was up-regulated after LT. Although net photosynthetic rate (n) decreased in leaves under LT, there were no change in photochemical reaction, thermal energy dissipation and photosynthetic electron transport were not changed. Also, LT was not influenced the energy distribution ratio between Y(II), Y(NPQ) and Y(NO). Inhibition of AOX pathway under LT decreased photochemical reaction and photosynthetic electron transport, and restrictedncompletely. However, photoinhbition did not occur because of the increase of thermal energy dissipation, which was induced by the down-regulation of AOX activity in leaves under LT. Taken together, up-regulation of AOX pathway would protect the photosynthetic electron transport chain and optimize photosynthesis in cucumber leaves under low temperature and weak light.
cucumber; low temperature and weak light; alternative oxidase pathway; photosynthesis; salicylhydroxamic acid
1674-8085(2015)06-0046-06
S642.2
A
10.3969/j.issn.1674-8085.2015.06.010
2015-07-09;修改日期:2015-09-17
江西省自然科学基金项目(20142BAB204014);江西省教育厅科技计划项目(GJJ13545)
王旭明(1994-),男,江西吉安人,井冈山大学生命科学学院生物技术专业2012级本科生(E-mail:641029548@qq.com);
*胡文海(1973-),男,江西吉安人,教授,博士,主要从事植物逆境生理方面的研究(E-mail:huwenhai@jgsu.edu.cn);
闫小红(1977-),女,内蒙古赤峰人,实验师,硕士,主要从事植物生理生态方面的研究(E-mail:yanxiaohong325@126.com).
